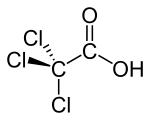
Trichloressigsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Keile zur Verdeutlichung der Geometrie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Trichloressigsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2HCl3O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, schwach sauer riechende Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 163,39 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte |
1,61 g·cm−3 (64 °C)[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
196 °C[1] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| pKS-Wert |
0,65[2] | |||||||||||||||||||||
| Löslichkeit |
sehr leicht in Wasser (1300 g·l−1 bei 20 °C)[1], Ethanol und Diethylether[2] | |||||||||||||||||||||
| Brechungsindex |
1,4603 (61 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 1 ml·m−3 bzw. 7 mg·m−3[5] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−503,3 kJ/mol[8] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Die Trichloressigsäure (kurz TCA, vom englischen trichloroacetic acid) ist eine chlorierte organische chemische Verbindung aus der Gruppe der Carbonsäuren. Bei ihr sind die drei Wasserstoffatome der Methylgruppe vollständig durch Chloratome ersetzt (substituiert). Ihre Salze heißen Trichloracetate.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Trichloressigsäure, Cl3CCOOH, ist mit einem pKs-Wert von 0,65[2] aufgrund des −I-Effekts eine wesentlich stärkere Säure als Essigsäure (pKs 4,75). Sie bildet farblose, stechend riechende Kristalle mit einem Schmelzpunkt von 59 °C und einem Siedepunkt von 196 °C. Außerdem ist Trichloressigsäure stark hygroskopisch.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Trichloressigsäure dient in der Kosmetik zum Entfernen von Hornhaut („Peeling“). Trichloressigsäure ist als Inhaltsstoff für kosmetische Mittel im europäischen Raum jedoch verboten.[9] Ihr Natriumsalz, das Natriumtrichloracetat, wurde als Herbizid eingesetzt. In der Europäischen Union und der Schweiz besteht keine Zulassung als Pflanzenschutzmittel mehr.[10]
In der Medizin stellt TCA eine Behandlungsoption von Genitalwarzen dar. Hierzu wird eine 80–90%ige Lösung auf die Warzen aufgetragen und in Folge die überschüssige Säure mit Natron neutralisiert.[11] In der Gynäkologie können Vorstufen von Gebärmutterhalskrebs mit TCA behandelt werden.[12]
Auch wird etwa 40%ige Trichloressigsäure angewendet, um anderweitig unstillbares Nasenbluten zu stoppen, indem das entsprechende Blutgefäß verätzt wird. Ebenso verhindert sie präventiv das Aufreißen empfindlicher Gefäße der Nasenschleimhaut.[13]
Darüber hinaus findet es im Zuge einer TCA-Fällung Anwendung als Fällungsmittel für Proteine aus einem Zellhomogenisat oder aus dem Kulturmedium (bei extrazellulären Proteinen).
In der Analytischen Chemie können mit Trichloressigsäure gut lösliche Metalle aus komplexen biologischen Proben wie Lebensmitteln oder Körpersäften ohne großen Aufwand separiert werden, so dass es keiner komplizierten, nasschemischen Oxidation der störenden organischen Matrix bedarf. Soll beispielsweise der Calciumgehalt von Milch oder der Eisengehalt in Blut bestimmt werden, wird das wässrige Probenmaterial mit einer TCA-Lösung im Verhältnis 1:1 gemischt und nach einer kurzen Extraktionszeit abzentrifugiert. Im Sediment befinden sich unlösliche Bestandteile wie denaturierte Eiweiße und Zellfragmente. Die überstehende Lösung kann direkt vermessen werden.
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Die IARC stufte Trichloressigsäure im Jahr 2014 als möglicherweise krebserzeugend ein.[14]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- chemikalienlexikon.de: Trichloressigsäure
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h Eintrag zu Trichloressigsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Trichloressigsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Oktober 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-490.
- ↑ Eintrag zu Trichloroacetic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 76-03-9 bzw. Trichloressigsäure), abgerufen am 2. November 2015.
- ↑ Drugs in Japan Vol. 6, S. 879, 1982.
- ↑ Summary Tables of Biological Tests, National Research Council Chemical-Biological Coordination Center. Vol. 6, S. 214, 1954.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- ↑ Anhang II der Verordnung (EG) Nr. 1223/2009.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu TCA in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 17. Februar 2016.
- ↑ WHO: GUIDELINES FOR THE MANAGEMENT OF SEXUALLY TRANSMITTED INFECTIONS, 2003, Seite 52, aufgerufen am 8. Juni 2014 (PDF; 2,82 MB).
- ↑ Medizinischen Universität Wien: HPV: Peeling für den Gebärmutterhals als Therapie für Krebsvorstufen. Abgerufen am 31. März 2024.
- ↑ Nasenbluten (Epistaxis): Therapie, Onmeda.de, abgerufen am 2. März 2015.
- ↑ IARC: Monograph 106 - Trichloressigsäure, 2014.

