Dimethylaminoethylacrylat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylaminoethylacrylat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H13NO2 | ||||||||||||||||||
| Kurzbeschreibung |
gelbliche Flüssigkeit mit stechendem, aminartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 143,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
172,8 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (240 g/l[2]) unter Hydrolyse, mischbar mit organischen Lösemitteln[4] | ||||||||||||||||||
| Brechungsindex |
1,4368 (20 °C)[5] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
20 mg·m−3[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Dimethylaminoethylacrylat (2-Dimethylaminoethylacrylat) oder DMAEA ist ein funktioneller ungesättigter Carbonsäureester mit einer tertiären Amingruppe. Er ist eine farblose bis gelbliche, mit Wasser unter Hydrolyse mischbare, bei Raumtemperatur flüssige chemische Verbindung mit stechendem, aminartigem Geruch. DMAEA ist ein wichtiges Acrylmonomer, das Copolymeren basische Eigenschaften verleiht.
Darstellung
Die Herstellung von 2-Dimethylaminoethylacrylat erfolgt durch Umesterung von Acrylsäureestern wie Acrylsäuremethylester (R= -CH3)[6] oder Acrylsäureethylester (R= -CH2-CH3)[7] mit 2-Dimethylaminoethanol unter basischer Katalyse mit Zinn- (z. B. Stannoxanen[8]) oder Titanverbindungen (z. B. Tetraisopropylorthotitanat[9]), wobei Produktausbeuten über 95 % d.Th. erzielt werden.[10]

Zum Reaktionsansatz müssen wegen der hohen Polymerisationsneigung von Edukt und Produkt Inhibitoren, wie z. B. Phenothiazin, zugegeben werden. Der im Falle der Verwendung von Acrylsäureethylester entstehende Ethanol bildet mit dem Ethylacrylat ein Azeotrop der Zusammensetzung Ethanol/Ethylacrylat 72,7 %:26,3 %, das bei 77,5 °C unter Normaldruck siedet[11] und zur Erzielung einer hohen Reaktionsausbeute aus dem Reaktionsgemisch abdestilliert wird. Das Produkt wird durch Vakuumdestillation gereinigt und mit ca. 1,000 ppm 4-Methoxyphenol (MEHQ) stabilisiert.
Eigenschaften
Dimethylaminoethylacrylat ist eine klare farblose bis leicht gelbliche Flüssigkeit mit stechendem aminartigen Geruch. Es ist mit Wasser mischbar, reagiert darin basisch und hydrolysiert schnell zu Acrylsäure und Dimethylaminoethanol (DMAE). An Luft bildet es zündfähige Gemische. DMAEA neigt bei erhöhten Temperaturen, bei Bestrahlung und in Gegenwart von Radikalinitiatoren zu spontanen Polymerisation. Es muss daher ausreichend stabilisiert, trocken und unter Lichtausschluss in dicht verschlossenen Gebinden kühl (<25 °C) gelagert werden. DMAEA wirkt beim Einatmen hoch giftig.[2]
Verwendung
Dimethylaminoethylacrylat ist ein funktioneller Acrylsäureester mit basischen Eigenschaften und reagiert als α,β-ungesättigte Carbonylverbindung daher nucleophil in einer Michael-Addition.
Als reaktionsfähiges Monomer bildet DMAEA Homopolymere und Copolymere mit Acrylsäure und Acrylsäuresalzen, -amiden und -estern, sowie mit Methacrylaten, Acrylnitril, Maleinsäureestern, Vinylacetat, Vinylchlorid, Vinylidenchlorid, Styrol, 1,3-Butadien, ungesättigten Polyestern und trocknenden Ölen. In Copolymeren verbessert DMAEA deren Nucleophilie, Basizität, Wasserlöslichkeit und Adhäsion an polare negativ geladene Substrate, sowie Anfärbbarkeit von Acrylfasern mit anionischen Farbstoffen. Solche Copolymere finden Anwendung als Harze und Lacke, Beschichtungen und Kleber, sowie als Haarfestiger.
Der bedeutendste Einsatz für DMAEA ist die Quaternisierung mit Alkylierungsmitteln, z. B. Methylchlorid, Dimethylsulfat, Benzylchlorid, zum quartären Ammoniumsalz.[12]
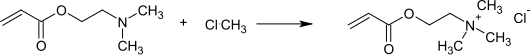
Wichtigster Vertreter ist das Umsetzungsprodukt mit Methylchlorid, Trimethylammoniumethylacrylatchlorid (auch Acryloxyethyltrimethylammoniumchlorid oder ADQUAT bzw. MADAME[1] genannt), das die ausgeprägtesten kationischen Eigenschaften aller Acrylate besitzt und als 80%ige wässrige Lösung gehandelt wird. Copolymerisation von ADQUAT mit Acrylamid führt zu hochmolekularen kationischen Polyacrylamiden, die weite Verbreitung als Koagulantien und Flockungsmitteln[13] in der (Ab)Wasserreinigung und als Retentions- und Entwässerungsmittel in der Papierherstellung finden.
Einzelnachweise
- ↑ a b Arkema S.A.: 2-dimethylaminoethyl acrylate ( des vom 31. Juli 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., abgerufen am 6. Dezember 2016.
- ↑ a b c d e f g h i j k l Eintrag zu 2-(Dimethylamino)ethylacrylat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ SIDS Initial Assessment Report For SIAM 16, May 27-30, 2003, Paris, France: 2-DIMETHYLAMINOETHYL ACRYLATE (PDF; 2,4 MB)
- ↑ Sicherheitsdatenblatt DIMETHYLAMINOETHYLACRYLAT, BASF AG, überarbeitet am 13. Dezember 2010.
- ↑ Technical Information, Dimethylaminoethylacrylate, BASF AG
- ↑ P. Jiang et al., A new catalytic transesterification for the synthesis of N,N-dimethylaminoethyl acrylate with organotin catalyst, Catalysis Letters, vol. 110, 101, August 2006, doi:10.1007/s10562-006-0091-1.
- ↑ Patent US6437173: Process for the continuous manufacturing of dialkylaminoalkyl (meth)acrylates having a critical order of steps. Veröffentlicht am 20. August 2002, Anmelder: Elf Atochem S.A., Erfinder: P. Hurtel et al..
- ↑ Patent EP1299345: Verfahren zur Herstellung von Aminoalkyl(meth)acrylaten. Veröffentlicht am 9. April 2003, Anmelder: Stockhausen GmbH, Erfinder: J. Houben et al..
- ↑ Deutsche Offenlegungsschrift DE 10127939 A1, Verfahren zur Herstellung von (Meth)acrylsäureestern, Erfinder: M. Geissendörfer et al., Anmelder: BASF AG, offengelegt am 29. Mai 2002.
- ↑ Patent US4851568: Process for the manufacture of dialkylaminoalkyl (meth)acrylates. Veröffentlicht am 25. Juli, Anmelder: Elf Atochem S.A., Erfinder: P. Hurtel et al..
- ↑ Technical Data Sheet, Ethyl Acrylate, BASF AG, June 2002.
- ↑ Patent EP0604844: Verfahren zur Herstellung von Trialkylammoniumalkyl(meth)acryl-Verbindungen. Veröffentlicht am 6. Juli 1994, Anmelder: Röhm GmbH, Erfinder: I. Bartholomae et al..
- ↑ SNF Floerger, Water Treatment



