Blastocystis
| Blastocystis | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Blastocystis sp. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Blastocystis | ||||||||||||
| (Alexieff 1911) Brumpt 1912 |
Blastocystis ist eine Gattung einzelliger, fakultativ pathogener Parasiten aus der Gruppe der Stramenopilen. Sie leben strikt anaerob, sind wenig wirtsspezifisch[1] und kommen im Verdauungstrakt unterschiedlicher Tierarten vor. Wirte können z. B. der Mensch, Nutztiere, Nagetiere, Vögel, Reptilien, Amphibien oder Schaben sein.[2] Die Infektionsrate beim Menschen schwankt stark und beträgt in den Industrieländern meist unter 10 %, kann aber in tropischen Entwicklungsländern auch 50 % überschreiten.[3]
Die Deutsche Gesellschaft für Protozoologie (DGP) hat Blastocystis zum „Einzeller des Jahres“ 2022 auserkoren.[4][5][6]
Systematik
Ursprünglich wurde aufgrund ihres hefeähnlichen Aussehens und fehlender Fortbewegungsorgane angenommen, dass es sich bei Blastocystis um eine Hefe oder einen anderen Pilz handle.[7] Später wurde sie den Sporozoa zugerechnet. Erst 1996 konnte aufgrund der rRNA-Sequenz die Zugehörigkeit zu den Stramenopilen nachgewiesen werden.[8][9]
Innerhalb der Gattung Blastocystis wurde ursprünglich an jeder infizierten Tierart eine eigene Art beschrieben. So wurde am Menschen z. B. Blastocystis hominis beschrieben und bei der Ratte Blastocystis ratti. In den vergangenen Jahren ergaben genetische Untersuchung jedoch, dass verschiedene Stämme von Blastocystis am Menschen unterschiedlichen Arten zuzuordnen sind. Ebenso zeigte sich, dass einzelne Blastocystis-Stämme eine Vielzahl von Wirten befallen können.[1] Daher wurde dazu übergegangen, Blastocystis nur noch in Subtypen zu unterteilen, die aufgrund ihrer DNA-Sequenz unterschieden werden. Die vorgeschlagene Bezeichnung ist daher Blastocystis sp. Subtyp nn, wobei nn die Nummer des jeweiligen Subtypus bezeichnet.[10] Derzeit sind mindestens 13 dieser Subtypen bekannt, von denen die meisten auch den Menschen befallen können.[11] Es ist sehr wahrscheinlich, dass mit der Analyse weiterer Tierarten noch weitere Subtypen entdeckt werden.
Infektion
Infektionsraten mit Blastocystis sind in tropischen Ländern höher als in kühleren Regionen. Außerdem sind Industriestaaten mit 1–10 % Infektionsrate deutlich weniger betroffen, als Entwicklungsländer mit Infektionsraten bis 76 %.[12]
Verschiedene Studien belegen, dass zwischen 50 und 80 % aller mit Blastocystis infizierten Personen Symptome zeigen.[13][14] Häufig mit Blastocystis in Verbindung gebrachte Symptome sind unter anderem Reizdarmsyndrom, Durchfall, Verstopfung, Flatulenz, Übelkeit, Bauchkrämpfe, Blähungen, Gewichtsverlust und Müdigkeit. Seltener auch Hautausschlag, Kopfschmerzen, Depressionen, Gelenkschmerzen und Darmentzündung.[15][16][17][18][19][20][21][22][23] Ursprünglich wurde angenommen, dass einige Subtypen von Blastocystis Symptome verursachen, während andere Subtypen keine Symptome auslösen. Malaysische Wissenschaftler berichteten, dass in symptomatischen Patienten große Mengen an amöboiden Zellen gefunden wurden, während diese bei symptomlosen Patienten nicht nachgewiesen werden konnten.[24] In nachfolgenden Studien fanden Wissenschaftler hingegen heraus, dass Subtypen aus symptomatischen Patienten in anderen Patienten keine Symptome auslösen konnten und schlossen daraus, dass Wirtsfaktoren wie Alter oder Genetik einen größeren Einfluss auf die Symptome haben, als der Subtyp von Blastocystis.[25]
Die Übertragung geschieht fäkal-oral über verschmutztes Trinkwasser oder verunreinigte Nahrung. Dabei wird vermutlich nur die zystische Form übertragen.[26] Genomische Studien bestätigen dabei sowohl die Übertragung von Mensch zu Mensch, von Mensch zu Tier und von Tier zu Mensch, wobei der Anteil des jeweiligen Übertragungsweges noch unbekannt ist.[27] Falls eine Übertragung von Tier zu Mensch vorkommt, könnten Nutztiere wie Schweine oder Hunde ein Erregerreservoir darstellen. Darauf deutet auch die Tatsache hin, dass Menschen, die in der Landwirtschaft arbeiten und häufigen Kontakt mit den entsprechenden Tieren haben, häufiger mit Blastocystis infiziert sind.[28]
Die Diagnose von Blastocystis geschieht heute in der Regel mikroskopisch, wobei dieser Test im negativen Fall unzuverlässig ist. Aber auch Antikörpertests sind mittlerweile möglich. Im Falle einer Infektion ist eine orale Behandlung mit Metronidazol, bei dem allerdings auch Resistenzen beschrieben sind, oder (das in Deutschland allerdings nur fraglich verfügbare) Chinolin-Derivat Iodoquinol[29] möglich, falls ein Zusammenhang zwischen den Symptomen und Blastocystis angenommen wird.[30][31][32][33][34] Studien haben allerdings gezeigt, dass bereits 40 % aller Stämme gegen dieses Medikament resistent sind.[35]
In einem 2005 erschienenen Artikel haben ägyptische Ärzte 84 Patienten mit Durchfall und Enteritis identifiziert, deren Symptome anscheinend vom Blastocystis hominis ausgelöst wurden. Bei 36 (86 %) der 42 behandelten Patienten und 16 (38 %) der 42 Personen aus der Placebogruppe (P < .0001) waren nach einer dreitägigen Nitazoxanid Behandlung die Symptome verschwunden und keine Organismen im Stuhl mehr nachweisbar. Die Forscher folgerten, dass entweder Blastocystis hominis pathogen ist und es mit Nitazoxanid behandelt werden kann, oder dass Nitazoxanid einen anderen unbekannten Organismus ausgelöscht hat.[36]
Morphologie
Blastocystis kann abhängig von den Umweltbedingungen verschiedene Formen annehmen, von denen die vakuoläre Form die häufigste ist. Daneben existieren auch multivakuoläre, avakuoläre, granuläre, zystische und amöboide Formen.[37]
- Vakuoläre Form
Typische und am häufigsten gefundene Form, die in der Größe zwischen 2 und 200 µm variieren kann. Eine große zentrale Vakuole füllt fast das komplette Volumen aus und ist nur von einer dünnen Cytoplasmaschicht umgeben, in der sich die anderen Organellen befinden. Ein flockiger Stoff befinden sich ungleichmäßig verteilt in der Vakuole. Es wird angenommen, dass die zentrale Vakuole als Speicherorgan dient, aber auch andere Aufgaben wie etwa Zellteilung sind möglich. In jeder Zelle befinden sich 1–4 Zellkerne.[37]
- Granuläre Form
Besitzt einen ähnlichen Aufbau wie die vakuoläre Form, zusätzlich befinden sich aber Granula sowohl im Cytoplasma, als auch in der Vakuole. Verschiedene Arten von Granula werden vermutet, die eine Rolle beim Stoffwechsel und bei der Vermehrung haben könnten. Die Zellen variieren in der Größe zwischen 6,5 und 80 µm und besitzen ebenfalls 1–4 Kerne.[37]

Balken 5 µm.
- Zystische Form
3–10 µm groß und von einer dicken Zellwand umgeben. Besitzt ebenfalls 1–4 Kerne pro Zelle und mehrere kleine Vakuolen. Durch die dicke Zellwand ist dies die widerstandsfähigste Form, die auch unter schwierigen Bedingungen ein Überleben ermöglicht, wie etwa in Magensäure, in destilliertem Wasser oder über längere Zeit bei Raumtemperatur. Diese Form ist die Verbreitungsform, die von Organismus zu Organismus verbreitet wird.[37][38][39]
- Amöboide Form
Diese Form wird zwischen 2,6 und 7,8 µm groß und besitzt 1–2 Zellkerne. Sie ist stationär und stark adhäsiv. Da sie nur bei infizierten Menschen mit Symptomen nachgewiesen werden konnte wird vermutet, dass sie für die Symptome verantwortlich ist, indem sie sich an der Darmwand festsetzt.[37][40]
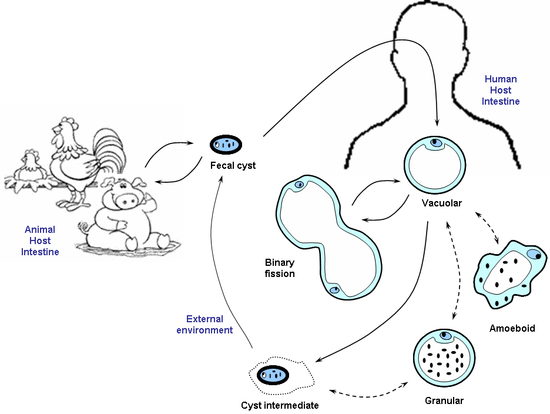
Lebenszyklus
Der Lebenszyklus von Blastocystis ist noch relativ unerforscht, so dass dies nur den vermuteten Lebenszyklus beschreibt. Die Verbreitungseinheit ist die zystische Form, die von infizierten Individuen ausgeschieden und durch verunreinigtes Wasser oder verunreinigte Nahrung aufgenommen wird. Die Zysten infizieren die Epithelzellen des Verdauungstraktes, wo sie sich in vakuoläre Zellen umwandeln und asexuell vermehren. Vakuoläre Zellen können sich anschließend entweder in multivakuoläre Zellen umwandeln, die sich durch Schizogonie ungeschlechtlich vermehren, oder in amöboide Zellen. Die amöboiden Zellen können sich durch Mitose ebenfalls ungeschlechtlich vermehren und sich zu Prä-Zysten umwandeln, welche sich durch Schizogonie zu dickwandigen Zysten umwandeln. Werden diese dickwandigen Zysten ausgeschieden und von einem anderen Organismus aufgenommen, beginnt der Lebenszyklus erneut.[41]
Mitochondrium-ähnliche Organellen
Obwohl Blastocystis strikt anaerob lebt, besitzt es Organellen, die von Mitochondrien abgeleitet sind (englisch mitochondrion-like organelles, MLOs). Wie üblich für Mitochondrien und auch bei den Hydrogenosomen von Nyctotherus gefunden, besitzen die MLOs von Blastocystis ein eigenes Genom.[43] Dieses Genom codiert einige Untereinheiten der NADH-Dehydrogenase, aber nicht für Cytochrom oder ATPase, so dass nur eine unvollständige Atmungskette existiert. Es wird daher vermutet, dass eine alternative Oxidase vorhanden ist. Daneben gibt es weitere Gemeinsamkeiten mit Mitochondrien, was den Stoffwechsel betrifft. Ferner zeigen Genomuntersuchungen als Gemeinsamkeit mit Hydrogenosomen eine [FeFe] Hydrogenase, die in den Organellen lokalisiert ist.[44]
Weblinks
Einzelnachweise
- ↑ a b Noël C, Dufernez F, Gerbod D, et al.: Molecular Phylogenies of Blastocystis Isolates from Different Hosts: Implications for Genetic Diversity, Identification of Species, and Zoonosis. In: Journal of Clinical Microbiology. Band 43, Nr. 1, Januar 2005, S. 348–55, doi:10.1128/JCM.43.1.348-355.2005, PMID 15634993, PMC 540115 (freier Volltext).
- ↑ Yoshikawa H, Wu Z, Howe J, Hashimoto T, Geok-Choo N, Tan KS: Ultrastructural and phylogenetic studies on Blastocystis isolates from cockroaches. In: The Journal of Eukaryotic Microbiology. Band 54, Nr. 1, 2007, S. 33–7, doi:10.1111/j.1550-7408.2006.00141.x, PMID 17300516.
- ↑ Boorom KF, Smith H, Nimri L, et al.: Oh my aching gut: irritable bowel syndrome, Blastocystis, and asymptomatic infection. In: Parasit Vectors. Band 1, Nr. 1, 2008, S. 40, doi:10.1186/1756-3305-1-40, PMID 18937874, PMC 2627840 (freier Volltext).
- ↑ Einzeller des Jahres 2022: Blastocystis ( des vom 10. November 2021 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., auf: Deutsche Gesellschaft für Protozoologie, zuletzt abgerufen am 10. November 2021.
- ↑ Gesellschaft für Protozoologie - Darm-Erreger ist "Einzeller des Jahres 2022", auf: zdf.de vom 8. November 2021
- ↑ "Einzeller des Jahres" steht fest, auf n-tv.de vom 8. November 2021, 6:35 Uhr
- ↑ Brumpt E: Blastocystis hominis N. sp et formes voisines. In: Bulletin of the Exotic Pathology Society. Band 5, 1912, S. 725–30.
- ↑ Stechmann A, Hamblin K, Pérez-Brocal V, et al.: Organelles in Blastocystis that Blur the Distinction between Mitochondria and Hydrogenosomes. In: Current Biology. Band 18, Nr. 8, April 2008, S. 580–5, doi:10.1016/j.cub.2008.03.037, PMID 18403202, PMC 2428068 (freier Volltext).
- ↑ Silberman JD, Sogin ML, Leipe DD, Clark CG: Human parasite finds taxonomic home. In: Nature. Band 380, Nr. 6573, 1996, S. 398, doi:10.1038/380398a0, PMID 8602239.
- ↑ Stensvold CR, Suresh GK, Tan KS, et al.: Terminology for Blastocystis subtypes--a consensus. In: Trends in Parasitology. Band 23, Nr. 3, März 2007, S. 93–6, doi:10.1016/j.pt.2007.01.004, PMID 17241816.
- ↑ Parkar U, Traub RJ, Vitali S, et al.: Molecular characterization of Blastocystis isolates from zoo animals and their animal-keepers. In: Veterinary Parasitology. Band 169, Nr. 1–2, 2010, S. 8–17, doi:10.1016/j.vetpar.2009.12.032, PMID 20089360.
- ↑ Tan KS (2008) New insights on classification, identification, and clinical relevance of Blastocystis spp. Clin Microbiol Rev 21: 639–665
- ↑ Yoshikawa H, Wu Z, Kimata I, et al.: Polymerase chain reaction-based genotype classification among human Blastocystis hominis populations isolated from different countries. In: Parasitol. Res. Band 92, Nr. 1, Januar 2004, S. 22–9, doi:10.1007/s00436-003-0995-2, PMID 14598169.
- ↑ Amin OM: Seasonal prevalence of intestinal parasites in the United States during 2000. In: Am. J. Trop. Med. Hyg. Band 66, Nr. 6, Juni 2002, S. 799–803, PMID 12224595.
- ↑ Gupta R, Parsi K: Chronic urticaria due to Blastocystis hominis. In: Australasian J. Dermatology. Band 47, Nr. 2, 2006, S. 117–9, doi:10.1111/j.1440-0960.2006.00244.x, PMID 16637808.
- ↑ Amin O: The epidemiology of Blastocystis hominis in the United States. In: Research Journal of Parasitology. Band 1, Nr. 1, S. 1–10.
- ↑ Biedermann T, Hartmann K, Sing A, Przybilla B: Hypersensitivity to non-steroidal anti-inflammatory drugs and chronic urticaria cured by treatment of Blastocystis hominis infection. In: Br. J. Dermatol. Band 146, Nr. 6, 2002, S. 1113–4, doi:10.1046/j.1365-2133.2002.473212.x, PMID 12072100.
- ↑ Pasqui AL, Savini E, Saletti M, Guzzo C, Puccetti L, Auteri A: Chronic urticaria and Blastocystis hominis infection: a case report. In: European Review for Medical and Pharmacological Sciences. Band 8, Nr. 3, 2004, S. 117–20, PMID 15368795.
- ↑ Valsecchi R, Leghissa P, Greco V: Cutaneous lesions in Blastocystis hominis infection. In: Acta Dermato-Venereologica. Band 84, Nr. 4, 2004, S. 322–3, doi:10.1080/00015550410025949, PMID 15339085.
- ↑ Micheloud D, Jensen J, Fernandez-Cruz E, Carbone J: [Chronic angioedema and Blastocystis hominis infection]. In: Revista de gastroenterología del Perú : órgano oficial de la Sociedad de Gastroenterología del Perú. Band 27, Nr. 2, 2007, S. 191–3, PMID 17712397 (spanisch).
- ↑ Krüger K, Kamilli I, Schattenkirchner M: [Blastocystis hominis as a rare arthritogenic pathogen. A case report]. In: Zeitschrift für Rheumatologie. Band 53, Nr. 2, 1994, S. 83–5, PMID 8023590.
- ↑ Lee MG, Rawlins SC, Didier M, DeCeulaer K: Infective arthritis due to Blastocystis hominis. In: Ann Rheum Dis. Band 49, Nr. 3, 1990, S. 192–3, doi:10.1136/ard.49.3.192, PMID 2322029, PMC 1004021 (freier Volltext).
- ↑ Carrascosa M, Martínez J, Pérez-Castrillón JL: Hemorrhagic proctosigmoiditis and Blastocystis hominis infectioqar. In: Annals of Internal Medicine. Band 124, Nr. 2, 1996, S. 278–9, PMID 8534017.
- ↑ Tan TC, Suresh KG: Predominance of amoeboid forms of Blastocystis hominis in isolates from symptomatic patients. In: Parasitol. Res. Band 98, Nr. 3, 2006, S. 189–93, doi:10.1007/s00436-005-0033-7, PMID 16323025.
- ↑ Dogruman-Al F, Kustimur S, Yoshikawa H, et al.: Blastocystis subtypes in irritable bowel syndrome and inflammatory bowel disease in Ankara, Turkey. In: Mem. Inst. Oswaldo Cruz. Band 104, Nr. 5, August 2009, S. 724–7, doi:10.1590/S0074-02762009000500011, PMID 19820833.
- ↑ Yoshikawa H, Yoshida K, Nakajima A, Yamanari K, Iwatani S, Kimata I: Fecal-oral transmission of the cyst form of Blastocystis hominis in rats. In: Parasitology Research. Band 94, Nr. 6, Dezember 2004, S. 391–6, doi:10.1007/s00436-004-1230-5, PMID 15480786.
- ↑ Yoshikawa H, Abe N, Iwasawa M, et al.: Genomic Analysis of Blastocystis hominis Strains Isolated from Two Long-Term Health Care Facilities. In: Journal of Clinical Microbiology. Band 38, Nr. 4, April 2000, S. 1324–30, PMID 10747102, PMC 86440 (freier Volltext).
- ↑ Doyle PW, Helgason MM, Mathias RG, Proctor EM: Epidemiology and pathogenicity of Blastocystis hominis. In: Journal of Clinical Microbiology. Band 28, Nr. 1, Januar 1990, S. 116–21, PMID 2298869, PMC 269548 (freier Volltext).
- ↑ Marianne Abele-Horn: Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich, 2., überarbeitete und erweiterte Auflage. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4, S. 290.
- ↑ U. Parkar, R.J. Traub, S. Kumar, et al.: Direct characterization of Blastocystis from faeces by PCR and evidence of zoonotic potential. In: Parasitology. Band 134, Pt 3, 2007, S. 359–367, doi:10.1017/S0031182006001582, PMID 17052374 (englisch).
- ↑ M.S. Mahmoud, W.A. Saleh: Secretory and humoral antibody responses to Blastocystis hominis in symptomatic and asymptomatic human infections. In: Journal of the Egyptian Society of Parasitology. Band 33, Nr. 1, 2003, S. 13–30, PMID 12739797 (englisch).
- ↑ S. Leelayoova, P. Taamasri, R. Rangsin, T. Naaglor, U. Thathaisong, M. Mungthin: In-vitro cultivation: a sensitive method for detecting Blastocystis hominis. In: Ann. Trop. Med. Parasitol. Band 96, Nr. 8, 2002, S. 803–807, doi:10.1179/000349802125002275, PMID 12625935 (englisch).
- ↑ K. Suresh, H. Smith: Comparison of methods for detecting Blastocystis hominis. In: Eur. J. Clin. Microbiol. Infect. Dis. Band 23, Nr. 6, 2004, S. 509–511, doi:10.1007/s10096-004-1123-7, PMID 15168139 (englisch).
- ↑ R. Stensvold, A. Brillowska-Dabrowska, H.V. Nielsen, M.C. Arendrup: Detection of Blastocystis hominis in unpreserved stool specimens by using polymerase chain reaction. In: J. Parasitol. Band 92, Nr. 5, 2006, S. 1081–1087, doi:10.1645/GE-840R.1, PMID 17152954 (englisch).
- ↑ J. Yakoob, W. Jafri, N. Jafri, M. Islam, M. Asim Beg: In vitro susceptibility of Blastocystis hominis isolated from patients with irritable bowel syndrome. In: Br. J. Biomed. Sci. Band 61, Nr. 2, 2004, S. 75–77, PMID 15250669 (englisch).
- ↑ Rossignol JF, Kabil SM, Said M, Samir H, Younis AM: Effect of nitazoxanide in persistent diarrhea and enteritis associated with Blastocystis hominis. In: Clin. Gastroenterol. Hepatol. Band 3, Nr. 10, 2005, S. 987–91, doi:10.1016/S1542-3565(05)00427-1, PMID 16234044.
- ↑ a b c d e Blastocystis hominis. Englisch. Online auf stanford.edu, 21. April 2013.
- ↑ Zaman V, Howe J, Ng M: Ultrastructure of Blastocystis hominis cysts. In: Parasitology Research. Band 81, Nr. 6, 1995, S. 465–9, doi:10.1007/BF00931787, PMID 7567903.
- ↑ Moe KT, Singh M, Howe J, et al.: Observations on the ultrastructure and viability of the cystic stage of Blastocystis hominis from human feces. In: Parasitology Research. Band 82, Nr. 5, 1996, S. 439–44, doi:10.1007/s004360050142, PMID 8738284.
- ↑ Tan TC, Suresh KG: Predominance of amoeboid forms of Blastocystis hominis in isolates from symptomatic patients. In: Parasitol. Res. Band 98, Nr. 3, Februar 2006, S. 189–93, doi:10.1007/s00436-005-0033-7, PMID 16323025.
- ↑ Parasites and Health. Blastocystis hominis infection ( des vom 27. April 2006 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.. Englisch. Online auf dpd.cdc.gov, 21. April 2013.
- ↑ K.S. Tan: Blastocystis in humans and animals: new insights using modern methodologies. In: Veterinary Parasitology. Band 126, Nr. 1–2, Dezember 2004, S. 121–144, doi:10.1016/j.vetpar.2004.09.017, PMID 15567582 (englisch).
- ↑ Alexandra Stechmann, Karleigh Hamblin, Vicente Pérez-Brocal, Daniel Gaston, Gregory S. Richmond, Mark van der Giezen, C. Graham Clark, Andrew J. Roger: Organelles in Blastocystis that Blur the Distinction between Mitochondria and Hydrogenosomes. In: Current Biology. Band 18, Nr. 8, April 2008, S. 580–585, doi:10.1016/j.cub.2008.03.037, PMID 18403202, PMC 2428068 (freier Volltext) – (englisch).
- ↑ A. D. Tsaousis, et al.: Anaerobic Parasitic Protozoa: Genomics and Molecular Biology. Caister Academic Press, 2010, ISBN 978-1-904455-61-5, The Blastocystis Mitochondrion-like Organelles, S. 205–219 (englisch).
