Aminomalononitriltosylat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Aminomalononitriltosylat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H11N3O3S | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 253,28 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
wasserlöslich[1], löslich in Tetrahydrofuran[3] und in Pyridin[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Aminomalononitriltosylat ist das stabile Salz des instabilen Aminomalononitrils AMN[5] mit p-Toluolsulfonsäure. Formal handelt es sich bei Aminomalononitril um das Trimer [(HCN)3] des Cyanwasserstoffs [HCN], das in einer homologen Reihe zwischen dem Tetramer [(HCN)4] Diaminomaleonitril und den Dimeren [(HCN)2] Iminoacetonitril, Aminocyanocarben und Azacyclopropenylidenimin[6] steht. Nach verschiedenen Hypothesen zur präbiotischen chemischen Evolution[7] könnte die Base Aminomalononitril eine Vorstufe für proteinogene Aminosäuren[8] und Peptide[9] als auch für Nukleoside[10][11] darstellen.
Aminomalononitril ist Ausgangsstoff für funktionelle Heterocyclen, wie z. B. Imidazole, Oxazole, Pyrazine und Purine.
Die schwarz gefärbten Polymere und Copolymere des AMN eignen sich für Oberflächenbeschichtungen mit außergewöhnlichen Eigenschaften.[12]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Aminomalononitril wurde als Oligomer des Cyanwasserstoffs (HCN) im All nachgewiesen und ist als mögliche extraterrestrische Quelle für die Nukleinbase Adenin vor dem Hintergrund der Hypothese eines außerirdischen Ursprungs des Lebens von wissenschaftlichem Interesse.[13]
Erstmals isoliert und charakterisiert wurde Aminomalononitril im Jahr 1874 bei der Behandlung von Cyanwasserstoff mit Alkalien, wobei überwiegend dunkel gefärbte Polymere entstanden.[14]
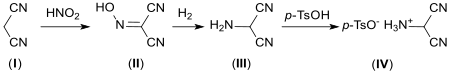
Eine brauchbare Syntheseroute geht aus von Malonodinitril (I), das zunächst mit Salpetriger Säure (HNO2) zu Hydroxyiminomalononitril (II) nitrosiert wird.[15][5] Die Zwischenstufe (II) und deren Amidinsalze könnten eine wichtige Rolle in der chemischen Evolution von Nukleosiden spielen.[16] Reduktion mit Aluminiumamalgam[15] oder Hydrierung an Raney-Nickel[17] oder einem Platin-Kontakt liefert Aminomalononitril (III), das mit p-Toluolsulfonsäure (p-TsOH) durch Salzbildung das stabile Endprodukt Aminomalononitritosylat (IV) bildet (Ausbeuten 49 bis 82 %).[18]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Während die Base Aminomalononitril „als strahlig-blätterige Masse“ auskristallisiert[14], liegt reines Aminomalononitriltosylat als weißer, hygroskopischer Feststoff vor, der bei Lagerung zur Polymerisation neigt und sich braun bis schwarz verfärbt. In saurer wässriger Lösung zersetzt sich die Substanz unter Bildung von Cyanwasserstoff. AMN-Tosylat ist in heißem Wasser, in THF und Pyridin gut löslich und kann zur Reinigung aus Acetonitril umkristallisiert werden.[17]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]α-Aminosäuren und Peptide aus AMN
[Bearbeiten | Quelltext bearbeiten]Bereits in der Erstveröffentlichung wurde die alkalische und saure Hydrolyse von Aminomalononitril zur einfachsten α-Aminosäure Glycin beschrieben.[14]
Mit Aldehyden und Acrylnitril bildet Aminomalononitril in Wasser unter milden Bedingungen, jedoch in niedrigen Ausbeuten, α-Aminosäuren.[19]
Eine Modellreaktion zur Alkylierung von AMN mit Benzylbromid – das unter präbiotischen Bedingungen eher nicht zur Verfügung stand – liefert nach Hydrolyse und Decarboxylierung die essentielle aromatische α-Aminosäure Phenylalanin.[8]
In frühen Arbeiten[20] wurde postuliert, dass Peptide bei der Polymerisation von Aminomalononitril und anschließender Decarboxylierung und Hydrolyse entstehen.[21]
Heterocyclen aus AMN
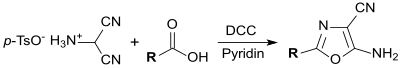
[Bearbeiten | Quelltext bearbeiten]Bei der Umsetzung von Aminomalononitril mit Carbonsäureanhydriden[10] bzw. mit Carbonsäuren in Gegenwart von Dicyclohexylcarbodiimid (DCC) und Pyridin[4] entstehen funktionalisierte 1,3-Oxazole.
In einer mikrowellen-assistierten Eintopfreaktion von AMN-Tosylat (A) mit Trimethylorthoformiat (B) und α-Aminosäureestern (C) entstehen substituierte Imidazole (D), aus denen mit Ameisensäure Purin-6-one (Oxopurine) (E) gebildet werden, die antivirale Eigenschaften aufweisen.[3]

Auch substituierte Pyrazine als Vorstufen für Pteridine, wie z. B. Folsäure, sind aus AMN-Tosylat durch Reaktion von Glyoxaloxim-Derivaten[22] oder β-Ketoestern[23] zugänglich.

Oligomere und Polymere aus AMN
[Bearbeiten | Quelltext bearbeiten]Oligomere bzw. Polymere aus Aminomalononitril – bzw. HCN-Trimer (HCN)3 – werden oft unter dem Begriff „HCN-Polymere“ zusammengefasst. Die Reaktion von AMN-Tosylat in alkalischer (pH 9) wässriger Kaliumcyanidlösung erzeugt das HCN-Tetramer [(HCN)4] Diaminomaleonitril (DAMN)[10], das in der cis-Form vorliegt.

Mit Formamidin reagiert AMN zu dem heterocyclischen Aminoimidazolcarbonitril (AICN), einem weiteren HCN-Tetramer, das nach partieller Hydrolyse zum Carboxamid (AICA) mit Cyanwasserstoff zu Adenin cyclisiert.[24] Die Purinbase Adenin kann formal auch als HCN-Pentamer [(HCN)5] aufgefasst werden.[25]
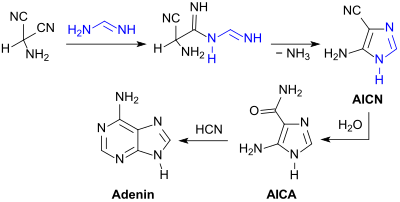
Aus der Zwischenstufe AICN ist auch die Purinbase Guanin zugänglich.[24]
Die Polymerisation des HCN-Oligomeren Aminomalononitril (aus AMN-Tosylat im Basischen) liefert meist braun bis schwarz gefärbte und in ihrer chemischen Konstitution äußerst komplexe Feststoffe unklarer chemischer Struktur, deren höhermolekulare Varianten durch Vernetzungs- und Kondensationsreaktionen weitgehend unlöslich sind.[26]
Ein hypothetischer Reaktionsweg verläuft über ein lineares Polyimin (X) und dessen intramolekulare Cyclisierung und Aromatisierung zu einem Polyaminoimidazol (Y), das durch intramolekulare Oxidation zu einem leiterartigen Polyimidazol und anschließend durch intermolekulare Ammoniakabspaltung verzweigen oder durch Hydrolyse zu einem Polyimidazolon (Z) weiterreagieren kann.[26]
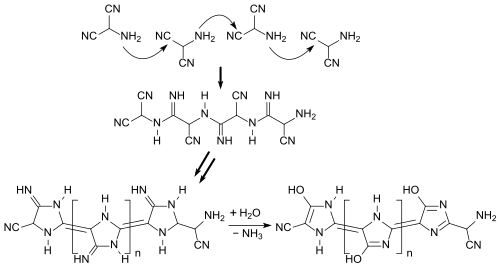
Polymeres Aminomalononitril und Copolymere von AMN mit Comonomeren wie Hydroxybenzaldehyden lassen sich auch aus wässriger Lösung erzeugen und bilden dabei Filme,[27] die sich auf feste Träger aufziehen lassen. Die Filme besitzen ungewöhnliche Eigenschaften, z. B. sehr hohe Hydrophilie und ausgezeichnete Biokompatibilität,[12] die sie für biomedizinische Anwendungen interessant erscheinen lassen.[28]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Hans R. Kricheldorf: Leben durch chemische Evolution? – Eine kritische Bestandsaufnahme von Experimenten und Hypothesen. 1. Auflage, Springer, Berlin, 2019, ISBN 978-3-662-57977-0.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Aminomalononitrile p-Toluenesulfonate bei TCI Europe, abgerufen am 4. August 2022.
- ↑ a b c d Datenblatt Aminomalononitrile p-Toluenesulfonate bei Sigma-Aldrich, abgerufen am 4. August 2022 (PDF).
- ↑ a b B.M. Bizzarri, A. Fanelli, L. Botta, M. De Angelis, A.T. Palamara, L. Nencioni, R. Saladino: Aminomalononitrile inspired prebiotic chemistry as a novel multicomponent tool for the synthesis of imidazole and purine derivatives with antiinfluenza A virus activity. In: RSC Adv. Band 11, 2021, S. 30020–30029, doi:10.1039/d1ra05240c.
- ↑ a b F. Freeman, T. Chen, J.B. van der Linden: Synthesis of highly functionalized 1,3-oxazoles. In: Synthesis. Band 8, 1997, S. 861–862, doi:10.1055/s-1997-1296.
- ↑ a b Patent US3670007: Aminomalonitrile and method of preparation thereof. Angemeldet am 21. November 1967, veröffentlicht am 13. Juni 1972, Anmelder: The Salk Institute for Biological Studies, Erfinder: J.P. Ferris.
- ↑ J.B. Moffat: Three dimers of hydrogen cyanide: iminoacetonitrile, aminocyanocarbene, and azacyclopropenylidenimine; geometry-optimized Ab initio energies. In: J. Chem. Soc., Chem. Commun. Band 21, 1975, S. 888–890, doi:10.1039/C39750000888.
- ↑ N. Kitadai, S. Maruyama: Origins of building blocks of life: A review. In: Geosci. Front. Band 9, 2018, S. 1117–1153, doi:10.1016/j.gsf.2017.07.007.
- ↑ a b C. Kuroda, R. Kobayashi, S. Kurebayashi, K. Tazawa, A. Masuda, R. Takeuchi, A. Washio, H. Onuki: Reaction of aminomalononitrile and benzylic compounds as a plausible route to phenylananine. In: Nat. Prod. Commun. Band 15, Nr. 1, 2020, S. 1–5, doi:10.1177/1934578X20901417.
- ↑ R.E. Moser, A.R. Claggett, C.N. Matthews: Peptide formation from aminomalononitrile (HCN trimer). In: Tetrahedron Lett. Band 9, Nr. 13, 1968, S. 1605–1608, doi:10.1016/S0040-4039(01)99012-4.
- ↑ a b c J.P. Ferris, Leslie Orgel: Aminomalononitrile and 4-amino-5-cyanoimidazole in hydrogen cyanide polymerization and adenine synthesis. In: J. Amer. Chem. Soc. Band 87, Nr. 21, 1965, S. 4976–4977, doi:10.1021/ja00949a068.
- ↑ F.M. Kruse, J.S. Teichert, Oliver Trapp: Prebiotic nucleoside synthesis: The selectivity of simplicity. In: Chem. Eur. J. Band 26, Nr. 65, 2020, S. 14776–14790, doi:10.1002/chem.202001513.
- ↑ a b R.J. Toh, R. Evans, H. Thissen, N.H. Voelcker, M. D’ischia, V. Ball: Structured superhydrophilic coatings made from aminomalononitrile. In: Nanomaterials Science & Engineering. Band 2, Nr. 2, 2020, S. 74–82, doi:10.34624/nmse.v2i2.11175.
- ↑ M.C. Bacchus-Montabonel: Theoretical investigation of proton collisions on prebiotic candidates: hydrogen cyanide polymers. In: Phys. Chem. Chem. Phys. Band 19, Nr. 30, 2017, S. 19566–19572, doi:10.1039/C7CP00826K.
- ↑ a b c R. Wippermann: Ueber Tricyanwasserstoff, eine der Blausäure polymere Verbindung. In: Ber. Dtsch. Chem. Ges. Band 7, Nr. 1, 1874, S. 767–772, doi:10.1002/cber.187400701244.
- ↑ a b J.P. Ferris, R.A. Sanchez, R.W. Mancuso: Aminomalononitrile p-Toluenesulfonate In: Organic Syntheses. 48, 1968, S. 1, doi:10.15227/orgsyn.048.0001; Coll. Vol. 5, 1973, S. 32 (PDF).
- ↑ S. Becker, C. Schneider, H. Kamorra, A. Crisp, T. Amatov, M. Dejmek, T. Carell: Wet-dry cycles enable the parallel origin of canonical and non-canonical nucleosides by continuous synthesis. In: Nature Commun. Band 9, 2018, S. 163, doi:10.1038/s41467-017-02639-1.
- ↑ a b H. Junek, M. Mittelbach: Synthesen mit Nitrilen, LIV [1] Reduktion von Oximinomalonitril zu Aminomalonitril mittels Raney-Katalysatoren. In: Z. Naturforsch. B. Band 34, Nr. 2, 1979, S. 280–282, doi:10.1515/znb-1979-0228.
- ↑ Patent US4827015: Process for the production of aminomalonic acid dinitrile. Angemeldet am 2. Juni 1988, veröffentlicht am 2. Mai 1989, Anmelder: Lonza Ltd., Erfinder: H. Mettler.
- ↑ J.W. Thanassi: Reactions of aminomalononitrile with electrophiles. In: J. Mol. Evol. Band 7, 1975, S. 65–73, doi:10.1007/BF01732180.
- ↑ C.N. Matthews, R.E. Moser: Prebiological protein synthesis. In: PNAS. Band 56, Nr. 4, 1966, S. 1087–1092, doi:10.1073/pnas.56.4.1087.
- ↑ C.N. Matthews: Response: HCN Did Not Condense to Give Heteropolypeptides on the Primitive Earth. In: Science. Band 203, Nr. 4385, 1979, S. 1136–1137, doi:10.1126/science.203.4385.1136.
- ↑ Patent US5877319: Process for preparing 3-alkoxy-5-alkylpyrazin-2-amines. Angemeldet am 8. Juli 1997, veröffentlicht am 2. März 1999, Anmelder: Lonza AG, Erfinder: W. Brieden, R. Fuchs.
- ↑ Edward C. Taylor, D.J. Dumas: Pteridines. 47. Preparation and chemistry of 2-amino-6-carbalkoxy-3-cyano-5-substituted pyrazine-1-oxides: Synthesis of pterin-6-carboxaldehyde. In: J. Org. Chem. Band 45, Nr. 12, 1980, S. 2485–2489, doi:10.1021/jo01300a045.
- ↑ a b M. Aydan, R. Kumar, R. Krishnamurthy: Chemistry of abiotic nucleotide synthesis. In: Chem. Rev. Band 120, Nr. 11, 2020, S. 4766–4805, doi:10.1021/acs.chemrev.9b00546.
- ↑ D. Roy, K. Najafian, Paul von Ragué Schleyer: Chemical evolution: the mechanism of the formation of adenine under prebiotic conditions. In: PNAS. Band 104, Nr. 44, 2007, S. 17272–17277, doi:10.1073/pnas.0708434104.
- ↑ a b M. Ruiz-Bermejo, J.L. de la Fuente, C. Pérez-Fernández, E. Mateo-Marti: A comprehensive review of HCN-derived polymers. In: Processes. Band 9, 2021, S. 597, doi:10.3390/pr9040597.
- ↑ H. Thissen, R.A. Evans, V. Ball: Films and materials derived from aminomalononitrile. In: Processes. Band 9, 2021, S. 82, doi:10.3390/pr9010082.
- ↑ D.J. Menzies, A. Ang, H. Thissen, R. Evans: Adhesive prebiotic chemistry inspired coatings for bone contacting applications. In: Biomater. Sci. Eng. Band 3, Nr. 5, 2017, S. 793–806, doi:10.1021/acsbiomaterials.7b00038.
