Cortisol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Hydrocortison | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C21H30O5 | |||||||||||||||||||||
| Kurzbeschreibung |
bitter schmeckende, farblose Plättchen[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 362,47 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Cortisol oder Kortisol (auch Hydrocortison und Hydrokortison) ist ein Stresshormon, das katabole (= abbauende) Stoffwechselvorgänge aktiviert und so dem Körper energiereiche Verbindungen zur Verfügung stellt. Seine dämpfende Wirkung auf das Immunsystem wird in der Medizin häufig genutzt, um überschießende Reaktionen zu unterdrücken und Entzündungen zu hemmen.
Cortisol wird zur Gruppe der Glucocorticoide gerechnet. Die Bildung von Cortisol in der Zona fasciculata der Nebennierenrinde wird durch das sogenannte adrenocorticotrope Hormon (ACTH) aus dem Hypophysenvorderlappen stimuliert (ad-reno-cortico-trop = auf die Neben-nieren-rinde gerichtet). Eine Überfunktion führt zum klinischen Bild des Morbus Cushing, eine Unterfunktion wird Morbus Addison genannt. Zudem ist Cortisol an der Regulation des Wachstums beteiligt.
Entdeckung
[Bearbeiten | Quelltext bearbeiten]In den 1930er Jahren befassten sich amerikanische und europäische Forscher unabhängig voneinander mit Wirkstoffen, die von den Drüsen der Nebenniere abgesondert wurden. In den Organen kommen die wegen ihrer hormonellen Wirkung gesuchten Substanzen in winzigen Mengen vor. So war mit den damals vorhandenen Analysemethoden eine unmittelbare Strukturaufklärung unmöglich. Edward Calvin Kendall und Mitarbeiter mussten daher Drüsen von 1,25 Millionen Rindern aus Schlachthäusern extrahieren.[4] Aus dem Extrakt isolierten sie u. a. acht Steroide, welche zunächst als Compounds A–H bezeichnet wurden. Kendall gab dann seiner Compound E den Namen Cortison; Compound F wurde später als Cortisol bezeichnet. Tadeus Reichstein konnte die chemische Struktur und Konfiguration der Substanz aufklären.[5][6][7] Die chirale Substanz kann formal vom Steroid-Kohlenwasserstoff Pregnan abgeleitet werden, wodurch sich die Nummerierung der Kohlenstoffatome ergibt. Sie enthält drei Hydroxygruppen und zwei Ketogruppen, von denen die eine α, β-ungesättigt (konjugiert) ist, eine Enonstruktur. Die Hydroxygruppen werden als primär, sekundär und tertiär klassifiziert, was sich in der Reaktivität widerspiegelt.
 Pregnan mit Nummerierung der Kohlenstoffatome.
Die CH3-Gruppen und die CH3CH2-Gruppe sind β-konfiguriert, d. h. weisen auf den Betrachter.
Pregnan mit Nummerierung der Kohlenstoffatome.
Die CH3-Gruppen und die CH3CH2-Gruppe sind β-konfiguriert, d. h. weisen auf den Betrachter.
Synthese
[Bearbeiten | Quelltext bearbeiten]Biosynthese
[Bearbeiten | Quelltext bearbeiten]Cortisol ist ein Steroidhormon der Nebennierenrinde. Es entsteht aus Cholesterin und ist daher abgeleitet vom Isopentenylpyrophosphat (IPP). Dabei findet zunächst in den Mitochondrien der Nebennierenrinde die Synthese von Pregnenolon statt, einer gemeinsamen Vorstufe von Steroidhormonen (z. B. Cortisol), Mineralocorticoiden (z. B. Aldosteron), Androgenen (z. B. Testosteron) und Östrogenen (z. B. Östradiol). Das Enzym, das die Bildung von Pregnenolon über die Zwischenverbindung 20α,20β-Dihydroxycholesterin katalysiert, heißt Cholesterindesmolase und ist eine Monooxygenase, die NADPH als Cofaktor benötigt. Bei dieser Sechs-Elektronen-Oxidation werden drei NADPH- und drei Sauerstoffmoleküle verbraucht. Sie benötigt als Coenzym das Häm-haltige Cytochrom P450. Der geschwindigkeitsbestimmende Schritt der Cortisolbiosynthese ist jedoch nicht die Cholesterindesmolase, sondern eine Cholesterin-Translokase, die sich an der äußeren Mitochondrienmembran befindet und das an der inneren Mitochondrienmembran benötigte Cholesterin transportiert. Dieses als „StAR-Protein“ (steroidogenic acute regulatory protein) bekannte Protein wird bei Anwesenheit von cAMP (zyklisches Adenosinmonophosphat) vermehrt exprimiert und ist daher der regulatorische Schritt, an dem das ACTH unter anderem die Cortisolsynthese beeinflusst.
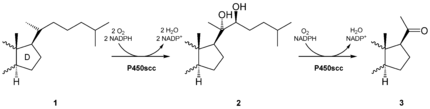
Pregnenolon verlässt das Mitochondrium und wird durch eine 3β-Hydroxysteroid-Dehydrogenase und eine Isomerase in Progesteron umgewandelt. Im Endoplasmatischen Reticulum (ER) wird dieses Progesteron durch das Enzym 17-Steroidhydroxylase in 17α-Hydroxyprogesteron umgewandelt. Durch eine weitere Hydroxylierung unter Katalyse der 21-Hydroxylase entsteht 11-Desoxycortisol, das dann wieder im Mitochondrium durch die Steroid-11β-Hydroxylase in Cortisol umgewandelt wird. Bei allen beschriebenen Enzymen handelt es sich um spezifische eisenhaltige Cytochrom-P450-Enzyme. Bei einem Defekt von Enzymen der Cortisolbiosynthese (meist 21-Hydroxylase) wird die Sekretion von ACTH nicht über eine negative Rückkopplung durch Cortisol gehemmt, und es sammeln sich die Vorstufen des 11-Desoxycortisols an. Diese können nun vermehrt zur Synthese von Androgenen genutzt werden, und es tritt als Krankheitsbild ein adrenogenitales Syndrom auf.
Chemische Synthesen
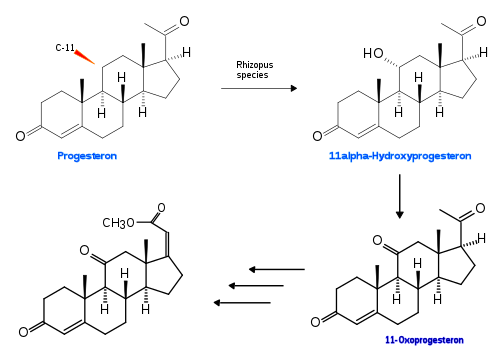
[Bearbeiten | Quelltext bearbeiten]Für weitere pharmakologische Untersuchungen war es zwingend notwendig, chemische Synthesen zu entwickeln. Diese waren zwar für die „Kunst der Organischen Synthese“ Pionierleistungen, aber sehr aufwendig und ergaben sehr geringe Ausbeuten. Frühere Studien der Biosynthese hatten jedoch gezeigt, dass Corticoide in vivo aus Progesteron gebildet werden, indem sowohl C-11 als auch die Seitenkette hydroxyliert werden. Progesteron kann aus Steroiden pflanzlicher Rohstoffe, z. B. Sitosterin, hergestellt werden. Dies führte Forscher der US-amerikanischen Firma Upjohn dazu, nach Organismen im Erdboden zu suchen, welche durch ihren Stoffwechsel solche Hydroxylierungen möglich machten. Rhizopus arrhizus und R. nigricans waren in der Lage, Progesteron in 11α-Hydroxyprogesteron umzuwandeln.
Auf dieser Reaktion basierte eine Synthese, welche in sieben weiteren Schritten das erste Zielmolekül (Acetylcortisol) erreichte.[8] Die Substanz wird in der Regel – nicht nomenklaturgerecht – als Cortisolacetat oder Hydrocortisonacetat bezeichnet.
Zwar besteht die Seitenkette an C-17 im Progesteron ebenfalls aus zwei Kohlenstoffatomen, wie im Zielmolekül, aber die Hydroxylierung von C-17 und C-21 war nicht einfach zu erreichen. Außerdem musste die α-Konfiguration der Hydroxygruppe an C-11 nach beta(β) invertiert werden. Strategisch war beabsichtigt, die Methylgruppe des Ketons (C-21) zu bromieren und durch eine Faworski-Umlagerung zur α,β-ungesättigten Carbonsäure bzw. deren Ester zu gelangen. Um selektiv die Methylgruppe zu bromieren, wurde diese aktiviert, indem nach dem Prinzip der Claisen-Kondensation mit Oxalsäure-diethylester ein Enolat erzeugt wurde. Dieses konnte durch Reaktion mit zwei Äquivalenten Brom in das gewünschte Dibromketon übergeführt werden, welches durch Behandlung mit Natriummethoxid im selben Reaktionsgefäß den Steroid-Ester lieferte.
Dieser sollte nun mit Lithiumaluminiumhydrid zum Alkohol reduziert werden, welcher eine weiter nutzbare Allylstruktur besitzt. Für die Reduktion war es notwendig, die Ketogruppe an C-3 zu schützen. Hierfür wurde die Dioxolan-Schutzgruppe verwendet. Bei der Umwandlung erfolgte aber eine Deprotonierung am C-6 (Tautomerie des konjugierten Enonsystems), was für die folgenden Reaktionsschritte jedoch unerheblich war.
Anstelle des Schützens via Dioxolan wurde auch die Reaktion des Ketons mit Pyrrolidin erforscht, bei der ein konjugiertes Dienamin entsteht, mit trigonalen Zentren an C-3, C-4, C-5 und C-6. Bei dessen Hydrolyse wird ebenfalls das Enonsystem zurückgebildet.

Mit Acetanhydrid wurde die HO-Gruppe an C-21 geschützt. Die C-C-Doppelbindung zwischen C-17 und C-20 ließ sich oxidieren: Osmiumtetroxid, kombiniert mit Wasserstoffperoxid oder Phenyliodosoacetat lieferte Acetylcortisol („Hydrocortisonacetat“). Letzteres – selbst ein pharmazeutischer Wirkstoff – kann zu Cortisol „verseift“ (hydrolysiert) werden.
Physiologische Wirkung
[Bearbeiten | Quelltext bearbeiten]Cortisol besitzt ein sehr breites Wirkungsspektrum und hat im Stoffwechsel vor allem Effekte auf den Kohlenhydrathaushalt (Förderung der Glukoseproduktion in der Leber und damit der Insulinwirkung entgegenwirkend), den Fettstoffwechsel (Förderung der lipolytischen Wirkung von Adrenalin und Noradrenalin) und den Proteinumsatz (katabol). Cortisol hat eine ähnliche Wirkung wie Aldosteron und wird deshalb in Niere, Darm und einigen anderen Geweben zu Cortison oxidiert, das nicht an den Mineralcorticoid-Rezeptor bindet und daher keinen antidiuretischen Effekt besitzt, d. h., es behindert nicht die Ausscheidung giftiger Stoffe über den Harn. Bei einem Mangel an funktionstüchtigem Nebennierenrindengewebe (Morbus Addison) muss Cortisol substituiert werden.
Cortisol ist für den Menschen und höhere Tiere das wichtigste Kortikosteroid-Hormon und lebensnotwendig. Es ist neben den Katecholaminen ein wichtiges Stresshormon und beeinflusst unter anderem den Blutdruck.[9] Das Cortisolsystem reagiert aber träger als das Katecholaminsystem, da es anders als Katecholamine und Glucagon nicht über G-Protein-gekoppelte Rezeptoren, sondern über eine Regulation der Genexpression wirkt. Hierbei bindet Cortisol an den nukleären Glucocorticoidrezeptor. Dieser wird dadurch in seiner Eigenschaft als Transkriptionsfaktor aktiviert und führt zur Expression verschiedener Zielgene, z. B. von Enzymen der Gluconeogenese oder auch von β2-Adrenozeptoren. So erklären sich die Wirkungen von Cortisol auf den Stoffwechsel. Daneben kann der cortisolgebundene Glucocorticoidrezeptor auch direkte Wechselwirkungen mit anderen Transkriptionsfaktoren (z. B. NF-κB) eingehen, dieser Mechanismus spielt für die Wirkung auf das Immunsystem eine Rolle (s. u.).
Die höheren Instanzen der Cortisol-Ausschüttung sind der Hypothalamus über die Hypophyse. Der Hypothalamus setzt hierbei das CRH (Corticotropin-releasing Hormone) frei, das in der Adenohypophyse (Hypophysenvorderlappen) zur Freisetzung des adrenocorticotropen Hormons (ACTH) führt. Bemerkenswert bei diesen Hormonen ist eine pulsatile Freisetzung, das heißt, sie werden in regelmäßigen Schüben (7–10 pro Tag) ausgeschüttet.[10] Die Cortisolwerte im Blutserum liegen für gewöhnlich am Morgen bei 165–690 nmol/l (Cortisol total) bzw. bei 5–23 nmol/l (freies Cortisol) und weisen eine typische Schwankung im Tagesverlauf auf (circadiane Rhythmik). Der höchste Wert wird morgens kurz nach dem Aufwachen erreicht (Cortisol Awakening Response, CAR). Wegen dieser starken circadianen Schwankung ist die einmalige Messung von Cortisol nicht sinnvoll. Die Überprüfung der Nebennierenrindenfunktion erfordert daher die Bestimmung eines Cortisol-Tagesprofils.
Pharmakologische Anwendung
[Bearbeiten | Quelltext bearbeiten]Cortisol wirkt in höheren Dosen entzündungshemmend und immunsuppressiv. Hydrocortison, wie die synthetische Form von Cortisol in der Pharmakologie genannt wird, wird zur Immunsuppression oral eingenommen oder intravenös injiziert. Hierbei muss aber beachtet werden, dass die Wirkung der intravenös applizierten Dosen die der oral verabreichten deutlich übersteigt, da Cortisol in der Leber metabolisiert wird (Glukoronidierung und anschließend Ausscheidung über die Niere, siehe First-Pass-Effekt). Jedoch ist diese Methode effektiver bei Erkrankungen mit gestreuten Symptomen wie Nesselsucht.
Zur entzündungshemmenden Wirkung (etwa bei Ekzemen) wird Hydrocortison als Salbe auf die betroffenen Hautpartien aufgetragen. Bei Gelenkentzündungen (beispielsweise durch Gicht) kann der Wirkstoff auch in das entzündete Gelenk injiziert werden.
Bei einer Nebennierenrindenunterfunktion (Morbus Addison) wird Cortisol als Substitutionstherapie verabreicht.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]- Monopräparate
- Alfacorton (CH), Colifoam (A), Ebenol (D), Ekzemsalbe (A), Hydrocortone (A), Hydrocutan (D), Hydroderm (A), Hydrogalen (D), Linola Akut (D), Linolacort Hydro (D), Locoid (CH), Muni (D), Sanadermil (CH), Sanatison (D), Solu-Cortef (CH), Soventol Hydrocort (D), Soventol HydroSpray (D), Systral Hydrocort (D), zahlreiche Generika (D, CH)
- Kombinationspräparate
- Baycuten HC (D), Ciproxin HC (CH), Cortifluid (CH), Daktacort (CH), Dermacalm (CH), Fucidin H (CH), Haemocortin (CH), Hydoftal (A), Hydrodexan (D), Neo-Hydro (CH), Otosporin (A, CH), Pigmanorm (D), Septomixine (CH)
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Cortisol. Neurolab
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu Hydrocortison. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2014.
- ↑ a b Datenblatt Hydrocortisone bei Sigma-Aldrich, abgerufen am 2. November 2021 (PDF).
- ↑ Eintrag zu Hydrocortisone in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 17. August 2021. (Seite nicht mehr abrufbar)
- ↑ E.C. Kendall. In: Cold Spring Harbor Quart. Biol. Band 5, 299 (1937).
- ↑ Helvetica Chimica Acta, 20, 953 (1937).
- ↑ Helvetica Chimica Acta, 25, 988 (1942).
- ↑ Helvetica Chimica Acta, 30, 205 (1947).
- ↑ O. Mancera, H. J. Ringold, C. Djerassi, G. Rosenkranz, F. Sondheimer. In: Journal of the American Chemical Society, 1953, Band 75, 1286.
- ↑ Vgl. auch T. Oyama, A. Matsuki: Plasma cortisol level during anaesthesia and surgery in man. In: Der Anaeasthesist. Band 20, 1971, S. 140 ff.
- ↑ Vgl. auch M. Follenius, G. Brandenberger, B. Hietter, M. Siméoni, B. Reinhardt; Diurnal cortisol peaks and their relationships to meals. In: J Clin Endocrinol Metab. Band 55, 1982, S. 757 ff.