Ibrutinib
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
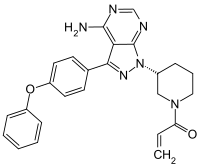
| Freiname | Ibrutinib | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C25H24N6O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 440,50 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Ibrutinib (Hersteller: AbbVie; in der EU von Janssen vermarktet) ist ein Arzneistoff aus der Gruppe der Tyrosinkinase-Inhibitoren, der unter dem Handelsnamen Imbruvica u. a. zur Behandlung der chronischen lymphatischen Leukämie (CLL) sowie des Mantelzelllymphoms eingesetzt wird.[2][3][4]
Entwicklung und klinische Studien[Bearbeiten | Quelltext bearbeiten]
Ibrutinib ist ein – ursprünglich von Pharmacyclics entwickelter – oral einzunehmender Tyrosinkinase-Inhibitor, der die Bruton-Tyrosinkinase (BTK) hemmt. Diese spielt eine zentrale Rolle bei der intrazellulären Signalübertragung in B-Lymphozyten. Das klinische Einsatzgebiet von Ibrutinib sind daher maligne B-Zell-Erkrankungen, im engeren Sinne B-Zell-Non-Hodgkin-Lymphome, aber auch Autoimmunerkrankungen, bei denen B-Zellen eine Rolle spielen, wie die Rheumatoide Arthritis.
Pharmacyclics wurde 2015 von Abbvie gekauft.[5]
Ibrutinib (damals noch unter dem Namen PCI-32765) wurde als Designer drug zur Hemmung von BTK erstmals 2007 synthetisiert. Die Substanz zeigte eine hohe in-vitro-Wirksamkeit gegen Lymphom-Zellen und gelangte schließlich in die klinische Testung. In zwei großen Therapiestudien, die im New England Journal of Medicine publiziert wurden, zeigte Ibrutinib Wirksamkeit bei intensiv vorbehandelten Patienten mit therapierefraktärer chronischer lymphatischer Leukämie (CLL) bzw. mit Mantelzelllymphom.[6] Aufgrund dieser Studienergebnisse beurteilte die US-amerikanische Food and Drug Administration (FDA) das Medikament mit dem Prädikat breakthrough („Durchbruch“), was ein beschleunigtes Zulassungsverfahren zur Folge hat (siehe auch Break Through Therapy).[7] Ibrutinib wurde am 13. November 2013 von der FDA für die Behandlung des Mantelzelllymphoms zugelassen. Der Handelsname in den Vereinigten Staaten lautet Imbruvica.[8] Ibrutinib wurde im Februar 2014 von der FDA für die Behandlung der CLL zugelassen.[9]
Nach den Ergebnissen der im Dezember 2015 veröffentlichten RESONATE-2-Studie war Ibrutinib auch in der Erstlinientherapie der CLL (d. h. bei nicht vorbehandelten Patienten) der Therapie mit Chlorambucil überlegen (gemessen am Gesamtüberleben, progressionsfreien Überleben).[10]
Eine im April 2015 publizierte Studie zeigte eine sehr gute Wirkung von Ibrutinib bei Patienten mit Makroglobulinämie Waldenström. Die Studie umfasste 63 Patienten, die mindestens eine vorangegangene Behandlung erhalten hatten und rezidiviert waren. Bei mehr als 90 % der Patienten war die Behandlung wirksam, bei 73 % sehr gut wirksam.[11]
Zulassungsstatus[Bearbeiten | Quelltext bearbeiten]
In den USA[Bearbeiten | Quelltext bearbeiten]
Im August 2017 erfolgte durch die FDA die sechste Zulassung für Ibrutinib: Graft-versus-Host-Reaktion.[12] Damit sind insgesamt in den USA folgende Indikationen zugelassen:
- Chronische lymphatische Leukämie (CLL),
- small lymphocytic lymphoma (SLL),
- Morbus Waldenström (WM),
- vorbehandeltes Mantelzelllymphom (MCL) als Einzelsubstanz,
- vorbehandelte marginal zone lymphoma (MZL) und
- vorbehandelte chronische Graft-versus-Host-Reaktion (cGVHD).
In der EU[Bearbeiten | Quelltext bearbeiten]
Im Juli 2014 empfahl der Ausschuss für Humanarzneimittel der Europäischen Arzneimittel-Agentur (EMA) Ibrutinib zur Zulassung für die Indikation Chronische Lymphatische Leukämie (CLL). Ibrutinib erhielt zudem eine Empfehlung zur Zulassung für die Indikation Mantelzelllymphom.[13]
In der EU sind folgende Indikationen zugelassen:[3]
- Chronische lymphatische Leukämie (CLL) in der Erstlinientherapie als Einzelsubstanz,
- vorbehandeltes Mantelzelllymphom (MCL) als Einzelsubstanz und
- vorbehandelter Morbus Waldenström als Einzelsubstanz (WM)
Literatur[Bearbeiten | Quelltext bearbeiten]
- Vinay Prasad, Sham Mailankody: Research and Development Spending to Bring a Single Cancer Drug to Market and Revenues After Approval. In: JAMA Internal Medicine. 2017 September, doi:10.1001/jamainternmed.2017.3601.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von (R)-1-(3-(4-amino-3-(4-phenoxyphenyl)-1H-pyrazolo[3,4-d]pyrimidin-1-yl)piperidin-1-yl)prop-2-en-1-one im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 19. Mai 2022.
- ↑ European public assessment report (EPAR), EMA, abgerufen am 9. Mai 2017.
- ↑ a b Zusammenfassung des EPAR für die Öffentlichkeit, EMA, abgerufen am 18. September 2017.
- ↑ Summary of the risk management plan (RMP) for Imbruvica (ibrutinib), EMA, abgerufen am 9. Mai 2017.
- ↑ AbbVie Completes Acquisition of Pharmacyclics, PM AbbVie vom 26. Mai 2015, abgerufen am 18. September 2017.
- ↑ Ibrutinib: Kinase-Inhibitor gegen B-Zell-Malignome aktiv. Deutsches Ärzteblatt, 20. Juni 2013, abgerufen am 23. Juli 2013.
- ↑ Ibrutinib Receives Two Oncology Breakthrough Therapy Designations from U.S. Food and Drug Administration. prnewswire.com, 12. Februar 2013, abgerufen am 29. Juli 2013 (englisch).
- ↑ FDA approves Imbruvica for rare blood cancer. U.S. Department of Health and Human Services, 13. November 2013, abgerufen am 13. November 2013.
- ↑ FDA approves Zydelig for three types of blood cancers. U.S. Department of Health and Human Services, 23. Juli 2014, abgerufen am 29. Juli 2014.
- ↑ Burger JA1, Tedeschi A, Barr PM, Robak T, Owen C, Ghia P, Bairey O, Hillmen P, Bartlett NL, Li J, Simpson D, Grosicki S, Devereux S, McCarthy H, Coutre S, Quach H, Gaidano G, Maslyak Z, Stevens DA, Janssens A, Offner F, Mayer J, O’Dwyer M, Hellmann A, Schuh A, Siddiqi T, Polliack A, Tam CS, Suri D, Cheng M, Clow F, Styles L, James DF, Kipps TJ; RESONATE-2 Investigators: Ibrutinib as Initial Therapy for Patients with Chronic Lymphocytic Leukemia. N Engl J Med. 2015; 373(25):2425-37. PMID 26639149.
- ↑ Treon SP, Tripsas CK, Meid K, Warren D, Varma G, Green R, Argyropoulos KV, Yang G, Cao Y, Xu L, Patterson CJ, Rodig S, Zehnder JL, Aster JC, Harris NL, Kanan S, Ghobrial I, Castillo JJ, Laubach JP, Hunter ZR, Salman Z, Li J, Cheng M, Clow F, Graef T, Palomba ML, Advani RH: Ibrutinib in previously treated Waldenström's macroglobulinemia. N Engl J Med. 2015 Apr 9;372(15):1430-40. doi:10.1056/NEJMoa1501548 PMID 25853747.
- ↑ U.S. FDA Approves IMBRUVICA® (ibrutinib) as First Approved Treatment Specifically for Adults with Chronic Graft-Versus-Host-Disease (cGVHD), PM AbbVie vom 2. August 2017, abgerufen am 18. September 2017.
- ↑ European Medicines Agency recommends approval of two new treatment options for rare cancers. European Medicines Agency's (EMA), 25. Juli 2014, abgerufen am 29. Juli 2014.
- ATC-L01
- Stoff mit Verdacht auf krebserzeugende Wirkung
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Arzneistoff
- Tyrosinkinase-Inhibitor
- Zytostatikum
- Vinylverbindung
- Aminoazin
- Alkensäureamid
- Diphenylether
- Piperidin
- Pyrazol
- Pyrimidin