Pseudo-nitzschia
| Pseudo-nitzschia | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Pseudo-nitzschia sp. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Pseudo-nitzschia | ||||||||||||
| H. Peragallo in H. Perag. & M. Perag., 1900[1][2] |


Pseudo-nitzschia ist eine Gattung mariner planktonischer Kieselalgen. Sie machen 4,4 % der weltweit vorkommenden pennaten Formen aus (Angehörige der früheren Ordnung Pennales, die zur Konjugation fähig sind).[3] Einige Arten sind in der Lage, das Neurotoxin Domoinsäure (englisch domoic acid, DA) zu produzieren, das für die als Amnesic Shellfish Poisoning (ASP) bekannte neurologische Störung beim Menschen verantwortlich ist. Derzeit sind ca. 58 Arten bekannt, von denen 28 nachweislich DA produzieren. Ursprünglich ging man davon aus, dass nur Dinoflagellaten schädliche Algentoxine produzieren können, doch 1987 kam es in den Buchten der kanadischen Prince-Edward-Insel zu einer tödlichen Pseudo-nitzschia-Blüte, die zu einem Ausbruch von ASP führte.[4] Bei diesem Ausbruch erkrankten etwa 100 Personen nachdem sie kontaminierte Muscheln verzehrt hatten; drei Menschen starben.[5] Seit diesem Ereignis wurden keine weiteren Todesfälle mit ASP in Verbindung gebracht, obwohl die Prävalenz von toxischen Kieselalgen und DA weltweit zugenommen hat. Diese Anomalie ist wahrscheinlich darauf zurückzuführen, dass das Bewusstsein für schädliche Algenblüten (englisch harmful algal blooms, HABs) und ihre Auswirkungen auf die Gesundheit von Mensch und Ökosystem gestiegen ist.[6]
Seitdem wurden Kieselalgen-Blüten in Küstengewässern und im offenen Meer weltweit beschrieben und mit steigenden Nährstoffkonzentrationen im Meer, der globalen Erwärmung der Meere und bakteriellen Verbindung gebracht.[7][6]
Die Kieselalgen-Gattung Pseudo-nitzschia ist nicht zu Verwechseln mit der Hakensaugwürmer-Gattung Pseudonitzschia (Monogenea > Monopisthocotylea > Capsalidae).
Morphologie und Physiologie[Bearbeiten | Quelltext bearbeiten]

Pseudo-nitzschia-Arten sind zweiseitig symmetrische pennate Kieselalgen. Die Zellwände bestehen aus länglichen Frusteln (englisch frustules) aus Siliziumdioxid (Silica, SiO2). Die Silicawand ist ziemlich dicht, was zu einem negativen Auftrieb und damit zu einem Absinken führt: Dies bietet den Kieselalgen eine Reihe von Vorteilen. Die Wand ermöglicht es den Kieselalgen zum Schutz vor zu viel Licht und Nährstoffmangel abzusinken, außerdem schützt sie vor räuberischem Zooplankton. Die Kieselalgenschalen tragen in hohem Maße zu den Sedimentschichten der Erde und zum Fossilienbestand bei. Dies macht sie für das Verständnis zahlreicher Prozesse wie z. B. die Messung des Tempos des Klimawandels außerordentlich nützlich.[8] Bevor sie auf den Meeresboden sinken, wird jedes Siliziumatom, das in den Ozean gelangt, etwa 40 Mal in die Zellwand einer Kieselalge integriert.[8]
Die Kieselalgen enthalten eine zentrale Naht (Raphe), die Schleim (Mucus) absondert. Dieser ermöglicht es den Zellen, sich gleitend fortzubewegen. Die Zellen befinden sich oft in sich stufenweise überlappenden Kolonien und zeigen kollektive Motilität (Bewegungsfähigkeit).[9]
Pseudo-nitzschia-Arten sind photoautotroph, d. h. sie synthetisieren ihr eigenes organisches Material durch die Nutzung von Licht (Photosynthese, analog zu den Pflanzen). Ihr spezielles Lichtsammelsystem (englisch light-harvesting system) schützt sie ebenfalls vor zu hoher Lichtintensität. Diese Kieselalgen haben zudem eine zentrale Vakuole, um Nährstoffe für die spätere Verwendung zu speichern.[8]
Lebenszyklus[Bearbeiten | Quelltext bearbeiten]
Harnstoffzyklus[Bearbeiten | Quelltext bearbeiten]
Die Physiologie der Verteilung, Fixierung und des Recyclings von anorganischen Kohlenstoff und Stickstoff spielt eine Schlüsselrolle bei der Stoffwechsel-Reaktion von Kieselalgen auf längeren Nährstoffmangel; der Ornithin- oder Harnstoffzyklus ermöglicht es ihnen, sofort auf die Verfügbarkeit von Nährstoffen zu reagieren und sich so zu erholen, indem sie ihre Stoffwechsel- und Wachstumsraten wieder erhöhen.[8]
Ruhestadien[Bearbeiten | Quelltext bearbeiten]
Um Stressphasen wie Nährstoffmangel zu überwinden, haben Kieselalgen üblicherweise die Fähigkeit, zwei verschiedene Ruhestadien einzunehmen. Eine Ruhespore ist in der Lage, über längere Zeiträume von Nährstoffmangel zu überleben. Um Schichten der Wassersäule mit niedrigen Nährstoffkonzentrationen zu vermeiden, können sich die Ruhesporen auf dem Boden absetzen, wo die Nährstoffkonzentration höher ist. Die Ruhesporen sind in der Lage, schnell zu reagieren, wenn wieder Nährstoffe zur Verfügung stehen.[8] Es gibt allerdings widersprüchliche Belege für das Vorhandensein oder Fehlen eines Ruhestadiums bei Pseudo-nitzschia (Stand 2012).[10]
Reproduktion[Bearbeiten | Quelltext bearbeiten]
Bei den Kieselalgen erfolgt die Fortpflanzung hauptsächlich ungeschlechtlich (vegetativ) durch binäre Spaltung (Zweiteilung alias Schizotomie), wobei jede Tochterzelle eine der beiden Frusteln der Elternzelle erhält. Die ungeschlechtliche Teilung führt bei Kieselalgen jedoch zu einer Verkleinerung. Um die Zellgröße einer Kieselalgenpopulation wiederherzustellen, muss eine sexuelle Fortpflanzung stattfinden. Vegetative diploide Zellen durchlaufen eine Meiose, um aktive und passive Gameten zu erzeugen. Diese Gameten verschmelzen dann zu einer Zygote, die sich zu einer Auxospore entwickelt.[11] Die sexuelle Fortpflanzung führt sowohl zu einer Zunahme der genotypischen Vielfalt als auch zu großen Ausgangszellen über die Bildung der Auxosporen.[12]
Der grundlegende Modus der sexuellen Fortpflanzung scheint bei den Pseudo-nitzschia-Arten konserviert zu sein. Wenn zwei Stämme mit kompatiblen Paarungstypen und einer für die sexuelle Fortpflanzung geeigneten Zellgröße gemischt werden, richten sich die Zellen nebeneinander aus und differenzieren sich zu Gametangien. In jedem Gametangium werden dann eine aktive (+) und eine passive (-) Gamete gebildet. Die aktive Gamete wandert zum passiven Partner und konjugiert. Die Zygote wird dann zu einer Auxospore, die keine starre Frustel besitzt und in deren Inneren wird eine große Ausgangszelle gebildet.[11]
Die Einleitung der sexuellen Fortpflanzung scheint ausschließlich in der exponentiellen Wachstumsphase stattzufinden und wird durch viele externe Faktoren wie Tageslänge, Beleuchtungsstärke und Temperatur geregelt. Damit die sexuelle Phase eingeleitet werden kann, müssen die Zellen unterhalb einer artspezifischen Größenschwelle liegen, zudem muss eine artspezifische Schwellenzellkonzentration (Zelldichte) erreicht sein: Eine Verringerung des Abstands der Zellen erleichtert den Kontakt und/oder der Wahrnehmung chemischer Hinweise zwischen den Zellen. Darüber hinaus ist der Beginn der sexuellen Phase mit einer deutlichen Verringerung des Wachstums der vegetativen und elterlichen Zellen verbunden; offenbar wird die vegetative Teilung gehemmt, wenn die beiden Linien entgegengesetzten Paarungstyps in Kontakt kommen.[12]
Genom und Transkriptom[Bearbeiten | Quelltext bearbeiten]
Das Genom von Pseudo-nitzschia multiseries umfasst 219 Mbp (Megabasenpaare), und ein Projekt zur Entschlüsselung des gesamten Genoms ist im Gange (Draft verfügbar).[13]
Die Transkriptome von drei Arten, P. arenysensis, P. delicatissima und P. multistriat, wurden sequenziert. Die Transkriptome kodieren zwischen 17.500 und 20.200 Proteine.[14]
Im Jahr 2018 wurde anhand der Transkriptomanalyse von P. multistriata ein Cluster von vier Genen identifiziert, die mit der DA-Biosynthese in Verbindung stehen. Die Identifizierung dieser Gene bietet die Möglichkeit, toxische Blüten von Pseudo-nitzschia genetisch zu überwachen, um die ihre Gefährlichkeit und die sie verursachenden Umweltbedingungen besser zu verstehen.[15]
Habitat[Bearbeiten | Quelltext bearbeiten]
Im Allgemeinen gedeihen Kieselalgen in nährstoffreichen Gewässern mit hohem Lichteinfall.[8] Einige Pseudo-nitzschia-Arten können in einem weiten Temperaturbereich (4-20 °C) wachsen, was es ihnen ermöglicht, eine Vielzahl von Lebensräumen (Habitaten) zu bewohnen.[16]
Pseudo-nitzschia-Arten wurden in allen Weltmeeren, einschließlich der Arktis und Antarktis, beobachtet.[6] In Nordamerika wurden sie entlang der Pazifikküste von Kanada bis Kalifornien, entlang der Atlantikküste im Nordosten Kanadas, in North Carolina und im Golf von Mexiko nachgewiesen.[17] Verschiedene Arten wurden im offenen Ozean sowie in Golfen und Buchten nachgewiesen, unter anderem vor den Küsten Kanadas, Portugals, Frankreichs, Italiens, Kroatiens, Griechenlands, Irlands, Australiens, Marokkos, Japans, Spaniens, Tunesiens, Namibias, Singapurs, Angolas, Argentiniens, Uruguays, der Philippinen, der Türkei und der Ukraine.[18][6]
Angesichts der Erwärmung des Ozeanwassers, des abnehmenden Meereises und der zunehmenden Lichteinstrahlung infolge des Klimawandels ist es wahrscheinlich, dass sich die Saison für ein günstiges Wachstum toxischer Pseudo-nitzschia-Arten ausweiten wird.[6] Es ist wichtig, die Pseudo-nitzschia-Blüten und ihre Toxizität weiterhin zu überwachen, insbesondere Lebensräumen, in denen diese Arten möglicherweise häufiger vorkommen werden, wie der Arktis und der Antarktis.
Dynamik schädlicher Algenblüten[Bearbeiten | Quelltext bearbeiten]
Schädliche Algenblüten (englisch Harmful Algal Blooms, HABs) von Pseudo-nitzschia-Arten und anderen ähnlichen Arten können bei vielen Meeresorganismen Krankheiten und Tod verursachen, ebenso beim Menschen, wenn er solche kontaminierten Organismen verzehrt. HABs können durch eine erhöhte Biomasseproduktion verursacht zu einer Sauerstoffverarmung führen. Pseudo-nitzschia-Blüten verursachen jedoch häufiger Schäden durch die Produktion des Neurotoxins Domoinsäure (DA), das in der Nahrungskette auf höhere trophische Ebenen übertragen werden und dort zur Bioakkumulation führen kann. Während und unmittelbar nach einer toxischen Blüte kann DA häufig im Muschelfleisch nachgewiesen werden.[19] Obwohl die Einstellung der Muschelernte in der Regel auf der Anzahl der Zellen von Pseudo-nitzschia in der Volumeneinheit beruht, korrelieren diese Zelldichten nicht immer mit der DA-Konzentration. Daher ist es wichtig, die anderen Umweltfaktoren zu verstehen, die zu einer höheren DA-Produktion führen können.[6]
Sedimentkerne weisen auf einen Zusammenhang zwischen der zunehmenden Nährstoffbelastung (Eutrophierung) der Küsten und der Zunahme und Ausprägung der Pseudo-nitzschia-Blüten hin.[7]
Geschichte der Pseudo-nitzschia-Blüten[Bearbeiten | Quelltext bearbeiten]

Die bis dahin größte Pseudo-nitzschia-Blüte wurde im September 2004 vor der Nordwestküste der Vereinigten Staaten (US-Bundesstaat Washington und der kanadischen Provinz British Columbia) verzeichnet. Die maximale Zelldichte während dieser Blüte erreichte 13 × 106 Zellen pro Liter mit einem Domoinsäuregehalt von 1,3 pg/Zelle an DA.[20]
Dieses DA-Auftreten wurde – wieder dominiert durch Pseudo-nitzschia[16] – 2015 überboten. Diese Blüte an der nordamerikanischen Pazifikküste führte zu einer längeren Einstellung der Fischerei von sog. „razor clams“,[A. 1] Kalifornische Felsenkrabben (alias Pazifische Braune Felsenkrabben, Romaleon antennarium) und Dungeness-Krabben (Metacarcinus magister). Im selben Jahr wurde später DA bei Walen (insbesondere Delfinen, Schweinswalen), Robben (insbes. Seelöwen) nachgewiesen. Diese Blüte wurde wahrscheinlich durch anomal warmes Wasser und Nährstoffe verursacht, die durch Auftrieb an die Oberfläche gelangten.[16]
Eine weitere Blüte von Pseudo-nitzschia ereignete sich im Juni/Juli 2023 im US-Bundesstaat Kalifornien. Mehr als 1.000 Kalifornische Seelöwen (Zalophus californianus) erlitten DA-Vergiftungen. Die Tiere zeigten ungewöhnliches Verhalten, wiegten den Kopf hin und her, hatten Schaum vor dem Maul und reagierten ungewöhnlich heftig auf Berührungen. Obwohl die Tiere sonst gegenüber dem Menschen kein aggressives Verhalten zeigten, kam es mindestens fünfmal zu Bissverletzungen von Strandgängern. Mindestens 150 dieser Tiere starben,[22] dazu mindestens 110 Delfine.[23] Als Ursache wurde eine Störung des Nährstoff-Gleichgewichts im Pazifik vermutet, ausgelöst durch eine Kombination aus Klimawandel, dem in diesem Jahr wieder aufgetretenen El Niño sowie menschlichen Schadstoff-Einleitungen. Seelöwen, die sich hauptsächlich von Anchovis und Sardinen ernähren, sind durch Anreicherung von Toxinen in der Nahrungskette besonders gefährdet, ebenso Delfine.[22][24][25][26] Nach Angaben des Channel Islands Marine and Wildlife Institute (Cimwi) handelt es sich um die schlimmste Algenblüte vor Ort seit 35 Jahren.[23]
Domoinsäure (DA)[Bearbeiten | Quelltext bearbeiten]
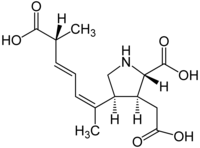
Muscheln werden durch die Aufnahme von giftigen Pseudo-nitzschia-Arten kontaminiert und können bei Algenblüten dann beim nachfolgenden Verzehr durch den Menschen zu einer Vergiftung mit Domoinsäure (englisch domoic acid, DA) führen. DA wirkt als starker Glutamat-Agonist und ist beim Menschen für die als Amnesic shellfish poisoning (ASP) bezeichneten Symptome (Gedächtnisverlust, Erbrechen, Durchfall) verantwortlich.[27] Die Auswirkungen reichen von Erbrechen, Krämpfen und Kopfschmerzen bei leichter Vergiftung bis zu permanentem anterogradem (fortschreitendem) Gedächtnisverlust, Koma und Tod.[28] Daher sind Überwachungssysteme und Managementpraktiken für die Freizeit- und Berufsfischerei wichtig, um die Gesundheit der Meerestiere – derjenigen, die sich von den Kieselalgen ernähren sowie ihrer Prädatoren (Räuber) – zu gewährleisten.
Für die Produktion von Domoinsäure ist die Photosynthese unerlässlich. Es hat sich gezeigt, dass Perioden der Dunkelheit oder eine chemische Blockierung der Photosynthese die Toxinproduktion hemmen. Die DA-Produktion erreicht ihren Höhepunkt in der stationären Phase des Wachstumszyklus, wenn die Zellteilung verlangsamt ist oder ganz ausbleibt.[20]
Die DA-Produktion beeinflussende Faktoren[Bearbeiten | Quelltext bearbeiten]
Viele Faktoren wurden mit der Förderung der DA-Produktion in Verbindung gebracht, darunter ausreichendes Licht, ein erhöhter oder verringerter pH-Wert und ernährungsspezifische Einschränkungen.[10][6] Bei der Art P. cuspidata wurde ein Zusammenhang zwischen Toxizität und Photosynthese-Photonenflussdichte (PAR-Photonen-Flussdichte, englisch photosynthesis photon flux density, PPFD) festgestellt. Bei einer niedrigen PPFD war die Wachstumsrate ungefähr halbiert und die Zellen waren deutlich toxischer.[20]
Die Auswirkung der Verfügbarkeit verschiedener Stickstoffquellen auf die Toxizität ist zwar vielfach untersucht worden, doch konnte keine allgemeine Regel für Unterschiede im Wachstum und in der DA-Produktion nachgewiesen werden. Die Ergebnisse variierten zudem stark je nach Art der Gattung. Die Toxinproduktion nimmt jedoch zu, wenn die Stickstoffquelle keine hohe Biomasse aufrechterhalten kann, was darauf hindeutet, dass eine Wachstumsbeschränkung die Toxizität auszulösen scheint (Stress).[29]
Auch das Vorhandensein von Zooplankton wirkt sich nachweislich auf die Toxizität von Pseudo-nitzschia aus. Es wurde nachgewiesen, dass die Anwesenheit von Ruderfußkrebse (Copepoda) die Toxinproduktion von P. seriata erhöht. Dieser Effekt scheint chemisch vermittelt zu sein, da er ohne physischen Kontakt ausgelöst werden konnte.[30]
Pseudo-nitzschia-Arten scheinen sehr stark auf Unterschiede in der Konzentration von Spurenmetallen wie Eisen (Fe) und Kupfer (Cu) zu reagieren. Unter Fe-limitierten Bedingungen (Stress) steigert Pseudo-nitzschia die DA-Produktion um das Sechs- bis 25-fache. Dieser Anstieg ermöglicht es ihnen, den für den Stoffwechsel erforderlichen Fe-Erwerb zu steigern, was verheerende Auswirkungen haben kann.[4]
Systematik[Bearbeiten | Quelltext bearbeiten]
Der Stammbaum der Kieselalgen lässt sich bis vor 180 bis 250 Millionen Jahren zurückverfolgen. Vor gut 65 Millionen Jahren (Kreide-Paläogen-Grenze) überlebten die Kieselalgen ein Massenaussterben, bei dem aber etwa 85 % ihrer Arten ausstarben.[8]
Die Arten (Spezies) von Pseudo-nitzschia wurden bis 1994 in der Gattung Nitzschia geführt. Die Arten, die sich durch die Fähigkeit, Ketten von sich überlappenden Zellen zu bilden, und andere kleinere morphologische Unterschiede zu den gewöhnlichen Niztschia-Mitgliedern zeigten, wurden dann in die neue Gattung Pseudo-nitzschia ausgegliedert.[31] Die Gattungszugehörigkeit kann zwar mit Hilfe der Lichtmikroskopie leicht erkannt werden. Die Identifizierung der zahlreichen Arten der Gattung kann jedoch taxonomisches Fachwissen erfordern und extrem zeitaufwändig sein; das Vorkommen kryptischer Arten (Kryptospezies) macht die Sache notorisch schwierig. Ähnliche Arten werden oft durch sehr kleine Unterschiede der Frusteln unterschieden: in der allgemeinen Form, sich wiederholenden Strukturen wie z. B. Bandstreifen (englisch band stria).[5]
Wegen der Bedeutung für die öffentliche Gesundheit ist die korrekte Artenbestimmung ein ernstes Problem, toxogene (Gifte bildende) und nicht toxogene Arten treten zudem häufig gemeinsam auf. Die Unterscheidung zwischen verschiedenen Pseudo-nitzschia-Arten ist daher unerlässlich, um die potenzielle Toxizität einer Algenblüte von Pseudo-nitzschia zu bestimmen. Identifizierungsverfahren aufgrund optischer Mikroskopie sind unzureichend, wenn – wie es bei einem Überwachungsprogramm für die öffentliche Gesundheit erforderlich ist – eine große Anzahl von Proben routinemäßig untersucht werden muss. Im Jahr 2015 wurde ein DNA-Mikroarray zum gleichzeitigen Nachweis mehrerer schädlicher Algenblütenarten entwickelt („DNA-Chip-Technologie“), wobei der Schwerpunkt auf Pseudo-nitzschia lag. Man geht davon aus, dass der Test insgesamt das Potenzial hat, Hunderte von Arten zu identifizieren und große Mengen verwandter Arten genau zu unterscheiden. Darüber hinaus hat sich gezeigt, dass diese Technologie toxisches Phytoplankton selbst bei extrem niedrigen Konzentrationen genau identifizieren kann. Die untere Grenze für den Nachweis von Pseudo-nitzschia liegt bei nur 500 Zellen.[32]
Die Geschichte der Nomenklatur dieser Gattung ist ausführlich in Hasle (1995)[33] und Bates (2000)[34] beschrieben.
Insgesamt wurden über 50 Arten der Gattung beschrieben. Die hier angegebene Artenliste folgt – wo nicht anders angegeben – dem World Register of Marine Species (WoRMS):[35]





Gattung Pseudo-nitzschia H.Peragallo in H.Perag. & M.Perag., 1900[1][2]
- Pseudo-nitzschia abrensis Pérez-Aicua & Orive, 2013#
- Pseudo-nitzschia allochrona Zingone, Percopo & Sarno, 2022[36]
- Pseudo-nitzschia americana (Hasle) Fryxell, 1993[37]
- Pseudo-nitzschia antarctica (uncertain, unassessed)[38]
- Pseudo-nitzschia arctica Percopo & Sarno, 2016
- Pseudo-nitzschia arenysensis Quijano-Scheggia, Garcés & Lundholm, 2009
- Pseudo-nitzschia australis Frenguelli, 1939#
- Pseudo-nitzschia batesiana H.C.Lim, S.T.Teng, C.P.Leaw & P.T.Lim, 2013#
- Pseudo-nitzschia bipertita S.T.Teng, H.C.Lim & C.P.Leaw, 2016[39]#
- Pseudo-nitzschia brasiliana N.Lundholm, G.R.Hasle & G.A.Fryxell, 2002[37]#
- Pseudo-nitzschia bucculenta F. Gai, C. K. Hedemand, N. Lundholm & Ø. Moestrup, 2018[40]
- Pseudo-nitzschia caciantha Lundholm, Moestrup & Hasle, 2003#
- Pseudo-nitzschia calliantha Lundholm, Moestrup & Hasle, 2003#
- Pseudo-nitzschia chiniana C.X. Huang & Yang Li, 2019[41]
- Pseudo-nitzschia circumpora H.C.Lim, C.P.Leaw & P.T.Lim, 2012
- Pseudo-nitzschia cuspidata (Hasle) Hasle, 1993#
- Pseudo-nitzschia decipiens Lundholm & Moestrup, 2006 (uncertain, unassessed)
- Pseudo-nitzschia delicatissima (Cleve) Heiden, 1928#
- Pseudo-nitzschia dolorosa Lundholm & Moestrup, 2006 (uncertain, unassessed)
- Pseudo-nitzschia fraudulenta (Cleve) Hasle, 1993#
- Pseudo-nitzschia fryxelliana Lundholm, 2012
- Pseudo-nitzschia fukuyoi H.Ch.Lim, S.T.Teng, Ch.P.Leaw & P.T.Lim, 2013#
- Pseudo-nitzschia galaxiae N.Lundholm & Ø.Moestrup, 2002#
- Pseudo-nitzschia granii (G.R. Hasle) G.R.Hasle, 1974#
- Pseudo-nitzschia hainanensis X.M. Chen & Y. Li, 2020[42]
- Pseudo-nitzschia hallegraeffii P.A. Ajani, A. Verma & S.A. Murray, 2018[43]
- Pseudo-nitzschia hasleana Lundholm, 2012#
- Pseudo-nitzschia heimii Manguin, 1957
- Pseudo-nitzschia inflatula (G.R.Hasle) G.R.Hasle, 1993
- Pseudo-nitzschia kodamae S.T. Teng, H.C. Lim, C.P. Leaw & P.T. Lim, 2015#
- Pseudo-nitzschia limii S.T.Teng, H.C.Lim & C.P.Leaw, 2016
- Pseudo-nitzschia linea Lundholm, Hasle & G.A.Fryxell, 2002[37]
- Pseudo-nitzschia lineola (Cleve) Hasle, 1965
- Pseudo-nitzschia lundholmiae H.C.Lim, S.T.Teng, C.P.Leaw & P.T.Lim, 2013#
- Pseudo-nitzschia mannii Amato & Montresor, 2008 (uncertain, unassessed)
- Pseudo-nitzschia micropora K.Priisholm, Ø.Moestrup & N.Lundholm, 2002
- Pseudo-nitzschia multiseries (Hasle) Hasle, 1995#
- Pseudo-nitzschia multistriata (Takano) Takano, 1995#
- Pseudo-nitzschia nanaoensis Yang Li & H.C. Dong, 2018[44]
- Pseudo-nitzschia obtusa (Hasle) Hasle & Lundholm, 2005#
- Pseudo-nitzschia plurisecta Orive & Pérez-Aicua, 2013#
- Pseudo-nitzschia prolongatoides (G.R.Hasle) G.R.Hasle, 1993
- Pseudo-nitzschia pseudodelicatissima (Hasle) Hasle, 1993#
- Pseudo-nitzschia pungens (Grunow ex Cleve) G.R.Hasle, 1993#
- Pseudo-nitzschia pungiformis (G.R.Hasle) G.R.Hasle, 1993
- Pseudo-nitzschia qiana C.X. Huang & Yang Li, 2019[41]
- Pseudo-nitzschia roundii D.U.Hernández-Becerril, 2006
- Pseudo-nitzschia sabit S.T. Teng, H.C. Lim, P.T. Lim & C.P. Leaw, 2015
- Pseudo-nitzschia seriata (Cleve) H.Peragallo, 1899 (Typus)[45][2]#
- Pseudo-nitzschia simulans Li, Huang & Xu, 2017#
- Pseudo-nitzschia sinica Y.Z.Qi & J.Wang, nom. inval.[46]
- Pseudo-nitzschia subcurvata (G.R.Hasle) G.A.Fryxell, 1993[47]#
- Pseudo-nitzschia subfraudulenta (G.R.Hasle) G.R.Hasle, 1993#
- Pseudo-nitzschia subpacifica (Hasle) Hasle, 1993#
- Pseudo-nitzschia taiwanensis X.M. Chen & Y. Li, 2020[42]
- Pseudo-nitzschia turgidula (Hustedt) G.R.Hasle, 1993#
- Pseudo-nitzschia turgiduloides (G.R.Hasle) G.R.Hasle, 1996
- Pseudo-nitzschia uniseriata H.C. Dong & Yang Li, 2020[39]
- Pseudo-nitzschia yuensis H.C. Dong & Yang Li, 2020[39]
Anmerkungen[Bearbeiten | Quelltext bearbeiten]
- ↑ Mit der Sammelbezeichnung „razor clam“ werden allgemein verschiedene Muschelarten bezeichnet, hier dürften z. B. aufgrund ihres Verbreitungsgebietes die Amerikanische Schwertmuschel (Ensis directus) und die Rasiermesser-Muschel (pacific razor clam, Siliqua patula[21]) gemeint sein.
Weiterführende Literatur[Bearbeiten | Quelltext bearbeiten]
Die allgemeine Biologie, Physiologie, Toxizität und Verbreitung der Pseudo-nitzschia-Arten wird in folgenden Quellen behandelt:
- Stephen S. Bates und Vera L. Trainer (2006),[49]
- Vera L. Trainer et al. (2008),[50]
- Aurélie Lelong et al. (2012),[10]
- Vera L.Trainer et al. (2012).[51]
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Pseudo-nitzschia H.Perag. in H.Perag. & Perag. Auf: Nordic Microalgae and aquatic protozoa. Mit vielen licht- und elektronenmikroskopischer Fotos verschiedener Spezies.
- DMF Image Gallery (Diatoms, Cyanobacteria, …). Auf: Digital Microscopy Facility.
- Domoic Acid and Pseudo-nitzschia References. Fisheries and Oceans Canada > Gulf Region. Government of Canada.
- Phytoplankton Monitoring Network. NCCOS/NOAA. Memento im Webarchiv vom 22. Februar 2012.
- Pseudo-nitzschia. Auf: Northwest Fisheries Science Center, Harmful Algal Blooms. Memento im Webarchiv vom 27. Juni 2009.
- Toxic Blooms: Understanding Red Tides. Auf: Woods Hole Oceanographic Institution. Memento im Webarchiv vom 14. März 2006.
- Marine Biotoxins Program. NCCOS/National Oceanic and Atmospheric Administration (NOAA), Center for Coastal Environmental Health and Biomolecular Research (CHBR). Memento im Webarchiv vom 27. Dezember 2008.
- California Program for Regional Enhanced Monitoring for PhycoToxins (Cal-PReEMPT). California Department of Health Services – University of California, Santa Cruz. Memento im Webarchiv vom 20. Juli 2011.
- Biotoxin Program. Office of Shellfish and Water Protection. Washington State Department of Health, Division of Environmental Health. Memento im Webarchiv vom 5. Februar 2007.
- Rene van Wezel: Series in Marine Phytoplankton: The genus Pseudo-nitzschia. Auf microscopy-uk.org.uk (Mic-UK).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b H. Peragallo, M. Peragallo: Diatomées marines de France et des districts maritimes voisins. Texte. S. 1-491, Anhang S. 1-48 . Grez-sur-Loing: J. Tempère, Micrographe-Editeur (französisch).
- ↑ a b c
AlgaeBase: [1].
Über die Webseite kann ein Link zu den Erstveröffentlichungen der Gattung und der Typusart bezogen werden. - ↑ Shruti Malviya, Eleonora Scalco, Stéphane Audic, Flora Vincent, Veluchamy Alaguraj, Julie Poulain, Patrick Wincker, Daniele Iudicone, Colomban de Vargas, Lucie Bittner, Adriana Zingone, Chris Bowler: Insights into global diatom distribution and diversity in the world's ocean. In: Proc Natl Acad Sci U S A. 113. Jahrgang, Nr. 11, 15. März 2016, S. E1516–1525, doi:10.1073/pnas.1509523113, PMID 26929361, PMC 4801293 (freier Volltext), bibcode:2016PNAS..113E1516M (englisch).
- ↑ a b Maria T. Maldonado, Margaret P. Hughes, Eden L. Rue, Mark L. Wells: The effect of Fe and Cu on growth and domoic acid production by Pseudo-nitzschia multiseries and Pseudo-nitzschia australis. In: Limnology and Oceanography, Band 47, Nr. 2, März 2002, S. 515–526, bibcode:2002LimOc..47..515M, CiteSeerX 10.1.1.580.133; doi:10.4319/lo.2002.47.2.0515 (englisch).
- ↑ a b Hong-Chang Lim, Chui-Pin Leaw, Suriyanti Nyun-Pau Su, Sing-Tung Teng, Gires Usup, Normawaty Mohammad-Noor, Nina Lundholm, Yuichi Kotaki, Po-Teen Lim: Morphology and Molecular Characterization of Pseudo-nitzschia (bacillariophyceae) from Malaysian Borneo, Including the New Species Pseudo-nitzschia circumpora sp. nov. In: Journal of Phycology, Band 48, Nr. 5, Oktober 2012, S. 1232–1247; doi:10.1111/j.1529-8817.2012.01213.x, PMID 27011282, esearchGate (englisch).
- ↑ a b c d e f g h Stephen S. Bates, Katherine A. Hubbard, Nina Lundholm, Marina Montresor, Chui Pin Leaw: Pseudo-nitzschia, Nitzschia, and domoic acid: New research since 2011. In: Harmful Algae, Band 79, November 2018, S. 3–43; doi:10.1016/j.hal.2018.06.001 (englisch).
- ↑ a b Michael L. Parsons, Quay Dortch: Sedimentological evidence of an increase in Pseudo-nitzschia (Bacillariophyceae) abundance in response to coastal eutrophication. In: Limnology and Oceanography, Band 47, Nr. 2, März 2002, S. 551–558, bibcode:2002LimOc..47..551P; doi:10.4319/lo.2002.47.2.0551 (englisch).
- ↑ a b c d e f g Akira Kuwata, David H. Jewson: Marine Protists. 2015, ISBN 978-4-431-55129-4, Ecology and Evolution of Marine Diatoms and Parmales, S. 251–275, doi:10.1007/978-4-431-55130-0_10 (englisch).
- ↑ Nina Lundholm, Øjvind Moestrup: The marine diatom Pseudo-nitzschia galaxiae sp. nov. (Bacillariophyceae): morphology and phylogenetic relationships. In: Phycologia. 41. Jahrgang, Nr. 6, November 2002, S. 594–605, doi:10.2216/i0031-8884-41-6-594.1 (englisch). ResearchGate.
- ↑ a b c d Aurélie Lelong, Hélène Hégaret, Philippe Soudant, Stephen S. Bates: Pseudo-nitzschia (Bacillariophyceae) species, domoic acid and amnesic shellfish poisoning: revisiting previous paradigms. In: Phycologia, Band 51, Nr. 2, März 2012, S. 168–216; doi:10.2216/11-37.1, ResearchGate.
- ↑ a b Eleonora Scalco, Alberto Amato, Maria Immacolata Ferrante, Marina Montresor: The sexual phase of the diatom Pseudo-nitzschia multistriata: cytological and time-lapse cinematography characterization. In: Protoplasma, Band 253, Nr. 6, November 2016, S. 1421–1431; doi:10.1007/s00709-015-0891-5, PMID 26494151 (englisch).
- ↑ a b Eleonora Scalco, Krzysztof Stec, Daniele Iudicone, Maria Immacolata Ferrante, Marina Montresor: The dynamics of sexual phase in the marine diatom Pseudo-nitzschia multistriata (Bacillariophyceae). In: Journal of Phycology, Band 50, Nr. 5, Oktober 2014, S. 817–828; doi:10.1111/jpy.12225, PMID 26988637 (englisch).
- ↑ Info - Pseudo-nitzschia multiseries CLN-47. Joint Genome Institute (JGI, genome.jgi.doe.gov, englisch). Memento im Webarchiv vom 31. Juli 2023.
- ↑ Valeria Di Dato, Francesco Musacchia, Giuseppe Petrosino, Shrikant Patil, Marina Montresor, Remo Sanges, Maria Immacolata Ferrante: Transcriptome sequencing of three Pseudo-nitzschia species reveals comparable gene sets and the presence of Nitric Oxide Synthase genes in diatoms. In: Scientific Reports. 5. Jahrgang, 20. Juli 2015, S. 12329, doi:10.1038/srep12329, PMID 26189990, PMC 4648414 (freier Volltext), bibcode:2015NatSR...512329D (englisch).
- ↑ John K. Brunson, Shaun M.K. McKinnie, Johnathan R. Chekan, John P. McCrow, Zachary D. Miles, Erin M. Bertrand, Vincent A. Bielinski, Hannah Luhavaya, Miroslav Obornic, G. Jason Smith, David A. Hutchins, Andrew E. Allen, Bradley S. Moore: Biosynthesis of the neurotoxin domoic acid in a bloom-forming diatom. In: Science. 361. Jahrgang, Nr. 6409, 28. September 2018, S. 1356–1358, doi:10.1126/science.aau0382, PMID 30262498, PMC 6276376 (freier Volltext), bibcode:2018Sci...361.1356B (englisch).
- ↑ a b c Ryan M. McCabe, Barbara M. Hickey, Raphael M. Kudela, Kathi A. Lefebvre, Nicolaus G. Adams, Brian D. Bill, Frances M. D. Gulland, Richard E. Thomson, William P. Cochlan, Vera L. Trainer: An unprecedented coastwide toxic algal bloom linked to anomalous ocean conditions. In: Geophysical Research Letters. 43. Jahrgang, Nr. 19, September 2016, S. 10366–10376, doi:10.1002/2016GL070023, PMID 27917011, PMC 5129552 (freier Volltext), bibcode:2016GeoRL..4310366M (englisch).
- ↑
An Early Warning System for Pseudo-nitzschia Harmful Algal Blooms on Pacific Northwest Outer-Coast Beaches. Auf: NOAA Coastal Science (NCCOS). Dazu:
- Factsheet: Pseudo-nitzschia spp. (PDF: Memento im Webarchiv vom 27. April 2017 englisch).
- ↑ Bidhan Dhar, Lucia Cimarelli, Kumar Singh, Letizia Brandi, Anna Brandi, Camilla Puccinelli, Stefania Marcheggiani, Roberto Spurio: Molecular Detection of a Potentially Toxic Diatom Species. In: International Journal of Environmental Research and Public Health. 12. Jahrgang, Nr. 5, 6. Mai 2015, S. 4921–4941, doi:10.3390/ijerph120504921, PMID 25955528, PMC 4454946 (freier Volltext) – (englisch).
- ↑ Michael A. Quilliam, P. Greig Sim, Archibald W. McCulloch& A. Gavin McInnes: High-Performance Liquid Chromatography of Domoic Acid, a Marine Neurotoxin, with Application to Shellfish and Plankton. In: International Journal of Environmental Analytical Chemistry, Band 36, Nr. 3, 1989, S. 139-154; doi:10.1080/03067318908026867 , Epub 23. September 2006.
- ↑ a b c Maureen E. Auro, William P. Cochlan: Nitrogen Utilization and Toxin Production by Two Diatoms of the Pseudo-nitzschia pseudodelicatissima Complex: P. cuspidata and P. fryxelliana. In: Journal of Phycology, Band 49, Nr. 1, Februar 2013, S. 156–169, doi:10.1111/jpy.12033, PMID 27008397 (englisch).
- ↑ Siliqua patula Rasiermesser-Muschel. Auf: Meerwasser-Lexikon.
- ↑ a b Felicity Nelson: A Neurotoxin Is Causing Sea Lions to Bite People in California. Auf: sciencealert vom 7. Juli 2023.
- ↑ a b
n-tv.de:
- Elend im Meer vor Kalifornien: Hunderte tote und verletzte Tiere angespült. Stand: 18. Juli 2023.
- Massenhaft Tiere angespült: Delfine und Seelöwen verenden wegen tödlicher Alge. Stand: 1. Juli 2023. Memento im Webarchiv vom 14. Juli 2023.
- ↑
Los Angeles Times (latimes.com):
- Summer Lin: Holiday beachgoers face an unexpected peril: aggressive, biting sea lions. Here’s what you can do. Stand: 29. Juli 2023.
- Summer Lin: What’s killing hundreds of sea lions and dozens of dolphins along the Southern California coast? Stand: 290. Juni 2023.
- ↑ Livia Albeck-Ripka: Hundreds of Sea Lions Are Dying. Is an Algal Bloom to Blame? In: The New York Times (nytimes.com) vom 21. Juni 2023. Memento im Webarchiv vom 3. August 2023.
- ↑ Rachel Ramirez: [Hundreds of dolphins and sea lions have washed up dead or sick in California amid toxic algae outbreak]. Auf: cnn.com, Stand: 30. Juni 2023.
- ↑ Georg Heusinger: Marine Biotoxine. Chemisches und Veterinäruntersuchungsamt (CVUA) Stuttgart, auf: ua-bw.de. erstveröffentlichung: 23. März 2021.
- ↑ Jeanne S. Teitelbaum, Robert J. Zatorre, Stirling Carpenter, Daniel Gendron, Alan C. Evans, Albert Gjedde, Neil R. Cashman: Neurologic sequelae of domoic acid intoxication due to the ingestion of contaminated mussels. In: New England Journal of Medicine, Band 322, Nr. 25, S. 1781-1787; doi:10.1056/NEJM199006213222505 (englisch).
- ↑ Véronique Martin-Jézéquel, Guillaume Calu, Leo Candela, Zouher Amzil, Thierry Jauffrais, Véronique Séchet, Pierre Weigel: Effects of Organic and Inorganic Nitrogen on the Growth and Production of Domoic Acid by Pseudo-nitzschia multiseries and P. australis (Bacillariophyceae) in Culture. In: MDPI: Marine Drugs, Band 13, Nr. 12, 26. November 2015, S. 7067–7086; doi:10.3390/md13127055, PMID 26703627, PMC 4699229 (freier Volltext) (englisch).
- ↑ Anna Tammilehto, Torkel Gissel Nielsen, Bernd Krock, Eva Friis Møller, Nina Lundholm: Induction of domoic acid production in the toxic diatom Pseudo-nitzschia seriata by calanoid copepods. In: Aquatic Toxicology, Band 159, Februar 2015, S. 52–61; doi:10.1016/j.aquatox.2014.11.026, PMID 25521565, PDF (englisch).
- ↑ Grethe Rytter Hasle: Pseudo-nitzschia as a genus distinct from Nitzschia (Bacillariophyceae). In: Journal of Phycology. 30. Jahrgang, Nr. 6, Dezember 1994, S. 1036–1039, doi:10.1111/j.0022-3646.1994.01036.x (englisch).
- ↑ Charlotte Noyer, Anne Abot, Lidwine Trouilh, Véronique Anton Leberre, Catherine Dreanno: Phytochip: Development of a DNA-microarray for rapid and accurate identification of Pseudo-nitzschia spp and other harmful algal species. In: Journal of Microbiological Methods, Band 112, Mai 2015, S. 55–66; doi:10.1016/j.mimet.2015.03.002, PMID 25765159, ARCHIMER (englisch).
- ↑ Grethe Rytter Hasle: Pseudo-nitzschia pungens and P. multiseries (Bacillariophyceae): nomenclatural history, morphology, and distribution. In: Journal of Phycology, Band 31, Nr. 3, Juni 1995, S. 428–435; doi:10.1111/j.0022-3646.1995.00428.x, ResearchGate (englisch).
- ↑ Stephen S. Bates: Domoic-acid-producing diatoms: Another genus added! In: Journal of Phycology. 36. Jahrgang, Nr. 6, 7. Juli 2008, S. 978–983, doi:10.1046/j.1529-8817.2000.03661.x (englisch). ResearchGate.
- ↑ WoRMS: Pseudo-nitzschia H. Peragallo in H. Peragallo & M. Peragallo, 1900 (Genus).
- ↑ Isabella Percopo, Maria Valeria Ruggiero, Diana Sarno, Lorenzo Longobardi, Rachele Rossi, Roberta Piredda, Adriana Zingone: Phenological segregation suggests speciation by time in the planktonic diatom Pseudo‐Nitzschia allochrona sp. nov. In: Ecology and Evolution, Band 12, Nr. 8, 4. August 2022, S. e9155; doi:10.1002/ece3.9155, PMID 35949533, PMC 9352866 (freier Volltext) (englisch).
- ↑ a b c Nina Lundholm, Grethe Rytter Hasle, Greta A. Fryxell, Paul E. Hargraves: Morphology, phylogeny and taxonomy of species within the Pseudo-nitzschia americana complex (Bacillariophyceae) with descriptions of two new species, Pseudo-nitzschia brasiliana and Pseudo-nitzschia linea. In: Phycologia. 41. Jahrgang, Nr. 5, 1. September 2002, ISSN 0031-8884, S. 480–497, doi:10.2216/i0031-8884-41-5-480.1 (englisch). ResearchGate.
- ↑ WoRMS: Pseudonitzschia antarctica Manguin, 1960 (Species. Parent: Pseudonitzschia accepted as Pseudo-nitzschia H. Peragallo in H. Peragallo & M. Peragallo, 1900), Pseudo-nitzschia antarctica Manguin, 1960 (Species, corr.).
- ↑ a b c Huan Chang Dong, Nina Lundholm, Sing Tung Teng, Aifeng Li, Chao Wang, Yang Hu, Yang Li: Occurrence of Pseudo-nitzschia species and associated domoic acid production along the Guangdong coast, South China Sea. In: Harmful Algae, Band 98, 1. September 2020, S. 101899; doi:10.1016/j.hal.2020.101899, PMID 33129456 (englisch).
- ↑ Frederik Frøsig Gai, Cecilie Kirketerp Hedemand, Deon C. Louw, Kolette Grobler, Bernd Krock, Øjvind Moestrup, Nina Lundholm: Morphological, molecular and toxigenic characteristics of Namibian Pseudo-nitzschia species – including Pseudo-nitzschia bucculenta sp. nov. In: Harmful Algae, Band 76, 1. Juni 2018, S. 80–95; doi:10.1016/j.hal.2018.05.003, PMID 29887207, PDF (englisch).
- ↑ a b Chun Xiu Huang, Huan Chang Dong, Nina Lundholm, Sing Tung Teng, Guan Chao Zheng, Zhi Jun Tan, Po Teen Lim, Yang Li: Species composition and toxicity of the genus Pseudo-nitzschia in Taiwan Strait, including P. chiniana sp. nov. and P. qiana sp. nov. In: Harmful Algae, Band 84, 1. April 2019, S. 195–209; doi:10.1016/j.hal.2019.04.003, PMID 31128805 (englisch).
- ↑ a b Xiu Mei Chen, Jin Xiu Pang, Chun Xiu Huang, Nina Lundholm, Sing Tung Teng, Aifeng Li, Yang Li: Two New and Nontoxigenic Pseudo-nitzschia species (Bacillariophyceae) from Chinese Southeast Coastal Waters. In: Journal of Phycology, Band 57, Nr. 1, 10. November 2020, S. 335–344; doi:10.1111/jpy.13101, PMID 33174223 (englisch).
- ↑ Penelope A. Ajani, Arjun Verma, Malwenn Lassudrie, Martina A. Doblin, Shauna A. Murray, Rafael Vazquez-Duhalt: A new diatom species P. hallegraeffii sp. nov. belonging to the toxic genus Pseudo-nitzschia (Bacillariophyceae) from the East Australian Current. In: PLOS ONE, Band 13, Nr. 4, 12. April 2018, S. e0195622, bibcode:2018PLoSO..1395622A; doi:10.1371/journal.pone.0195622, PMID 29649303, PMC 5896966 (freier Volltext), PDF (englisch)
- ↑ Yang Li, Huan Chang Dong, Sing Tung Teng, Stephen S. Bates, Po Teen Lim, P. Kroth: Pseudo‐nitzschia nanaoensis sp. nov. (Bacillariophyceae) from the Chinese coast of the South China Sea. In: Journal of Phycology, Band 54, Nr. 6, Dezember 2018, S. 918–922; doi:10.1111/jpy.12791, PMID 30270437, PDF (englisch).
- ↑ AlgaeBase: Pseudo-nitzschia seriata (Cleve) H. Peragallo 1899 (englisch).
- ↑ AlgaeBase: Pseudo-nitzschia sinica Y. Z. Qi & J. Wang, nom. Inval. 1994 (englisch).
- ↑ Anna J. Olesen, Anneliese Leithoff, Andreas Altenburger, Bernd Krock, Bánk Beszteri, Sarah Lena Eggers, Nina Lundholm: First evidence of the toxin domoic acid in Antarctic diatom species. In: MDPI: Toxins, Band 13, Nr. 2, S. 93; doi:10.3390/toxins13020093.
- ↑ IOC-UNESCO & WoRMS: Pseudo-nitzschia H. Peragallo in H. Peragallo & M. Peragallo, 1900. In: Taxonomic Reference List of Harmful Micro Algae (HAB, englisch).
- ↑ Stephen S. Bates, Vera Trainer: The Ecology of Harmful Diatoms. In: Ecology of Harmful Algae. Januar 2006, S. 81–93, doi:10.1007/978-3-540-32210-8_7 (englisch). ResearchGate.
- ↑ Vera L. Trainer, B. M. Hickey, Stephen S. Bates: Oceans and human health: risks and remedies from the sea. Hrsg.: Patrick J. Walsh, Sharon L. Smith, Lora E. Fleming, Helena Solo-Gabriele, William H. Gerwick. Band 17, Nr. 3. Elsevier Science Publishers, New York 2008, Toxic diatoms, S. 219–237, doi:10.1289/ehp.117-a124a (englisch, google.com).
Lora Fleming, Lota B. Alcantara Creencia, William H. Gerwick, Hong Ching Goh, Matthew O. Gribble, Bruce Maycock, Helena Solo-Gabriele (Hrsg.): 2. Auflage, 14. Juli 2023, ISBN 978-0-323-95227-9, ISBN 978-0-323-95228-6 (E-Book).
ePDF. - ↑ Vera L. Trainer, Stephen S. Bates, Nina Lundholm, Anne E. Thessen, William P. Cochlan, Nicolaus G. Adams, Charles G. Trick: Pseudo-nitzschia physiological ecology, phylogeny, toxicity, monitoring and impacts on ecosystem health. In: Harmful Algae, Band 14, 1. Februar 2012, S. 271–300; doi:10.1016/j.hal.2011.10.025, ResearchGate (englisch)