„5-Fluoruracil“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
→Eigenschaften: Belege zum Konzept der chemischen Synthese. |
|||
| Zeile 37: | Zeile 37: | ||
'''5-Fluoruracil''' ('''5-FU'''), auch '''Fluorouracil''' ([[Internationaler Freiname|INN]]), ist eine [[Heterocyclen|heterocyclische]] [[organische Verbindung]] mit einem [[Pyrimidin]]<nowiki />grundgerüst und zwei [[Carbonylgruppe]]n an den Positionen 2 und 4 sowie einem [[Fluor]] an Position 5. Es ist ein [[Derivat (Chemie)|Derivat]] der [[Nukleinbase]] [[Uracil]]. |
'''5-Fluoruracil''' ('''5-FU'''), auch '''Fluorouracil''' ([[Internationaler Freiname|INN]]), ist eine [[Heterocyclen|heterocyclische]] [[organische Verbindung]] mit einem [[Pyrimidin]]<nowiki />grundgerüst und zwei [[Carbonylgruppe]]n an den Positionen 2 und 4 sowie einem [[Fluor]] an Position 5. Es ist ein [[Derivat (Chemie)|Derivat]] der [[Nukleinbase]] [[Uracil]]. |
||
Es ist ein [[Arzneistoff]], welcher als [[Zytostatikum]] in der [[Chemotherapie]], vor allem beim [[Darmkrebs|kolorektalen Karzinom]] und bei [[Brustkrebs]] verwendet wird. Es wurde von dem amerikanischen Chemiker [[Charles Heidelberger]] entwickelt und 1962 von der Pharmafirma [[Hoffmann-La Roche]] auf den Markt gebracht. |
Es ist ein [[Arzneistoff]], welcher als [[Zytostatikum]] in der [[Chemotherapie]], vor allem beim [[Darmkrebs|kolorektalen Karzinom]] und bei [[Brustkrebs]] verwendet wird. Es wurde von dem amerikanischen Chemiker [[Charles Heidelberger]] entwickelt und 1962 von der Pharmafirma [[Hoffmann-La Roche]] auf den Markt gebracht. Ausschlaggebend für die Synthese von 5-FU waren Heidelbergers Überlegungen zum tumorhemmenden Potential von [[Natriumfluoracetat|Fluoracetat]], dem Salz der [[Fluoressigsäure]].<ref>{{Literatur |Autor=Charles Heidelberger |Titel=Fluorinated Pyrimidines and Their Nucleosides |Sammelwerk=Antineoplastic and Immunosuppressive Agents |Verlag=Springer, Berlin, Heidelberg |Datum=1975 |Reihe=Handbuch der experimentellen Pharmakologie / Handbook of Experimental Pharmacology |Seiten=193–231 |ISBN=9783642658082 |DOI=10.1007/978-3-642-65806-8_12 |Online=https://link.springer.com/chapter/10.1007/978-3-642-65806-8_12 |Abruf=2018-04-19}}</ref> Später beschrieb Heidelberger die Metabolisierung von 5-FU unter Bezugnahme auf das vom britischen Biochemiker und Kampfstoffforscher Sir Rudolph Peters entwickelte Prinzip der ''letalen Synthese'' ([[Biotransformation]] von Fluoracetat zu Fluorcitrat).<ref>{{Literatur |Autor= |Titel=Carbon-Fluorine Compounds. Chemistry, Biochemistry and Biological Activities. |Hrsg=Katherine Elliott, Joan Birch |Sammelwerk= |Band= |Nummer= |Auflage= |Verlag=Associated Scientific Publishers |Ort=Amsterdam |Datum=1972 |Seiten=130 |ISBN=9780470719855}}</ref> |
||
5-Fluoruracil findet auch Anwendung als [[Warze]]n-Therapeutikum (Verrumal<sup>®</sup>). |
5-Fluoruracil findet auch Anwendung als [[Warze]]n-Therapeutikum (Verrumal<sup>®</sup>). |
||
Version vom 19. April 2018, 09:35 Uhr
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
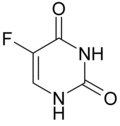
| |||||||||||||
| Strukturformel des Dioxo-Tautomers | |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | 5-Fluorouracil | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C4H3FN2O2 | ||||||||||||
| Kurzbeschreibung |
weißes Pulver[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Wirkstoffklasse | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 130,08 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
löslich in Wasser (11,1 g·l−1 bei 22 °C)[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Toxikologische Daten | |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
5-Fluoruracil (5-FU), auch Fluorouracil (INN), ist eine heterocyclische organische Verbindung mit einem Pyrimidingrundgerüst und zwei Carbonylgruppen an den Positionen 2 und 4 sowie einem Fluor an Position 5. Es ist ein Derivat der Nukleinbase Uracil.
Es ist ein Arzneistoff, welcher als Zytostatikum in der Chemotherapie, vor allem beim kolorektalen Karzinom und bei Brustkrebs verwendet wird. Es wurde von dem amerikanischen Chemiker Charles Heidelberger entwickelt und 1962 von der Pharmafirma Hoffmann-La Roche auf den Markt gebracht. Ausschlaggebend für die Synthese von 5-FU waren Heidelbergers Überlegungen zum tumorhemmenden Potential von Fluoracetat, dem Salz der Fluoressigsäure.[4] Später beschrieb Heidelberger die Metabolisierung von 5-FU unter Bezugnahme auf das vom britischen Biochemiker und Kampfstoffforscher Sir Rudolph Peters entwickelte Prinzip der letalen Synthese (Biotransformation von Fluoracetat zu Fluorcitrat).[5]
5-Fluoruracil findet auch Anwendung als Warzen-Therapeutikum (Verrumal®).
Eigenschaften
5-Fluoruracil ist ein Feststoff, der bei 282–286 °C unter Zersetzung schmilzt.[1]
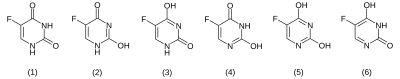
Von 5-Fluoruracil gibt es sechs mögliche tautomere Formen im festen Zustand, wobei die Dioxo-Form (1) bevorzugt ist.
Pharmakologische Eigenschaften
Wirkung
5-Fluoruracil ist ein Antimetabolit, der bei der Zellteilung aufgrund der Strukturähnlichkeit mit den Pyrimidinbasen Cytosin und Thymin (DNA-Nukleotide) beziehungsweise Uracil (RNA-Nukleotid) anstatt dieser in die DNA und RNA eingebaut wird. So wandelt das Enzym UMP-Pyrophosphorylase (EC 2.4.2.9) 5-Fluoruracil in 5-Fluor-UMP um, das dann weiter zu 5-Fluor-UTP phosphoryliert und in die RNA eingebaut wird. Dieses bewirkt die Synthese fehlerhafter RNA, wodurch die Protein-Biosynthese gehemmt wird.
5-Fluor-dUMP hemmt darüber hinaus auch die Thymidylat-Synthase (EC 2.1.1.45), was letztendlich dazu führt, dass die DNA-Synthese und die Zellteilung inhibiert werden.[6]
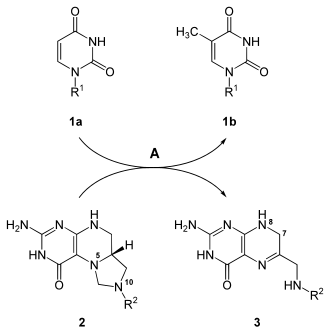
Die Synthese von dTMP (1b) aus dUMP (1a) wird durch die Thymidylat-Synthase (A) katalysiert, dabei wird N5,N10-Methylentetrahydrofolat (2) zu 7,8-Dihydrofolat (3) umgesetzt. 5-Fluor-dUMP inhibiert das Enzym und damit diese Reaktion.
Es wirkt insbesondere in der Interphase des Zellzyklus. Neben einer Hemmung der DNA- und RNA-Synthese inhibiert es auch den sogenannten Exosomkomplex, der für die Zelle lebensnotwendig ist.
5-Fluoruracil wird in Form der Prodrugs Capecitabin oder 5-Fluorcytosin verabreicht und erst in der Zelle zum aktiven Metaboliten umgewandelt. Beispielsweise wird 5-Fluorcytosin durch eine Cytosin-Permease in die Zelle aufgenommen und dort sofort durch die Cytosin-Desaminase zu 5-Fluoruracil desaminiert.[7]
Nebenwirkungen
Die Nebenwirkungen (Übelkeit, Erbrechen, Schleimhautentzündungen, Knochenmarkschädigung) können beträchtlich sein (siehe Abschnitt Nebenwirkungen im Artikel Zytostatikum).
Als langfristige Nebenwirkungen wurden bei Tierexperimenten und Patientenuntersuchungen Gehirnschäden durch Schädigung von Gliazellen ausgemacht.[8]
Durch die zusätzliche Gabe von Tetrahydrofolsäure bzw. Folinsäure ist eine höhere Dosierung von 5-FU möglich, man nutzt diesen Effekt für Kombinationstherapien. Eine Wirkungsverstärkung bewirkt auch Interferon-α.
Der Abbau von 5-Fluoruracil geschieht über das Enzym Dihydropyrimidindehydrogenase.[9] Bei Patienten, die von der seltenen angeborenen Stoffwechselerkrankung Dihydropyrimidin-Dehydrogenase-Mangel (DPD) betroffen sind, kann die Behandlung mit 5-Fluorouracil zu schwersten Intoxikationen führen. [10] Betroffene Personen sind häufig asymptomatisch. Die Ausschlussdiagnostik erfolgt durch die Analyse der Purine & Pyrimidine und den konkreten Untersuchungsauftrag "Ausschluss DPD bei geplanter 5-Fluorouracil-Therapie" aus Urin.
Siehe auch
Handelsnamen
Benda-5 FU (D), Efudix (D, CH), Haemato-fu (D), Neofluor (D), Onkofluor (D), Ribofluor (D), diverse Generika (D, A, CH)
Verrumal (D, A, CH)
Einzelnachweise
- ↑ a b c Datenblatt 5-Fluorouracil bei Sigma-Aldrich (PDF).
- ↑ a b c Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar).
- ↑ a b Eintrag zu 5-Fluoruracil in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Charles Heidelberger: Fluorinated Pyrimidines and Their Nucleosides. In: Antineoplastic and Immunosuppressive Agents (= Handbuch der experimentellen Pharmakologie / Handbook of Experimental Pharmacology). Springer, Berlin, Heidelberg, 1975, ISBN 978-3-642-65808-2, S. 193–231, doi:10.1007/978-3-642-65806-8_12 (springer.com [abgerufen am 19. April 2018]).
- ↑ Katherine Elliott, Joan Birch (Hrsg.): Carbon-Fluorine Compounds. Chemistry, Biochemistry and Biological Activities. Associated Scientific Publishers, Amsterdam 1972, ISBN 978-0-470-71985-5, S. 130.
- ↑ Joachim Morschhäuser: Resistenzen und Resistenzmechanismen: Wie entkommen Pilze der Therapie? in: Pharmazie in unserer Zeit, 2003, 32 (2), S. 124–129 (doi:10.1002/pauz.200390029).
- ↑ F. von Bruchhausen: Hagers Handbuch der Pharmazeutischen Praxis: Drogen A-K, 5. Auflage, Springer Verlag, Berlin 1998, ISBN 3-540-61618-7, S. 226.
- ↑ Wie 5-Fluorouracil das Gehirn schädigt.
- ↑ S. Maurer, J. Thödtmann: Das Mammakarzinom: Diagnostik und Therapie. Govi-Verlag, Eschborn 2003, ISBN 978-3-7741-0996-4.
- ↑ Van Kuilenburg ABP (2004) Dihydropyrimidine dehydrogenase and the efficasy and toxicity of 5-fluorouracil. Eur J Cancer 40:939–950.