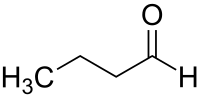
Butanal
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Butanal | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C4H8O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 72,11 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,80 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
75 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,3843 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
20 ml·m−3, 64 mg·m−3[2] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Butanal (nach IUPAC-Nomenklatur: n-Butanal, auch als Butyraldehyd bekannt) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Aldehyde. Neben dem linearen n-Butanal existiert noch die isomere Verbindung iso-Butanal (Isobutyraldehyd).
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Natürlich kommt Butanal in Echtem Lorbeer, Äpfeln, Reis (Oryza sativa), Pelargonien (Pelargonium graveolens) und Echter Guave vor.[7]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Großtechnisch hergestellt wird n-Butanal nur durch die Hydroformylierung von Propen bei Temperaturen von 90 – 125 °C und Drücken von 10 – 60 bar. Als Katalysatorsysteme werden meist Rhodium und sulfonierte Triarylphosphine in wässriger Lösung verwendet.[8]
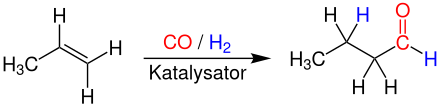
Als Nebenprodukt entsteht iso-Butanal (2-Methylpropanal). Butanal ist auch durch schonende Oxidation des entsprechenden Alkohols 1-Butanol zugänglich.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Butanal ist eine farblose, stechend riechende, flüchtige, leichtentzündliche Flüssigkeit, die bei Normaldruck bei 75 °C siedet.[2] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,59112, B = 952,851 und C = −82,569 im Temperaturbereich von 303.86 bis 347.18 K.[9]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−245,4 kJ·mol−1[10]
−211,8 kJ·mol−1[10]als Flüssigkeit
als GasVerbrennungsenthalpie ΔcH0liquid −2477,1 kJ·mol−1[11] Wärmekapazität cp 164,7 J·mol−1·K−1 (25 °C)[12]
2,28 J·g−1·K−1 (25 °C).[12]als Flüssigkeit
als FlüssigkeitKritische Temperatur Tc 537,2 K[13] Kritischer Druck pc 43,20 bar[13] Kritische Dichte ρc 3,88 mol·l−1[14] Kritisches Volumen Vc 0,258 l·mol−1[15] Schmelzenthalpie ΔFH 10,773 kJ·mol−1[12] beim Schmelzpunkt Verdampfungsenthalpie ΔVH 32,9 kJ·mol−1[16] beim Normaldrucksiedepunkt
Die Löslichkeit von Wasser in Butanal ändert sich nur wenig mit steigender Temperatur. Dagegen sinkt die Löslichkeit von Butanal in Wasser mit steigender Temperatur.[15]
| Löslichkeiten im System Butanal – Wasser[15] | ||||||||||||
| Temperatur | in °C | 0 | 10 | 20 | 30 | 40 | 50 | |||||
| Löslichkeit von Wasser in Butanal | in Ma% | 3,2 | 2,8 | 2,6 | 2,4 | 2,4 | 2,4 | |||||
| Löslichkeit von Butanal in Wasser | in Ma% | 9,8 | 8,6 | 7,6 | 6,8 | 6,1 | ||||||
Mit einem Wassergehalt von 8,8 Ma% bildet die Verbindung ein bei 68 °C siedendes Azeotrop. Weitere azeotrop siedende Gemische werden mit Ethanol und n-Hexan gebildet.[15]
| Azeotrope mit verschiedenen Lösungsmitteln[15] | ||||||||||||
| Lösungsmittel | Wasser | Ethanol | n-Hexan | |||||||||
| Gehalt Butanal | in Ma% | 91,2 | 59,4 | 26 | ||||||||
| Siedepunkt | in °C | 68 | 70,7 | 60 | ||||||||
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Butanal bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −11 °C.[2][17] Der Explosionsbereich liegt zwischen 1,7 Vol.‑% (51 g/m3) als untere Explosionsgrenze (UEG) und 12,5 Vol.‑% (375 g/m3) als obere Explosionsgrenze (OEG).[2][17] Der maximale Explosionsdruck beträgt 7,5 bar.[2] Die Grenzspaltweite wurde mit 0,92 mm bestimmt.[2][17] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA. Die Zündtemperatur beträgt 190 °C.[17][2] Der Stoff fällt somit in die Temperaturklasse T4.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Butanal polymerisiert beim Erhitzen sowie unter Einfluss von Säuren und Alkali. Es reagiert mit Oxidationsmitteln, starken Säuren, starken Basen und Aminen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Butanal wird zur Herstellung von Vulkanisationsbeschleunigern, Kunstharzen und Weichmachern benötigt. Es ist Grundlage synthetischer Gerb- und Riechstoffe.[3] Außerdem wird aus n-Butanal durch katalytische Hydrierung großtechnisch n-Butanol erzeugt. Des Weiteren kann es durch Oxidation zu Butansäure (Buttersäure) umgesetzt werden.[18]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Die Substanz kann in den Körper durch Inhalation der Dämpfe und durch Verschlucken aufgenommen werden. Dabei werden die Augen, die Haut und die Atemwege gereizt. Der Dampf ist schwerer als Luft und kann sich auf dem Boden ausbreiten.
Die Bildung explosiver Peroxide ist möglich.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu BUTYRALDEHYDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. September 2021.
- ↑ a b c d e f g h i j k l m n o p q r s Eintrag zu Butyraldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Butyraldehyde. In: Römpp Online. Georg Thieme Verlag, abgerufen am 22. August 2017.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-72.
- ↑ Eintrag zu Butyraldehyde im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-26.
- ↑ BUTANAL (engl.) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 25. Juli 2023.
- ↑ Patent DE3530839A1: Verfahren zur Herstellung von 2-Ethylhexanol. Angemeldet am 29. August 1985, veröffentlicht am 5. März 1987, Anmelder: Ruhrchemie AG, Erfinder: Günther Kessen, Boy Cornils, Josef Hibbel, Hans-Wilhelm Bach, Wilhelm Gick, Ernst Wiebus, Wolfgang Zgorzelski.
- ↑ M. Seprakova, J. Paulech, J. Dykyj: Dampfdruck der Butyraldehyde. In: Chem. Zvesti. 13, 1959, S. 313–316.
- ↑ a b K. B. Wiberg, L. S. Crocker, K. M. Morgan: Thermochemical studies of carbonyl compounds. 5. Enthalpies of reduction of carbonyl groups. In: J. Am. Chem. Soc. 113, 1991, S. 3447–3450, doi:10.1021/ja00009a033.
- ↑ G. R. Nicholson: 478. The heats of combustion of butanal and heptanal. In: J. Chem. Soc. 1960, S. 2377–2378.
- ↑ a b c V. G. Vasil'ev, B. V. Lebedev: Thermodynamics of butanal in the temperature range 0-330K. In: Zh. Obshch. Khim. 59, 1989, S. 2415–2420.
- ↑ a b A. S. Teja, D. J. Rosenthal: The Critical Pressures and Temperatures of Twelve Substances Using A Low Residence Time Flow Apparatus. In: AIChE Symp. Ser. 86, 279, 1990, S. 133–137.
- ↑ M. J. Anselme, A. S. Teja: The critical properties of rapidly reacting substances. In: AIChE Symp. Ser. 86, 279, 1990, S. 128–132.
- ↑ a b c d e D. K. Raff: Butanals. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag, Weinheim 2013. doi:10.1002/14356007.a04_447.pub2.
- ↑ J. G. Wojtasinski: Measurement of Total Pressures for Determining Liquid-Vapor Equilibrium Relations of the Binary System Isobutyraldehyde n-Butyraldehyde. In: J. Chem. Eng. Data. 8, 1963, S. 381–385, doi:10.1021/je60018a028.
- ↑ a b c d E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen - Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Eintrag zu Butanole. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Februar 2019.

