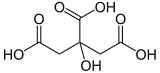
Citronensäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Citronensäure | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H8O7 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser, geruchloser Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung: ab 175 °C[3] | |||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Citronensäure[7] (auch Zitronensäure[8]) ist eine farblose, wasserlösliche Carbonsäure, die zu den Tricarbonsäuren und zu den Fruchtsäuren zählt. Neben der wasserfreien Variante existiert das Citronensäuremonohydrat (C6H8O7 · H2O), das pro Molekül Citronensäure ein Molekül Kristallwasser enthält. Die Salze und Ester der Citronensäure sind die Citrate. Ein Konstitutionsisomer der Citronensäure ist die Isocitronensäure.
Geschichte
Carl Wilhelm Scheele isolierte 1784 erstmals Citronensäure aus Zitronensaft[9] – daher der Name. Allerdings dürfte Citronensäure schon den ersten Alchemisten bekannt gewesen sein, wenn auch unter anderem Namen. Bereits im 9. Jahrhundert soll der arabische Alchemist Dschābir ibn Hayyān (Geber) Citronensäure entdeckt haben.

Vorkommen

Citronensäure ist eine der im Pflanzenreich am weitesten verbreiteten Säuren und tritt als Stoffwechselprodukt in allen Organismen auf. Zitronensaft enthält beispielsweise 5–7 % Citronensäure. Sie kommt aber auch in Äpfeln, Birnen, Sauerkirschen, Himbeeren, Brombeeren, Johannisbeeren, in Nadelhölzern, Pilzen, Tabakblättern, im Wein und sogar in der Milch vor.
Citronensäure ist weit verbreitet, weil sie (namengebend) als Zwischenprodukt im Citratzyklus (auch Tricarbonsäurezyklus, Krebszyklus) auftritt. Dieser Prozess nimmt eine Schlüsselrolle im Kohlenhydrat- und Fettsäure-Stoffwechsel aller sauerstoffverbrauchenden Lebewesen einschließlich des Menschen ein. Dieser Zyklus liefert auch die molekularen Grundstrukturen für den Aufbau der meisten Aminosäuren.
Gewinnung und Darstellung
Herstellung aus Zitrusfrüchten
Nach dem ursprünglichen Verfahren wurde Citronensäure aus Zitrusfrüchten gewonnen.[10] Zitronensaft wurde mit konzentrierter Ammoniaklösung versetzt, eingedickt und filtriert. Das leicht lösliche Ammoniumcitrat wurde durch Fällung mit Calciumchlorid in schwerer lösliches Calciumcitrat umgewandelt. Die Lösung wurde erneut filtriert und der Filterkuchen in 25%iger Schwefelsäure gelöst, wobei noch schlechter lösliches Calciumsulfat (Gips) ausfällt. Nach erneuter Filtration wird eine Citronensäurelösung gewonnen. Die reine Citronensäure erhält man durch Kristallisation.
Biotechnische Herstellung
Industriell stellt man Citronensäure durch Submersfermentation zuckerhaltiger Rohstoffe wie Melasse und Mais her.[11] Für die Fermentation werden Aspergillus-niger-Stämme verwendet. Vor allem in den USA und in China kommen oft transgene Varianten des Schimmelpilzes zum Einsatz, in Europa ist dies nicht gestattet. Bei der Citronensäure-Produktion müssen besonders drei Bedingungen erfüllt sein:
- Hoher Glucose- und Sauerstoffgehalt im Nährmedium
- Niedriger pH-Wert (pH < 3). Dieser hemmt zum einen das Folgeenzym der Citratsynthase im Citratzyklus, die Aconitase. Ein solch niedriger pH-Wert liegt fern des pH-Optimums des Enzyms und senkt dessen Aktivität stark ab. Dies führt dazu, dass die Pilze die Citronensäure nur in geringem Maße weiter verstoffwechseln. Zum anderen wird die Außenmembran der Pilzzellen instabil und die Citronensäure wird in das Außenmedium abgegeben. Hinzu kommt, dass die Kontaminationsgefahr durch unerwünschte Fremdorganismen bei derart niedrigem pH-Wert gering ist.
- Niedrige Fe2+-Konzentration (< 5 mg/l). Dadurch fehlt der Aconitase der Cofaktor. Die Fe2+-Ionen werden durch Zugabe von Kaliumhexacyanidoferrat(III) gebunden. Mn2+-Konzentrationen (< 2 µg/l) führen ebenfalls zu hohen Citrat-Ausbeuten.
Um Citronensäure aus der verunreinigten Fermenterlösung zu gewinnen, wird sie durch Zugabe von Kalkmilch und Erhitzen als Calciumcitrat ausgefällt:[12]
Durch Zugabe von verdünnter Schwefelsäure wird das ausgefallene Calciumcitrat zu Citronensäure und Gips umgesetzt:[12]
Reinheit und Verträglichkeit der Citronensäure auf dem Markt zeigen große Unterschiede. Verschiedene Aspergillus-niger-Stämme produzieren unter bestimmten Wachstumsbedingungen Mykotoxine. Die Produktion dieser Stoffe findet unter kontrollierten Bedingungen nicht statt. In hoch aufgereinigter Citronensäure finden sich keine Rückstände von Schimmelpilzen.
Eigenschaften


Physikalische Eigenschaften
Citronensäure bildet im wasserfreien Zustand rhombische Kristalle, die leicht sauer schmecken. Eine wässrige Lösung der Citronensäure leitet den elektrischen Strom, da die Carboxygruppen Protonen abspalten und somit bewegliche Ladungsträger (Ionen) in der Lösung vorliegen. Die Säuredissoziationskonstanten der Citronensäure sind pKs1 = 3,13, pKs2 = 4,76 und pKs3 = 6,4. Der teilweise beziehungsweise vollständig dissoziierte Säurerest der Citronensäure wird als Citrat bezeichnet. Für die Löslichkeit in Wasser werden in der Literatur stark abweichende Werte genannt.[6][13][14]
Chemische Eigenschaften

Citronensäure wird aufgrund ihrer drei Carboxygruppen (–COOH) zu den organischen Tricarbonsäuren gezählt. Zudem weist die Hydroxygruppe (–OH) an Position 3 des Kohlenstoffrückgrates sie als Hydroxycarbonsäure aus. Citronensäure ist ein Chelator für Metallionen.
Citronensäure geht viele für Carbonsäuren typische Reaktionen ein:
Citronensäure kann mit verschiedenen Oxidationsmitteln (beispielsweise Peroxiden oder Hypochloriten) oxidiert werden. In Abhängigkeit von den Reaktionsbedingungen können dabei β-Ketoglutarsäure, Oxalsäure, Kohlendioxid und Wasser entstehen.
In geringen Mengen eingenommen fördert Citronensäure indirekt das Knochenwachstum, weil sie die Aufnahme von Calcium begünstigt. In größeren Mengen wirkt sie jedoch toxisch (LD50 bei Ratten: 3 g/kg).[3]
Isomere
Bei der Isocitronensäure sitzt die Hydroxygruppe (–OH) an Position 2 des Kohlenstoffrückgrats. Sie unterscheidet sich von der Citronensäure durch die Stellung dieser Hydroxygruppe, die bei der Citronensäure an Position 3 ist.
-
Citronensäure
-
Isocitronensäure
Verwendung

Citronensäure ist häufig in kalklösenden Reinigungsmitteln enthalten, da sie geruchlos ist. Durch die saure Wirkung löst sie Calciumcarbonat zum wasserlöslichen Calcium-dicitrato-Komplex, einen typischen Chelatkomplex [Ca(Cit)2]4−. Der Komplex zerfällt durch steigende Temperatur und steigenden pH-Wert, es fällt wasserunlösliches Calciumcitrat Ca3(Cit)2 aus. Bei einem Überschuss an Citronensäure löst sich Calciumcitrat wieder.[15]
Zum Lösen von Kalk- sowie Eisen- und Manganverbindungen, die sich bei der Verockerung von Brunnen bilden, wird Citronensäure gemeinsam mit einer geringen Zugabe von Ascorbinsäure als Reduktionsmittel (alternativ Natriumdithionit) eingesetzt.[16]
Citronensäure und ihre Salze werden zur Konservierung und auch zur Homogenisierung als Schmelzsalz sowie als Säuerungsmittel bzw. Säureregulator von Lebensmitteln verwendet, beispielsweise in Getränken. In Brausepulver und -stäbchen ist sie zusammen mit Natriumhydrogencarbonat enthalten. Als natürlicher Bestandteil der meisten Früchte ist sie in Fruchtsäften (Fruchtsäuren) enthalten. Citronensäure ist in der EU als Lebensmittelzusatzstoff unter der Nummer E 330 in den meisten Lebensmitteln unbegrenzt zugelassen. Eine Ausnahme bilden Schokoladenerzeugnisse und Fruchtsäfte, für die nur eine begrenzte Zulassung vorliegt, sowie einige Lebensmittel, wie zum Beispiel Honig, Milch und Butter, für die keine Zulassung vorliegt.[17] Da sie als Peptisator wirkt, wird sie zur Herstellung stabiler Suspensionen eingesetzt. In Fischgerichten kann sie biogene Amine in nicht flüchtige Salze überführen und so den Fischgeruch mindern.
Der vielfache Einsatz von Citronensäure in Lebensmitteln wird kritisiert, da sie als Komplexbildner Aluminium löst und dessen Resorption erhöht. Hohe Gehalte an Citronensäure begünstigen die Demineralisation von Zahnschmelz, was zur Zahnerosion bzw. Karies führen kann.[18] Bei sogenannten „Candy-Sprays“ – Süßwaren, die in Pumpsprays angeboten und direkt in den Mund gesprüht werden – besteht darüber hinaus die Gefahr, dass Schleimhäute wegen des hohen Citronesäuregehaltes gereizt werden oder es zu Atembeschwerden kommt.[19]
Citronensäure und Citrate verhindern die Blutgerinnung. Deshalb konserviert man Blutspenden in Beuteln, die eine Citratpufferlösung enthalten. Für Gerinnungsanalysen verwendet man Citratblut, bei dem Blut mit Citrat im Verhältnis 9:1 (9 Teile Blut + 1 Teil 0,11 mol/l Natriumcitrat) gemischt wird. Eine spezielle Verwendung ist der Einsatz in Zellseparatoren. Dabei wird aus einer Vene Blut entnommen, im Gerät werden die gewünschten Blutbestandteile (zum Beispiel Thrombozyten) abgetrennt, und das restliche Blut wird in die Vene zurückgeführt. Damit das Blut im Gerät keine gefährlichen Gerinnsel bildet, wird es mit Citratpuffer versetzt.
Citronensäure wird wie auch EDTA als Spüllösung bei Wurzelkanalbehandlungen in der Zahnmedizin verwendet.
Weitere Einsatzgebiete der Citronensäure:
- Citronensäure wird als Wasserenthärter und alternativer Weichspüler eingesetzt.
- Citronensäure wird zur Passivierung von rostfreiem Edelstahl verwendet. Bei diesem Verfahren werden die freien Eisenanteile aus der Oberfläche gelöst. Dadurch wird das Chrom-Eisen-Verhältnis beeinflusst, was zu einer Verbesserung der Passivschicht und damit zur Verbesserung des Korrosionsschutzes führt.
- Citronensäure wird zur pH-Wert-Einstellung von Kosmetika, z. B. Hautpflegelotion oder -creme, verwendet.[20][21]
- In hoher Dosierung dient Citronensäure auch als Rostentferner.
- Citronensäure wird als Katalysator bei der Biokohleherstellung durch Hydrothermale Carbonisierung verwendet.[22]
Citronensäuretrimethylester, Citronensäuretriethylester und Citronensäuretri-n-butylester werden unter anderem als Weichmacher verwendet.
Literatur
- Rolf D. Schmid: Taschenatlas der Biotechnologie und Gentechnik. 2. Auflage. Wiley-VCH Verlag, Weinheim 2006, ISBN 3-527-31310-9.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage. John Wiley & Sons, New York 2004, ISBN 0-471-19350-X.
Weblinks
Einzelnachweise
- ↑ Eintrag zu CITRIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- ↑ Eintrag zu E 330: Citric acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- ↑ a b c d e f g Eintrag zu Zitronensäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Citronensäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Juli 2014.
- ↑ a b c Christian Beyer: Quantitative anorganische Analyse: ein Begleiter für Theorie und Praxis. Springer Science & Business, 1996, ISBN 3-528-06779-9, S. 96 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e Datenblatt Citronensäure bei Sigma-Aldrich, abgerufen am 30. November 2009 (PDF).
- ↑ Karl-Friedrich Arndt, Axel Satzger: Langenscheidt Fachwörterbuch Chemie und chemische Technik Englisch Deutsch-Englisch. Hrsg.: Technische Universität Dresden. Langenscheidt, Berlin 2009, ISBN 978-3-86117-476-9 (Online-Fachwörterbücher von Langenscheidt Chemie: Suche nach Citronsäure und Zitronensäure).
- ↑ Wörterverzeichnis des Rates für deutsche Rechtschreibung
- ↑ Carl Wilhelm Scheele: Anmärkning om Citron-Saft, samt sätt att crystallisera den samma. In: Kongliga Vetenskaps Academiens Nya Handlingar. Band 5. Stockholm 1784, S. 105–109 (biodiversitylibrary.org).
- ↑ Frank H. Verhoff: Citric Acid. In: Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim.
- ↑ Walid A. Lotfy, Khaled M. Ghanem, Ehab R. El-Helow: Citric acid production by a novel Aspergillus niger isolate: II. Optimization of process parameters through statistical experimental designs. In: Bioresource Technology (2007), Band 98, Heft 18, S. 3470–3477, doi:10.1016/j.biortech.2006.11.032. PMID 17317159.
- ↑ a b Holger Alwast: Gutachten: "Umweltverträgliche Alternativen zum Abbau von Naturgips". Hrsg.: Bund für Umwelt und Naturschutz Deutschland e.V. – BUND. Berlin 20. September 2020, 8.2 Gips aus der Zitronensäureherstellung, S. 51 (bund.net [PDF; abgerufen am 8. November 2024]).
- ↑ Datenblatt Citronensäure bei Merck, abgerufen am 5. März 2016.
- ↑ OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Citric acid, abgerufen am 5. März 2016.
- ↑ Martina Vavrusova, Leif H. Skibsted: Aqueous solubility of calcium citrate and interconversion between the tetrahydrate and the hexahydrate as a balance between endothermic dissolution and exothermic complex formation. In: International Dairy Journal. Band 57, Juni 2016, S. 20–28, doi:10.1016/j.idairyj.2016.02.033: „Excess citrate increased calcium citrate solubility but decreased the calcium ion activity of the saturated solution […]“
- ↑ Patent Nr.: DE19953807A1; Patent Nr.: EP 0456271A1.
- ↑ Verordnung (EG) Nr. 1333/2008 in der konsolidierten Fassung vom 31. Oktober 2022
- ↑ Hohe Gehalte an Zitronensäure in Süßwaren und Getränken erhöhen das Risiko für Zahnschäden. (PDF) In: Bundesinstitut für Risikobewertung. 9. Januar 2004, abgerufen am 20. Juli 2022.
- ↑ Bewertung von „Candy Sprays“ mit erhöhtem Zitronensäuregehalt. (PDF) In: BfR. 21. Januar 2013, abgerufen am 20. Juli 2022.
- ↑ Vollrath, Hopp: Citronensäure: Beispiel für ein biotechnisches Produkt. In: Grundlagen der Life Sciences, Wiley-VCH Verlag, Weinheim 2000, ISBN 978-3-527-29560-9.
- ↑ Professor Blumes Medienangebot: Citronensäure in der Kosmetik.
- ↑ Peter Brandt: Die „Hydrothermale Carbonisierung“: eine bemerkenswerte Möglichkeit, um die Entstehung von CO2 zu minimieren oder gar zu vermeiden? In: Journal für Verbraucherschutz und Lebensmittelsicherheit, 2009, 4 (2), S. 151–154; doi:10.1007/s00003-009-0472-7.