Halothan
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Halothan | |||||||||||||||||||||
| Andere Namen |
2-Brom-2-chlor-1,1,1-trifluorethan | |||||||||||||||||||||
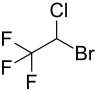
| Summenformel | C2HBrClF3 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, leicht flüchtige Flüssigkeit mit süßem Geruch[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 197,39 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,871 g·cm−3[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
50,2 °C[2] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Brechungsindex |
1,3697[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Treibhauspotential |
50 (bezogen auf 100 Jahre)[5] | |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−720,0 kJ/mol[6] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Halothan ist ein halogenierter Kohlenwasserstoff, der 1951 im Auftrag der Imperial Chemical Industries von Charles Walter Suckling (1920–2013)[7] synthetisiert wurde. Seit seiner ersten klinischen Anwendung unter dem Handelsnamen als Fluothane am 20. Januar 1956 durch J. Raventós,[8] der das Halothan zunächst mit Suckling pharmakologisch erprobt hatte, und Michael Johnstone[9] in Manchester wird es als nach Chloroform erstes klinisch längerfristig verwendetes und brauchbares halogeniertes Inhalationsanästhetikum,[10][11] das über die Atemwege zugeführt wird, eingesetzt, und ersetzte bereits 1957 weitgehend den Äther. Halothan ist in Europa und den USA dann 20 bis 25 Jahre später weitgehend von den neueren halogenierten Anästhetika (Flurane wie Isofluran, Sevofluran und Desfluran) abgelöst worden. Halothan wurde 1997 in die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation aufgenommen.
Unter der Verwendung von Halothan kann es zur malignen Hyperthermie kommen.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
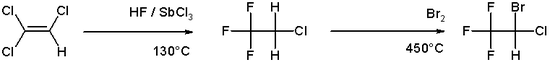
Die industrielle Synthese von Halothan erfolgt ausgehend von Trichlorethylen, welches mit Fluorwasserstoff in Gegenwart von Antimontrichlorid bei 130 °C zu 2-Chlor-1,1,1-trifluorethan reagiert. Dieses reagiert dann mit Brom bei 450 °C weiter zu Halothan.[12]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Erwünschte Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Halothan ist eine farblose Flüssigkeit mit süßem Geruch. Da Halothan sehr lichtempfindlich ist, wird es meist in braunen Flaschen gelagert. Halothan ist gut blut- und fettlöslich. Es flutet im Blut recht schnell an und ab, weshalb es als Narkosemittel besonders geeignet ist. Außerdem bildet es keine explosiven Gemische, lässt sich mit Distickstoffmonoxid (N2O) kombinieren (Dosisreduktion möglich) und ist ein äußerst potentes Inhalationsnarkotikum. Der therapeutische Bereich liegt etwa bei 0,5–1 % atm. Alveolarkonzentration.[13] Zudem kann es zur Durchbrechung eines Status asthmaticus[14] bzw. Behandlung eines Bronchospasmus eingesetzt werden.[15][16]
Unerwünschte Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Halothan weist, wie fast alle Narkotika, eine geringe therapeutische Breite auf und bewirkt einen dosisabhängigen Blutdruckabfall. Die Herzfrequenz bleibt unter Halothan gleich oder nimmt ab.[17] Des Weiteren sensibilisiert Halothan den Herzmuskel gegen Katecholamine, weshalb es auch zu Herzrasen kommen kann. Bei der Metabolisierung (etwa 15–20 %) in der Leber werden Bromidionen frei, die in größeren Mengen toxisch wirken, Allergien auslösen können und das Immunsystem supprimieren. In seltenen Fällen (1:10.000) entwickelt sich (als allergische Reaktion) eine Halothan-Hepatitis, weshalb empfohlen wird, Patienten nur alle drei Monate mit Halothan zu narkotisieren. Hier ist festzuhalten, dass das Personal, anders als der Patient, sehr stark belastet sein kann.
Halothan verliert als Narkotikum immer mehr an Bedeutung, da halogenierte Ether wie Enfluran, Isofluran oder Sevofluran deutlich bessere pharmakologische Eigenschaften besitzen.
Die atmosphärische Lebensdauer beträgt ein Jahr, das Treibhauspotential (GWP) 50 und die Emissionen liegen bei 250 Tonnen pro Jahr.[18]
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
Halothan ist in Deutschland und in der Schweiz nicht mehr im Handel. Es war unter den Namen Fluothane (D), Narcotan (D) und Halothane BP (CH) verfügbar.
Literatur[Bearbeiten | Quelltext bearbeiten]
- Erich Kirchner (Hrsg.): 20 Jahre Fluothane. Springer, Berlin 1978 (= Anaesthesiologie und Intensivmedizin. Band 109), ISBN 978-3-540-08602-4.
- Max S. Sadove, Vernon E. Wallace: Halothane. Blackwell Scientific Publications, Oxford 1962.
- Charles W. Suckling: Some chemical and physiological factors in the development of “fluothane”. In: British Journal of Anaesthesiology. Band 29, 1957, S. 466 f.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Eintrag zu 2-Brom-2-chlor-1,1,1-trifluorethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Halothane in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Eintrag zu Halothan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 151-67-7 bzw. Halothan), abgerufen am 2. November 2015.
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- ↑ Michael J. McCann, Colin J. Suckling: Charles Walter Suckling. 24 July 1920–30 October 2013. 19. Dezember 2018, doi:10.1098/rsbm.2018.0025.
- ↑ Vgl. J. Raventós: Action of Fluothane. A new volatile anaesthetic. In: British Journal of Pharmakology. Band 11, 1956, S. 384 ff.
- ↑ M. Johnstone: The human cardiovascular response to fluothane anaesthesia. In: British Journal of Anaesthesiology. Band 28, Nr. 9, S. 392–410.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 15 und 26.
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 882.
- ↑ Suckling u. a.: PROCESS FOR THE PREPARATION OF 1,1,1-TRIFLUORO-2-BROMO-2-CHLOROETHANE. US patent 2921098, granted January 1960, assigned to Imperial Chemical Industries.
- ↑ H. H. Frey, W. Löscher: Lehrbuch der Pharmakologie und Toxikologie für die Veterinärmedizin. 2. Auflage. Enke Verlag, 2007, ISBN 3-8304-1070-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ S. H. Schwartz: Treatment of status asthmaticus with halothane. In: J. Amer. Med. Ass. Band 251, 1984, S. 2688–2689.
- ↑ C. M. Colaco, R. R. Crago, A. Weisbert: Halothane for status asthmaticus in the intensive care unit. A case report. In: Canad. Anaesth. Soc. J. Band 25, 1978, S. 329–330.
- ↑ C. A. Hirshman, N. A. Bergman: Halothane and enflurane protect against bronchospasm in a dog asthma model. In: Anesthesiology. Band 56, 1982, S. 107–111.
- ↑ Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/ Heidelberg/ New York u. a. 1999, ISBN 3-540-65024-5, S. 3–6, hier: S. 3 f.
- ↑ Martin K. Vollmer, Tae Siek Rhee, Matt Rigby, Doris Hofstetter, Matthias Hill, Fabian Schoenenberger, Stefan Reimann: Modern inhalation anesthetics: Potent greenhouse gases in the global atmosphere. In: Geophysical Research Letters. 42. Jahrgang, Nr. 5, 2015, S. 1606, doi:10.1002/2014GL062785.