Tris(dimethylamino)methan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tris(dimethylamino)methan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H19N3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 145,25 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Siedepunkt |
42–43 °C bei 16 hPa[1] | ||||||||||||||||||
| Löslichkeit |
mischbar mit unpolaren, aprotischen, wasserfreien Lösungsmitteln[3] | ||||||||||||||||||
| Brechungsindex |
1,4360 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Tris(dimethylamino)methan (TDAM) ist der einfachste Vertreter von Tris(dialkylamino)methanen der allgemeinen Formel (R2N)3CH, in dem drei der vier Wasserstoffatome des Methans durch Dimethylaminogruppen (-N(CH3)2) ersetzt sind.[4] Tris(dimethylamino)methan kann sowohl als Amin, als auch als Orthoamid aufgefasst werden.
TDAM ist eine starke Base und kann als Formylierungsmittel, als Reagenz für die Aminomethylenierung und als Quelle für das basische Carben Bis(dimethylamino)carben der Formel R2N-C:-NR2 eingesetzt werden.[3]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Tris(dimethylamino)methan entsteht bei der Reaktion von N,N,N′,N′-Tetramethylformamidiniumchlorid[4][5][6] oder Bis(dimethylamino)acetonitril[7] mit Lithiumdimethylamid oder Natriumdimethylamid mit Ausbeuten zwischen 55 und 84 %.[3]

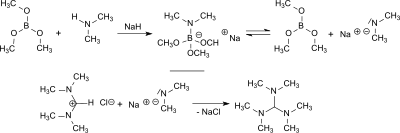
Aus Dimethylamin und Natriumhydrid entsteht in Gegenwart von Borsäuretrimethylester in situ Natriumdimethylamid, das mit N,N,N′,N′-Tetramethylformamidiniumchlorid in 84%iger Ausbeute und mit Bis(dimethylamino)acetonitril in 77%iger Ausbeute TDAM bildet.[8]
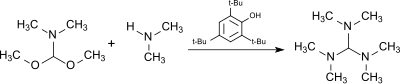
Die Umsetzung von Dimethylformamid-dimethylacetal (aus DMF-Dimethylsulfat-Komplex und Natriummethanolat[9]) mit Dimethylamin in Gegenwart des sauren, gegen Alkylierungsmittel weitgehend stabilen Katalysators 2,4,6-Tri-tert-butylphenol erzeugt Tris(dimethylamino)methan.[10]
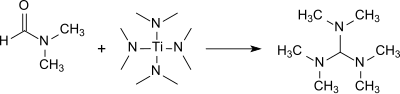
TDAM wird in guter Ausbeute (83 %) bei der Reaktion von DMF mit Tetrakis(dimethylamino)titan gebildet.[11]
Aus N,N,N′,N′,N′′,N′′-Hexamethylguanidiniumchlorid (über das aus Tetramethylharnstoff und Phosgen entstehende N,N,N′,N′-Tetramethyl-chloroformamidinium-chlorid und Dimethylamin einfach erhältlich[12]) entsteht unter Einwirkung des Reduktionsmittels Natrium-bis(2-methoxyethoxy)-aluminiumhydrid (Red-Al) Tris(dimethylamino)methan in 53%iger Ausbeute.[13]
Natriumhydrid und Borsäuretrimethylester reduzieren N,N,N′,N′,N′′,N′′-Hexamethylguanidiniumchlorid in 80%iger Ausbeute zu TDAM um.[8]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Tris(dimethylamino)methan ist eine klare, farblose oder schwach gelb gefärbte Flüssigkeit mit stark aminartigem Geruch. Die Verbindung ist mit vielen nicht-polaren aprotischen und wasserfreien Lösungsmitteln beliebig mischbar. Mit protischen Lösungsmitteln, wie Wasser und Alkoholen, aber auch mit schwach CH-aziden Substanzen, wie Aceton oder Acetonitril reagiert TDAM beim Erhitzen.[3]
Bei Erhitzen auf Temperaturen von 150–190 °C erfolgt Zersetzung unter Bildung von Tetrakis(dimethylamino)ethen,[14]
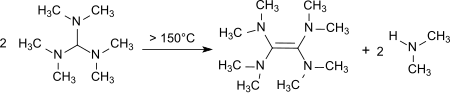
einem starken Elektronendonator.[15]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Tris(dimethylamino)methan dissoziiert in N,N,N′,N′-Tetramethylformamidinium-Kationen und Dimethylamid-Anionen, die von CH- und NH-aciden Verbindungen Protonen abstrahieren. Die so gebildeten Anionen addieren an die Formamidiniumkationen unter Bildung von Addukten, die wiederum Dimethylamin eliminieren und im Sinne einer Aminomethylenierung zu Dimethylaminomethylen (= CH-N(CH3)2-Verbindungen) bzw. zu Amidinen reagieren.[16]
Reaktion zu Dimethylaminomethylen:
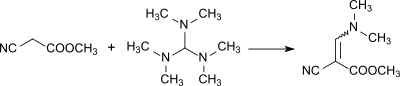
Reaktion zu Amidinen:

Die Aminomethylenierung liefert Zwischenprodukte für die Synthese von Heterocyclen, wie z. B. Pyrimidine, Pyrazole, 1,4-Dihydropyridine und Indole.
Durch längeres Erhitzen von TDAM mit Selen in Xylol ist N,N,N′,N′-Tetramethylselenoharnstoff zugänglich, wobei Bis(dimethylamino)carben als Zwischenstufe vermutet wird.[17]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Tris(dimethylamino)methane bei Sigma-Aldrich, abgerufen am 4. Dezember 2016 (PDF).
- ↑ Eintrag zu Tris(dimethylamino)methane bei TCI Europe, abgerufen am 10. Dezember 2016.
- ↑ a b c d e W. Kantlehner: Tris(dimethylamino)methane. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rt403.
- ↑ a b H. Bredereck, F. Effenberger, T. Brendle: Synthese und Reaktionen von Trisdimethylaminomethan. In: Angew. Chem. Band 78, Nr. 2, 1966, S. 147–148, doi:10.1002/ange.19660780212.
- ↑ Patent DE1217391: Verfahren zur Herstellung von Tris-dimethylaminomethan. Angemeldet am 29. September 1964, veröffentlicht am 8. Dezember 1966, Anmelder: H. Bredereck, Erfinder: H. Bredereck, F. Effenberger, T. Brendle.
- ↑ H. Bredereck, F. Effenberger, T. Brendle, H. Muffler: Orthoamide, V. Synthese von Tris-dialkylamino-methanen. In: Chem. Ber. Band 101, Nr. 5, 1968, S. 1885–1888, doi:10.1002/cber.19681010541.
- ↑ W. Kantlehner, T. Maier, P. Speh: Tris-[dialkylamino]-methane und Tetraalkylformamidinium-thiocyanate aus Bis-[dialkylamino]-acetonitrilen. In: Synthesis. Band 5, 1979, S. 342–343, doi:10.1055/s-1979-28671.
- ↑ a b W. Kantlehner, R. Stieglitz, M. Hauber, E. Haug, C. Regele: Orthoamide. LII Beiträge zur Synthese von Orthocarbonsäureamiden. In: J. prakt. Chem. Band 342, Nr. 3, 2000, S. 256–268, doi:10.1002/(SICI)1521-3897(200003)342:3<256::AID-PRAC256>3.0.CO;2-G.
- ↑ H. Bredereck, F. Effenberger, G. Simchen: Reaktionsfähige Säureamid-Dimethylsulfat-Komplexe. In: Angew. Chem. Band 73, Nr. 14, 1961, S. 493, doi:10.1002/ange.19610731407.
- ↑ Patent DE2214497: Verfahren zur Herstellung eines aminosubstituierten Methanderivates. Angemeldet am 24. März 1972, veröffentlicht am 5. Oktober 1972, Anmelder: F. Hoffmann-La Roche & Co. AG, Erfinder: W. Leimgruber, A.E. Wick.
- ↑ H. Weingarten, W.A. White: A novel amination reaction of carboxylic acid derivatives with tetrakis(dimethylamino)titanium. In: J. Am. Chem. Soc. Band 88, Nr. 4, 1966, S. 850–850, doi:10.1021/ja00956a049.
- ↑ W. Kantlehner, E. Haug, W.W. Mergen, P. Speh, T. Maier, J.J. Kapassakalidis, H.J. Bräuner, H. Hagen: Ein Herstellungsverfahren für N,N,N′,N′,N′′,N′′-Hexaalkylguanidinium-chloride. In: Synthesis. Band 11, 1983, S. 904–905, doi:10.1055/s-1983-30558.
- ↑ W. Kantlehner, P. Speh, H.J. Bräuner: Eine einfache Synthese für Tris[dialkylamino]methane. In: Synthesis. Band 11, 1983, S. 905, doi:10.1055/s-1983-30559.
- ↑ H. Bredereck, F. Effenberger, H.J. Bredereck: Eine neue Synthese von Tetra-(dimethylamino)-äthylen. In: Angew. Chem. Band 78, Nr. 21, 1966, S. 984, doi:10.1002/ange.19660782113.
- ↑ N. Wiberg, J.W. Buchler: Tetrakis(dimethylamino)-äthylen: ein starker Elektronendonator. In: Angew. Chem. Band 74, Nr. 14, 1962, S. 490–491, doi:10.1002/ange.19620741410.
- ↑ H. Bredereck, F. Effenberger, T. Brendle: Synthese und Reaktionen von Trisdimethylaminomethan. In: Angew. Chem. Band 78, Nr. 2, 1966, S. 147–148, doi:10.1002/ange.19660780212.
- ↑ W. Kantlehner, M. Hauber, M. Vettel: Orthoamide.IL. Umsetzungen von Orthoamid-Derivaten mit Schwefel und Selen, Synthesen von 1,3-Thiazol- und 1,3-Selenazolderivaten. In: J. prakt. Chem. Band 338, Nr. 1, 1996, S. 403–413, doi:10.1002/prac.19963380180.

