„Dialyse“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Aka (Diskussion | Beiträge) K Abkürzung korrigiert, Halbgeviertstrich, Leerzeichen in Überschrift |
Ftan (Diskussion | Beiträge) Abgrenzung PD zu HD |
||
| Zeile 51: | Zeile 51: | ||
==== Peritonealdialyse (PD) ==== |
==== Peritonealdialyse (PD) ==== |
||
Die Peritonealdialyse (PD) ist auch unter dem Begriff Bauchfelldialyse bekannt. Es gibt unterschiedliche PD-Verfahren, z. B. die mit Geräten durchgeführte Methode der |
Die Peritonealdialyse (PD) ist auch unter dem Begriff Bauchfelldialyse bekannt. Es gibt unterschiedliche PD-Verfahren, z. B. die mit Geräten durchgeführte Methode der APD (kontinuierliche zyklische PD, s. u.) oder die manuelle CAPD (continuously ambulatory peritoneal dialysis, kontinuierliche ambulante Peritonealdialyse, s. u.). Die IPD (intermittierende PD, s. o.) zählt zur Zentrumdialyse. Die Wahl des Verfahrens hängt unter anderem von den Transporteigenschaften des Peritoneums (s. u.) und der Grunderkrankung des Patienten ab. |
||
Bei der PD und der HD handelt es sich um gleichwertige Dialyseverfahren. Wissenschaftliche Daten aus den USA und Europa zeigen für PD-Patienten ein besseres Überleben in den ersten 3 Jahren und ein ähnliches Langzeit-Überleben wie bei HD-Patienten.<ref name="Weinhandl">{{Literatur |Autor=Weinhandl ED et al. |Titel=Propensity-Matched Mortality Comparison of Incident Hemodialysis and Peritoneal Dialysis Patients|Sammelwerk=J Am Soc Nephrol|Band= 21 |Nummer=3|Datum=2010-03|Seiten=499-506|DOI=10.1681/ASN.2009060635|PMID=20133483|PMC=2831857}}</ref><ref name="Heaf">{{Literatur |Autor= Heaf JG et al. |Titel=Relative Survival of Peritoneal Dialysis and Haemodialysis Patients: Effect of Cohort and Mode of Dialysis Initiation|Sammelwerk=PLoS One|Band= |Nummer= |Datum=2014-03|Seiten= |DOI=10.1371/journal.pone.0090119 |PMID= |PMC=}}</ref><ref name="Luijtgaarden">{{Literatur |Autor=Van de Luijtgaarden MW et al.|Titel=Trends in dialysis modality choice and related patient survival in the ERA-EDTA Registry over a 20-year period|Sammelwerk=Nephrol Dial Transplant|Band=31|Nummer=1|Datum=2016-01|Seiten=120-128|DOI=10.1093/ndt/gfv295|PMID=26311215|PMC=}}</ref><ref name="Waldum-Grevbo">{{Literatur |Autor=Waldum-Grevbo B et al. |Titel=Impact of initial dialysis modality on mortality: a propensity-matched study.|Sammelwerk=BMC Nephrology:179|Band= 16|Nummer=|Datum=2015-06|Seiten=179|DOI=10.1186/s12882-015-0175-5|PMID=26519164|PMC=4628291}}</ref> Trotzdem kommt in Deutschland die PD bei nur 5-10 % aller Patienten zum Einsatz.<ref name=" Jahn">{{Literatur |Autor=Jahn M et al. |Titel= Neue Indikationen für die Peritonealdialyse|Sammelwerk=Nephrologe|Band=12 |Nummer= |Datum=2017 |Seiten=6-13 |DOI=|PMID= |PMC = }}</ref> Die Lebensqualität von PD-Patienten wird deutlich höher bewertet, denn einerseits können sich PD-Patienten ihre Zeit individueller einteilen, andererseits haben sie eine größere räumliche Flexibilität sowie Unabhängigkeit. Berufstätigkeit, Hobbys, Nahrungs- und Flüssigkeitszufuhr werden deutlich weniger eingeschränkt. |
|||
Die Wahl des Verfahrens hängt unter anderem von den Transporteigenschaften des Peritoneums (s. u.) und der Grunderkrankung des Patienten ab. |
|||
Das Bauchfell ([[Peritoneum]]) ist eine [[Tunica serosa|seröse]] Haut, die die Bauchhöhle auskleidet und große Teile des Darms umhüllt. Es ist ein relativ gut durchblutetes Gewebe, das zum Beispiel auch eine wichtige Funktion in der Immunabwehr des Körpers spielt. |
Das Bauchfell ([[Peritoneum]]) ist eine [[Tunica serosa|seröse]] Haut, die die Bauchhöhle auskleidet und große Teile des Darms umhüllt. Es ist ein relativ gut durchblutetes Gewebe, das zum Beispiel auch eine wichtige Funktion in der Immunabwehr des Körpers spielt. |
||
Version vom 14. Dezember 2018, 15:31 Uhr
Als Dialyse (griechisch διάλυσις dialysis ‚Auflösung‘, ‚Loslösung‘, ‚Trennung‘) wird ein Blutreinigungsverfahren bezeichnet, das bei Nierenversagen als Ersatzverfahren zum Einsatz kommt. Die Dialyse ist neben der Nierentransplantation die wichtigste Nierenersatztherapie bei chronischem Nierenversagen und eine der Behandlungsmöglichkeiten bei akutem Nierenversagen.
Dialyse im eigentlichen Sinn ist der durch Diffusion erfolgende Stoffaustausch über eine semipermeable Membran, wobei gelöste Moleküle aus hochkonzentrierten Flüssigkeiten (hier Blut/Plasma) in schwachkonzentrierte Lösungen (Dialyselösung) wandern.[1]
Mehr zur Technik der Dialyse siehe Dialysegerät.
Geschichte
Hämodialyse (HD)
Die weltweit erste „Blutwäsche“ über semipermeable Membranen beim Menschen wurde 1924 von Georg Haas in Gießen durchgeführt. Den Durchbruch brachte jedoch erst Willem Kolff 1945 in Kampen (Niederlande) mit seinem Trommeldialysegerät mit Zellophan-Schläuchen als Dialysemembran. Diese Membran erlaubte eine kontrollierte Blutreinigung von definierten Stoffmengen. Eine technisch überlegene Parallelentwicklung von Nils Alwall in Lund (Schweden) 1946 erlaubte auch die Ausschwemmung von Ödemflüssigkeit aus Lungen und Gewebe (Ultrafiltration). Weitere Pioniere waren Erich Streicher und Curt Moeller.
Peritonealdialyse (PD oder Bauchfelldialyse)
Ende des 19. Jahrhunderts wurden die Grundlagen für die Peritonaldialyse (PD) von Georg Ganter gelegt. 1923 führte er in Würzburg die erste klinische Peritonealdialyse durch. Stephen Rosenak und P. Sewon entwickelten in den zwanziger Jahren des vorigen Jahrhunderts einen Metallkatheter für eine kontinuierliche Peritoneallavage. 1959 wurde erstmals mithilfe flexibler Kunststoffkatheter aus Polyäthylen der Langzeiteinsatz möglich. Anfang der 1960er Jahre erfolgte die erste automatisiere Peritonealdialyse. Die heutige PD hat aufgrund von Verweilkathetern aus Silikon-Kautschuk ihren Durchbruch geschafft. 1975 entwickelten Popovich und Moncrief (Texas) die ersten Ansätze der so genannten kontinuierlichen ambulanten Bauchfelldialyse (CAPD, continuous ambulatory peritoneal dialysis, s. u.). Ende der 1970er Jahre stellten die Arbeitsgruppe Oreopoulos in Toronto die heutige Form der CAPD vor.
Dialyseverfahren

Es werden einerseits extrakorporal (außerhalb des Körpers) und intrakorporal (innerhalb des Körpers) erfolgende Verfahren unterschieden. Andererseits unterscheidet man auch nach dem Gesichtspunkt, wo die Dialyse statt findet: in einem (Dialyse-)Zentrum oder aber zuhause. Das gebräuchlichste extrakorporale Verfahren ist die Hämodialyse (im Zentrum). Das nicht-extrakorporale Verfahren ist die Peritonealdialyse (zuhause).
Da für die Durchführung der Verfahren umfassende Kenntnisse der möglichen Nebenwirkungen erforderlich sind, werden diese meist von Nephrologen oder Intensivmedizinern angewendet.
Zentrumsdialyse
Hämodialyse (HD)

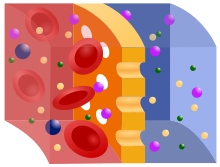
Hämodialyse ist der Austausch gelöster Substanzen über eine semipermeable Membran (Dialysator) durch Diffusion entlang einem Konzentrationsgefälle zwischen Blut und Dialysat, wobei zusätzlich durch Ultrafiltration ein Flüssigkeitsentzug durch hydrostatischen Druckunterschied erfolgt.[2] Bei der Hämodialyse wird nach dem Prinzip des Konzentrationsausgleichs kleinmolekularer Substanzen zweier Flüssigkeiten verfahren, die durch eine semipermeable Membran getrennt sind (Osmose). Von der Filtermembran getrennt befindet sich auf der einen Seite das Blut mit Elektrolyten wie Kalium und Phosphat sowie mit den harnpflichtigen Substanzen (z. B. Kreatinin, Harnstoff, Harnsäure). Auf der anderen Seite der Membran befindet sich eine keimarme, aufbereitete Lösung (Dialysierflüssigkeit), deren Wasser bei Online-Zubereitung durch Umkehrosmose aufbereitet wurde, die keine Abfallprodukte enthält und einen an den jeweiligen Bedürfnissen des Patienten orientierten Anteil an Elektrolyten (etwa Kaliumionen von 0 bis 4 mmol/l und Calciumionen von 1,5 bis 1,75 mmol/l)[3] aufweist. Die semipermeable Filtermembran (Dialysemembran) zwischen Blut und Dialyselösung besitzt Poren, die kleine Moleküle wie Wasser, Elektrolyte und harnpflichtige Substanzen durchlassen, aber große Moleküle wie Eiweiße und Blutzellen zurückhalten. Zudem kann während der Hämodialyse eine metabolische Azidose durch Bikarbonat ausgeglichen werden, was bessere Kreislaufstabilität und geringere subjektive Beschwerden als die frühere, apparativ weniger aufwändige, Acetatpufferung bewirkt.
Grundvoraussetzungen für die Durchführung einer etwa zwei bis vier Stunden[4] dauernden Hämodialyse sind eine ausreichende Kreislaufstabilität, ein ausreichendes Blutvolumen und ein guter (arterieller, venöser) Zugang am Patienten. Letzteres wird durch die operative Anlage eines arteriovenösen Shunts (früher externer Scribner-Shunt, heute in der Regel interner Cimino-Shunt) am Unter- oder Oberarm erreicht. Bei problematischen Eigengefäßen werden dabei auch Gefäßprothesen (Goretex) verwendet. In sehr seltenen Fällen wird der Shunt am Oberschenkel oder zwischen der Arteria subclavia und der Vena subclavia (wegen der Lage auch Collier- oder Dekolletéshunt genannt), mit oder ohne Verwendung von künstlichen Gefäßen, angelegt. Eine weitere Möglichkeit ist das Einbringen eines Dialysekatheters in eine entsprechend große Körpervene für die Akutdialyse (Shaldon-Katheter, meist über den Hals (Vena jugularis interna) oder durch die Schlüsselbeingrube (Vena subclavia), selten über die Leiste (Vena femoralis)), dauerhaft nur bei multimorbiden Patienten mit sehr schlechter Gefäßsituation oder schwerer Herzinsuffizienz (Demers-Vorhofkatheter oder Hickman-Katheter).

Während einer Behandlung wird über den Patientenzugang Blut aus dem Patienten gepumpt, im Dialysator (Filter) an der Dialysemembran vorbeigeführt und anschließend gereinigt dem Patienten wieder zurückgegeben. Giftstoffe (Stoffwechselabbauprodukte) und niedermolekulare Stoffe (membrangängige Stoffe) werden aus dem Blut wegen des Konzentrationsgefälles mittels Diffusion durch die Membran auf die andere Filterseite in die Dialyselösung (Dialysat) gefördert und dadurch entfernt. Der Dialysator wird dabei ständig von frischem Dialysat durchströmt (ca. 500 ml/min). Die Hämodialysebehandlung wird in der Regel für jeweils circa vier bis fünf Stunden (Nachtdialyse bis zu acht Stunden) pro Behandlung und mindestens dreimal in der Woche durchgeführt (abhängig von Körpergewicht, Nierenrestfunktion, Herzleistung). Patienten, die eine Heimhämodialyse durchführen, vermeiden das problematische längere Behandlungsintervall am Wochenende und dialysieren häufiger, im Regelfall alle zwei Tage oder täglich.
Patienten mit chronischer Niereninsuffizienz leiden häufig auch unter Überwässerung. Das überschüssige Wasser wird dem Blut durch Anlegen eines Druckgradienten (Unterdruck auf Dialysatseite) entzogen. Dadurch wird geregelt, wie viel Flüssigkeit dem Blut entzogen wird, und so die natürliche diuretische Funktion der Niere nachgeahmt. Der Flüssigkeitsentzug ist jedoch dadurch beschränkt, dass im Körper die Flüssigkeit (gilt ebenfalls auch für die Giftstoffe) nicht beliebig schnell in die Blutbahn nachdiffundieren kann, um den Flüssigkeitsverlust auszugleichen, wodurch ein lebensgefährlicher Blutdruckabfall droht. Außerdem geben verschiedene Gewebe Flüssigkeit unterschiedlich schnell ab, so kann es z. B. zu einem Krampf der Muskulatur kommen, obwohl noch zu viel Flüssigkeit im Körper vorhanden ist. Durch diese Effekte ist der erreichbare Flüssigkeitsentzug durch die Dialyse beschränkt und die Patienten dürfen daher nicht nach Belieben trinken. Da andererseits viele Patienten aufgrund der Häufung harnpflichtiger Substanzen im Körper unter ständigem starken Durst leiden, wird die geringe erlaubte Trinkmenge (Restausscheidung in 24 Stunden plus 500 ml) häufig als belastend empfunden.
Eine Verlängerung der Dialysezeit ist vor allem durch die tägliche Heimhämodialyse (HHD) möglich und ermöglicht eine gleichmäßigere Therapie. Da die Dialyseeffektivität in der ersten Behandlungshälfte am höchsten ist, ist es medizinisch sinnvoll, jedoch selten praktiziert, häufige, aber kurze Dialysen statt seltene, längere Dialysen durchzuführen. Mit der täglichen Hämodialyse werden Vorteile der Peritonealdialyse (Dialyse jeden Tag) und der konventionellen Hämodialyse (hohe Effektivität) miteinander kombiniert. Für Patienten, die keine Möglichkeit zur Heimhämodialyse haben, bietet sich die Nachtdialyse im Zentrum an, um die Dialysezeit zu verlängern. Manche Patienten können während der Dialyse schlafen, manchmal erst nach einer Eingewöhnungszeit, andere allerdings gar nicht. Aufgrund der Praktikabilität und der Patienten-Akzeptanz, aber auch weil die Krankenkassen grundsätzlich nur Pauschalen pro Patient für die Behandlung zahlen, wird eine häufigere Dialyse als dreimal pro Woche für Patienten, die keine Möglichkeit zur HHD haben, nicht angeboten. Ausnahmen bilden hierbei zusätzliche Dialysen bei Überwässerung, um das „Trockengewicht“ des Patienten zu senken, oder die Phase der Dialyseaufnahme ("Andialyse"), in der der Patient unter Umständen eine Woche lang täglich dialysiert wird.
Intermittierende Peritonealdialyse (IDP)
Eine intermittierende Peritonealdialyse erfolgt 3–4 Mal pro Woche in einer Dialyseeinrichtung. In einem Zeitraum von etwa 8 Stunden werden dabei in etwa halbstündigen Einzelphasen etwa 30–40 l Dialyselösung verbraucht. Die IDP ist die im zeitlichen Ablauf am ehesten mit der maschinellen Hämodialyse vergleichbare Form der Peritonealdialyse, bei der die Dialyse durch medizinisches Personal geleitet und überwacht wird.
Heimdialyse
Heimhämodialyse
Bei der Heimhämodialyse führt der Patient die Dialysebehandlung mit dem Dialysegerät zu Hause drei- bis sechsmal wöchentlich selbstständig durch. Hierbei kann er auch von einer Hilfsperson – in der Regel dem Lebenspartner – unterstützt werden. Die Wohnung des Patienten sollte über ausreichend Platz verfügen, in dem das Dialysegerät aufgestellt werden kann, bestenfalls in einem separaten Raum.
Peritonealdialyse (PD)
Die Peritonealdialyse (PD) ist auch unter dem Begriff Bauchfelldialyse bekannt. Es gibt unterschiedliche PD-Verfahren, z. B. die mit Geräten durchgeführte Methode der APD (kontinuierliche zyklische PD, s. u.) oder die manuelle CAPD (continuously ambulatory peritoneal dialysis, kontinuierliche ambulante Peritonealdialyse, s. u.). Die IPD (intermittierende PD, s. o.) zählt zur Zentrumdialyse. Die Wahl des Verfahrens hängt unter anderem von den Transporteigenschaften des Peritoneums (s. u.) und der Grunderkrankung des Patienten ab.
Bei der PD und der HD handelt es sich um gleichwertige Dialyseverfahren. Wissenschaftliche Daten aus den USA und Europa zeigen für PD-Patienten ein besseres Überleben in den ersten 3 Jahren und ein ähnliches Langzeit-Überleben wie bei HD-Patienten.[5][6][7][8] Trotzdem kommt in Deutschland die PD bei nur 5-10 % aller Patienten zum Einsatz.[9] Die Lebensqualität von PD-Patienten wird deutlich höher bewertet, denn einerseits können sich PD-Patienten ihre Zeit individueller einteilen, andererseits haben sie eine größere räumliche Flexibilität sowie Unabhängigkeit. Berufstätigkeit, Hobbys, Nahrungs- und Flüssigkeitszufuhr werden deutlich weniger eingeschränkt.
Das Bauchfell (Peritoneum) ist eine seröse Haut, die die Bauchhöhle auskleidet und große Teile des Darms umhüllt. Es ist ein relativ gut durchblutetes Gewebe, das zum Beispiel auch eine wichtige Funktion in der Immunabwehr des Körpers spielt.
Aufgrund des besonderen Aufbaus kann das Peritoneum ebenfalls als „Filtermembran“ genutzt werden: Hierzu wird dem Patienten ein Schlauch (Katheter) in die Bauchhöhle implantiert. Über diesen Katheter wird eine Dialyselösung in den Bauchraum gefüllt und dort über mehrere Stunden (z. B. bei CAPD) oder für 20–30 Minuten (z. B. IPD) belassen. Die kleinmolekularen Substanzen können nun aus dem Blut über die Kapillargefäße des Bauchfells in die Dialyselösung übertreten, da ein Konzentrationsgefälle herrscht. Wenn dem Körper auf diesem Wege auch Flüssigkeit (Wasser) entzogen werden soll, muss die Dialyselösung einen höheren Gehalt an löslichen Substanzen aufweisen als das Blut. Hierzu wird sie mit Traubenzucker, Dextrinen oder anderen Substanzen (experimentell) angereichert. Die Dialyselösung muss nach einer bestimmten Zeit (in der Regel etwa vier bis sechs Stunden bei CAPD) abgelassen und durch eine frische ersetzt werden. Im Gegensatz zur künstlichen Membran bei der Blutdialyse ist das Peritoneum auch für Eiweiße recht durchlässig, wodurch es zu einem relevanten Eiweißverlust kommt. Vorteile dieses Verfahrens sind: das längere Aufrechterhalten der Restnierenfunktion,[10] die insgesamt selteneren Komplikationen des Dialysezugangs und die Schonung des Kreislaufs, die auch bei sehr alten und herzkranken Menschen eine Nierenersatztherapie ermöglicht. Ein weiterer möglicher Vorteil ist die weitgehende Unabhängigkeit der Patienten von einem Dialysezentrum: Bei Eignung kann man die Dialyse zu Hause durchführen, auch Urlaubsreisen sind unkomplizierter möglich, da die Materialien direkt an den Urlaubsort geliefert werden und die Terminabsprachen mit einem Urlaubsdialysezentrum entfallen. Ein Nachteil der Peritonealdialyse ist die Gefahr, dass die Bauchhöhle bei einem möglichen Kontakt mit der Umgebung mit pathogenen Keimen mit der Folge einer Bauchfellentzündung infiziert wird. Im Gegensatz zu Bauchfellentzündungen anderer Ursache, die eine schwere und oft tödliche Erkrankung darstellen, ist die CAPD-assoziierte Peritonitis jedoch einfach therapierbar, kann oft sogar ambulant behandelt werden und hat nur eine geringe Sterblichkeit. Hierzu wird ein Antibiotikum direkt mit der Dialyselösung in die Bauchhöhle gegeben. Dennoch führen wiederholte Bauchfellentzündungen zu einer Verschlechterung der Effektivität der Bauchfelldialyse.[11] Die Patienten müssen daher beim Wechseln der Lösungen sehr sorgfältig arbeiten. Moderne Kathetersysteme ermöglichen die Spitze und das Innere des Katheters steril zu halten. Limitiert ist das Verfahren wegen seiner vergleichsweise geringeren Effektivität durch das Körpergewicht und die Nierenrestfunktion – ist die Körpermasse größer und die Nierenrestfunktion gering, eignet sich die PD weniger. Im Laufe der Anwendung insbesondere stärkerer glukosehaltiger Dialyselösungen über mehrere Jahre hinweg kommt es bei manchen Patienten zur Veränderung des Bauchfells, die bei gleicher Glukosekonzentration eine abnehmende oder sogar negative Filtrationsleistung zur Folge hat. Dann müssen zur Vermeidung von Ödembildung und Bluthochdruck die Konzentration von Glukose in der Dialyselösung erhöht und die Verweilzeit der Lösung im Bauchraum verringert werden. Aufgrund der Veränderungen des Peritoneums, die in einem sehr variablen Zeitraum in den allermeisten Fällen irgendwann zu einem sogenannten Ultrafiltrationsversagen und damit nicht ausreichender Entgiftung und Entwässerung führen, ist die Peritonealdialyse immer ein Verfahren auf Zeit. Gute Erfahrungen macht man mit der Peritonealdialyse als „bridge to transplant“ bei jüngeren Menschen. Die laufende Glukoseaufnahme aus der Dialyselösung und auch der kontinuierliche Eiweißverlust kann auch zur Entwicklung oder Verschlechterung eines Diabetes mellitus führen. Trotzdem konnte in Studien gezeigt werden, dass insbesondere Diabetiker in den ersten Jahren der Dialysepflicht von der Peritonealdialyse profitieren.[12]
Automatisierte Peritonealdialyse (APD)
Die automatisierte Peritonealdialyse (APD) ist ein Heimtherapie-Verfahren, das zumeist während der Nacht durchgeführt wird, und bei dem der Beutelwechsel durch eine Maschine automatisch erfolgt.
Kontinuierliche ambulante Peritonealdialyse (CAPD)
Im Gegensatz zur APD wird bei der CAPD der Beutelwechsel durch den Patienten selbst oder mit Hilfe seiner Familienangehörigen oder von Pflegediensten tagsüber von Hand zuhause (oder auch am Arbeitsplatz) durchgeführt.
Sonderformen der Hämodialyse
Hämofiltration
Hämofiltration ist eine reine Ultrafiltration und Ersatz durch Elektrolytlösung. Bei der Hämofiltration (Abfiltrieren von Plasmawasser mit Substitution)[13] wird dem Blut Flüssigkeit entzogen, ohne dass eine Spüllösung (Dialysat) verwendet wird. Aufgrund eines über eine Pumpe angelegten Druckgradienten (Transmembrandruck) an der Filtermembran wird konvektiv Plasmaflüssigkeit aus dem Blut über die Membran entzogen (Ultrafiltration). Durch diesen transmembranen Fluss werden auch alle filtergängigen Stoffe mitentfernt. Dies ermöglicht eine langsame Entgiftung und bei Bedarf eine schnelle Volumenveränderung im Patientenkörper. Die entzogene Flüssigkeit wird durch eine Elektrolytlösung (Substituat) individuell angepasst ersetzt. Es handelt sich um ein maschinelles Verfahren.
Als Spontanfiltration bezeichnet man ein Verfahren, bei dem der Blutfluss spontan von Arterie zu Vene erfolgt, durch den Eigendruck einer Schlagader des Patientenkreislaufs (ohne Pumpe) Plasmaflüssigkeit abgepresst und durch eine Elektrolytlösung ersetzt wird: Kontinuierliche arteriovenöse Hämofiltration (CAVH). Diese wenig effektive und vom Blutdruck abhängige Methode wurde bald durch die pumpengetriebene kontinuierliche venovenöse Hämofiltration (CVVH) abgelöst, die ihrerseits durch die Kombination mit Dialyse zur kontinuierlichen venovenösen Hämodiafiltration erweitert worden ist (CVVHDF). Diese Verfahren werden auf Intensivstationen zur Behandlung von Patienten mit akutem Nierenversagen eingesetzt.
Im Prinzip ähnlich wie CAVH und CVVH sind die Verfahren kontinuierliche arteriovenöse Hämodialyse (CAVHD) und kontinuierliche venovenöse Hämodialyse (CVVHD).[14]
Hämodiafiltration
Die Hämodiafiltration bezeichnet ein extrakorporales Verfahren zur Blutreinigung, bei dem die Hämodialyse und die Hämofiltration in Kombination angewendet werden. Dieses Verfahren kommt insbesondere bei chronischer Niereninsuffizienz zur Anwendung und ermöglicht sowohl die Entfernung von nieder- als auch von mittelmolekularen Substanzen bei kontrolliertem Ersatz des Ultrafiltrats durch physiologische Elektrolytlösung (Diluat). Die Ersatzlösung wird entweder dem Blut vor oder nach dem Dialysator zugegeben und im Dialysator wieder entfernt (Ultrafiltration). Dadurch kann ein höherer transmembraner Fluss erzeugt werden, der zur effektiveren Entfernung der Giftstoffe führt.
Hämoperfusion
Die Hämoperfusion ist kein Nierenersatzverfahren, sondern ein Behandlungsverfahren bei akuten Vergiftungen und wird nur von besonders dafür eingerichteten Kliniken durchgeführt. Dabei wird das Blut durch Adsorbenzien (z. B. Aktivkohle oder Austauscherharze) gepumpt, dadurch können einige fettlösliche oder proteingebundene Stoffe (z. B. bestimmte überdosierte Medikamente, organische Lösungsmittel, Insektizide, Pilzgifte) aus dem Blut entfernt werden. Das Verfahren ist nur für eine vergleichsweise geringe Zahl von Substanzen etabliert.
Beginn einer Dialysetherapie (Blutwäsche)

Die Entscheidung, ob und wann eine Dialysebehandlung oder Hämofiltration bei Patienten mit Nierenversagen notwendig wird, hängt von verschiedenen Faktoren ab, welche akuter oder chronischer Natur sein können.
- Akute Indikationen für den Beginn einer Dialysebehandlung:
- Akutes Nierenversagen, z. B. während einer Sepsis („Blutvergiftung“), nach einem Trauma (Unfall) oder nach großen operativen Eingriffen
- Hyperkaliämie
- Metabolische Azidose
- Überwässerung (manifestiert sich meistens als Lungenödem mit Atemnot)
- Urämische Serositis, wie Perikarditis, und urämische Enzephalopathie
- Akute Vergiftungen mit dialysierbaren Substanzen, wie zum Beispiel Lithium oder Acetylsalicylsäure
- Chronische Ursachen für den Beginn einer Dialysebehandlung:
- Symptomatisches Nierenversagen
- Niedrige Glomeruläre Filtrationsrate (GFR), meistens bei einer GFR, die niedriger als 10–15 ml/min/1,73 m² ist
- Anders nicht beherrschbare Hyperphosphatämie oder Urämie (Harnstoff-N größer als ca. 100 mg/dl)
Siehe auch
Literatur
- Zeitschrift Hämodialyse. Mitteilungsblatt der Interessengemeinschaft der Dialysepatienten Saar e.V. Bd. 1, 1973/1974 – Bd. 3, 1975, ZDB-ID 224632-6, fortgesetzt als: Der Dialysepatient. Offizielles Organ des Bundesverbandes Niere e.V. Bd. 1, 1976 – 32, 2007, ISSN 0724-0252, fortgesetzt als: Der Nierenpatient. Offizielles Organ des Bundesverbandes Niere e.V. Bd. 33, 2008 – lfd., ISSN 1865-8822.
- Gerd Breuch, Willi Servos: Dialyse für Einsteiger. Elsevier, Urban und Fischer, München u. a. 2007, ISBN 978-3-437-27790-0.
- Günther Schönweiß: Dialysefibel 2. Plädoyer für die individuelle Dialyse. 2., völlig neubearbeitete und erweiterte Auflage. abakiss, Bad Kissingen 1996, ISBN 3-931916-01-4.
- Kidney Int. Suppl. 2008 Apr; Dialysis outcomes in Colombia (DOC) study: a comparison of patient survival on peritoneal dialysis vs hemodialysis in Colombia. Sanabria M1 et al.
- Perit Dial Int. 2014 Jan 2. Better Outcomes Of Peritoneal Dialysis In Diabetic Patients In Spite Of Risk Of Loss Of Autonomy For Home Dialysis. Cotovoio, P et al.
- Steffen Geberth & Rainer Nowack: Praxis der Dialyse. Springer, 2. Auflage, Berlin & Heidelberg 2014. ISBN 978-3-642-41207-3 (Print); ISBN 978-3-642-41208-0 (eBook),
- Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 29–93, hier: S. 60–66 (Dialyse).
Weblinks
- Bundesverband Niere e. V. Selbsthilfedachverband. Abgerufen am 31. Januar 2009.
- Verband Deutsche Nierenzentren (DN) e. V. Abgerufen am 31. Januar 2009.
- Der Blutfluß an der Dialysemaschine (Video). Abgerufen am 31. Januar 2009.
Einzelnachweise
- ↑ Manfred Vasold: Dialyse. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 304 f.; hier: S. 304.
- ↑ Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 29–93, hier: S. 62–66 (Dialyseverfahren).
- ↑ Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. In: Jörg Braun, Roland Preuss (Hrsg.): Klinikleitfaden Intensivmedizin. 9. Auflage. Elsevier, München 2016, ISBN 978-3-437-23763-8, S. 29–93, hier: S. 62–66 (Dialyseverfahren), insbesondere S. 62.
- ↑ Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. 2016, S. 62.
- ↑ Weinhandl ED et al.: Propensity-Matched Mortality Comparison of Incident Hemodialysis and Peritoneal Dialysis Patients. In: J Am Soc Nephrol. Band 21, Nr. 3, März 2010, S. 499–506, doi:10.1681/ASN.2009060635, PMID 20133483, PMC 2831857 (freier Volltext).
- ↑ Heaf JG et al.: Relative Survival of Peritoneal Dialysis and Haemodialysis Patients: Effect of Cohort and Mode of Dialysis Initiation. In: PLoS One. März 2014, doi:10.1371/journal.pone.0090119.
- ↑ Van de Luijtgaarden MW et al.: Trends in dialysis modality choice and related patient survival in the ERA-EDTA Registry over a 20-year period. In: Nephrol Dial Transplant. Band 31, Nr. 1, Januar 2016, S. 120–128, doi:10.1093/ndt/gfv295, PMID 26311215.
- ↑ Waldum-Grevbo B et al.: Impact of initial dialysis modality on mortality: a propensity-matched study. In: BMC Nephrology:179. Band 16, Juni 2015, S. 179, doi:10.1186/s12882-015-0175-5, PMID 26519164, PMC 4628291 (freier Volltext).
- ↑ Jahn M et al.: Neue Indikationen für die Peritonealdialyse. In: Nephrologe. Band 12, 2017, S. 6–13.
- ↑ Kidney Int Suppl. 2008 Apr; Dialysis outcomes in Colombia (DOC) study: a comparison of patient survival on peritoneal dialysis vs hemodialysis in Colombia.Sanabria M1, Muñoz J, Trillos C, Hernández G, Latorre C, Díaz CS, Murad S, Rodríguez K, Rivera A, Amador A, Ardila F, Caicedo A, Camargo D, Díaz A, González J, Leguizamón H, Lopera P, Marín L, Nieto I, Vargas E
- ↑ Ann Clin Microbiol Antimicrob. 2006; 5: 6; Treatment and outcome of CPD-associated peritonitis. Troidle L, Finkelstein F
- ↑ Kidney Int Suppl. 2008 Apr; Dialysis outcomes in Colombia (DOC) study: a comparison of patient survival on peritoneal dialysis vs hemodialysis in Colombia. Sanabria M1 et al.
- ↑ W. Koller, T. H. Luger, Ch. Putensen, G. Putz: Blutreinigende Verfahren in der Intensivmedizin. In: J. Kilian, H. Benzer, F. W. Ahnefeld (Hrsg.): Grundzüge der Beatmung. Springer, Berlin u. a. 1991, ISBN 3-540-53078-9, 2., unveränderte Aufl. ebenda 1994, ISBN 3-540-57904-4, S. 404–419; hier: S. 408.
- ↑ Amitava Majumder, Anne Paschen: Ärztliche Arbeitstechniken. 2016, S. 62 f.