2-Methylglutarsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Methylglutarsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H10O4 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 146,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
2-Methylglutarsäure (2-Methylpentandisäure) ist eine wasserlösliche α,ω-Dicarbonsäure, die sich von der Glutarsäure ableitet und in 2-Stellung eine Methylgruppe trägt. Die bei der Synthese als Racemat anfallende chirale Dicarbonsäure ist aus γ-Valerolacton, einer Plattformchemikalie aus nachwachsenden Rohstoffen[7] gut zugänglich.[8]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die erste Synthese von 2-Methylglutarsäure wurde bereits 1878 berichtet.[6] Bei der Reaktion von 2-Methyl-3-oxo-butansäure-ethylester (Ethyl-2-methylacetoacetat) mit 3-Iodpropionsäure-ethylester entsteht der entsprechende β-Ketoester, der nach Säurespaltung mit konzentrierter Kalilauge und anschließendem Ansäuern mit verdünnter Schwefelsäure in Essigsäure und 2-Methylglutarsäure übergeht.

Die Synthese von 2-Methylglutarsäure aus Lävulinsäure – der Vorstufe von γ-Valerolacton – wurde 1886 beschrieben. Die Addition von Blausäure an Lävulinsäure führt zum entsprechenden Cyanhydrin 4-Hydroxy-4-cyanovaleriansäure. Mit verdünnter Schwefelsäure wird die Cyano- zur Carboxygruppe hydrolysiert und zur 2-Methyl-pent-2-ensäure dehydratisiert, die anschließend zur 2-Methylpentansäure hydriert wird.[9][10]
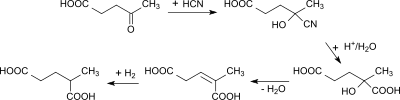
Ebenfalls im Jahr 1886 wurde die Reaktion von γ-Valerolacton mit Cyanwasserstoff zur Cyanvaleriansäure und weiter zur 2-Methylglutarsäure beschrieben.[11]

Auf einem ebenfalls 1896 publizierten Syntheseweg wird analog der Wislicenus-Synthese von 1878 anstelle des methyl-substituierten Acetessigesters der Dimethylester der Methylmalonsäure mit 3-Iodpropionsäuredimethylester in einer Malonestersynthese mit Natriummethanolat zum Triester umgesetzt und anschließend mit Schwefelsäure zur 2-Methylglutarsäure hydrolysiert.[4]

Eine Variante dieses Synthesewegs stellt die Michael-Addition von Malonsäurediethylester an Methacrylsäureethylester in Gegenwart von Natriumethanolat dar. Der erhaltene Triester wird mit konzentrierter Salzsäure hydrolysiert.[12]

Die in industriellem Maßstab durchgeführte Hydrocarboxylierung von 1,3-Butadien mit Kohlenmonoxid in Gegenwart von Rhodium-Katalysatoren und Iodwasserstoff als Promotor führt im ersten Schritt zu 3-Pentensäure[13] und bei weiterer Reaktion mit CO in Gegenwart von Rhodium-Komplexen, Methyliodid als Promotor, Dichlormethan und geringen Wassermengen[14] oder in Gegenwart von Iridium-Komplexen, Iodwasserstoff, Essigsäure und Wasser[15] (neben nicht umgesetzter 3-Pentensäure und den isomeren 2- und 4-Pentensäure) zu einem Gemisch von Adipinsäure, γ-Valerolacton, Valeriansäure, 2-Ethylbernsteinsäure, Dimethylbernsteinsäure und ca. 17 % 2-Methylglutarsäure.

Diese Reaktion wurde als Route zu Adipinsäure als Dicarbonsäurebaustein für Nylon 6,6 intensiv untersucht, hat sich aber wegen der für eine kommerzielle Nutzung zu geringen Ausbeute des Zielprodukts nicht durchgesetzt.
Aus dem technischen Gemisch der Hydrocarboxylierung lässt sich 2-Methylglutarsäure z. B. durch Vakuumdestillation in Form seines cyclischen Anhydrids (2-Methylglutarsäureanhydrid) isolieren.[16]
Analog zur Hydrocarboxylierung von Butadien mit CO erzeugt Hydrocyanierung mit Cyanwasserstoff an einem Palladium-Kontakt über das Zwischenprodukt 3-Pentennitril[17] ein 2-Methylglutaronitril[18]-enthaltendes Gemisch,[19] das zur 2-Methylglutarsäure hydrolysiert werden kann.

Ein Produktgemisch ähnlicher Zusammensetzung erhält man bei der Reaktion von γ-Valerolacton mit Kohlenmonoxid in Essigsäure-Lösung mit Bromwasserstoff als Promotor.[20]
Unter Standard-Reaktionsbedingungen (30 °C, Atmosphärendruck) für eine Stunde reagiert γ-Valerolacton mit Kohlenmonoxid in Gegenwart der (außerordentlich giftigen und ätzenden) Supersäure Fluor-Antimonsäure HSbF6 (im Molverhältnis HF/SbF5 1:2,3) in fast quantitativer Ausbeute zu 2-Methylglutarsäure.[8]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Methylglutarsäure ist ein geruchloser, weißer, wasserlöslicher, in verwachsenen Prismen kristallisierender[4] Feststoff. In der frühen Literatur wurde die Säure auch als sehr leicht löslich in Ethanol und Diethylether beschrieben.[6] Die chirale Dicarbonsäure liegt als Produkt der chemischen Synthese als Racemat vor.
| Stereoisomere von 2-Methylglutarsäure | ||
| Name | R-(-)-2-Methylglutarsäure | S-(+)-2-Methylglutarsäure |
| Strukturformel |  |

|
| CAS-Nummer | 1115-81-7 | 1115-82-8 |
| 617-62-9 (unspez.) | ||
| PubChem | 6950149 | 3246694 |
| 12046 (unspez.) | ||
| Wikidata | Q27236479 | Q27276967 |
| Q22329225 (unspez.) | ||
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Diester
[Bearbeiten | Quelltext bearbeiten]Diester der 2-Methylglutarsäure, wie z. B. Dimethyl-2-methylglutarat[21] werden als nichtflüchtige und nichtentflammbare, bioabbaubare Lösungsmittel in Reinigern für Anwendungen in der Industrie, wie z. B. in der Textilreinigung,[22] aber auch im Haushalt und in der Kosmetik vermarktet.
Esteramide
[Bearbeiten | Quelltext bearbeiten]Aus dem Diester der 2-Methylglutarsäure – bei der industriellen Umsetzung bevorzugt aus den Diestern des bei der Hydrocarboxylierung von Butadien mit CO anfallenden Dicarbonsäuregemischs – lässt sich in hoher chemischer Selektivität bei Temperaturen zwischen 20 und 50 °C in Gegenwart von Natriummethanolat in Methanol mit Dimethylamin in 96%iger Ausbeute ein Esteramidgemisch herstellen,[23] das als Lösungsmittel, z. B. für Formulierungen von Pflanzenschutzmitteln, interessante Eigenschaften aufweist.[24] Die Patentanmeldung beschreibt auch die alternative Synthese des aus 2-Methylglutarsäure über sein cyclisches 2-Methylglutarsäureanhydrid gebildeten Esteramidgemischs, das zunächst mit Methanol zum Monomethylester umgesetzt wird, dessen Carbonsäurefunktion mit Thionylchlorid in ein Carbonsäurechlorid überführt wird, die anschließend mit Dimethylamin zum Esteramid reagiert. Die Reihenfolge kann auch umgekehrt und das cyclische Anhydrid zuerst mit Dimethylamin zur Reaktion gebracht werden.[24]

Polyester
[Bearbeiten | Quelltext bearbeiten]2-Methylglutarsäure kann auch als Dicarbonsäure-Komponente neben Adipinsäure zur Herstellung aliphatischer Polyester eingesetzt werden,[25] die sich durch die fehlende Bildung von störenden cyclischen Oligomeren auszeichnen und sich zur Herstellung bioabbaubarer Fasern, Folien und Gegenstände eignen.
Polyamide
[Bearbeiten | Quelltext bearbeiten]Hexamethylendiamin polykondensiert mit 2-Methylglutarsäure bei 210 °C in Gegenwart von Natriumhypophospit als Wärmestabilisator zu Polyamiden.[26]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt 2-Methylglutaric acid bei Sigma-Aldrich, abgerufen am 30. Dezember 2015 (PDF).
- ↑ a b Datenblatt 2-Methylglutaric acid bei Alfa Aesar, abgerufen am 30. Dezember 2015 (Seite nicht mehr abrufbar).
- ↑ a b Eintrag zu 2-Methylglutaric acid bei TCI Europe, abgerufen am 30. Dezember 2015.
- ↑ a b c K. Auwers: Studien in der Gruppe der Bernsteinsäuren und Glutarsäuren, IV. Ueber α-Methylglutarsäure. In: Liebigs Ann. Chem. Band 292, Nr. 1, 1896, S. 132–159, doi:10.1002/jlac.18962920108.
- ↑ Eintrag zu 2-Methylglutaric acid in der Human Metabolome Database (HMDB), abgerufen am 28. Januar 2016.
- ↑ a b c Johannes Wislicenus, L. Limpach: Synthese der Glutarsäure und α-Methylglutarsäure mit Hülfe des Acetessigesters. In: Justus Liebigs Ann. Chem. Band 192, Nr. 1–2, 1878, S. 128–135, doi:10.1002/jlac.18781920109.
- ↑ K. Yan, Y. Yang, J. Chai, Y. Lu: Catalytic reactions of gamma-valerolactone: A platform to fuels and value-added chemicals. In: Appl. Catal. B: Environmental. Band 179, 2015, S. 292–305, doi:10.1016/j.apcatb.2015.04.030.
- ↑ a b N. Yoneda, A. Suzuki, Y. Takahashi: Carboxylation of γ-butyrolactones with carbon monoxide using HF-SbF5 super acid. In: Chem. Lett. 1981, S. 767–768, doi:10.1246/cl/1981.767.
- ↑ K. Krekeler: Über die Penthiophengruppe. In: Ber. dtsch. chem. Ges. Band 19, Nr. 2, 1886, S. 3266–3274, doi:10.1002/cber.188601902359.
- ↑ J. Block, K. Krekeler, B. Tollens: Ueber die aus Lävulinsäure nach Blausäureaddition entstehenden Säuren γ-Methylhydroxyglutarsäure und Methylglutolactonsäure. In: Justus Liebigs Ann. Chem. Band 238, Nr. 3, 1887, S. 287–301, doi:10.1002/jlac.18872380304.
- ↑ Wilhelm Wislicenus: Ueber die Einwirkung von Cyankalium auf Lactone, II. Valerolacton und Cyankalium. In: Liebigs Ann. Chem. Band 233, Nr. 1, 1886, S. 101–116, doi:10.1002/jlac.18862330107.
- ↑ K. Machiy, I. Ichimoto, K. Tonari, M. Kirihata, H. Ueda: An Efficient Synthetic Method for (± )-Malyngolide and Its Optical Resolution. In: Agric. Biol. Chem. Band 49, Nr. 6, 1985, S. 1767–1773, doi:10.1080/00021369.1985.10866953.
- ↑ Patent US4622423: Hydrocarboxylation of butadiene to 3-pentenoic acid. Angemeldet am 9. November 1984, veröffentlicht am 11. November 1986, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: P.M. Burke.
- ↑ Patent US4788333: Hydrocarboxylation of unsaturated carboxylic acids to linear dicarboxylic acids. Angemeldet am 7. Januar 1985, veröffentlicht am 29. November 1988, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: P.M. Burke.
- ↑ Patent US5227522: Preparation of adipic acid by hydrocarboxylation of pentenic acids. Angemeldet am 24. April 1992, veröffentlicht am 13. Juli 1993, Anmelder: Rhone-Poulenc Chimie, Erfinder: P. Denis, J.-M. Grosselin, F. Metz.
- ↑ Patent US5587056: Separation of aliphatic diacids from adipic acid admixtures thereof. Angemeldet am 14. Juni 1995, veröffentlicht am 24. Dezember 1996, Anmelder: Rhone-Poulenc Chimie, Erfinder: P. Denis, C. Patois, R. Perron.
- ↑ Patent US33496215: Hydrocyanation of olefins using selected nickel phosphite catalysts. Angemeldet am 23. November 1965, veröffentlicht am 17. Februar 1970, Anmelder: E.I. du Pont de Nemours and Co., Erfinder: W.C. Drinkard, Jr., R.V. Lindsey, Jr..
- ↑ Solvay: GPS Safety Summary, 2-methylglutaronitrile ( vom 5. August 2014 im Internet Archive)
- ↑ Patent US3752839: Hydrocyanation olefins. Angemeldet am 2. Juli 1970, veröffentlicht am 14. August 1973, Anmelder: E.I. du Pont de Nemours and Co., Erfinder: W.C. Drinkard, Jr., R.V. Lindsey, Jr..
- ↑ Patent EP0395038A2: Preparation of adipic acid from lactones. Angemeldet am 26. April 1990, veröffentlicht am 31. Oktober 1990, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: P.M. Burke.
- ↑ Solvay: GPS Safety Summary, Dimethyl 2-methylglutarate ( vom 5. August 2014 im Internet Archive)
- ↑ Patent US7863232B2: Treatment/cleaning of textile materials utilizing formulations of branched carboxylic acid diesters. Angemeldet am 16. Juli 2008, veröffentlicht am 4. Januar 2011, Anmelder: Rhodia Operations, Erfinder: J.-E. Zanetto, S. Nair, S. Mutoy.
- ↑ Patent US20130237722A1: Process for preparing esteramide compounds. Angemeldet am 9. Juni 2011, veröffentlicht am 12. September 2013, Anmelder: Rhodia Operations, Erfinder: T. Vidal, R. Rached, M. Guglieri.
- ↑ a b Patent US20140221211A1: Use of esteramides as solvents, novel esteramides and process for preparing esteramides. Angemeldet am 9. April 2014, veröffentlicht am 7. August 2014, Anmelder: Rhodia Operations, Erfinder: O. Jentzer, M. Guglieri.
- ↑ Patent WO2013153147A1: Polyesters comprising 2-methylglutaric acid, process for production of the said polyesters and products obtained therewith. Angemeldet am 11. April 2013, veröffentlicht am 17. Oktober 2013, Anmelder: Novamont S.P.A., Erfinder: T. Milizia, R. Vallero.
- ↑ Patent WO9912993: Manufacture of branched polyamides. Angemeldet am 3. September 1998, veröffentlicht am 18. März 1999, Anmelder: Dupont Canada, Inc., Erfinder: H. Ng.
