3-Buten-1,2-diol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie – 1:1-Gemisch der Enantiomeren | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Buten-1,2-diol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H8O2 | ||||||||||||||||||
| Kurzbeschreibung |
klare farblose[1] Flüssigkeit | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 88,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser[4][5], in Tetrahydrofuran THF, MTBE und Acrylnitril[5] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
3-Buten-1,2-diol ist ein vicinales Diol mit einer endständigen Doppelbindung. Die Verbindung ist ein Oxidationsprodukt des 1,3-Butadiens und wird auch im menschlichen Körper als Metabolit des Butadiens gefunden. Racemisches 3,4-Dihydroxy-1-buten wird als Synthesebaustein (engl. building block) für funktionelle Verbindungen, wie z. B. Monomere, und die Enantiomeren (R)- und (S)-3,4-Dihydroxy-1-buten für Naturstoffsynthesen eingesetzt.[6]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]3-Buten-1,2-diol entsteht beim Abbau des karzinogenen 1,3-Butadiens im Körper, wobei zunächst durch eine Cytochrom P450-vermittelte Oxidation 3,4-Epoxy-1-buten (auch als Butadienmonoxid bezeichnet) entsteht, das anschließend durch eine Epoxidhydrolase in das 1,2-Diol hydrolysiert wird.[7] 1,2-BDiol wird in der Leber durch eine Alkoholdehydrogenase weiter zu 3-Hydroxy-2-butanon (Acetoin) und letztendlich zu Kohlendioxid metabolisiert.
Wegen teils geringer Ausbeuten und Einsatz schlecht verfügbarer Ausgangsstoffe oder problematischer Reaktanden wurden mehrere Synthesewege zu racemischem und enantiomerenreinem 3-Buten-1,2-diol vorgeschlagen.
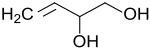
Bei der Chloropren-Synthese aus 1,3-Butadien tritt als unerwünschtes Nebenprodukt 1,4-Dichlor-2-buten auf, das mit Natriumoxalat und Natriumcarbonat in Wasser bei 100 °C innerhalb von 2 Stunden zu 3-Buten-1,2-diol (ca. 31 %) und 2-Buten-1,4-diol (39 %) hydrolysiert werden kann.[3]
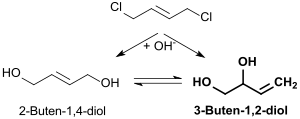
Das durch Hydrierung des nach Walter Reppe aus Acetylen und Formaldehyd entstehenden 2-Butin-1,4-diol im industriellen Maßstab zugängliche 2-Buten-1,4-diol lässt sich durch Erhitzen mit Quecksilber(II)-sulfat[8] – besser jedoch mit Kupfer(I)-chlorid – in einer Allylumlagerung in Ausbeuten bis ca. 40 % in racemisches 3-Buten-1,2-diol isomerisieren.[4]

Die enantioselektive Synthese von 3-Buten-1,2-diol aus 2-Buten-1,4-diol ist aufwendig und die bisher entwickelten Synthesewege sind bezüglich chemischer Ausbeute und Enantiomerenüberschuss noch unbefriedigend.[6]
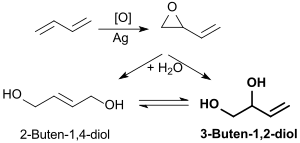
Oxidation von 1,3-Butadien an einem Silber-Kontakt erzeugt 3,4-Epoxy-1-buten (Vinyloxiran)[9], das sich durch Erhitzen mit Wasser auf 100 °C zu einem Gemisch von 3-Buten-1,2-diol (71 %) und 2-Buten-1,4-diol (14 %) hydrolysieren lässt.[10]
Auch für diesen Syntheseweg wurde eine enantioselektive Variante mit dem palladiumhaltigen Homogenkatalysator Tris(dibenzylidenaceton)dipalladium(0) [Pd2(dba)3] angegeben, die (2R)-3-Buten-1,2-diol in 84%iger Ausbeute und mit 85 % Enantiomerenüberschuss liefert.[5]
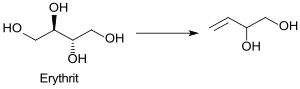
Aus dem Zuckeralkohol Erythrit (fermentativ aus dem nachwachsenden Rohstoff Glucose zugänglich[11]) kann 3-Buten-1,2-diol in brauchbaren Ausbeuten (56 %) durch Deoxydehydration[12] erhalten werden.[13]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]3-Buten-1,2-diol ist eine klare farblose Flüssigkeit, die sich in Wasser[4][5], Tetrahydrofuran THF, Methyl-tert-butylether MTBE und in Acrylnitril[5] löst.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]3-Buten-1,2-diol reagiert mit Kohlendioxid oder Dimethylcarbonat[13] zu Vinylethylencarbonat (4-Vinyl-1,3-dioxolan-3-on) VEC, das Homo- und Copolymere bildet und als Additiv in Lithium-Metall-Akkumulatoren untersucht wird, wo es durch Ausbildung einer festen Elektrolytschicht die Passivierung der Li-Anode aufhalten sollte.[14]

Ozonolyse von 3-Buten-1,2-diol in methanolischer Lösung liefert nach Hydrolyse des als Zwischenprodukt entstehenden Halbacetals Glycerinaldehyd in 77 % Ausbeute.[15]

Durch Umsetzung mit Acetanhydrid entsteht aus 3-Buten-1,2-diol das entsprechende Diacetat (3,4-Diacetoxy-1-buten), das durch Hydroformylierung und anschließende Deacetylierung zu β-Formylcrotonylacetat (auch C5-Acetat genannt), einer Vorstufe für Vitamin A umgesetzt werden kann.[16]

3,4-Dihydroxy-1-buten eignet sich auch als Ausgangsstoff für die als Methionin-Ersatzstoff in der Nutztierernährung verwendete 2-Hydroxy-4-methylthiobuttersäure HMB.[17]

Nach fast quantitativer anti-Markownikow-Addition von Methanthiol an die Doppelbindung wird die primäre Alkoholgruppe selektiv mikrobiologisch, z. B. von Bakterien der Gattung Rhodococcus zur Carboxygruppe oxidiert.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt 3,4-Dihydroxy-1-butene bei Sigma-Aldrich, abgerufen am 26. Dezember 2020 (PDF).
- ↑ a b c Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 54.
- ↑ a b c G.S. Grigoryan, L.G. Grigoryan, A.T. Malkhassyan: THREE STEP SYNTHESIS OF ESTERS OF 1,4-BUTANEDIOL AND HIGHER FATTY ACIDS FROM 1,4-DICHLORO-2-BUTENE AS SIDE-PRODUCT OF CHLOROPRENE MANUFACTURING PROCESS. In: Proc. Yerewan State Univ. Band 3, 2016, S. 9–13 (http://www.ysu.am/files/4. THE THREE STEP SYNTHESIS.pdf).
- ↑ a b c Patent US4661646: Process for the preparation of 1-butene-3,4-diol. Angemeldet am 21. November 1985, veröffentlicht am 28. April 1987, Anmelder: Bayer AG, Erfinder: R. Schalenbach, H. Waldmann.
- ↑ a b c d e N. Cheeseman, M. Fox, M. Jackson, I.C. Lennon, G. Merke: An efficient, palladium-catalyzed, enantioselective synthesis of (2R)-3-butene-1,2-diol and its use in highly selective Heck reactions. In: PNAS. Band 101, Nr. 15, 2004, S. 5396–5399, doi:10.1073/pnas.0307047101.
- ↑ a b Pablo Zarotti: Doctoral Thesis: Investigations of ligands for Cu-catalyzed conjugate addition reactions. ETH Zürich, Research Collection, 2006, abgerufen am 27. März 2020.
- ↑ R.A. Kemper, A.A. Elfarra: Oxidation of 3-butene-1,2-diol by alcohol dehydrogenase. In: Chem. Res. Toxicol. Band 9, Nr. 7, 1996, S. 1127–1134, doi:10.1021/tx960090e.
- ↑ A.V. Rama Rao, D. Subhas Bose, M.K. Gurjar, T. Ravindranathan: 3-Butene-1,2-diol: An attractive precursor for the synthesis of enantiomerically pure organic compounds. In: Tetrahedron. Band 45, Nr. 22, 1989, S. 7031–7040, doi:10.1016/S0040-4020(01)899171-7.
- ↑ Patent US5945550: Gas phase process for epoxidation of non-allylic olefins. Angemeldet am 24. Juli 1998, veröffentlicht am 31. August 1999, Anmelder: Eastman Chemical Co., Erfinder: S.D. Barnicki, J.R. Monnier, K.T. Peters.
- ↑ Patent DE4342030A1: Verfahren zur Herstellung von Butendiolen und Butendiolethern. Angemeldet am 9. Dezember 1993, veröffentlicht am 9. Dezember 1994, Anmelder: BASF AG, Erfinder: R. Pinkos, R. Fischer.
- ↑ D.A. Rzechonek, A. Dobrowolski, W. Rymowicz, A.M. Mironczuk: Recent advances in biological production of erythritol. In: Crit. Rev. Biotechnol. Band 38, Nr. 4, 2018, S. 620–633, doi:10.1080/07388551.2017.1380598.
- ↑ L.J. Donnelly, S.P. Thomas, J.B. Love: Recent advances in the deoxydehydration of vicinal diols and polyols. In: Chem. Asian J. Band 14, Nr. 21, 2019, S. 3782–3790, doi:10.1002/asia.201901274.
- ↑ a b N.N. Tshibalonza, R. Gérardy, Z. Alsafra, G. Eppe, J.-C.M. Monbaliu: A versatile biobased continuous flow strategy for the production of 3-butene-1,2-diol and vinyl ethylene carbonate from erythritol. In: Green Chem. Band 20, Nr. 22, 2018, S. 5147–5157, doi:10.1039/C8GC02468E.
- ↑ Y.Yang et al.: Vinyl ethylene carbonate as an effective SEI-forming additive in carbonate-based electrolyte for lithium-metal anodes. In: ACS Appl. Mater. Interfaces. Band 11, Nr. 6, 2019, S. 6118–6125, doi:10.1021/acsami.8b20706.
- ↑ Patent WO2001062696A1: Process for the preparation of glyceraldehyde and derivatives thereof. Angemeldet am 20. Februar 2001, veröffentlicht am 30. August 2001, Anmelder: Akzo Nobel N.V., Erfinder: U. Wecker, M.J. Bergfeld.
- ↑ Patent EP1247794A2: Verfahren zur Herstellung von C5-Acetat für die Vitamin A-Synthese. Angemeldet am 3. April 2002, veröffentlicht am 9. Oktober 2002, Anmelder: BASF AG, Erfinder: U. Rheude, M. Vicari, W. Aquila, G. Wegner, J. Niekerken.
- ↑ Patent EP1801227B1: Verfahren zur Herstellung von 2-Hydroxy-4-(methylthio)butansäure. Angemeldet am 13. Oktober 2005, veröffentlicht am 15. April 2009, Anmelder: Sumitomo Chemical Co., Erfinder: K. Hagiya, H. Asako.
