Methylmalonazidurien
| Klassifikation nach ICD-10 | |
|---|---|
| E71.1 | Sonstige Störungen des Stoffwechsels verzweigter Aminosäuren - Methylmalonazidämie |
| ICD-10 online (WHO-Version 2019) | |
Methylmalonazidurien, auch Methylmalonazidämien genannt, sind eine Gruppe erblicher Stoffwechselstörungen, die den Körper daran hindern, Proteine und Fette ordnungsgemäß abzubauen.[1] Dies führt zu einer Anhäufung toxischer Mengen an Methylmalonsäure in den Körperflüssigkeiten und -geweben. Aufgrund des gestörten Stoffwechsels der verzweigtkettigen Aminosäuren (BCAA) gehören sie zu den klassischen Organoazidopathien.[2]
Bei Methylmalonazidurien gibt es unterschiedliche Diagnosen, Behandlungsanforderungen und Prognosen, die von der spezifischen genetischen Mutation abhängen, die die vererbte Form der Störung verursacht.[3]
Die ersten Symptome können bereits ab dem ersten Lebenstag auftreten bis hin erst im Erwachsenenalter.[4] Die Symptome können von leicht bis lebensbedrohlich reichen.[1] Einige Formen können zum Tod führen, wenn sie nicht diagnostiziert oder behandelt werden.
Methylmalonazidurien treten in gleicher Häufigkeit über ethnische Grenzen hinweg auf.[5]
Symptome und Anzeichen
[Bearbeiten | Quelltext bearbeiten]Je nach betroffenem(n) Gen(en) und Mutation können die vorliegenden Symptome von leicht bis lebensbedrohlich reichen.
- Azidose[6]
- Kardiomyopathie[7][8]
- Koma[9]
- Dehydrierung[10][6][11]
- Schlaganfall[10]
- Entwicklungsverzögerungen[10][6][11]
- Dysmorphie[7][8]
- Enzephalopathie, progressiv[10]
- Gedeihstörung[10][6][11]
- Magen-Darm-Störungen[7][8]
- Hepatomegalie[6][11]
- Hyperammonämie[6]
- Hyperglycinämie[6] / Hyperglycinurie[6]
- Hypoglykämie[6]
- Muskelhypotonie[6][11]
- Infektionen, wiederkehrend[10]
- Ketonämie[6] / Ketonurie[6]
- Nierenversagen[10][11]
- Lethargie[10][6][11]
- Niedrige Konzentrationen an roten Blutzellen, weißen Blutzellen und Blutplättchen[6]
- Gedächtnisprobleme[9]
- Pankreatitis[11]
- Atemstörung[6]
- Sprachverzögerung[9]
- Krampfanfall[10][6]
- Schlaganfall[10]
- Erbrechen[10][6][11]
In der Regel sind Methylmalonazidurien bei der Geburt nicht erkennbar, da sich die Symptome erst zeigen, wenn dem Säugling Proteine zugeführt werden.[10] Daher treten die Symptome in der Regel irgendwann im ersten Lebensjahr auf.[12] Es gibt jedoch auch Methylmalonazidurien, die erst im Erwachsenenalter Symptome entwickeln.[4]
Ursache
[Bearbeiten | Quelltext bearbeiten]Genetisch
[Bearbeiten | Quelltext bearbeiten]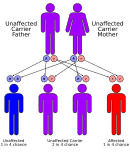
Methylmalonazidurien werden autosomal rezessiv vererbt, das heißt, das defekte Gen befindet sich auf einem Autosom, und es müssen zwei Kopien des Gens – eine von jedem Elternteil – vererbt werden, um von der Störung betroffen zu sein. Die Eltern eines Kindes mit einer autosomal rezessiv vererbten Störung sind Träger einer Kopie des defekten Gens, sind aber in der Regel nicht von der Störung betroffen. Eine Ausnahme bildet die Methylmalonazidurie mit Homocystinurie, cblX-Typ, die auf Varianten im HCFC1-Gen zurückzuführen ist und X-chromosomal rezessiv vererbt wird.[13]
Im Folgenden sind Genotypen aufgeführt, die für isolierte Methylmalonazidurien verantwortlich sind:[13]
| Gen | Typ | OMIM | Bezeichnung | Prävalenz | Manifestationsalter |
|---|---|---|---|---|---|
| MCEE | 251120 | Methylmalonazidurie durch Methylmalonyl-CoA-Epimerase-Mangel | <1:1.000.000[14] | Kindesalter, Kleinkindalter[14] | |
| MMAA | cblA | 251100 | Methymalonazidurie, Vitamin B12-sensible, Typ cblA | <1:1.000.000[15] | Kindesalter[15] |
| MMAB | cblB | 251110 | Methymalonazidurie, Vitamin B12-sensible, Typ cblB | Kindesalter[16] | |
| MMADHC | cblDv2 | 277410 | Methylmalonazidurie, Vitamin B12-sensible, Typ cblDv2 | ||
| MMUT | mut0 | 251000 | Methymalonazidurie, Vitamin B12-resistente, Typ mut0 | Kleinkindalter, Neugeborenenzeit[17] | |
| mut- | Methymalonazidurie, Vitamin B12-resistente, Typ mut- | Kleinkindalter, Neugeborenenzeit[18] |
Der Typ mut kann weiter in die Subtypen mut0 und mut- unterteilt werden, wobei mut0 durch einen vollständigen Mangel an Methylmalonyl-CoA-Mutase und schwerere Symptome und mut- durch eine verringerte Mutase-Aktivität gekennzeichnet ist.[5]
Darüber hinaus sind auch die folgenden Gene für Methylmalonazidurien verantwortlich:[13][19]
| Gen | Typ | OMIM | Bezeichnung | Prävalenz | Manifestationsalter |
|---|---|---|---|---|---|
| ABCD4 | cblJ | 614857 | Methylmalonazidurie mit Homocystinurie, Typ cblJ | <1:1.000.000[20] | Kleinkindalter, Neugeborenenzeit[20] |
| ACSF3 | 614265 | Kombinierte Malon- und Methylmalonazidurie (CMAMMA) | 1:30.000[9] | Alle Altersgruppen[21] | |
| ALDH6A1 | 614105 | Entwicklungsverzögerung durch Methylmalonat-Semialdehyd-Dehydrogenase-Mangel | <1:1.000.000[22] | Kleinkindalter, Neugeborenenzeit[22] | |
| AMN | 618882 | Imerslund-Gräsbeck-Syndrom 2 | Kindesalter[23] | ||
| CBLIF | 261000 | Kongenitaler Intrinsic-Faktor-Mangel | <1:1.000.000[24] | Kindesalter[24] | |
| CD320 | TcblR | 613646 | Methylmalonazidurie durch Transcobalamin-Rezeptor-Defekt | <1:1.000.000[25] | Kleinkindalter, Neugeborenenzeit[25] |
| CUBN | 261100 | Imerslund-Gräsbeck-Syndrom 1 | Kindesalter[23] | ||
| HCFC1 | cblX | 309541 | Methylmalonazidurie mit Homocystinurie, Typ cblX | <1:1.000.000[26] | Kleinkindalter, Neugeborenenzeit[26] |
| LMBRD1[27] | cblF | 277380 | Methylmalonazidurie mit Homocystinurie, Typ cblF | <1:1.000.000[28] | Kindesalter[28] |
| MLYCD | 248360 | Malonazidurie | <1:1.000.000[29] | Kindesalter[29] | |
| MMACHC | cblC | 277400 | Methylmalonazidurie mit Homocystinurie, Typ cblC | 1:200.000[30] | Alle Altersgruppen[31] |
| MMADHC[32] | cblD | 277410 | Methylmalonazidurie mit Homocystinurie, Typ cblD | <1:1.000.000[33] | Alle Altersgruppen[33] |
| SUCLA2 | 612073 | Mitochondriales DNA-Depletionssyndrom, enzephalomyopathische Form mit Methylmalonazidurie | <1:1.000.000[34] | Kleinkindalter[34] | |
| SUCLG1 | 245400 | Fatale infantile Laktatazidose mit Methylmalonazidurie | Kleinkindalter, Neugeborenenzeit[35] | ||
| TCN2 | 275350 | Transcobalamin-II-Mangel | <1:1.000.000[36] | Kleinkindalter, Neugeborenenzeit[36] | |
| ZBTB11 | 618383 | Autosomal-rezessive intellektuelle Entwicklungsstörung 69 |
Ernährungsbedingt
[Bearbeiten | Quelltext bearbeiten]Auch wenn er nicht immer mit den vererbten Varianten in Verbindung gebracht wird, kann ein schwerer ernährungsbedingter Vitamin-B12-Mangel ebenfalls zu einem Syndrom mit den gleichen Symptomen und Behandlungen führen wie die genetisch bedingten Methylmalonazidurien.[37] Methylmalonyl-CoA benötigt Vitamin B12 zur Bildung von Succinyl-CoA. Wenn die Menge an B12 für die Umwandlung des Cofaktors Methylmalonyl-CoA in Succinyl-CoA nicht ausreicht, führt die Anhäufung von ungenutztem Methylmalonyl-CoA schließlich zur Methylmalonazidurie. Diese Diagnose wird häufig als Indikator für einen Vitamin-B12-Mangel im Serum verwendet.[38]
Pathophysiologie
[Bearbeiten | Quelltext bearbeiten]
Bei Methylmalonazidurien ist der Körper nicht in der Lage richtig abzubauen:
- die essentiellen Aminosäuren: Methionin, Valin, Threonin und Isoleucin[39]
- Propionsäure aus der intestinalen Fermentation[39]
- ungeradzahlige Fettsäuren[39]
- Cholesterin-Seitenkette[39]
Infolgedessen sammelt sich Methylmalonsäure in Flüssigkeiten und Geweben an. Den Betroffenen fehlen entweder funktionelle Kopien oder ausreichende Mengen eines oder mehrerer der folgenden Enzyme:[6][11][9]
- Methylmalonyl-CoA-Mutase (MUT)
- Acyl-CoA-Synthetase-Familienmitglied 3 (ACSF3)
- Methylmalonyl-CoA-Epimerase (MCEE)
- Enzyme, die an der Adenosylcobalamin-Synthese beteiligt sind
Diese werden im Folgenden kurz vorgestellt:
Methylmalonyl-CoA-Mutase
[Bearbeiten | Quelltext bearbeiten]Es wird geschätzt, dass bis zu 60 % der isolierten Methylmalonaziduriefälle auf ein mutiertes MMUT-Gen zurückzuführen sind, das für das Protein Methylmalonyl-CoA-Mutase kodiert. Dieses Enzym ist für die Verstoffwechselung von potenziell toxischen Derivaten des Abbaus der oben genannten Aminosäuren und Fette, vor allem Cholesterin, verantwortlich,[11] insbesondere wandelt dieses Enzym Methylmalonyl-CoA in Succinyl-CoA um.[40] Ohne dieses Enzym hat der Körper keine Möglichkeit, Methylmalonsäure und verwandte Verbindungen zu neutralisieren oder zu entfernen. Die Wirkung dieses Enzyms kann auch durch Mutationen in den Genen MMAA, MMAB und MMADHC beeinträchtigt werden, von denen jedes für ein Protein kodiert, das für die normale Funktion der Methylmalonyl-CoA-Mutase erforderlich ist.[11]
Acyl-CoA-Synthetase-Familienmitglied 3
[Bearbeiten | Quelltext bearbeiten]CMAMMA ist wahrscheinlich die häufigste Form der Methylmalonazidurien, wird aber nur selten diagnostiziert, da sie beim routinemäßigen Neugeborenenscreening nicht erkannt wird, die Symptome sehr vielfältig sind und in einigen Fällen erst im Erwachsenenalter auftreten.[9][41] Mutationen des ACSF3-Gens führen zu einem Mangel des mitochondrialen Enzyms Acyl-CoA-Synthetase-Familienmitglied 3, was zu erhöhten Werten von Methylmalonsäure und Malonsäure führt.[9] Da die Aufgabe des Enzyms sowohl in der Umwandlung von Methylmalonsäure in Methylmalonyl-CoA besteht, damit diese in den Citratzyklus eingespeist werden kann, als auch in der Umwandlung von Malonsäure in Malonyl-CoA, was den ersten Schritt der mitochondrialen Fettsäuresynthese (mtFASII) darstellt.[42][43] CMAMMA kann daher nicht nur als organische Azidurie, sondern auch als Defekt der mitochondrialen Fettsäuresynthese definiert werden.[43]
Methylmalonyl-CoA-Epimerase
[Bearbeiten | Quelltext bearbeiten]Mutationen im MCEE-Gen, das für das Methylmalonyl-CoA-Epimerase-Protein kodiert, das auch als Methylmalonyl-Racemase bezeichnet wird, führen zu einer viel milderen Form der Erkrankung als die verwandte Variante der Methylmalonazidurie vom Typ mut. Wie die Mutase hat auch die Epimerase die Aufgabe, dieselben Substanzen abzubauen, allerdings in einem deutlich geringeren Ausmaß als die Mutase.[11] Die phänotypischen Unterschiede, die durch einen Mangel der Epimerase im Gegensatz zur Mutase verursacht werden, sind so gering, dass in der medizinischen Fachwelt darüber diskutiert wird, ob dieser genetische Mangel als Störung oder klinisches Syndrom angesehen werden kann.[44]
Adenosylcobalamin
[Bearbeiten | Quelltext bearbeiten]Auch als Vitamin B12 bekannt, ist diese Form von Cobalamin ein notwendiger Cofaktor der Methylmalonyl-CoA-Mutase. Selbst bei einer funktionsfähigen Version des Enzyms in physiologisch normalen Mengen kann die Mutase nicht funktionieren, wenn B12 nicht in diese aktive Form umgewandelt werden kann.[11]
Diagnose
[Bearbeiten | Quelltext bearbeiten]Neugeborenenscreening
[Bearbeiten | Quelltext bearbeiten]Aufgrund der Schwere und der Schnelligkeit, mit der diese Stoffwechselstörung zu Komplikationen führen kann, wenn sie nicht diagnostiziert wird, ist das Screening auf Methylmalonazidurie häufig Bestandteil des Neugeborenenscreenings.[10][45] Zu diesem Zweck wird im Alter von 24–48 Stunden ein Trockenbluttest für unter anderem den Parameter Propionylcarnitin (C3) durchgeführt, um isolierte Methylmalonazidurien zu entdecken.[13][46]
Aufgrund normaler Propionylcarnitinwerte und asymptomatischer Symptome zum Zeitpunkt der Testung rutscht die – vermutlich häufigste Form der Methylmalonazidurie – CMAMMA durch das Neugeborenenscreening.[9][13] Die autosomal-rezessive intellektuelle Entwicklungsstörung 69 weist ebenfalls normale Propionylcarnitinwerte auf.[13] Des Weiteren kann eine Methylmalonazidurie mit Homocystinurie vom Typ cblC, ebenfalls durchrutschen, wenn sie leicht und mit später Manifestation ist.[47]
Routine- und biochemische Labortests
[Bearbeiten | Quelltext bearbeiten]Aufgrund der Unfähigkeit Aminosäuren vollständig abbauen zu können, wird das Nebenprodukt der Eiweißverdauung, die chemische Verbindung Methylmalonsäure in unverhältnismäßig hoher Konzentration im Blut und Urin der Betroffenen gefunden. Diese abnormen Werte werden als Hauptdiagnosekriterien für die Diagnose der Stoffwechselstörung verwendet. In der Regel wird die Stoffwechselstörung durch eine Urinanalyse oder ein Blutbild festgestellt.[12] Erhöhte Werte von Ammoniak, Glycin und Ketonkörpern können auch im Blut und Urin vorhanden sein.[6]
Hinsichtlich erhöhter Methylmalonsäurewerte lässt sich eine kombinierte Malon- und Methylmalonazidurie (CMAMMA) von einer klassischen Methylmalonazidurie labortechnisch schnell durch die Berechnung des Verhältnisses von Malonsäure zu Methylmalonsäure im Blutplasma unterscheiden, eine Berechnung mit Werten aus dem Urin ist dagegen ungeeignet.[48] Aus dem Verhältnis lässt sich dann auch ablesen, ob eine CMAMMA (mehr Methylmalonsäure als Malonsäure) oder eine Malonazidurie (mehr Malonsäure als Methylmalonsäure) vorliegt.[48][7][49]
Vitamin-B12-Ansprechbarkeitstest
[Bearbeiten | Quelltext bearbeiten]Der Test wird zur weiteren Differentialdiagnose und zur Überprüfung der Wirksamkeit einer Vitamin-B12-Behandlung verwendet, wodurch unnötige Injektionen (von Vitamin B12) bei Kindern vermieden werden können.[50] Zur besseren Vergleichbarkeit und Interpretation von verschiedenen Patientenberichten haben Fowler et al. ein Protokoll für einen standardisierten Vitamin-B12-Ansprechbarkeitstest (in vivo) entwickelt:[50]
- Person ist stoffwechselstabil und seit mindestens einem Monat unter der gleichen Behandlung. Angabe der jeweiligen Energie- und Proteinzufuhr.
- Vitamin B12 mindestens einen Monat vorher absetzen. Bei einer Verschlechterung abbrechen und die Verabreichung von Vitamin B12 wieder aufnehmen.
- Sammeln von Urin von 3 verschiedenen Tagen für den Ausgangswert. Wenn der Test empfindlich genug ist, können auch Blutplasmakonzentrationen verwendet werden.
- Intramuskuläre Injektion von 1 mg Hydroxocobalamin an 3 aufeinanderfolgenden Tagen.
- Nach der Injektion werden 10 Tage lang an abwechselnden Tagen Urin- oder Plasmaproben gesammelt.
- Die Urin- oder Plasmaproben sollten im gleichen Durchgang mittels GCMS analysiert werden.
- Wenn die mittlere Urin- oder Plasmakonzentration von Methylmalonsäure um mehr als 50 % abnimmt, spricht die Person auf Vitamin B12 an.
Darüber hinaus kann das Ansprechen auf Vitamin B12 auch in vitro getestet werden.[13][50] Dies kann einige Erkenntnisse liefern, aber es kann nicht immer das Ansprechenverhalten auf Vitamin B12 in vivo korrekt vorhersagen.[13]
Molekular genetische Untersuchung
[Bearbeiten | Quelltext bearbeiten]Die endgültige Diagnose wird durch molekulargenetische Tests bestätigt, wenn biallelische pathogene Varianten in dem/den betroffenen Gen(en) gefunden werden. Aufgrund ihrer hohen Sensitivität, leichten Zugänglichkeit und Nichtinvasivität ersetzen molekulargenetische Tests in den meisten Fällen Enzymtests.[13] Hierzu gibt es spezifische Multigenpanels für Methylmalonazidurie, aber die getesteten Gene können von Labor zu Labor variieren und können vom Kliniker an den individuellen Phänotyp angepasst werden.[13][19] Die in diesen Panels verwendeten molekulargenetischen Methoden reichen von der Sequenzanalyse über die Deletions-/Duplikationsanalyse bis hin zu anderen, nicht auf Sequenzierung basierenden Tests, aber in der überwiegenden Mehrheit der Fälle wird die Diagnose durch Sequenzanalyse gestellt.[13]
Darüber hinaus sind molekulargenetische Tests notwendig, um Verdachtsdiagnosen zu überprüfen und Fehldiagnosen korrigieren zu können, die eventuell durch irreführende Symptome und Ergebnisse des Vitamin-B12-Ansprechbarkeitstestes zustande gekommen sind.[51]
Sonstige
[Bearbeiten | Quelltext bearbeiten]Der Verdacht auf eine Methylmalonazidurie kann sich auch durch eine CT- oder MRT-Untersuchung, allerdings sind diese Tests keineswegs spezifisch und erfordern eine klinische und metabolische Korrelation.[10]
| Methylmalonsäurewerte | Homocysteinwerte | Differentialdiagnose | Nächste Diagnostik | Vitamin-B12-Ansprechbarkeit (in vivo) | Differentialdiagnose | Nächste Diagnostik | |
|---|---|---|---|---|---|---|---|
| Methylmalonsäurewerte | Homocysteinwerte | ||||||
| Sehr hoch | Normal | mut0, mut-, cblA, cblB, cblDv2 | Vitamin-B12-Ansprechbarkeit (in vivo) | kein Ansprechen | mut0, mut-, cblB | Molekulargenetische Untersuchung, 14C-Propionat-inkorporation, Cobalaminkompensationsstudien | |
| Ansprechen (Reduzierung von >50 % oder normale Werte) | cblA, cblB, cblDv2, mut-? | ||||||
| Hoch | MCEE, TcblR, SUCLG1/A2, CMAMMA, MMSDH und andere | Vitamin-B12-Ansprechbarkeit (in vivo), Enzymtest, Molekulargenetische Untersuchung | kein Ansprechen | MCEE, CMAMMA und andere | |||
| Ansprechen (Reduzierung von >50 % oder normale Werte) | TcblR | ||||||
| Hoch | cblC,cbID, cblF, cblJ, cbIX, TC-II, TcbIR, B12-Mangelsyndrome | Vitamin-B12-Ansprechbarkeit (in vivo) | Hoch oder normal | Hoch oder normal | cblC,cbID, cblF, cblJ | ||
| Normal | Normal | TC-II, TcbIR, B12-Mangelsyndrome | |||||
| Falsch positiv, mütterlicher B12-Mangel | |||||||
Behandlung
[Bearbeiten | Quelltext bearbeiten]Diätetik
[Bearbeiten | Quelltext bearbeiten]In erster Linie beruht die Behandlung aller Formen dieser Erkrankung auf einer eiweißarmen Ernährung und, je nach Variante der Erkrankung, auf verschiedenen Nahrungsergänzungsmitteln.
Zudem sprechem alle Varianten auf das Levo-Isomer von Carnitin an, da bei den Betroffenen durch den unsachgemäßen Abbau der betroffenen Substanzen ein Carnitinmangel entsteht. Carnitin hilft auch bei der Entfernung von Acyl-CoA, welches sich bei eiweißarmer Ernährung häufig ansammelt, indem es in Acyl-Carnitin umgewandelt wird, das mit dem Urin ausgeschieden werden kann.
Einige Formen der Methylmalonazidurie sprechen auf Cobalamin an, obwohl sich eine Cyanocobalaminsupplementierung bei einigen Formen als nachteilig erweisen könnte.[52] Es wurde festgestellt, dass die Methylmalonazidurie-Typen cblA und cblB auf Vitamin B12 ansprechen. Dagegen sind mut0 und mut- nicht auf Vitamin B12 ansprechende Typen.[53][54]
Wenn der Betroffene sowohl auf Cobalamin- als auch auf Carnitinpräparate anspricht, dann kann es für diesen möglich sein Nahrungsmittel mit geringen Mengen der problematischen Aminosäuren Isoleucin, Threonin, Methionin und Valin aufzunehmen, ohne eine Stoffwechselentgleisung zu bekommen.[10]
Transplantation
[Bearbeiten | Quelltext bearbeiten]Eine extremere Behandlung ist die Nieren- oder Lebertransplantation von einem Spender, der nicht an der Krankheit leidet. Die fremden Organe produzieren dann eine funktionsfähige Version der defekten Enzyme und bauen die Methylmalonsäure ab, jedoch gelten alle Nachteile einer Organtransplantation auch in dieser Situation.[10] Es gibt Hinweise darauf, dass das Zentralnervensystem Methylmalonyl-CoA in einem vom Rest des Körpers isolierten System verstoffwechseln kann. Wenn dies der Fall ist, dann kann eine Transplantation die neurologischen Auswirkungen der Methylmalonsäure vor der Transplantation nicht rückgängig machen oder eine weitere Schädigung des Gehirns durch fortgesetzte Anhäufung verhindern.[55][40]
mRNA-Therapie
[Bearbeiten | Quelltext bearbeiten]Vorklinische Proof-of-Concept-Studien in Tiermodellen haben gezeigt, dass sich die mRNA-Therapie auch für seltene Stoffwechselerkrankungen eignet, darunter die isolierte Methylmalonazidurie.[56][57] In diesem Zusammenhang ist der Methylmalonazidurietherapiekandidat mRNA-3705 des Biotechnologieunternehmens Moderna zu nennen, der sich derzeit in der Phase 1/2 befindet.[58]
Niedermolekulare Therapeutika
[Bearbeiten | Quelltext bearbeiten]Hier ist das experimentelle Therapeutikum HST5040 von HemoShear Therapeutics für Methylmalonazidurien und Propionazidurie zu nennen, welches sich aktuell in Phase 2 befindet.[59][60] Täglich oral oder per Magensonde eingenommen, soll es eine toxische Anhäufung von Propionyl-CoA und Methymalonyl-CoA bzw. deren Abkömmlinge verhindern, in dem es CoA vom Propionyl-CoA Pfad abhält, was zu normalen oder nahezu normalen Leveln von vorher genannten Metaboliten und folglich möglicherweise zu einer Verbesserung des metabolischen Zustandes und der energieproduzierenden Pfade führen soll.[61][60]
Ein weiteres Niedermolekulartherapeutikum in Entwicklung ist BBP-671 von BridgeBio Pharma für Pantothenatkinase-assoziierte Neurodegeneration (PKAN), Propionazidurie und Methylmalonazidurien, was sich aktuell in Phase 1 befindet.[62] Durch allosterisch Aktivierung von Pantothenatkinasen soll BBP-671 die Produktion von CoA aus Vitamin B5 steigern und somit metabolische Prozesse wieder normalisieren.[63]
Prognose
[Bearbeiten | Quelltext bearbeiten]Obwohl es keine unterschiedlichen Stadien der Krankheit gibt, ist die Methylmalonazidurie eine fortschreitende Erkrankung, deren Symptome sich mit zunehmender Konzentration von Methylmalonsäure verstärken. Wenn die auslösenden Proteine und Fette nicht aus der Ernährung entfernt werden, kann diese Anhäufung zu irreparablen Nieren- oder Leberschäden und schließlich zum Tod führen.[10]
Die Prognose hängt von der Schwere der Erkrankung und dem Ansprechen der Person auf die Behandlung ab. Die Prognose ist in der Regel besser für diejenigen mit Vitamin-B12-ansprechenden Varianten und nicht vielversprechend für diejenigen, die an nicht-Vitamin-B12-ansprechenden Varianten leiden.[40] Mildere Varianten treten in der Bevölkerung häufiger auf als die schwereren.[12] Selbst mit einer Ernährungsumstellung und kontinuierlicher medizinischer Betreuung können neurologische Schäden bei Menschen mit einer nicht ansprechenden Azidurie möglicherweise nicht verhindert werden.[40] Ohne angemessene Behandlung oder Diagnose ist es nicht ungewöhnlich, dass der erste Azidurieanfall tödlich verläuft.[10]
Trotz dieser Herausforderungen haben sich die Behandlung und das Verständnis der Krankheit seit ihrer Entdeckung im Jahr 1967 so weit verbessert, dass selbst Menschen mit nicht ansprechenden Formen der Methylmalonazidurie das Erwachsenenalter erreichen und sogar Kinder sicher austragen und zur Welt bringen können.[55]
Forschung
[Bearbeiten | Quelltext bearbeiten]Nosologische Geschichte
[Bearbeiten | Quelltext bearbeiten]Die erste Methylmalonazidurie wurde 1967 von Oberholzer et al. beschrieben.[64][55]
Neurologische Wirkungen
[Bearbeiten | Quelltext bearbeiten]Dass Methylmalonsäure katastrophale Auswirkungen auf das Nervensystem haben kann, ist seit langem bekannt; der Mechanismus, über den dies geschieht, wurde jedoch nie geklärt. In 2015 wurde eine Studie über die Auswirkungen von Methylmalonsäure auf Neuronen veröffentlicht, die aus fötalen Ratten in einer in-vitro-Umgebung isoliert wurden, wobei eine Kontrollgruppe von Neuronen mit einer anderen Säure mit ähnlichem pH-Wert behandelt wurde.[65] Diese Tests legen nahe, dass Methylmalonsäure zu einer Verringerung der Zellgröße und einen Anstieg der zellulären Apoptose in Abhängigkeit von der Konzentration führt, wobei bei höheren Konzentrationen extremere Auswirkungen zu beobachten sind.[65] Darüber hinaus haben Microarrayanalysen dieser behandelten Neuronen ergeben, dass Methylmalonsäure auf epigenetischer Ebene die Transkriptionsrate von 564 Genen verändert, darunter insbesondere solche, die an den Apoptose-, p53- und MAPK-Signalwegen beteiligt sind.[65]
Mitochondriale Dysfunktion
[Bearbeiten | Quelltext bearbeiten]Da die Umwandlung von Methylmalonyl-CoA in Succinyl-CoA in den Mitochondrien stattfindet, wird seit langem eine mitochondriale Dysfunktion als Folge einer verminderten Funktion der Elektronentransportkette als ein Merkmal von Methylmalonazidurien vermutet. Jüngste [Wann? Vor 10.12.2015] Forschungen mit Rattenmodellen haben ergeben, dass die Mitochondrien von Ratten, die von der Krankheit betroffen sind, auf eine ungewöhnliche Größe anwachsen, auch als Megamitochondrien bezeichnet. Diese Megamitochondrien scheinen auch deformierte innere Strukturen und einen Verlust an Elektronenreichtum in ihrer Matrix aufzuweisen. Diese Megamitochondrien zeigten auch Anzeichen einer verminderten Atmungskettenfunktion, insbesondere des Komplexes IV, der nur noch mit etwa 50 % Effizienz funktionierte. Ähnliche Veränderungen wurden in den Mitochondrien einer Leberbiopsie festgestellt, die bei einer Transplantation eines 5-jährigen Jungen mit Methylmalonazidurie vom Typ mut entnommen wurde.[66]
Benigner Mut-Phänotyp
[Bearbeiten | Quelltext bearbeiten]Fallstudien bei mehreren Patienten mit nicht ansprechender Methylmalonazidurie vom Typ mut0 und der spezifischen Mutation p.P86L haben die Möglichkeit einer weiteren Unterteilung der Methylmalonazidurien vom Typ mut nahegelegt.[67] Obwohl derzeit unklar ist, ob dies auf die spezifische Mutation oder auf eine frühzeitige Erkennung und Behandlung zurückzuführen ist, schienen diese Personen trotz des vollständigen Nichtansprechens auf Vitamin B12 eine weitgehend gutartige und nahezu völlig asymptomatische Version der Methylmalonazidurie zu entwickeln.[67] Obwohl sie durchwegs erhöhte Methylmalonsäurewerte im Blut und Urin aufwiesen, schienen diese Personen größtenteils normal entwickelt zu sein.[67]
Erwähnenswerte Fälle
[Bearbeiten | Quelltext bearbeiten]- Bei Ryan Stallings, einem Säugling aus St. Louis, wurde 1989 fälschlicherweise eine Ethylenglykolvergiftung statt einer Methylmalonazidurie diagnostiziert, was zu einer fälschlichen Verurteilung wegen Mordes und einer lebenslangen Haftstrafe für seine Mutter, Patricia Stallings, führte.[55]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- Brigitte Marian (Hrsg.): Krankheit, Krankheitsursachen und -bilder (= MCW Block 8). 1. Auflage. facultas wuv universitätsverlag, Wien 2007, ISBN 978-3-7089-0183-1.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Methylmalonic acidemia. In: MedlinePlus. United States National Library of Medicine, abgerufen am 30. April 2024 (englisch).
- ↑ Guglielmo RD Villani, Giovanna Gallo, Emanuela Scolamiero, Francesco Salvatore, Margherita Ruoppolo: “Classical organic acidurias”: diagnosis and pathogenesis. In: Clinical and Experimental Medicine. Band 17, Nr. 3, August 2017, ISSN 1591-8890, S. 305–323, doi:10.1007/s10238-016-0435-0, PMID 27613073.
- ↑ Suzanne M. Matsui, Maurice J. Mahoney, Leon E. Rosenberg: The Natural History of the Inherited Methylmalonic Acidemias. In: New England Journal of Medicine. Band 308, Nr. 15, 14. April 1983, ISSN 0028-4793, S. 857–861, doi:10.1056/NEJM198304143081501, PMID 6132336 (englisch).
- ↑ a b Stefan Kölker, Angeles Garcia Cazorla, Vassili Valayannopoulos, Allan M. Lund, Alberto B. Burlina, Jolanta Sykut‐Cegielska, Frits A. Wijburg, Elisa Leão Teles, Jiri Zeman, Carlo Dionisi‐Vici, Ivo Barić, Daniela Karall, Persephone Augoustides‐Savvopoulou, Lise Aksglaede, Jean‐Baptiste Arnoux, Paula Avram, Matthias R. Baumgartner, Javier Blasco‐Alonso, Brigitte Chabrol, Anupam Chakrapani, Kimberly Chapman, Elisenda Cortès i Saladelafont, Maria L. Couce, Linda de Meirleir, Dries Dobbelaere, Veronika Dvorakova, Francesca Furlan, Florian Gleich, Wanda Gradowska, Stephanie Grünewald, Anil Jalan, Johannes Häberle, Gisela Haege, Robin Lachmann, Alexander Laemmle, Eveline Langereis, Pascale de Lonlay, Diego Martinelli, Shirou Matsumoto, Chris Mühlhausen, Hélène Ogier de Baulny, Carlos Ortez, Luis Peña‐Quintana, Danijela Petković Ramadža, Esmeralda Rodrigues, Sabine Scholl‐Bürgi, Etienne Sokal, Christian Staufner, Marshall L. Summar, Nicholas Thompson, Roshni Vara, Inmaculada Vives Pinera, John H. Walter, Monique Williams, Peter Burgard: The phenotypic spectrum of organic acidurias and urea cycle disorders. Part 1: the initial presentation. In: Journal of Inherited Metabolic Disease. Band 38, Nr. 6, November 2015, ISSN 0141-8955, S. 1041–1057, doi:10.1007/s10545-015-9839-3, PMID 25875215.
- ↑ a b About Methylmalonic Acidemia. In: National Human Genome Research Institute. U.S. National Institutes of Health, abgerufen am 3. November 2015 (englisch).
- ↑ a b c d e f g h i j k l m n o p q r s Acidemia, Methylmalonic. NORD (National Organization for Rare Disorders), abgerufen am 29. Oktober 2015 (englisch).
- ↑ a b c d A. Alfares, L. D. Nunez, K. Al-Thihli, J. Mitchell, S. Melancon, N. Anastasio, K. C. H. Ha, J. Majewski, D. S. Rosenblatt, N. Braverman: Combined malonic and methylmalonic aciduria: exome sequencing reveals mutations in the ACSF3 gene in patients with a non-classic phenotype. In: Journal of Medical Genetics. Band 48, Nr. 9, 1. September 2011, ISSN 0022-2593, S. 602–605, doi:10.1136/jmedgenet-2011-100230 (englisch).
- ↑ a b c A. R. Gregg, A. W. Warman, D. R. Thorburn, W. E. O’Brien: Combined malonic and methylmalonic aciduria with normal malonyl‐coenzyme A decarboxylase activity: A case supporting multiple aetiologies. In: Journal of Inherited Metabolic Disease. Band 21, Nr. 4, Juni 1998, ISSN 0141-8955, S. 382–390, doi:10.1023/A:1005302607897, PMID 9700595 (englisch).
- ↑ a b c d e f g h NIH Intramural Sequencing Center Group, Jennifer L Sloan, Jennifer J Johnston, Irini Manoli, Randy J Chandler, Caitlin Krause, Nuria Carrillo-Carrasco, Suma D Chandrasekaran, Justin R Sysol, Kevin O’Brien, Natalie S Hauser, Julie C Sapp, Heidi M Dorward, Marjan Huizing, Bruce A Barshop, Susan A Berry, Philip M James, Neena L Champaigne, Pascale de Lonlay, Vassilli Valayannopoulos, Michael D Geschwind, Dimitar K Gavrilov, William L Nyhan, Leslie G Biesecker, Charles P Venditti: Exome sequencing identifies ACSF3 as a cause of combined malonic and methylmalonic aciduria. In: Nature Genetics. Band 43, Nr. 9, September 2011, ISSN 1061-4036, S. 883–886, doi:10.1038/ng.908, PMID 21841779, PMC 3163731 (freier Volltext).
- ↑ a b c d e f g h i j k l m n o p q r Methylmalonic acidemia. In: MedlinePlus. United States National Library of Medicine, abgerufen am 27. Oktober 2015 (englisch).
- ↑ a b c d e f g h i j k l m n Methylmalonic acidemia. In: MedlinePlus. United States National Library of Medicine, abgerufen am 2. November 2015 (englisch).
- ↑ a b c Ashwini Malhotra, Navdeep Saini, Sanjay Chhabra, Sunny Chhabra: Methylmalonic acidemia mimicking diabetic ketoacidosis and septic shock in infants. In: Indian Journal of Critical Care Medicine. Band 19, Nr. 3, März 2015, ISSN 0972-5229, S. 183–185, doi:10.4103/0972-5229.152776, PMID 25810618, PMC 4366921 (freier Volltext).
- ↑ a b c d e f g h i j k l Manoli I, Sloan JL, Venditti CP.: Isolated Methylmalonic Acidemia. 2005 Aug 16. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews®. Seattle (WA): University of Washington, Seattle; 1993–2024. https://www.ncbi.nlm.nih.gov/books/NBK1231/
- ↑ a b Eintrag zu Methylmalonazidämie durch Methylmalonyl-CoA-Epimerase-Mangel. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ a b Eintrag zu Methylmalonazidämie, Vitamin B12-sensible, Typ cblA. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ Eintrag zu Methylmalonazidämie, Vitamin-B12-sensible, Typ cblB. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ Eintrag zu Methylmalonazidämie, Vitamin B12-resistente, Typ mut0. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ Eintrag zu Methylmalonazidämie, Vitamin B12-resistente, Typ mut-. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ a b Methylmalonic Aciduria Gene Panel, Varies. In: Mayo Clinic Laboratories. Mayo Foundation for Medical Education and Research, abgerufen am 26. Mai 2024 (englisch).
- ↑ a b Eintrag zu Methylmalonazidämie mit Homocystinurie Typ cblJ. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ Eintrag zu Malon- und Methylmalonazidurie, kombinierte. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ a b Eintrag zu Entwicklungsverzögerung durch Methylmalonat-Semialdehyd-Dehydrogenase-Mangel. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 27. April 2024.
- ↑ a b Eintrag zu Imerslund-Gräsbeck-Syndrom. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ a b Eintrag zu Intrinsic-Faktor-Mangel, kongenitaler. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 15. Mai 2024.
- ↑ a b Eintrag zu Methylmalonazidurie durch Transcobalamin-Rezeptor-Defekt. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ a b Eintrag zu Methylmalonazidämie mit Homocystinurie Typ cblX. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ Frank Rutsch, Susann Gailus, Isabelle R Miousse, Terttu Suormala, Corinne Sagné, Mohammad Reza Toliat, Gudrun Nürnberg, Tanja Wittkampf, Insa Buers, Azita Sharifi, Martin Stucki, Christian Becker, Matthias Baumgartner, Horst Robenek, Thorsten Marquardt, Wolfgang Höhne, Bruno Gasnier, David S Rosenblatt, Brian Fowler, Peter Nürnberg: Identification of a putative lysosomal cobalamin exporter altered in the cblF defect of vitamin B12 metabolism. In: Nature Genetics. Band 41, Nr. 2, Februar 2009, ISSN 1061-4036, S. 234–239, doi:10.1038/ng.294.
- ↑ a b Eintrag zu Methylmalonazidämie mit Homocystinurie Typ cbl F. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ a b Eintrag zu Malonazidurie. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ Sloan JL, Carrillo N, Adams D, Venditti CP. Disorders of Intracellular Cobalamin Metabolism. 2008 Feb 25 [updated 2021 Dec 16]. In: Adam MP, Mirzaa GM, Pagon RA, Wallace SE, Bean LJH, Gripp KW, Amemiya A, editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993–2022
- ↑ Eintrag zu Methylmalonazidämie mit Homocystinurie Typ cbl C. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ David Coelho, Terttu Suormala, Martin Stucki, Jordan P. Lerner-Ellis, David S. Rosenblatt, Robert F. Newbold, Matthias R. Baumgartner, Brian Fowler: Gene Identification for the cblD Defect of Vitamin B 12 Metabolism. In: New England Journal of Medicine. Band 358, Nr. 14, 3. April 2008, ISSN 0028-4793, S. 1454–1464, doi:10.1056/NEJMoa072200.
- ↑ a b Eintrag zu Methylmalonazidämie mit Homocystinurie Typ cbl D. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ a b Eintrag zu Mitochondriales DNA-Depletionssyndrom, enzephalomyopathische Form mit Methylmalonazidurie. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 11. Mai 2024.
- ↑ Eintrag zu Fatale infantile Laktatazidose mit Methylmalonazidurie. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 11. Mai 2024.
- ↑ a b Eintrag zu Transcobalamin II-Mangel. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 29. April 2024.
- ↑ Marilyn C. Higginbottom, Lawrence Sweetman, William L. Nyhan: A Syndrome of Methylmalonic Aciduria, Homocystinuria, Megaloblastic Anemia and Neurologic Abnormalities in a Vitamin B 12 -Deficient Breast-Fed Infant of a Strict Vegetarian. In: New England Journal of Medicine. Band 299, Nr. 7, 17. August 1978, ISSN 0028-4793, S. 317–323, doi:10.1056/NEJM197808172990701, PMID 683264.
- ↑ Vitamin B12 deficiency - The methylmalonic aciduria connection. In: The Biology Project. Department of Biochemistry and Molecular Biophysics, The University of Arizona, 31. Januar 2000, abgerufen am 29. Mai 2024 (englisch).
- ↑ a b c d Matthias R Baumgartner, Friederike Hörster, Carlo Dionisi-Vici, Goknur Haliloglu, Daniela Karall, Kimberly A Chapman, Martina Huemer, Michel Hochuli, Murielle Assoun, Diana Ballhausen, Alberto Burlina, Brian Fowler, Sarah C Grünert, Stephanie Grünewald, Tomas Honzik, Begoña Merinero, Celia Pérez-Cerdá, Sabine Scholl-Bürgi, Flemming Skovby, Frits Wijburg, Anita MacDonald, Diego Martinelli, Jörn Oliver Sass, Vassili Valayannopoulos, Anupam Chakrapani: Proposed guidelines for the diagnosis and management of methylmalonic and propionic acidemia. In: Orphanet Journal of Rare Diseases. Band 9, Nr. 1, Dezember 2014, ISSN 1750-1172, doi:10.1186/s13023-014-0130-8, PMID 25205257, PMC 4180313 (freier Volltext).
- ↑ a b c d Kumbham P, Mandava P, Zweifler RM, Kent TA, Nelson Jr SL, Gerstein BY: Methylmalonic Acidemia. 19. September 2022 (medscape.com).
- ↑ NHGRI researchers serve up mysterious disease diagnosis - three ways. National Human Genome Research Institute, abgerufen am 28. April 2024 (englisch).
- ↑ Marie Cosette Gabriel, Stephanie M. Rice, Jennifer L. Sloan, Matthew H. Mossayebi, Charles P. Venditti, Huda B. Al‐Kouatly: Considerations of expanded carrier screening: Lessons learned from combined malonic and methylmalonic aciduria. In: Molecular Genetics & Genomic Medicine. Band 9, Nr. 4, April 2021, ISSN 2324-9269, doi:10.1002/mgg3.1621, PMID 33625768, PMC 8123733 (freier Volltext).
- ↑ a b Zeinab Wehbe, Sidney Behringer, Khaled Alatibi, David Watkins, David Rosenblatt, Ute Spiekerkoetter, Sara Tucci: The emerging role of the mitochondrial fatty-acid synthase (mtFASII) in the regulation of energy metabolism. In: Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. Band 1864, Nr. 11, November 2019, S. 1629–1643, doi:10.1016/j.bbalip.2019.07.012.
- ↑ METHYLMALONYL-CoA EPIMERASE DEFICIENCY. In: Online Mendelian Inheritance in Man. Johns Hopkins University, abgerufen am 4. Mai 2024 (englisch).
- ↑ Kimberly G Lee. "Newborn screening tests". MedlinePlus Medical Encyclopedia. Division of Neonatology, Medical University of South Carolina. Abgerufen am 26. April 2016.
- ↑ Newborn Screening Process. Health Resources and Services Administration, abgerufen am 11. Mai 2024 (englisch).
- ↑ Manoli, I: Organic acidurias – I. (PDF) In: Society for Inherited Metabolic Disorders. 15. September 2023, abgerufen am 27. Mai 2024.
- ↑ a b Monique G. M. de Sain-van der Velden, Maria van der Ham, Judith J. Jans, Gepke Visser, Hubertus C. M. T. Prinsen, Nanda M. Verhoeven-Duif, Koen L. I. van Gassen, Peter M. van Hasselt: A New Approach for Fast Metabolic Diagnostics in CMAMMA. In: JIMD Reports. Band 30. Springer Berlin Heidelberg, Berlin, Heidelberg 2016, ISBN 978-3-662-53680-3, S. 15–22, doi:10.1007/8904_2016_531, PMID 26915364, PMC 5110436 (freier Volltext).
- ↑ M Dewit, I Decoo, E Verbeek, R Schot, G Schoonderwoerd, M Duran, J Deklerk, J Huijmans, M Lequin, F Verheijen: Brain abnormalities in a case of malonyl-CoA decarboxylase deficiency. In: Molecular Genetics and Metabolism. Band 87, Nr. 2, Februar 2006, S. 102–106, doi:10.1016/j.ymgme.2005.09.009.
- ↑ a b c B. Fowler, J. V. Leonard, M. R. Baumgartner: Causes of and diagnostic approach to methylmalonic acidurias. In: Journal of Inherited Metabolic Disease. Band 31, Nr. 3, Juni 2008, ISSN 0141-8955, S. 350–360, doi:10.1007/s10545-008-0839-4.
- ↑ Katarína Brennerová, Martina Škopková, Mária Ostrožlíková, Jana Šaligová, Juraj Staník, Vladimír Bzdúch, Daniela Gašperíková: Genetic testing is necessary for correct diagnosis and treatment in patients with isolated methylmalonic aciduria: a case report. In: BMC Pediatrics. Band 21, Nr. 1, Dezember 2021, ISSN 1471-2431, doi:10.1186/s12887-021-03067-3, PMID 34915869, PMC 8675494 (freier Volltext).
- ↑ J.C. Linnell, D.M. Matthews, J.M. England: THERAPEUTIC MISUSE OF CYANOCOBALAMIN. In: The Lancet. Band 312, Nr. 8098, November 1978, S. 1053–1054, doi:10.1016/S0140-6736(78)92379-6.
- ↑ Eintrag zu Methylmalonazidämie, Vitamin B12-resistente, Typ mut-. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 18. Februar 2024.
- ↑ Eintrag zu Methylmalonazidämie, Vitamin B12-resistente, Typ mut0. In: Orphanet (Datenbank für seltene Krankheiten), abgerufen am 18. Februar 2024.
- ↑ a b c d Methylmalonic Aciduria due to Methylmalonyl-CoA Mutase deficiency. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Ding An, Jessica L. Schneller, Andrea Frassetto, Shi Liang, Xuling Zhu, Ji-Sun Park, Matt Theisen, Sue-Jean Hong, Jenny Zhou, Raj Rajendran, Becca Levy, Rebecca Howell, Gilles Besin, Vladimir Presnyak, Staci Sabnis, Kerry E. Murphy-Benenato, E. Sathyajith Kumarasinghe, Timothy Salerno, Cosmin Mihai, Christine M. Lukacs, Randy J. Chandler, Lin T. Guey, Charles P. Venditti, Paolo G.V. Martini: Systemic Messenger RNA Therapy as a Treatment for Methylmalonic Acidemia. In: Cell Reports. Band 21, Nr. 12, Dezember 2017, S. 3548–3558, PMID 29262333, PMC 9667413 (freier Volltext) – (DOI=10.1016/j.celrep.2017.11.081).
- ↑ Paolo G.V. Martini, Lin T. Guey: A New Era for Rare Genetic Diseases: Messenger RNA Therapy. In: Human Gene Therapy. Band 30, Nr. 10, 1. Oktober 2019, ISSN 1043-0342, S. 1180–1189, doi:10.1089/hum.2019.090 (liebertpub.com).
- ↑ A Clinical Trial of a Methylmalonic Acidemia (MMA) Due to MUT Deficiency Treatment for Children and Adults. Abgerufen am 8. Februar 2024.
- ↑ Study of HST5040 in Subjects With Propionic or Methylmalonic Acidemia (HERO). In: ClinicalTrials.gov. Abgerufen am 26. Mai 2024 (englisch).
- ↑ a b Allison J. Armstrong, Maria Sol Collado, Brad R. Henke, Matthew W. Olson, Stephen A. Hoang, Christin A. Hamilton, Taylor D. Pourtaheri, Kimberly A. Chapman, Marshall M. Summar, Brian A. Johns, Brian R. Wamhoff, John E. Reardon, Robert A. Figler: A novel small molecule approach for the treatment of propionic and methylmalonic acidemias. In: Molecular Genetics and Metabolism. Band 133, Nr. 1, Mai 2021, S. 71–82, doi:10.1016/j.ymgme.2021.03.001, PMID 33741272, PMC 9109253 (freier Volltext).
- ↑ HST5040 Overview. (PDF) HemoShear Therapeutics, abgerufen am 26. Mai 2024 (englisch).
- ↑ A First in Human, Dose Escalation Study to Evaluate the Safety and Tolerability of BBP-671 in Healthy Volunteers and Patients With Propionic Acidemia or Methylmalonic Acidemia. In: ClinicalTrials.gov. Abgerufen am 26. Mai 2024 (englisch).
- ↑ Chitra Subramanian, Matthew W. Frank, Rajaa Sukhun, Christopher E. Henry, Anna Wade, Mallory E. Harden, Satish Rao, Rajendra Tangallapally, Mi-Kyung Yun, Stephen W. White, Richard E. Lee, Uma Sinha, Charles O. Rock, Suzanne Jackowski: Pantothenate Kinase Activation Restores Brain Coenzyme A in a Mouse Model of Pantothenate Kinase-Associated Neurodegeneration. In: Journal of Pharmacology and Experimental Therapeutics. Band 388, Nr. 1, Januar 2024, ISSN 0022-3565, S. 171–180, doi:10.1124/jpet.123.001919.
- ↑ V. G. Oberholzer, B. Levin, E. A. Burgess, W. F. Young: Methylmalonic aciduria. An inborn error of metabolism leading to chronic metabolic acidosis. In: Archives of Disease in Childhood. Band 42, Nr. 225, 1. Oktober 1967, ISSN 0003-9888, S. 492–504, doi:10.1136/adc.42.225.492, PMID 6061291, PMC 2019805 (freier Volltext).
- ↑ a b c Lianshu Han, Shengnan Wu, Feng Han, Xuefan Gu: Insights into the molecular mechanisms of methylmalonic acidemia using microarray technology. In: International Journal of Clinical and Experimental Medicine. Band 8, Nr. 6, 15. Juni 2015, ISSN 1940-5901, S. 8866–8879, PMID 26309541, PMC 4538064 (freier Volltext).
- ↑ Randy J. Chandler, Patricia M. Zerfas, Sara Shanske, Jennifer Sloan, Victoria Hoffmann, Salvatore DiMauro, Charles P. Venditti: Mitochondrial dysfunction in mut methylmalonic acidemia. In: The FASEB Journal. Band 23, Nr. 4, April 2009, ISSN 0892-6638, S. 1252–1261, doi:10.1096/fj.08-121848, PMID 19088183, PMC 2660647 (freier Volltext).
- ↑ a b c Hunter R Underhill, Si Houn Hahn, Susan L Hale, J Lawrence Merritt: Asymptomatic methylmalonic acidemia in a homozygous MUT mutation (p. P86L ). In: Pediatrics International. Band 55, Nr. 6, Dezember 2013, ISSN 1328-8067, doi:10.1111/ped.12195.