Threonin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Strukturformel von L-Threonin, dem natürlich vorkommenden Isomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Threonin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C4H9NO3 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit charakteristischem Geruch[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 119,12 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,07 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Threonin, abgekürzt Thr oder T, ist in seiner natürlichen L-Form eine essentielle proteinogene α-Aminosäure.
Im Threonin findet sich am β-Kohlenstoffatom (= 3-Position) eine Hydroxygruppe; es kann auch als 3-Methyl-Serin oder 3-hydroxyliertes Desmethyl-Valin betrachtet werden. Aufgrund der Hydroxygruppe ist Threonin wesentlich polarer und reaktiver als Valin.
Threonin wird zu den polaren Aminosäuren gezählt. Es kann an seiner Hydroxygruppe phosphoryliert werden, was bei der Regulation von Enzymen eine Rolle spielen kann.
Stereochemie[Bearbeiten | Quelltext bearbeiten]
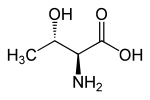
Threonin hat zwei stereogene Zentren an den Kohlenstoffatomen in 2- und 3-Position. Daher gibt es vier Stereoisomere des Threonins mit folgenden absoluten Konfigurationen: (2S,3R), (2R,3S), (2S,3S) und (2R,3R). Das in den Proteinen gebunden enthaltene L-Threonin besitzt (2S,3R)-Konfiguration und wird auch (2S,3R)-2-Amino-3-hydroxy-butansäure (Bezeichnung gemäß der IUPAC-Nomenklatur) genannt. Die anderen drei Stereoisomere [(2R,3S)-Threonin, (2S,3S)-allo-Threonin und (2R,3R)-allo-Threonin] des L-Threonins besitzen nur geringe Bedeutung.
Wenn von „Threonin“ ohne weiteren Namenszusatz (Präfix) gesprochen wird, ist gemeinhin L-Threonin gemeint.
| Isomere von Threonin | ||||
| Name | L-Threonin | D-Threonin | L-allo-Threonin | D-allo-Threonin |
| Andere Namen | (2S,3R)-2-Amino-3-hydroxybutansäure | (2R,3S)-2-Amino-3-hydroxybutansäure | (2S,3S)-allo-2-Amino-3-hydroxybutansäure | (2R,3R)-allo-2-Amino-3-hydroxybutansäure |
| Strukturformel |  |
 |
 |

|
| CAS-Nummer | 72-19-5 | 632-20-2 | 28954-12-3 | 24830-94-2 |
| 80-68-2 (unspez.) | ||||
| EG-Nummer | 200-774-1 | 211-171-8 | 249-327-2 | 246-488-0 |
| 201-300-6 (unspez.) | ||||
| ECHA-Infocard | 100.000.704 | 100.010.157 | 100.044.829 | 100.042.247 |
| 100.001.183 (unspez.) | ||||
| PubChem | 6288 | 69435 | 99289 | 90624 |
| 205 (unspez.) | ||||
| DrugBank | DB00156 | DB03700 | − | − |
| − (unspez.) | ||||
| FL-Nummer | 17.021 (unspez.) | |||
| Wikidata | Q186521 | Q44073885 | Q27103859 | Q27094610 |
| Q27117433 (unspez.) | ||||
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Threonin ist Bestandteil von tierischen und pflanzlichen Proteinen. Der Tagesbedarf für Erwachsene wird mit etwa 16 mg pro kg Körpergewicht angenommen.[8] Die folgenden Beispiele für den Gehalt an Threonin beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil am Gesamtprotein angegeben.[9]
| Lebensmittel | Protein | Threonin | Anteil |
|---|---|---|---|
| Rindfleisch, roh | 21,26 g | 849 mg | 4,0 % |
| Hähnchenbrustfilet, roh | 23,09 g | 975 mg | 4,2 % |
| Lachs, roh | 20,42 g | 860 mg | 4,2 % |
| Hühnerei | 12,58 g | 556 mg | 4,4 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 148 mg | 4,5 % |
| Walnüsse | 15,23 g | 596 mg | 3,9 % |
| Weizen-Vollkornmehl | 13,70 g | 395 mg | 2,9 % |
| Mais-Vollkornmehl | 6,93 g | 261 mg | 3,8 % |
| Reis, ungeschält | 7,94 g | 291 mg | 3,7 % |
| Erbsen, getrocknet | 24,55 g | 872 mg | 3,6 % |
Alle diese Nahrungsmittel enthalten L-Threonin chemisch gebunden als Proteinbestandteil, nur ausnahmsweise freies L-Threonin. In Fischen sind die Anti-Frost-Proteine fast ausschließlich aus L-Threonin und L-Alanin aufgebaut.[10]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Der amerikanische Biochemiker William Cumming Rose beschäftigte sich während seiner wissenschaftlichen Laufbahn intensiv mit der Bedeutung von Aminosäuren für die Ernährung.[11] Bei Versuchen an Ratten in den 1930er Jahren musste er feststellen, dass die Fütterung mit den bis dahin bekannten 19 Aminosäuren nicht für ein Wachstum der Ratten ausreichte.[12] Daraufhin suchte er systematisch nach einer weiteren essentiellen Aminosäure; schließlich konnte er sie aus Fibrin isolieren und ihrer Struktur nach identifizieren.[13] Mit dieser als Threonin bezeichneten Aminosäure war damit die letzte der kanonischen proteinogenen Aminosäuren entdeckt. Der Name Threonin wurde aufgrund der Threose-Grundstruktur dieser Aminosäure gewählt.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Die hier angegebenen Daten beziehen sich nur auf L-Threonin und D-Threonin.
- Restname: Threonyl
- Seitenkette: hydrophil
- isoelektrischer Punkt: 5,64[14]
- Van-der-Waals-Volumen: 93
- Lipidlöslichkeit: log KOW = −0,7
Biosynthese[Bearbeiten | Quelltext bearbeiten]
Da L-Threonin zu den essentiellen Aminosäuren gehört, muss L-Threonin mit der Nahrung durch L-Threonin-haltige Proteine aufgenommen werden. In Pflanzen und Mikroorganismen beginnt die Biosynthese des L-Threonins ausgehend vom L-Aspartat, dessen Ursprünge (Oxalacetat) dem Citratcyclus entstammen. Das L-Aspartat wird über zwei Zwischenstufen, mittels entsprechender Enzyme (Aspartatkinase, Aspartatsemialdehyd-Dehydrogenase, Homoserindehydrogenase) zum L-Homoserin umgesetzt. In einem weiteren Schritt wird der primäre Alkohol vom L-Homoserin von einer Homoserinkinase phosphoryliert. Dieses Phosphohomoserin wird im letzten Schritt von der Homoserinphosphat-Mutaphosphatase (PLP) zum L-Threonin umgesetzt.
Abbau[Bearbeiten | Quelltext bearbeiten]
Für Abbau inklusive Strukturformeln siehe Abschnitt Weblinks
L-Threonin wird entweder zu Acetaldehyd sowie Glycin abgebaut, was von der Threonin-Aldolase (EC 4.1.2.5) katalysiert wird. Die Aminosäure kann aber auch zu Propionyl-CoA umgesetzt werden.
Stoffwechselkrankheiten[Bearbeiten | Quelltext bearbeiten]
Der Abbau von Threonin ist bei den folgenden Stoffwechselkrankheiten gestört:
Herstellung[Bearbeiten | Quelltext bearbeiten]
L-Threonin kann nach der Extraktionsmethode mit Hilfe von Ionenaustauschern aus Protein-Hydrolysaten gewonnen werden. Vorwiegend wird L-Threonin heute jedoch durch Fermentation hergestellt.
Verwendung[Bearbeiten | Quelltext bearbeiten]
Als Bestandteil von Aminosäure-Infusionslösungen [Aminoplasmal® (D), Aminosteril®-N-Hepa (D), Primene® (A)] zur parenteralen Ernährung findet L-Threonin, neben anderen Aminosäuren, breite Anwendung in der Humanmedizin. Für Patienten mit gestörter Verdauung wurde eine oral anzuwendende „chemisch definierte Diät“ entwickelt, die L-Threonin enthält. In dieser Diät bilden die Aminosäuren die Stickstoffquelle; alle lebensnotwendigen Nährstoffe liegen in chemisch genau definierter Form vor.[15]
Viele Getreidesorten weisen einen zu geringen Gehalt einer essentiellen Aminosäure auf. Durch diesen Mangel an nur einer Aminosäure sinkt die Verwertbarkeit aller aufgenommenen Aminosäuren auf den durch die in zu geringer Menge enthaltene essentielle Aminosäure („limitierende Aminosäure“)[15] bestimmten Wert. Man steigert den Nährwert des Getreides dann durch den gezielten Zusatz geringer Mengen jener essentieller Aminosäuren, die darin defizitär sind. Mit Ausnahme von Mais enthalten die meisten Getreidearten weniger L-Threonin als von den Nutztieren benötigt wird. Der Zusatz von L-Threonin zu Mischfutter ist in der Futtermittel-Industrie verbreitet und schont so natürliche Ressourcen.
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu THREONINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ Datenblatt Threonin bei Merck, abgerufen am 25. Dezember 2019.
- ↑ a b c d Eintrag zu Threonin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. November 2022. (JavaScript erforderlich)
- ↑ a b Datenblatt L-Threonine, 98+% bei Alfa Aesar, abgerufen am 25. Dezember 2019 (Seite nicht mehr abrufbar).
- ↑ a b c Carl S. Vestling, Donald T. Warner: The isoelectric points of threonine and some related compounds. In: Journal of Biological Chemistry. Band 144, Nr. 3, 1942, S. 687–690 (englisch, jbc.org [PDF]).
- ↑ Eintrag zu L-Threonin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ Datenblatt Threonin bei Sigma-Aldrich, abgerufen am 17. Oktober 2016 (PDF).
- ↑ D. H. Baker: Tolerance for branched-chain amino acids in experimental animals and humans, in: J. Nutr., 2005, Bd. 135 (6), S. 1585S–1590S; PMID 15930474.
- ↑ Nährstoffdatenbank des US-Landwirtschaftsministeriums, 21. Auflage.
- ↑ G. C. Barrett: Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, London, New York, 1985, S. 11, ISBN 0-412-23410-6.
- ↑ S. Hansen: Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois. (Memento vom 15. Juni 2016 im Internet Archive) Berlin 2015.
- ↑ W. C. Rose, Feeding experiments with mixtures of highly purified amino acids: I. The inadequacy of diets containing nineteen amino acids, J Biol Chem, Band 94, S. 155ff (1931)
- ↑ W. C. Rose, R. H. McCoy und C. E. Meyer, Feeding experiments with mixtures of highly purified amino acides: VIII. Isolation and identification of a new essential amino acid, J Biol Chem, Band 112, S. 283ff. (1935).
- ↑ Bernd Hoppe und Jürgen Martens: Aminosäuren – Herstellung und Gewinnung, in: Chemie in unserer Zeit, 1984, Bd. 18, S. 73–86; doi:10.1002/ciuz.19840180302.
- ↑ a b Yoshiharu Izumi, Ichiro Chibata, Tamio Itoh: Herstellung und Verwendung von Aminosäuren, in: Angewandte Chemie (Zeitschrift), 1978, 90 (3), S. 187–194; doi:10.1002/ange.19780900307.