Mifepriston
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
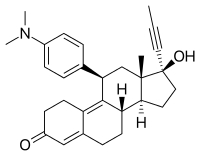
| Freiname | Mifepriston | |||||||||||||||||||||
| Andere Namen |
17β-Hydroxy-11β-(4-dimethylamino-phenyl)-17α-(1-propinyl)estra-4,9-dien-3-on | |||||||||||||||||||||
| Summenformel | C29H35NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse |
| |||||||||||||||||||||
| Wirkmechanismus |
Antagonist am Progesteron-Rezeptor, wodurch es zur Degeneration der Uterusschleimhaut und zur Störung der Plazentafunktion kommt[2] | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 429,60 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Mifepriston ist eine künstlich hergestellte organische chemische Verbindung, die Wirkung als Progesteron- und Glukokortikoid-Rezeptorantagonist[3] zeigt. Es hemmt die Wirkung des Gestagens Progesteron dadurch, dass es eine fünfmal höhere Affinität für die Rezeptoren dieses Hormons hat, aber keine Wirkung am Rezeptor auslöst. Außerdem blockiert es die Rezeptoren für Glukokortikoide durch eine dreifach höhere Affinität gegenüber Dexamethason. In der Gynäkologie findet Mifepriston in Kombination mit den Prostaglandinen Gemeprost oder Misoprostol Verwendung bei der Herbeiführung eines Schwangerschaftsabbruchs. Es ist der Wirkstoff der ersten sogenannten Abtreibungspille RU-486, die inzwischen unter dem Namen Mifegyne vertrieben wird. Mifepriston wird auch als Langzeittherapeutikum des Hyperkortisolismus im Rahmen eines Cushing-Syndroms verwendet.
Anwendungsgebiete[Bearbeiten | Quelltext bearbeiten]
Schwangerschaftsabbruch[Bearbeiten | Quelltext bearbeiten]
Mifepriston ist der Wirkstoff in der „Abtreibungspille“ (Handelsname: Mifegyne). Mifepriston ist eine kostengünstige Alternative zum gynäkologischen Eingriff und für die betroffenen Frauen mit weniger gesundheitlichen Risiken verbunden, besonders in ärmeren Ländern (z. B. Infektion).
Die Abtreibungspille ist nicht mit der Pille danach zu verwechseln, bei der es sich um kein Abtreibungspräparat, sondern um ein Mittel zur postkoitalen Empfängnisverhütung handelt.
Die Einnahme von Mifepriston in der Schwangerschaft führt innerhalb von 48 Stunden zum Öffnen des Muttermundes und zur Ablösung der Gebärmutterschleimhaut. Nach 36 bis 48 Stunden wendet die Schwangere ein Prostaglandin an, beispielsweise Gemeprost oder Misoprostol. Die Prostaglandintabletten werden entweder eingenommen oder in die Scheide eingeführt. Dies bewirkt, dass sich die Gebärmutter zusammenzieht, es wird ein künstlicher Abort ausgelöst und die Frucht wird ausgestoßen. Mifepriston ist während der ganzen Schwangerschaft wirksam, hat laut Studien jedoch die höchste Erfolgsrate bei der Einnahme vor dem 49. Tag. Die Wirkung auf den Muttermund ist auch bei nicht schwangeren Frauen gegeben und wird vor bestimmten gynäkologischen Eingriffen genutzt.
Cushing-Syndrom[Bearbeiten | Quelltext bearbeiten]
In der Behandlung des Cushing-Syndroms soll Mifepriston als Glucocorticoid-Rezeptorantagonist wirken. Die Blockade des Rezeptors unterdrückt die Anbindung des natürlichen Liganden Cortisol und infolgedessen auch seine Wirkung.
Außerdem wird es zur Behandlung einer (sekundären) Hyperglykämie verwendet, wenn der erhöhte Blutzuckerspiegel durch hohe Cortisolspiegel im Blut (Hyperkortisolismus) verursacht wird. Dies tritt im Rahmen eines endogenen Cushing-Syndroms auf.[4][5]
Jedoch werden durch diese Behandlung lediglich Symptome gelindert, da die eigentliche Ursache der Krankheit primär chirurgisch behandelt wird. 2012 wurde der Wirkstoff unter dem Präparatenenamen Korlym von der FDA zugelassen zur Behandlung von Patienten, bei denen keine Operation möglich oder diese nicht ausreichend ist.[6]
Entwicklung und späte Zulassung[Bearbeiten | Quelltext bearbeiten]
Ab 1980 wurde RU-486 vom Pharmalabor Roussel Uclaf (RU; heute Teil von Sanofi-Aventis) gegen erhebliche Widerstände der Hoechst AG, die 1974 56 % des zweitgrößten französischen Pharmakonzerns erworben hatte, entwickelt. Bereits vor der Zulassung erregte es Aufsehen – Teile der Frauenbewegung begrüßten die Entwicklung des Wirkstoffes, Abtreibungsgegner liefen Sturm dagegen. Zunächst bewilligte Claude Evin, Frankreichs Minister für Solidarität, Gesundheit und sozialen Schutz, am 23. September 1988 den Einsatz von Mifepriston in den rund 800 Abtreibungskliniken des Landes. Einen Monat nach Markteinführung zog es der Vorstand aus politischen Gründen (Reaktionen aus religiösen Kreisen) zurück und erst auf Anordnung des Gesundheitsministers (36,25 % gehörten dem Staat) wurde es wieder begrenzt erhältlich. Selbst zur Forschung nach weiteren Indikationen wurde Mifepriston weltweit fast nicht abgegeben. In Deutschland weigerte sich die Hoechst AG beharrlich, eine Zulassung ihres Wirkstoffes zu beantragen, und trug u. a. vor, dass sie einen Boykott ihrer Produkte befürchte.
1997 übertrug Hoechst die Rechte an dem Wirkstoff unentgeltlich an den ehemaligen RU-Vorstand und Erfinder Edouard Sakiz. 1998 erfolgte die Zulassung in Großbritannien und Schweden.[7] In Deutschland wurde Mifepriston am 22. November 1999 zugelassen.[8] Die Schweiz und andere europäische Länder folgten, die USA im September 2000.
Die Einnahme für den Schwangerschaftsabbruch wurde ursprünglich bis zur 7. Schwangerschaftswoche (49. Tag) nach Beginn der letzten Menstruation zugelassen, in Großbritannien und Schweden bis zum 63. Tag. 2007 ordnete die EU-Kommission den Mitgliedsstaaten eine Zulassungsänderung an, mit der das Anwendungsgebiet auf den Schwangerschaftsabbruch bis zur 9. Woche (63. Tag) – bei anschließender Verwendung eines Prostaglandinanalogs – EU-weit vereinheitlicht wurde.[9] In der Schweiz gilt die Zulassung immer noch bis zum 49. Tag. Für medizinisch notwendige Abbrüche ist Mifepriston auch später in der Schwangerschaft zugelassen und derzeit (in Kombination mit Misoprostol) die effizienteste Methode. Es gibt jedoch viele sogenannte Off-Label-Anwendungen: bis zur 12. Woche, andere Dosierung, andere Indikationen wie Endometriose (Wucherung der Gebärmutterschleimhaut) oder als Pille danach.
Nach § 47a des deutschen Arzneimittelgesetzes darf dieses Arzneimittel nur direkt an bestimmte Einrichtungen, in denen Schwangerschaftsabbrüche vorgenommen werden, und nur auf Verschreibung eines dort behandelnden Arztes abgegeben werden. Es darf nicht über die Apotheke in Verkehr gebracht werden. In Österreich darf Mifepriston seit Juli 2020 auch von niedergelassenen Frauenärzten zum Zweck des Schwangerschaftsabbruchs abgegeben werden.[10]
Synthese[Bearbeiten | Quelltext bearbeiten]
Die Synthese beginnt bei 3,3-(Ethylendioxy)estra-5(10),9(11)-dien-17β-on (I) und startet mit einer Grignard-Reaktion. Hierzu wird zunächst 1-Brompropin mit Magnesium zu 1-Propinylmagnesiumbromid (II) umgesetzt. Die Reaktion verläuft unter Tetrahydrofuran als Lösemittel. Die Grignard-Reaktion verläuft am Carbonylkohlenstoff der Ketogruppe. Nach dem gebildeten Grignard-Komplex wird mit Wasser und Säure aufgearbeitet, sodass sich eine Hydroxygruppe und eine Propinylgruppe bildet. Im nächsten Schritt wird 3,3-(Ethylendioxy)-17β-(propin-1-yl)estra-5(10),9(11)-dien-17β-ol (III) mit Wasserstoffperoxid zu einem Epoxid oxidiert. Es entsteht 3,3-(Ethylendioxy)-17β-(propin-1-yl)-5α,10α-epoxyestra-9(11)-en-17β-ol (IV). Es folgt eine weitere Grignard-Reaktion. Hierzu wird 4-Brom-N,N-dimethylanilin mit Magnesium zu 4-(N,N-Dimethyl)-anilin-magnesiumbromid (V) umgesetzt. Wieder wird der Ether Tetrahydrofuran zur wasserfreien Verarbeitung als Lösemittel eingesetzt. Dieses Mal wird die Grignard-Reaktion nicht an einer Carbonylgruppe durchgeführt, sondern an der noch bestehenden Doppelbindung von Verbindung (IV). Diese kann nach Binden des Dimethylaminophenyl-Rests umklappen, sodass das Epoxid aufgelöst wird. So entsteht 11β-(4-Dimethylaminophenyl)-3,3-(ethylendioxy)-17β-(propin-1-yl)estra-9-en-17β-ol (VI). Im letzten Schritt erfolgt mittels Salzsäure eine saure Hydrolyse eines Ketals. Hierzu wird eines der Sauerstoffatome des Ketals protoniert. Der Ring öffnet sich und die entstehende positive Ladung wird zunächst durch eine Doppelbindung ausgehend des gebundenen Sauerstoffs auf diesen verschoben. Durch Angriff des Wassers und eine Protonenübertragung spaltet sich Ethandiol ab. Nach Rückbildung des Katalysators entsteht ein Keton.[11]

Gegenanzeigen[Bearbeiten | Quelltext bearbeiten]
Bei Patienten mit Nierenversagen oder Leberversagen, chronischer Nierenschwäche, schwerem oder unzureichend behandeltem Asthma bronchiale sowie starkem Untergewicht ist die Behandlung mit dem Wirkstoff nicht erlaubt. Ab dem 64. Tag einer Schwangerschaft nach dem ersten Tag der letzten Regelblutung darf Mifepriston nicht mehr eingesetzt werden.
Nebenwirkungen[Bearbeiten | Quelltext bearbeiten]
Die meisten Nebenwirkungen sind nicht Mifepriston, sondern dem im Rahmen eines Schwangerschaftsabbruchs ebenso verabreichten Prostaglandin (z. B. Misoprostol) zuzuschreiben.
Als leichte Nebenwirkungen können Übelkeit, Erbrechen, Durchfall, Kopfschmerzen, Hitzewallungen auftreten. Häufig bewirken die Gebärmutter-Kontraktionen mehr oder weniger starke Schmerzen. Starke Blutungen treten in etwa 5 % der Fälle auf und können in bis zu 1,4 % der Fälle eine Kürettage erforderlich machen. Über Infektionen wurde bei weniger als 5 % der Frauen berichtet. Während der Einleitung eines Schwangerschaftsabbruchs im zweiten Trimester oder der Einleitung von Wehen wegen Tod des Fetus in utero während des dritten Trimesters wurde in seltenen Fällen eine Uterusruptur nach der Prostaglandin-Aufnahme berichtet. Das betraf insbesondere Mehrfachgebärende oder Patientinnen mit Kaiserschnitt-Narbe. Misserfolgsrate: 1,3 % bis 7,5 %. Eine teratogene Wirkung (Schädigung des Embryos) durch Mifepriston kann nicht völlig ausgeschlossen werden. Bei Misoprostol (Cytotec) wird sie angenommen. Deshalb wird Frauen in den ca. 1 % der Fälle, in welchen die Schwangerschaft sich weiter entwickelt, dringend ein chirurgischer Abbruch empfohlen.
Klage in Texas (USA)[Bearbeiten | Quelltext bearbeiten]
Am 24. Juni 2022 hob der Oberste Gerichtshof im Verfahren Dobbs v. Jackson Women’s Health Organization das Urteil Roe v. Wade auf; seitdem müssen die Legislativen der Bundesstaaten über die Legalität von Schwangerschaftsabbrüchen entscheiden (siehe Schwangerschaftsabbruch#Vereinigte Staaten).
Die American Medical Association, Amerikas größte Ärzte-Interessenvertretung, warnte im Februar 2023 vehement vor einem Verbot von Mifepriston. Bundesrichter Matthew J. Kacsmaryk, ein Bezirksrichter für den nördlichen Bezirk von Texas und nominiert vom damaligen US-Präsidenten Donald Trump, hatte über eine Klage gegen die Abtreibungspille Mifepriston zu entscheiden. Die „Alliance Defending Freedom“ (etwa Allianz zur Verteidigung der Freiheit) hatte diese Klage 2022 als Rechtsvertreter der „Alliance for Hippocratic Medicine“ eingereicht.[12] Am 7. April 2023 hob der Bundesrichter die vor mehr als 20 Jahren erteilte Zulassung für Mifepriston in den USA auf.[13] In einem anderen Gerichtsverfahren im Bundesstaat Washington, in dem 18 Justizminister der Demokraten die Aufhebung sämtlicher Beschränkungen fordern, wies wenige Stunden später der dortige, noch während der Regierungszeit von Präsident Barack Obama nominierte Bundesrichter Thomas O. Rice die FDA jedoch an, Mifepriston weiterhin verfügbar zu halten.[14][15]
Siehe auch[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt Mifepristone bei Sigma-Aldrich, abgerufen am 10. April 2011 (PDF).
- ↑ Mutschler, Geisslinger, Kroemer, Schäfer-Korting, Mutschler Arzneimittelwirkungen, 8. Auflage, 2001, ISBN 3-8047-1763-2.
- ↑ Mifepristone (RU486) von der FDA bei besonderen Fällen von Cushing-Syndrom zugelassen – Deutsche Gesellschaft für Endokrinologie.
- ↑ Wannachalee, T., Turcu, A. F., & Auchus, R. J. (2018). Mifepristone in the treatment of the ectopic adrenocorticotropic hormone syndrome. Clinical endocrinology, 89(5), 570-576. doi:10.1111/cen.13818 PMID 30019523
- ↑ Pivonello, R., De Martino, M. C., De Leo, M., Simeoli, C., & Colao, A. (2017). Cushing’s disease: the burden of illness. Endocrine, 56(1), 10-18 doi:10.1007/s12020-016-0984-8 PMID 27189147
- ↑ Mifepristone (RU486) von der FDA bei besonderen Fällen von Cushing-Syndrom zugelassen, Medizinische Kurznachrichten der Deutschen Gesellschaft für Endokrinologie (DGE), 6. März 2012.
- ↑ Hexal-Tochter vertreibt Mifegyne pharmazeutische-zeitung.de, abgerufen am 24. November 2018
- ↑ JETZT AUCH IN DEUTSCHLAND: MIFEPRISTON arznei-telegramm.de, am 19. November 1999, abgerufen am 24. November 2018
- ↑ Mifegyne (Wirkstoff Mifeproston): Die EU-Kommission beschließt Änderungen der Produktinformationen des Arzneimittels, BfArM 10. März 2008.
- ↑ "Abtreibungspille" Mifegyne wird in Österreich leichter zugänglich. In: Der Standard, 2. Juli 2020.
- ↑ G. Teutsch, T. Ojasoo, J. P. Raynaud: 11β-substituted steroids, an original pathway to antihormones. In: Journal of Steroid Biochemistry. Band 31, Nr. 4, 1988, S. 549–565, doi:10.1016/0022-4731(88)90006-4.
- ↑ Sofia Dreisbach, Washington: USA: Droht nach Klage das Ende der Abtreibungspille? In: faz.net. 13. März 2023 (faz.net [abgerufen am 20. März 2023]).
- ↑ Schwangerschaftsabbruch: US-Bundesrichter kippt Zulassung für meistbenutzte Abtreibungspille. Der Spiegel, 7. April 2023.
- ↑ Pam Belluck: Judge Invalidates F.D.A. Approval of the Abortion Pill Mifepristone. The New York Times, 7. April 2023.
- ↑ Oliver Kühn: US-Richter widersprechen sich : Der nächste Abtreibungsstreit für den Supreme Court? FAZ, 8. April 2023.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Die Abtreibungspille – Vergleich chirurgische Abtreibung und Abtreibungspille auf der Seite der Schweizerischen Vereinigung für Straflosigkeit des Schwangerschaftsabbruchs
- profamilia.de – Informationen bei pro familia