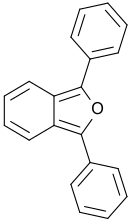
1,3-Diphenylisobenzofuran
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,3-Diphenylisobenzofuran | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C20H14O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 270,33 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
praktisch wasserunlöslich, löslich in vielen Lösungsmitteln, wie z. B. Acetonitril, Benzol, Dichlormethan, Chloroform, Dimethylsulfoxid, Tetrahydrofuran und Toluol[5] | |||||||||||||||
| Brechungsindex |
1,6700 bei 25 °C (589 nm)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
1,3-Diphenylisobenzofuran ist ein hochreaktives Dien, das auch instabile und kurzlebige Dienophile in einer Diels-Alder-Reaktion abfangen kann und als Standardreagenz[6] zur Bestimmung von Singulett-Sauerstoff[7] – auch in biologischen Systemen[8] – Verwendung findet.
Cycloadditionen mit 1,3-Diphenylisobenzofuran mit nachfolgender Sauerstoffabspaltung eröffnen den Zugang zu einer Vielzahl von Polyaromaten.
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die erste Synthese von 1,3-Diphenylisobenzofuran wurde 1905 von A. Guyot und J. Catel berichtet.[9][10] Durch Reaktion von Phenylmagnesiumbromid mit 3-Phenylphthalid (z. B. aus dem Methylester von 3-Hydroxyphthalid mit Phenylboronsäure in 95%iger Ausbeute[11]) entsteht ein Lactol, das mit Mineralsäuren unter Wasserabspaltung 1,3-Diphenylisobenzofuran in 87%iger Ausbeute liefert.[12]

In der Patentliteratur ist die Darstellung von 1,3-Diphenylisobenzofuran durch [4+2]-Cycloaddition von 1,3-Butadien und Dibenzoylethylen (1,4-Diphenyl-2-buten-1,4-dion, aus Fumaroylchlorid und Benzol in Gegenwart von Aluminiumchlorid[13]) beschrieben.[14] Das überwiegend in der trans-Konfiguration vorliegende Dibenzoylethylen[15] wird beim Erhitzen in die zur Addition erforderliche cis-Konfiguration überführt.[16]

Das entstandene 4,5-Dibenzoylcyclohexen wird mit Acetanhydrid zum Dihydroisobenzofuran cyclisiert, das wiederum durch Brom-Addition und Bromwasserstoff-Eliminierung zum 1,2-Dibenzoylbenzol geöffnet und mit Zink-Essigsäure zum Endprodukt 1,3-Diphenylisobenzofuran cyclisiert wird.[17] Eine Veröffentlichung aus dem Jahr 1940 beschreibt hohe Ausbeuten auf den einzelnen Stufen der langen Reaktionsfolge.[4]
Phthaloylchlorid ist ein wesentlich preisgünstigeres Ausgangsmaterial für 1,2-Dibenzoylbenzol durch Friedel-Crafts-Acylierung mit Benzol[18], das durch Kaliumborhydrid in 78%iger Ausbeute zu 1,3-DPBF reduziert wird.[19]

Weniger umständlich und mit besseren Ausbeuten können 1,3-Diarylisobenzofurane aus 2-Acylbenzaldehyden und Boronsäuren[20]

oder aus Salicylaldehyden über Phenacylhydrazone, deren Oxidation mit Blei(IV)-acetat zu ortho-Diketonen[21] und anschließende Umsetzung mit einer Aryl-Grignardverbindung erhalten werden.[22]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]

1,3-Diphenylisobenzofuran ist ein gelber, licht- und luftempfindlicher, kristalliner und in vielen organischen Lösungsmitteln löslicher Feststoff mit einer maximalen Absorption in Lösung um 420 nm, die eine intensive Fluoreszenz erzeugt.[23] Wegen der Stabilität von 1,3-DPBF in DMF und DMSO können Fluoreszenzmessungen in diesen Lösungsmitteln durchgeführt werden, während das gelöste Isobenzofuran auch in Abwesenheit von Sauerstoff in CHCl3 und CCl4 rasch durch Angriff von CHCl2- bzw. CCl3-Radikalen photolysiert wird.[24]
1,3-Diphenylisobenzofuran bildet in Ethanol eine orange-gelbe, fluoreszierende Lösung, die bei Bestrahlung unter Sauerstoffausschluss durch Bildung eines farblose Kristalle bildenden Photodimeren in eine farblose, nicht-fluoreszierende Lösung übergeht.[25]

Verwendung[Bearbeiten | Quelltext bearbeiten]
Reagenz zur Bestimmung von Singulett-Sauerstoff[Bearbeiten | Quelltext bearbeiten]
In Anwesenheit von mit rotem Laserlicht bestrahlten Methylenblau reagiert 1,3-Diphenylisobenzofuran mit intermediär gebildeten Singulett-Sauerstoff 1O2 zu einem instabilen Peroxid, das in (farbloses) 1,2-Dibenzoylbenzol zerfällt.[26]
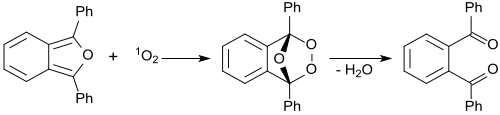
Auf dieser Reaktion beruht der Nachweis von Singulett-Sauerstoff durch 1,3-Diphenylisobenzofuran, auch in biologischen Systemen. Dazu wurden auch wasserlösliche Derivate des 1,3-DPBF als 1O2-Fänger entwickelt.[27]
Dienophil in Diels-Alder-Reaktionen[Bearbeiten | Quelltext bearbeiten]
Isobenzofurane, wie das 1,3-Diphenylisobenzofuran, gehören zu den reaktivsten Diels-Alder-Dienen, die derzeit bekannt sind[28] und eignen sich für Abfangreaktionen kurzlebiger und instabiler Olefine und Alkine. Dazu leistete die Arbeitsgruppe um Georg Wittig wichtige Beiträge.
Mit dem wenig stabilen Cyclohexin reagiert 1,3-DPBF zu einem tricyclischen Addukt, das nach Hydrierung und Wasserstoffabspaltung ein 9,10-Diphenylcyclohexenonaphthalin bildet.[29]

Mit Arin (Dehydrobenzol) entsteht analog in 85%iger Ausbeute ein sauerstoffverbrücktes Anthracen, das mit Zink zum 9,10-Diphenylanthracen (88 % Ausbeute) reduziert werden kann.[30]

Das bei Temperaturen oberhalb seines Schmelzpunkts (−29 °C) instabile Cyclopropenon reagiert bei Raumtemperatur mit 1,3-Diphenylisobenzofuran quantitativ zu einem Diels-Alder-Addukt,[31]) das ausschließlich als exo-Isomer vorliegt.[32]

Acetylendicarbonsäurediethylester als Dienophil reagiert mit 1,3-Diphenylisobenzofuran in 84%iger Ausbeute zum entsprechenden Addukt.[33]

Auch mit heterocyclischen Dienophilen, wie z. B. 3-Sulfolen bildet 1,3-Diphenylisobenzofuran das entsprechende Diels-Alder-Addukt.[34]
Molekülbaustein zum Aufbau von Polyaromaten[Bearbeiten | Quelltext bearbeiten]
Polyaromatische Kohlenwasserstoffe (PAK) sind in ihren Eigenschaften als Vorstufen für Graphit, aber insbesondere als Umweltschadstoffe mit ausgeprägter Persistenz und Kanzerogenität von hohem Interesse. 1,3-DPBF reagiert auch mit Acenaphthylen beim Erhitzen auf 160 °C quantitativ zu 7,12-Diphenylbenzo[k]fluoranthen.[35]

Die zweifache Diels-Alder-Reaktion von 1,3-DPBF mit p-Benzochinon liefert praktisch quantitativ ein Addukt, das mit p-Toluolsulfonsäure in 49%iger Ausbeute ein Pentacen-Derivat liefert.[36]

Literatur[Bearbeiten | Quelltext bearbeiten]
- W. Friedrichsen: Benzo[c]furans. In: Adv. Heterocycl. Chem. Band 26, 1980, S. 135–234, doi:10.1016/S0065-2725(08)60141-5.
- W. Friedrichsen: Recent advances in the chemistry of benzo[c]furans and related compounds. In: Adv. Heterocycl. Chem. Band 73, 1999, S. 1–96, doi:10.1016/S0065-2725(08)600940-X (englisch).
- R. Rodrigo: Progress in the chemistry of isobenzofurans: Applications to the synthesis of natural products and polyaromatic hydrocarbons. In: Tetrahedron. Band 44, Nr. 8, 1988, S. 2093–2135, doi:10.1016/S0040-4020(01)81720-8 (englisch).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu 1,3-Diphenylisobenzofuran bei TCI Europe, abgerufen am 27. Juli 2017.
- ↑ a b c d Datenblatt 1,3-Diphenylisobenzofuran 97 % bei Sigma-Aldrich, abgerufen am 27. Juli 2017 (PDF).
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 604.
- ↑ a b R. Adams, M.H. Gold: The Synthesis of 1,3-Diphenyldihydroisobenzofurans, 1,3-Diphenylisobenzofurans and o-Dibenzoylbenzenes from the Diene Addition Products to Dibenzoylethylene. In: J. Am. Chem. Soc. Band 62, Nr. 1, 1940, S. 56–61, doi:10.1021/ja01858a012.
- ↑ P.C. Kierkus: 1,3-Diphenylisobenzofuran. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rd420.
- ↑ R.H. Young, K. Wehrly, R.L. Martin: Solvent effects in dye-sensitized photooxidation reactions. In: J. Am. Chem. Soc. Band 93, Nr. 22, 1971, S. 5774–5779, doi:10.1021/ja00751a031.
- ↑ J.A. Howard, G.D. Mendenhall: Autoxidation and photooxidation of 1,3-diphenylisobenzofuran: A kinetic and product study. In: Can. J. Chem. Band 53, Nr. 14, 1975, S. 2199–2201, doi:10.1139/v75-307.
- ↑ P. Carloni et al.: On the use of 1,3-diphenylisobenzofuran (DPBF). Reactions with carbon and oxygen centered radicals in model and natural systems. In: Res. Chem. Intermed. Band 19, Nr. 5, 1993, S. 395–405, doi:10.1163/156856793X00181.
- ↑ A. Guyot, J. Catel, Compt. Rend. Hebd. Acad. Sci., Ser. C140, 1348 (1905)
- ↑ A. Guyot, J. Catel, Bull. Soc. Chim. France, [3] (35), 1124 (1906)
- ↑ M. Kuriyama, N. Ishiyama, R. Shimazawa, R. Shirai, O. Onomura: Efficient synthesis of 3-arylphthalides using palladium-catalyzed arylation of aldehydes with organoboronic acids. In: J. Org. Chem. Band 74, Nr. 23, 2009, S. 9210–9213, doi:10.1021/jo901964k.
- ↑ M. S. Newman: Evidence favoring a two-step mechanism for the Diels-Alder reaction. In: J. Org. Chem. Band 26, Nr. 8, 1961, S. 2630–2633, doi:10.1021/jo01066a004.
- ↑ R.E. Lutz: trans-Dibenzoylethylene In: Organic Syntheses. 20, 1940, S. 29, doi:10.15227/orgsyn.020.0029; Coll. Vol. 3, 1955, S. 248 (PDF).
- ↑ Patent US2325727: Dehydroisobenzofurans and process for preparing them. Angemeldet am 27. Juli 1940, veröffentlicht am 3. August 1943, Anmelder: E.I. du Pont de Nemours & Co., Erfinder: R. Adams.
- ↑ Datenblatt 1,2-Dibenzoylethylene, predominantly trans, 96% bei Alfa Aesar, abgerufen am 22. August 2017 (Seite nicht mehr abrufbar).
- ↑ D.V. Klemm, A. Tuncay: Photochemical and thermal isomerization of trans- and cis-1,2-dibenzoylethylene: A microscale approach. In: J. Chem. Educ. Band 66, Nr. 6, 1989, S. 519, doi:10.1021/ed066p519.
- ↑ Patent US2356907: 1,3-Diphenylisobenzofurans and process for preparing the same. Angemeldet am 27. Juli 1940, veröffentlicht am 29. August 1944, Anmelder: E.I. du Pont de Nemours & Co., Erfinder: R. Adams.
- ↑ Houben-Weyl Methods of Organic Chemistry, Vol. XIII/2a: Organometallic Compounds of Group II of the Periodic Table, 4th Edition. Thieme, Stuttgart 1973, ISBN 978-3-13-213204-7, S. 419.
- ↑ M. Cava, M.J. Mitchell, A.A. Deana: Condensed cyclobutane aromatic compounds. XIII. An attempted synthesis of 1,2-diphenylbenzocyclobutene. In: J. Org. Chem. Band 25, Nr. 9, 1960, S. 1481–1484, doi:10.1021/jo01079a005.
- ↑ J. Jacq, B. Bessières, C. Einhorn, J. Einhorn: Regiospecific synthesis of functionalised 1,3-diarylisobenzofurans via palladium- and rhodium-catalysed reaction of boronic acids with o-acylbenzaldehydes under thermal or microwave activation. In: Org. Biomol. Chem. Band 8, 2010, S. 4927–4933, doi:10.1039/0OB00110D.
- ↑ A. Kotali, P.G. Tsoungas: Oxidation of N-aroylhydrazones of o-hydroxyaryl ketones with lead(IV)acetate: A facile route to aromatic o-diketones. In: Tetrahedron Lett. Band 28, Nr. 37, 1987, S. 4321–4322, doi:10.1016/S0040-4039(00)96497-9.
- ↑ J. Jacq, C. Einhorn, J. Einhorn: A versatile and regiospecific synthesis of functionalised 1,3-diarylisobenzofurans. In: Org. Lett. Band 10, Nr. 17, 2008, S. 3757–3760, doi:10.1021/ol80155a.
- ↑ M. Wozniak, F. Tanfani, E. Bertoli, G. Zolese, J. Antonsiewicz: A new fluorescence method to detect singlet oxygen inside phospholipid model membranes. In: Biochim. Biophys. Acta. Band 1082, Nr. 1, 1991, S. 94–100, doi:10.1016/0005-2760(91)90304-Z.
- ↑ X.-F. Zhang, X. Liu: The photostability and fluorescence properties of diphenylisobenzofuran. In: J. Luminiscence. Band 131, Nr. 11, 2011, S. 2263–2266, doi:10.1016/j.jlumin.2011.05.048.
- ↑ A. Schönberg, A. Mustafa, G. Aziz: Diels-Alder Reaction. II. Experiments with 2-Styrylchromones. On the Nature of the Dimer of 1,3-Diphenylisobenzofuran. In: J. Am. Chem. Soc. Band 76, Nr. 18, 1954, S. 4576–457722, doi:10.1021/ja01647a020.
- ↑ Grundpraktikum Physikalische Chemie, V28, Photooxidation von Diphenylisobenzofuran, Untersuchung der Reaktionskinetik durch Photometrie. (PDF) Universität Ulm, 6. Dezember 2010, archiviert vom (nicht mehr online verfügbar) am 17. Mai 2017; abgerufen am 30. August 2017.
- ↑ C. Schmitz, J.M. Aubry, J. Rigaudy: A new access to the anthracene core: Synthesis of two water soluble singlet oxygen traps derived from 1,3-diphenylisobenzofuran and 9,10-diphenylanthracene. In: Tetrahedron. Band 38, Nr. 10, 1982, S. 1425–1430, doi:10.1016/0040-4020(82)80224-X.
- ↑ D. Tobia, B. Rickborn: Substituent effects on rates of inter- and intramolecular cycloaddition reactions of isobenzofurans. In: J. Org. Chem. Band 52, Nr. 12, 1987, S. 2611–2615, doi:10.1021/jo00388a055.
- ↑ G. Wittig: Über kleine Ringe mit Kohlenstoffdreifachbindung – noch eine Chemie des "Als ob". In: Pure Appl. Chem. Band 7, Nr. 2-3, 1963, S. 173–192, doi:10.1351/pac196307020173.
- ↑ G. Wittig, E. Knauss, K. Niethamer: Über 9,10-Dihydroanthracen-Derivate mit Heterobrückenatomen. In: Justus Liebigs Ann. Chem. Band 630, Nr. 1, 1960, S. 10–18, doi:10.1002/jlac.19606300103.
- ↑ R. Breslow, M. Oda: Isolation and characterization of pure cyclopropenone. In: J. Am. Chem. Soc. Band 94, Nr. 13, 1972, S. 4787–4788, doi:10.1021/ja00768a089.
- ↑ Exo selectivity of the Diels-Alder addition of cyclopropenone and 1-3-diphenylisobenzofuran. Abgerufen am 28. August 2017.
- ↑ J.A. Berson: Reactions of 1,3-diphenylisobenzofuran with acetylenic dienophiles. In: J. Am. Chem. Soc. Band 75, Nr. 5, 1953, S. 1240–1241, doi:10.1021/ja01101a503.
- ↑ M.P. Cava, J.P. VanMeter: Condensed cyclobutane aromatic compounds. XXX. Synthesis of some unusual 2,3-naphthoquinonoid heterocycles. A synthetic route to derivatives of naphtho[2,3-b]biphenylene and anthra[b]cyclobutene. In: J. Org. Chem. Band 34, Nr. 3, 1969, S. 538–545, doi:10.1021/jo01255a012.
- ↑ Houben-Weyl Science of Synthesis, Vol. 45b: Compounds with All-Carbon Functions. Thieme, Stuttgart 2009, ISBN 978-3-13-146551-1, S. 1038.
- ↑ G.P. Miller, J. Briggs: Progress towards the synthesis of tris- and tetrakis[60]fullerene adducts. In: Electrochem. Soc. Proc. Band 2002-12, 2002, ISBN 1-56677-333-4, S. 279–284.