Cyclopropancarbonitril
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
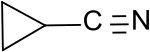
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cyclopropancarbonitril | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H5N | |||||||||||||||
| Kurzbeschreibung |
klare farblose[1] Flüssigkeit | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 67,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Siedepunkt |
135 °C[1] | |||||||||||||||
| Löslichkeit |
mischbar mit Wasser,[3] löslich in Diethylether und n-Hexan[2] | |||||||||||||||
| Brechungsindex |
1,4229 (20 °C, 589 nm)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Cyclopropancarbonitril ist das kleinste Cycloalkan mit einer Nitrilgruppe, die direkt mit der Cyclopropylgruppe verknüpft ist. Wegen seiner einfachen synthetischen Zugänglichkeit eignet es sich als Ausgangsverbindung für funktionelle Cyclopropan-Derivate, wie z. B. Cyclopropancarbonsäure oder Cyclopropylamin und für ringoffene ungesättigte C3-Nitrile, wie die Isomeren Crotononitril und Allylcyanid.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Darstellung des Cyclopropancarbonitrils durch Destillation von 4-Chlorbutyronitril mit Kaliumhydroxid wurde erstmals 1898 beschrieben.[4]
4-Chlorbutyronitril wird durch Reaktion von 4-Chlor-1-brompropan mit Kaliumcyanid in 60 bis 70 %iger Ausbeute erhalten,[5] dieses wiederum durch Umsetzung von 3-Chlor-1-propanol mit Phosphortribromid in 94 %iger Ausbeute.[4] 3-Chlor-1-propanol (Trimethylenchlorhydrin) entsteht nach einer Vorschrift von Carl S. Marvel beim Durchleiten von Chlorwasserstoffgas durch 1,3-Propandiol bei 160 °C in 50 bis 60 %iger Ausbeute.[6]
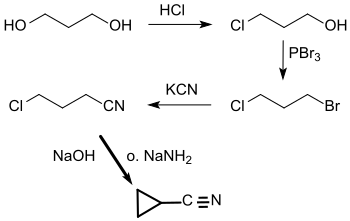
Der Ringschluss zum Cyclopropan kann mit Natriumamid in flüssigem Ammoniak mit 60 %[7] bzw. 89 %[4] Ausbeute durchgeführt werden, mit Natriumhydroxid NaOH in Dimethylsulfoxid DMSO (100 % Ausbeute)[8] oder ohne Lösungsmittel unter Phasentransferkatalyse mit festem NaOH und Benzyltriethylammoniumchlorid (99 % Ausbeute).[9]
Eine alternative Syntheseroute führt vom Cyclopropancarbaldehyd über das mit Hydroxylamin gebildete Oxim durch Wasserabspaltung mit konzentrierter Ameisensäure in Ausbeuten über 90 % zu Cyclopropancarbonitril.[10]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Cyclopropancarbonitril ist eine bei Raumtemperatur klare, farblose Flüssigkeit, die sich mit Wasser und einigen organischen Lösungsmitteln mischt.
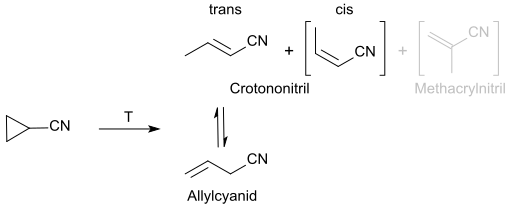
Beim Erhitzen auf Temperaturen von 660 – 760 °K bei Drücken von 2 – 89 Torr isomerisiert Cyclopropancarbonitril unter Öffnung des unter Spannungsenergie stehende Cyclopropanrings überwiegend zu dem trans-isomeren Crotononitril neben wenig Allylcyanid und Spuren von Methacrylnitril.[11]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Aus Cyclopropancarbonitril sind durch klassische Methoden der Organischen Chemie einige Derivate zugänglich, die Ausgangsstoffe u. a. für Arzneistoffe und Pestizide liefern.
So entsteht durch katalytische[12] oder enzymatische[13] Hydratisierung Cyclopropancarboxamid (A), das durch Hofmann-Umlagerung mit Natriumhypochlorit[14] in Cyclopropylamin (B) überführt werden kann, einem Baustein für das Fluorchinolon-Antibiotikum Ciprofloxacin, das Larvizid Cyromazin oder den Herbizid-Safener Cyprosulfanid.

Die Umsetzung mit Methylmagnesiumchlorid liefert Cyclopropylmethylketimin (C), das mit Wasser zum Cyclopropylmethylketon (D) reagiert, einem Baustein für das Fungizid Cyprodinil.
Katalytische Hydrierung von Cyclopropylcyanid[15] führt zu Cyclopropylmethylamin (E),[S 1] einem Baustein für das Herbizid Cyclopyranil.
Die vollständige Hydrolyse der Nitrilgruppe des Cyclopropancarbonitrils mit Schwefelsäure[16] oder mit Enzymzubereitungen aus Rhodococcus-Stämmen[17] liefert Cyclopropancarbonsäure, ein Baustein für die Herbizide Cyprazol, Cypromid und Cyclosulfamuron und das Fungizid Cyprofuram.[18]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Cyclopropancarbonitril bei Sigma-Aldrich, abgerufen am 25. Januar 2018 (PDF).
- ↑ a b c William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–138.
- ↑ Datenblatt Cyclopropanecarbonitrile bei Alfa Aesar, abgerufen am 25. Januar 2018 (Seite nicht mehr abrufbar).
- ↑ a b c J.B. Cloke, R.J. Anderson, J. Lachmann, G.E. Smith: The preparation of cyclopropyl cyanide and trimethylene chlorobromide. In: J. Am. Chem. Soc. Band 53, Nr. 7, 1931, S. 2791–2796, doi:10.1021/ja01358a054.
- ↑ C.F.H. Allen: γ-Chlorobutyronitrile In: Organic Syntheses. 8, 1928, S. 52, doi:10.15227/orgsyn.008.0052; Coll. Vol. 1, 1941, S. 156 (PDF).
- ↑ C.S. Marvel, H.O. Calvery: Trimethylene chlorohydrin In: Organic Syntheses. 8, 1941, S. 112, doi:10.15227/orgsyn.008.0102; Coll. Vol. 1, 1941, S. 533 (PDF).
- ↑ M.J. Schlatter: Cyclopropyl cyanide In: Organic Syntheses. 23, 1943, S. 20, doi:10.15227/orgsyn.023.0020; Coll. Vol. 3, 1955, S. 223 (PDF).
- ↑ Patent US3843709: Preparation of cyclopropyl cyanide from 4-chlorobutyronitrile. Angemeldet am 15. Oktober 1973, veröffentlicht am 22. Oktober 1974, Anmelder: Gulf Research & Development Co., Erfinder: J.D. Bacha, C.M. Selwitz.
- ↑ Patent US3974199: Process for production of cyclopropylcyanide. Angemeldet am 16. Juni 1975, veröffentlicht am 10. August 1976, Anmelder: The Dow Chemical Co., Erfinder: J.H. Plonka, R.G. Pews.
- ↑ Patent US6222058B1: Process for the manufacture of cyclopropanecarbonitrile. Angemeldet am 30. März 1998, veröffentlicht am 24. April 2001, Anmelder: Eastman Chemical Co., Erfinder: S. Liang.
- ↑ D.A. Luckraft, P.J. Johnson: Kinetics of the reactions of cyclopropane derivatives. III. Gas-phase unimolecular isomerization of cyclopropyl cyanide to the cyclopropenes. In: Int. J. Chem. Kinet. Band 5, Nr. 1, 1973, S. 137–147, doi:10.1002/kin.550050112.
- ↑ K.-T. Liu, M.-H. Shih, H.-W. Huang, C.-J. Hu: Catalytic hydration of nitriles to amides with manganese dioxide on silica gel. In: Synthesis. Band 9, 1988, S. 715–717, doi:10.1055/s-1988-27684.
- ↑ T. Nagasawa, H. Nanba, K. Ryuno, K. Takeuchi, H. Yamada: Nitrile hydratase of Pseudomonas chlororaphis B23 – Purification and characterization. In: The FEBS Journal. Band 162, Nr. 3, 1987, S. 691–698, doi:10.1111/j.1432-1033.1987.tb10692.x.
- ↑ Patent US4590292: Process for the manufacture of cyclopropylamine. Angemeldet am 10. Juni 1986, veröffentlicht am 20. Mai 1986, Anmelder: Ciba-Geigy Corp., Erfinder: J.T. Blackwell, H.L. Daughety, H.C. Grace, W.H. Oliver.
- ↑ Patent DE2061035: Verfahren zur Herstellung von Cyclopropylmethylalkylaminen. Angemeldet am 11. Dezember 1970, veröffentlicht am 2. März 1972, Anmelder: Esso Research and Engineering Co., Erfinder: J. Lindner, L.L. Moravetz, G.N. Schmit, N.F. Newman.
- ↑ C.M. McCloskey, G.H. Coleman: Cyclopropanecarboxylic acid In: Organic Syntheses. 24, 1944, S. 36, doi:10.15227/orgsyn.024.0036; Coll. Vol. 3, 1955, S. 221 (PDF).
- ↑ M.A. Cohen, J. Sawden, N.J. Turner: Selective hydrolysis of nitriles under mild conditions by an enzyme. In: Tetrahedron Lett. Band 31, Nr. 49, 1990, S. 7223–7226, doi:10.1016/S0040-4039(00)97285-X.
- ↑ Compendium of Pesticide Common Names alanwood.net (englisch).

