Trypsine
| Trypsin-1 | ||
|---|---|---|

| ||
| Trypsin-1 tetramer, Human nach PDB 2RA3 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 224 Aminosäuren | |
| Kofaktor | Ca2+ | |
| Isoformen | einkettig / zweikettig | |
| Bezeichner | ||
| Gen-Namen | PRSS1 ; TRY1 | |
| Externe IDs | ||
| Arzneistoffangaben | ||
| ATC-Code | B06AA07 D03BA01 M09AB52 | |
| Enzymklassifikation | ||
| EC, Kategorie | 3.4.21.4, Serinprotease | |
| MEROPS | S01.127 | |
| Reaktionsart | Hydrolyse | |
| Substrat | Arginin-, Lysin-Bindungen in Peptiden | |
| Produkte | Spaltprodukte | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Eukaryoten | |
Humanes Trypsin ist ein Gemisch dreier Verdauungsenzyme, die im Dünndarm Proteine zersetzen und zu den Peptidasen zählen: Trypsin-1 (kationisches Trypsin, zwei Drittel), Trypsin-2 (anionisches Trypsin, etwa ein Drittel) und Trypsin-3 (Mesotrypsin, wenige Prozent). Viele ähnliche Enzyme bei Säugetieren, Insekten, Fischen und Pilzen tragen ebenfalls den Namen Trypsin.
Mangel an Trypsin-1 führt beim Menschen zur Unterernährung durch Proteinmangel. Ursache kann eine Mutation am TRY1-Gen sein. Eine andere Folge einer solchen Mutation ist erbliche Pankreatitis, bei der körpereigenes Trypsin-1 nicht abgebaut werden kann und die Bauchspeicheldrüse verdaut. Mutation am Gen für Trypsin-2 kann zur chronischen Pankreatitis beitragen.[1]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]Die Proteasen Trypsin, Chymotrypsin und Carboxypeptidasen werden als inaktive Zymogen-Vorstufen vom Pankreas abgesondert. Das Darmenzym Enteropeptidase, das an das Darmepithel gebunden ist, steuert die Umwandlung der Vorstufe Trypsinogen zu Trypsin. Trypsin aktiviert sich selbst (positive Rückkopplung) und wandelt Chymotrypsinogen, Proelastase wie auch Procarboxypeptidase und weitere inaktive Enzyme in deren aktive Formen (Chymotrypsin, Elastase und Carboxypeptidase) um.
Biologische Funktion
[Bearbeiten | Quelltext bearbeiten]Trypsin gehört zu den Endopeptidasen, die Proteine an bestimmten Stellen spalten. Trypsin ist eine Serinprotease. Es spaltet selektiv nach Darmregion Peptidbindungen nach den basischen Aminosäuren Lysin, Arginin und auch nach modifiziertem Cystein. Proteinasen sind nicht auf bestimmte Proteine spezialisiert, sondern auf bestimmte Aminosäurensequenzen (Strukturmerkmale) innerhalb der Proteine; dies ist für den Verdauungsvorgang wichtig, da ansonsten im Dünndarm für jedes vorkommende Protein ein spezifisches Enzym benötigt werden würde.
Endopeptidasen sind wichtige Substanzen bei der chemisch-analytischen Proteinsequenzierung. Die gespaltenen (denaturierten) Proteine werden leicht hydrolysiert und binden Wassermoleküle an sich.
Eine ähnliche Funktion und Wirkung hat das von der Magenwand freigesetzte Pepsin.
Trypsin besitzt ein pH-Wert-Optimum von 8–8,5.[2] Es ist eine weit verbreitete falsche Annahme, dass Trypsin ein auf den Dünndarm abgestimmtes pH-Optimum hat.[3] Der pH-Wert im Dünndarm liegt aber im sauren bis schwach alkalischen Bereich.[4][5]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Enzym bei entzündlichen Prozessen
[Bearbeiten | Quelltext bearbeiten]Die Wirkung des Trypsins in Form der Madentherapie wurde von Ambroise Paré, Dominique-Jean Larrey und William Stevenson Baer (1872–1931) bemerkt. Daraufhin wurde ein Extrakt der Maden hergestellt, der laut A. Läwen jedoch keine Wirkung zeigte.[6]
1857 wurde das Trypsin als solches dann von Lucien Corvisart (1824–1882) entdeckt und 1867 von Wilhelm Kühne weitgehend isoliert[7] und benannt. Seit 1955 wurde es bei Entzündungen des Mund-Rachen-Raums, der Nase und der oberen Atemwege eingesetzt.[6]
Irving Innerfield versuchte 1954 mittels intramuskulärer Injektion von Trypsin diabetische Zellgewebsentzündungen und Beingeschwüre zu heilen.[6]
Verdauungsenzym
[Bearbeiten | Quelltext bearbeiten]Die proteolytische Eigenschaft des Trypsins beobachteten 1836 Johannes Evangelista Purkinje und Seligmann Simon Pappenheim (1775–1840) und 1856 auch Claude Bernard. Lucien Corvisart begann 1857 mehrere Versuche mit den Pankreassekreten von Hunden und Schafen, um die Wirkung genauer zu beschreiben.[6]
1862 konnte Alexander Jakulowitsch Danilewski das Trypsin dann erstmals durch Verreiben mit Sand und Kieselgur und anschließender Aufschwemmung in Kollodium isolieren. Im Jahr 1875 erkannte Rudolf Heidenhain, dass es sich in Form einer inaktiven Vorstufe in den Zellen der Bauchspeicheldrüse befindet und erst mit der Sekretion in den Zwölffingerdarm wirksam[8] wird. Seinen Namen bekam es dann 1876 von Wilhelm Kühne.[6]
1899 fand Iwan Pawlow (1849–1936) heraus, dass das Dünndarmsekret das Trypsinogen aktiviert. Das Enzym hierbei nannte er Enterokinase.[6]
Dass das Hormon Sekretin dafür verantwortlich ist, dass der Bauchspeichel sezerniert wird, belegten Ernest Henry Starling und William Maddock Bayliss 1902. Dass es sich bei Trypsin und Pepsin um zwei verschiedene Enzyme handelt, wiesen Emil Abderhalden (1877–1950), V. Hemtiquez und Frankel in den Jahren 1912–1916 jeweils unabhängig voneinander nach.[6]
Im Jahr 1930 entdeckten Ernst Kurt Frey, Heinrich Kraut und Eugen Werle einen Trypsin-Inhibitor.[9] 1931 wurde die Kristallstruktur des Trypsins von John Howard Northrop dargestellt.[6]
1941 fanden McClean und Hale heraus, dass unter anderem Trypsin die Fähigkeit hat, das Fortschreiten einer bakteriellen Infektion in einem Gewebe zu unterbinden, indem es die bakterielle Hyaluronidase inaktiviert. So wurde es in Kombination mit Antibiotika erfolgreich gegen lokale Entzündungen angewendet. Aufzeichnungen hierzu gibt es bei Greuer und Hess aus dem Jahr 1954.[6]
Krebstherapie
[Bearbeiten | Quelltext bearbeiten]1906 wurde Trypsin von John Beard bei Neoplasmen eingesetzt und schrieb seine Ergebnisse im Werk "The Enzyme treatment of cancer" 1911 nieder. Zur gleichen Zeit führte auch die intratumorale Injektion durchgeführt von Ferdinand Blumenthal, William Allan Pusey und P. T. Hald zum Erweichen von Tumoren. Britische Ärzte ließen industriell Präparate fertigen und behandelten weitere Patienten damit. Hier blieb jedoch die Wirkung aus, da die Enzyme bei Lagerung bei Raumtemperatur ihre Aktivität verlieren, was damals noch nicht bekannt war, und deswegen wurde dieser Therapieansatz verworfen.
Verwendung
[Bearbeiten | Quelltext bearbeiten]In Zellkulturlabors wird Trypsin zur Trypsinisierung verwendet, um adhärente Zellen vom Boden der Kulturschalen zu lösen bzw. um Zellen zu vereinzeln (Passagierung). Solange man die Zellen nicht zu lange mit Trypsin behandelt, werden sie nicht geschädigt, und nur die extrazellulären Proteine werden gespalten.
In der Proteomik ist Trypsin die am häufigsten eingesetzte Protease, um für die massenspektrometrische Analyse Peptide zu erzeugen, z. B. beim In-Gel-Verdau.
Für die Chromosomenanalyse in Form eines Karyogramms werden in der GTG-Bänderungstechnik die Chromosomen mit Trypsin behandelt und anschließend nach Giemsa gefärbt.[10]
Pharmazeutisch wird Trypsin nur noch in Kombinationspräparaten verwendet. Beispiele hierfür sind Alphintern, Phlogenzym und Wobenzym N.[6]
Nachweisreaktion
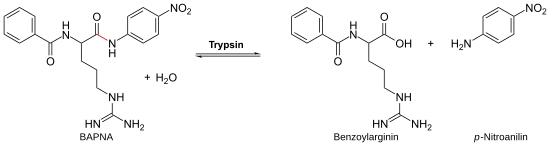
[Bearbeiten | Quelltext bearbeiten]Die Aktivität von Trypsin kann durch N-Benzoyl-D,L-Arginin-p-nitroanilid (BAPNA) nachgewiesen werden. Dabei wird BAPNA durch das Trypsin am Arginin gespalten, und es entsteht p-Nitroanilin. Die dadurch ansteigende Konzentration von p-Nitroanilin kann bei einer Wellenlänge von 405 nm spektroskopisch verfolgt werden.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]- Jennifer McDowall/Interpro: Protein Of The Month: Trypsin and Chymotrypsin. (englisch)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ OMIM: Trypsin-1
- ↑ Tibor Sipos, Joseph R. Merkel: Effect of calcium ions on the activity, heat stability, and structure of trypsin. In: Biochemistry. Band 9, Nr. 14, 1970, S. 2766–2775, doi:10.1021/bi00816a003.
- ↑ Laurence A. Moran: On the meaning of pH optima for enzyme activity. In: Sandwalk. 9. Dezember 2014, abgerufen am 23. November 2016.
- ↑ J. Fallingborg: Intraluminal pH of the human gastrointestinal tract. In: Danish Medical Bulletin. Band 46, Nr. 3, 1999, ISSN 0907-8916, S. 183–196, PMID 10421978.
- ↑ L. Ovesen, F. Bendtsen, U. Tage-Jensen, N. T. Pedersen, B. R. Gram, S. J. Rune: Intraluminal pH in the stomach, duodenum, and proximal jejunum in normal subjects and patients with exocrine pancreatic insufficiency. In: Gastroenterology. Band 90, Nr. 4, 1986, S. 958–962, PMID 3949122.
- ↑ a b c d e f g h i j Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarbeitete und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5, S. 110.
- ↑ K. Zimmermann: Bauchspeicheldrüse. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 89–106, hier: S. 90.
- ↑ K. Zimmermann: Bauchspeicheldrüse. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 89–106, hier: S. 90.
- ↑ K. Zimmermann: Bauchspeicheldrüse. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 89–106, hier: S. 92.
- ↑ GTG-Bänderung (G-bands by trypsin using Giemsa). Institut für Humangenetik im Universitätsklinikum Jena, abgerufen am 14. März 2011.