„Cuban“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K Bot: Link Polymorphie (Materialwissenschaft) nach Polymorphie (Stoffeigenschaft) gändert, siehe WP:RC, Vorlage Commonscat an Inhalte in Commons angepasst |
Ergänzung zur Kristallstruktur aus verschiedenen Lösungsmitteln Markierungen: Visuelle Bearbeitung Mobile Bearbeitung Mobile Web-Bearbeitung |
||
| Zeile 65: | Zeile 65: | ||
Cuban ist bei Raumtemperatur eine feste, kristalline Substanz, die in zwei [[Polymorphie (Stoffeigenschaft)|polymorphen]] Kristallformen auftritt.<ref name="White">M. A. White, R. E. Wasylishen, P. E. Eaton, Y. Xiong, K. Pramod, N. Nodari: ''Orientational Disorder in Solid Cubane: A Thermodynamic and <sup>13</sup>C NMR Study.'' In: ''[[J. Phys. Chem.]]'', 96, Nr. 1, 1992, S. 421–425, [[doi:10.1021/j100180a078]].</ref> Bei Raumtemperatur liegt die Kristallform II vor, die sich bei 121,9 °C in einem [[Phasenübergang]] erster Ordnung in die Kristallform I umwandelt.<ref name="White" /> Diese Kristallform liegt in [[Plastischer Kristall|plastisch kristalliner]] Form vor.<ref name="White" /> Das bedeutet, die Verbindung befindet sich zwischen den beiden Phasenübergängen in einem [[Mesomorpher Zustand|mesomorphen Zustand]]. Bei 131,8 °C wird die flüssige Phase erreicht.<ref name="White" /> Die [[Dampfdruck]]funktion ergibt sich nach [[Antoine-Gleichung|August]] entsprechend log<sub>10</sub>(P) = −A/T+B (P in Torr, ''T'' in K) mit A = 2200 und B = 8.<ref name="White" /> Die Verbindung ist mit einer Standard[[bildungsenthalpie]] von Δ<sub>f</sub>H<sub>solid</sub> = 542 kJ·mol<sup>−1</sup> beziehungsweise Δ<sub>f</sub>H<sub>gas</sub> = 622 kJ·mol<sup>−1</sup> stark endotherm.<ref name="Kybett">B. D. Kybett, S. Carroll, P. Natalis, D. W. Bonnell, J. L. Margrave, J. L. Franklin: ''Thermodynamic Properties of Cubane.'' In: ''[[J. Am. Chem. Soc.]]'', 88, 1966, S. 626–626, [[doi:10.1021/ja00955a056]].</ref> Die Standard[[verbrennungsenthalpie]] Δ<sub>c</sub>H<sub>solid</sub> beträgt −4833,27 kJ·mol<sup>−1</sup>.<ref name="Kybett" /> |
Cuban ist bei Raumtemperatur eine feste, kristalline Substanz, die in zwei [[Polymorphie (Stoffeigenschaft)|polymorphen]] Kristallformen auftritt.<ref name="White">M. A. White, R. E. Wasylishen, P. E. Eaton, Y. Xiong, K. Pramod, N. Nodari: ''Orientational Disorder in Solid Cubane: A Thermodynamic and <sup>13</sup>C NMR Study.'' In: ''[[J. Phys. Chem.]]'', 96, Nr. 1, 1992, S. 421–425, [[doi:10.1021/j100180a078]].</ref> Bei Raumtemperatur liegt die Kristallform II vor, die sich bei 121,9 °C in einem [[Phasenübergang]] erster Ordnung in die Kristallform I umwandelt.<ref name="White" /> Diese Kristallform liegt in [[Plastischer Kristall|plastisch kristalliner]] Form vor.<ref name="White" /> Das bedeutet, die Verbindung befindet sich zwischen den beiden Phasenübergängen in einem [[Mesomorpher Zustand|mesomorphen Zustand]]. Bei 131,8 °C wird die flüssige Phase erreicht.<ref name="White" /> Die [[Dampfdruck]]funktion ergibt sich nach [[Antoine-Gleichung|August]] entsprechend log<sub>10</sub>(P) = −A/T+B (P in Torr, ''T'' in K) mit A = 2200 und B = 8.<ref name="White" /> Die Verbindung ist mit einer Standard[[bildungsenthalpie]] von Δ<sub>f</sub>H<sub>solid</sub> = 542 kJ·mol<sup>−1</sup> beziehungsweise Δ<sub>f</sub>H<sub>gas</sub> = 622 kJ·mol<sup>−1</sup> stark endotherm.<ref name="Kybett">B. D. Kybett, S. Carroll, P. Natalis, D. W. Bonnell, J. L. Margrave, J. L. Franklin: ''Thermodynamic Properties of Cubane.'' In: ''[[J. Am. Chem. Soc.]]'', 88, 1966, S. 626–626, [[doi:10.1021/ja00955a056]].</ref> Die Standard[[verbrennungsenthalpie]] Δ<sub>c</sub>H<sub>solid</sub> beträgt −4833,27 kJ·mol<sup>−1</sup>.<ref name="Kybett" /> |
||
Bei Raumtemperatur kristallisiert Cuban in [[trigonal]]er Kristallstruktur mit der Raumgruppe R3 mit einem Molekül pro Elementarzelle.<ref>E. B. Fleischer: ''X-Ray Structure Determination of Cubane.'' In: ''[[J. Am. Chem. Soc.]]'', 86, 1964, S. 3889–3890, [[doi:10.1021/ja01072a069]].</ref> Die mittels [[Elektronenbeugung]] bestimmten Bindungslängen betragen für die C–C-Bindung 157,27±0,19 pm, für die C–H-Bindung 111,8±0,8 pm und unterscheiden sich nur wenig von denen im [[Cyclobutan]] mit 155,1 pm für die C–C-Bindung und 109 pm für die C–H-Bindung.<ref name="Hedberg" /><ref>N. L. Allinger, P. E. Eaton: ''The geometries of pentaprismane and hexaprismane insights from molecular mechanics.'' In: ''[[Tetrahedron Lett.]]'', 24, 1983, S. 3697–3700, [[doi:10.1016/S0040-4039(00)94512-X]].</ref><ref>N. L. Allinger: ''Conformational Analysis. 130. MM2. A Hydrocarbon Force Field Utilizing V<sub>1</sub> and V<sub>2</sub> Torsional Terms.'' In: ''[[J. Am. Chem. Soc.]]'', 99, 1977, S. 8127–8134, [[doi:10.1021/ja00467a001]].</ref> |
Bei Raumtemperatur kristallisiert Cuban in [[trigonal]]er Kristallstruktur mit der Raumgruppe R3 mit einem Molekül pro Elementarzelle.<ref>E. B. Fleischer: ''X-Ray Structure Determination of Cubane.'' In: ''[[J. Am. Chem. Soc.]]'', 86, 1964, S. 3889–3890, [[doi:10.1021/ja01072a069]].</ref> Aus Methanol kristallisiert das Molekül in Form von farblosen Rhomben aus.<ref>{{Literatur |Autor=Fritz Vögtle |Titel=Reizvolle Moleküle der Organischen Chemie |Verlag=Vieweg+Teubner Verlag |Ort=Wiesbaden |Datum=1989 |Reihe=Teubner Studienbücher Chemie |ISBN=978-3-519-03503-9 |DOI=10.1007/978-3-322-96705-3 |Online=http://link.springer.com/10.1007/978-3-322-96705-3 |Abruf=2023-10-28}}</ref> Die mittels [[Elektronenbeugung]] bestimmten Bindungslängen betragen für die C–C-Bindung 157,27±0,19 pm, für die C–H-Bindung 111,8±0,8 pm und unterscheiden sich nur wenig von denen im [[Cyclobutan]] mit 155,1 pm für die C–C-Bindung und 109 pm für die C–H-Bindung.<ref name="Hedberg" /><ref>N. L. Allinger, P. E. Eaton: ''The geometries of pentaprismane and hexaprismane insights from molecular mechanics.'' In: ''[[Tetrahedron Lett.]]'', 24, 1983, S. 3697–3700, [[doi:10.1016/S0040-4039(00)94512-X]].</ref><ref>N. L. Allinger: ''Conformational Analysis. 130. MM2. A Hydrocarbon Force Field Utilizing V<sub>1</sub> and V<sub>2</sub> Torsional Terms.'' In: ''[[J. Am. Chem. Soc.]]'', 99, 1977, S. 8127–8134, [[doi:10.1021/ja00467a001]].</ref> |
||
=== Chemische Eigenschaften === |
=== Chemische Eigenschaften === |
||
Version vom 29. Oktober 2023, 00:16 Uhr
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Cuban | ||||||||||||
| Andere Namen |
Pentacyclo[4.2.0.02,5.03,8.04,7]octan | ||||||||||||
| Summenformel | C8H8 | ||||||||||||
| Kurzbeschreibung |
schimmernde, farblose Rhomben[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 104,15 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,29 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
200 °C (Zersetzung)[1] | ||||||||||||
| Dampfdruck |
146,7 Pa (25 °C)[4] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Cuban ist eine chemische Verbindung aus der Gruppe der gesättigten polycyclischen Kohlenwasserstoffe. Neben Cunean und Octabisvalen ist Cuban ein Vertreter der drei möglichen gesättigten C8H8-Kohlenwasserstoffe und ein Valenzisomer von Cyclooctatetraen. Die acht Kohlenstoffatome des Cubanmoleküls sind in Form eines Würfels angeordnet.
Das Kohlenstoffgerüst umschließt einen Hohlraum, daher gehört Cuban zur Klasse der Käfigverbindungen, genauer zu den platonischen Kohlenwasserstoffen. Es galt bis zu seiner Erstsynthese im Jahre 1964 zunächst nur als in der Theorie existent und wegen der ungewöhnlich spitzen 90-Grad-Bindungswinkel der Kohlenstoffatome als instabil. Durch diese 90-Grad-Winkel speichert Cuban viel Energie in diesen Bindungen, daher kann es als Grundkörper hochenergetischer Treibstoffe oder Sprengstoffe dienen (siehe auch Tetranitrocuban, Octanitrocuban).
Geschichte
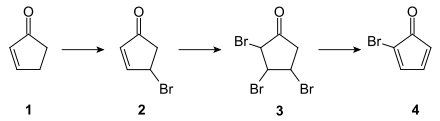
Die Darstellung von Cuban in einer dreizehnstufigen Synthese durch Philip Eaton wurde erstmals 1964 publiziert.[6][7] Die Originalsynthese geht von 2-Cyclopenten-1-on (1) aus, das zunächst in einer Wohl-Ziegler-Reaktion mit N-Bromsuccinimid zu (2) monobromiert wird. Die Tribromverbindung (3) wird durch Weiterbromierung mit elementarem Brom erhalten, aus der die eigentliche Ausgangsverbindung der Cuban-Synthese 2-Bromcyclopentadienon (4) durch Dehydrohalogenierung gewonnen wird:
Diese Ausgangsverbindung (2-Bromcyclopentadienon) wird in einem ersten Schritt über eine Diels-Alder-Reaktion zu (2) dimerisiert. Beide Carbonylgruppen in (2) werden mit Ethylenglycol geschützt (2a). Anschließend wird die endo-ständige Acetal-Gruppe selektiv unter Bildung der Verbindung (3) hydrolysiert. Es schließt sich eine intramolekulare photochemische [2+2]-Cycloaddition zum Bromketon (4) an:
Das so gewonnene Bromketon wird über eine Faworski-Umlagerung durch Ring-Kontraktion zur Carbonsäure (5) umgelagert. Die freie Carbonsäure (5) wird in einen Peroxycarbonsäureester (6) überführt und danach thermisch zu (7) decarboxyliert:
Zuletzt wird die verbliebene Acetal-Gruppe ebenfalls hydrolysiert, das Bromketon (8) in einer zweiten Faworski-Reaktion umgelagert und die dabei entstehende Carbonsäure (9) in den entsprechenden Peroxycarbonsäureester (10) überführt. Das Zielmolekül Cuban (11) wird nach einer thermischen Decarboxylierung von (10) erhalten:
Synthese
Der Aufbau der Cubanstruktur kann in einer einfacheren fünfstufigen Synthese zunächst zur Cuban-1,4-dicarbonsäure erfolgen.[8][9] Die Startverbindung der Synthese ist hier Cyclopentanon, welches aus Adipinsäure und Bariumhydroxid als Katalysator, in Gegenwart von Temperaturen von etwa 300 °C synthetisiert wird. Dieses wird im ersten Schritt mittels Ethylenglycol zum cyclischen Ethylenketal umgewandelt. Dafür benötigt es einen Säurekatalysator, sowie einen Dean-Stark Wasserabscheider, um das Wasser, welches bei der Reaktion als Nebenprodukt entsteht, aus dem Reaktionsgemisch zu entfernen. Dies sorgt für eine Verschiebung des Gleichgewichts auf die Produktseite. Nach mehreren Stunden rückkochen und anschließender, mehrfacher fraktionierter Destillation erhält man das Produkt. Durch Bromierung entsteht ein dreifach bromiertes Cyclopentanonketal mit dem Namen 2,2,5-Tribromcyclopentanonethylenketal, welches nach Dehydrohalogenierung und Diels-Alder-Reaktion in ein polycyclisches Diels-Alder-Zwischenprodukt überführt wird. Eine intramolekulare photochemische [2+2]-Cycloaddition führt zu einer teilweisen Cubanstruktur, genauer einem Decahydron. Eine neue Vorschrift zeigt dafür eine Bestrahlung des Diels-Alder-Zwischenprodukts mit UV-Licht der Wellenlänge 390 nm in Acetonitril als Lösemittel, welchem Benzophenon als Photosensibilisator zugegeben wurde.[10] Durch eine Reaktion unter Rückfluss in Gegenwart von Natronlauge wird die teilweise Cubanstruktur vervollständigt. Das Gesamtprodukt dieser Synthese ist die Cuban-1,4-Dicarbonsäure. Die Gesamtausbeute beträgt über alle Reaktionsstufen etwa 25 %.[9] Die Synthese wurde bis in den Kilogrammmaßstab durchgeführt.[9]
Cuban-1,4-dicarbonsäure ist eine Basisverbindung für die Synthese weiterer substituierter Cubanverbindungen.[9] Die Decarboxylierung zum Cuban erfolgt in zwei Schritten über den tert-Butylperester.[6] Eine nahezu quantitative Synthese gelingt durch den photochemischen Abbau eines Thiohydroxamsäureesters.[11][9]
Eigenschaften
Physikalische Eigenschaften
Cuban ist bei Raumtemperatur eine feste, kristalline Substanz, die in zwei polymorphen Kristallformen auftritt.[12] Bei Raumtemperatur liegt die Kristallform II vor, die sich bei 121,9 °C in einem Phasenübergang erster Ordnung in die Kristallform I umwandelt.[12] Diese Kristallform liegt in plastisch kristalliner Form vor.[12] Das bedeutet, die Verbindung befindet sich zwischen den beiden Phasenübergängen in einem mesomorphen Zustand. Bei 131,8 °C wird die flüssige Phase erreicht.[12] Die Dampfdruckfunktion ergibt sich nach August entsprechend log10(P) = −A/T+B (P in Torr, T in K) mit A = 2200 und B = 8.[12] Die Verbindung ist mit einer Standardbildungsenthalpie von ΔfHsolid = 542 kJ·mol−1 beziehungsweise ΔfHgas = 622 kJ·mol−1 stark endotherm.[13] Die Standardverbrennungsenthalpie ΔcHsolid beträgt −4833,27 kJ·mol−1.[13]
Bei Raumtemperatur kristallisiert Cuban in trigonaler Kristallstruktur mit der Raumgruppe R3 mit einem Molekül pro Elementarzelle.[14] Aus Methanol kristallisiert das Molekül in Form von farblosen Rhomben aus.[15] Die mittels Elektronenbeugung bestimmten Bindungslängen betragen für die C–C-Bindung 157,27±0,19 pm, für die C–H-Bindung 111,8±0,8 pm und unterscheiden sich nur wenig von denen im Cyclobutan mit 155,1 pm für die C–C-Bindung und 109 pm für die C–H-Bindung.[4][16][17]
Chemische Eigenschaften
Trotz der hochgespannten Bindungen ist die Verbindung stabil. Eine messbare Zersetzung wird erst bei Temperaturen oberhalb von 200 °C beobachtet.[9] Die Aktivierungsenergie für die Thermolyse ist mit einem Wert von 180,5 kJ·mol−1 relativ hoch.[18] Gegenüber Licht, Luft und Wasser ist Cuban ebenfalls relativ stabil.[9] Cuban kann intramolekulare metallkatalysierte Bindungsumlagerungen eingehen. Die Reaktion führt in Gegenwart von Silber- oder Palladiumkatalysatoren zum Cunean.[19]
Mit Rhodiumkatalysatoren wird zunächst syn-Tricyclooctadien gebildet, welches thermisch bei 50–60 °C zum Cyclooctatetraen umgewandelt werden kann.[20]
Literatur
- P. E. Eaton: Cubane: Ausgangsverbindungen für die Chemie der neunziger Jahre und des nächsten Jahrhunderts. In: Angew. Chem. Band 104, 1992, S. 1447–1462, doi:10.1002/ange.19921041105.
Einzelnachweise
- ↑ a b Eintrag zu Cuban. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- ↑ Jai Prakash Agrawal: High Energy Materials: Propellants, Explosives and Pyrotechnics , Wiley-VCH Verlag GmbH & Co. KGaA 2010, ISBN 978-3-527-32610-5, S. 138.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 439.
- ↑ a b L. Hedberg, K. Hedberg, E. P. E Kenneth, N. Nodari, A. G. Robiette: Bond lengths and quadratic force field for cubane. In: J. Am. Chem. Soc. 113, 1991, S. 1514–1517, doi:10.1021/ja00005a007.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b P. E. Eaton, T. W. Cole: Cubane. In: J. Am. Chem. Soc. 86 1964, S. 3157–3158, doi:10.1021/ja01069a041.
- ↑ P. E. Eaton, T. W. Cole: The Cubane System. In: J. Am. Chem. Soc. 86, 1964, S. 962–964, doi:10.1021/ja01059a072.
- ↑ N. B. Chapman, J. M. Key, K. J. Toyne: The Preparation and Properties of Cage Polycyclic Systems – I. Pentacyclo[5.3.0.02,5.03,9.04,8]decane and Pentacyclo[4.3.0.02,5.03,8.04,7]nonane Derivatives. In: J. Org. Chem. 35, 1970, S. 3860–3867. doi:10.1021/jo00836a062.
- ↑ a b c d e f g P. E. Eaton: Cubane: Ausgangsverbindungen für die Chemie der 1990er Jahre und des nächsten Jahrhunderts. In: Angew. Chem., 104, 1992, S. 1447–1462, doi:10.1002/ange.19921041105.
- ↑ Diego E. Collin, Edward H. Jackman, Nicolas Jouandon, Wei Sun, Mark E. Light, David C. Harrowven, Bruno Linclau: Decagram Synthesis of Dimethyl 1,4-Cubanedicarboxylate Using Continuous-Flow Photochemistry. In: Synthesis. Band 53, Nr. 07, April 2021, S. 1307–1314, doi:10.1055/s-0040-1705964.
- ↑ D. H. R. Barton, D. Crich, W. B. Motherwell: New and improved methods for the radical decarboxylation of acids. In: J. Chem. Soc., Chem. Commun. 1983, S. 939–941, doi:10.1039/C39830000939.
- ↑ a b c d e M. A. White, R. E. Wasylishen, P. E. Eaton, Y. Xiong, K. Pramod, N. Nodari: Orientational Disorder in Solid Cubane: A Thermodynamic and 13C NMR Study. In: J. Phys. Chem., 96, Nr. 1, 1992, S. 421–425, doi:10.1021/j100180a078.
- ↑ a b B. D. Kybett, S. Carroll, P. Natalis, D. W. Bonnell, J. L. Margrave, J. L. Franklin: Thermodynamic Properties of Cubane. In: J. Am. Chem. Soc., 88, 1966, S. 626–626, doi:10.1021/ja00955a056.
- ↑ E. B. Fleischer: X-Ray Structure Determination of Cubane. In: J. Am. Chem. Soc., 86, 1964, S. 3889–3890, doi:10.1021/ja01072a069.
- ↑ Fritz Vögtle: Reizvolle Moleküle der Organischen Chemie (= Teubner Studienbücher Chemie). Vieweg+Teubner Verlag, Wiesbaden 1989, ISBN 978-3-519-03503-9, doi:10.1007/978-3-322-96705-3 (springer.com [abgerufen am 28. Oktober 2023]).
- ↑ N. L. Allinger, P. E. Eaton: The geometries of pentaprismane and hexaprismane insights from molecular mechanics. In: Tetrahedron Lett., 24, 1983, S. 3697–3700, doi:10.1016/S0040-4039(00)94512-X.
- ↑ N. L. Allinger: Conformational Analysis. 130. MM2. A Hydrocarbon Force Field Utilizing V1 and V2 Torsional Terms. In: J. Am. Chem. Soc., 99, 1977, S. 8127–8134, doi:10.1021/ja00467a001.
- ↑ H.-D. Martin, T. Urbanek, P. Pföhler, R. Walsh: The pyrolysis of cubane; an example of a thermally induced hot molecule reaction. In: J. Chem. Soc., Chem. Commun., 1985, S. 964–965, doi:10.1039/C39850000964.
- ↑ P. E. Eaton, L. Cassar, J. Halpern: Silver(I)- and Palladium(II)-Catalyzed Isomerizations of Cubane. Synthesis and Characterization of Cuneane. In: J. Am. Chem. Soc., 92, 1970, S. 6366–6368, doi:10.1021/ja00724a061.
- ↑ L. Cessar, P. E. Eaton, J. Halpern: Catalysis of Symmetry-Restricted Reactions by Transition Metal Compounds. The Valence Isomerization of Cubane. In: J. Am. Chem. Soc., 92, 1970, S. 3515–3518, doi:10.1021/ja00714a075.