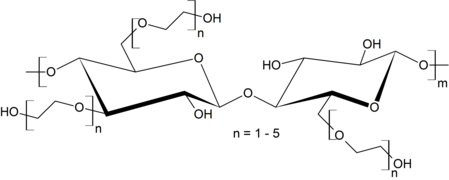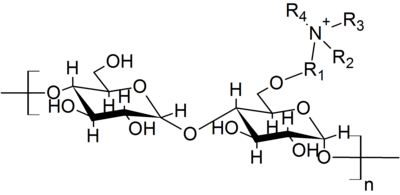Polymeranaloge Reaktion
Polymeranaloge Reaktionen nennt man Reaktionen, bei denen an Polymeren funktionelle Gruppen durch chemische Reaktionen in andere Gruppen überführt werden.[1]
Dabei werden unterschiedliche Arten der Polymeranalogen Reaktionen unterschieden:
- Polymeranaloge Reaktionen im klassischen Sinn (Polymertransformationen), bei denen das Reaktionsprodukt das gewünschte Polymer ist
- Reaktivharze sind (meist vernetzte) Polymere mit funktionellen Gruppen, mit denen andere (meist niedermolekulare) Verbindungen hergestellt werden können. Das Reaktivharz kann anschließend (meist) wieder recycliert werden. Das bekannteste Beispiel sind Ionenaustauscherharze, bei denen die (niedermolekularen) Ionen ausgetauscht werden können
Bei diesen Reaktionen ändert sich die molare Masse und gegebenenfalls auch die Konstitution der Polymere, der Polymerisationsgrad bleibt aber erhalten.[1] Eine komplette Umsetzung der reaktiven Gruppen ist normalerweise nicht möglich, wobei die Reaktivharze und Ionenaustauscher Ausnahmen bilden. In vielen Fällen ist eine komplette Umsetzung auch nicht gewünscht, hier bilden Polyvinylalkohol/Polyvinylamin Ausnahmen, bei denen man neben teilhydrolysierten auch komplett hydrolysierte Typen anstrebt. Da sich die physikalischen und chemischen Eigenschaften der Produkte mit dem Substitutionsgrad ändern, versucht man in Fällen wo bestimmte Substitutionsgrade angestrebt werden diese gezielt durch die Reaktionsführung zu erreichen, um die gewünschten Eigenschaften zu erhalten. So sinkt in der Regel ab einem bestimmten Substitutionsgrad bei Cellulose- und Stärkederivaten die Löslichkeit bzw. Quellfähigkeit und auch die biologische Abbaubarkeit. Ab welchem Grad dies geschieht, hängt u. a. von der Größe und Hydrophobie des Substituenten ab.
Bei einer Vernetzung reagiert ein Polymer mit einer funktionellen Gruppe und einem niedermolekularen Vernetzer oder einem anderen Polymer zu größeren Aggregaten, die nach der Reaktion eine weit größere Molmasse und Polymerisationsgrad haben als das Ausgangspolymer.
Künstliche Polymere
Polymere aus nicht existenzfähigen Monomeren
Polyvinylalkohol
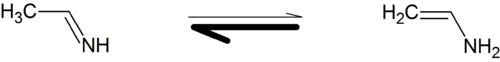
Durch polymeranaloge Reaktion werden Polymere hergestellt, die nicht direkt aus den (formalen) Monomeren synthetisiert werden können, weil diese Monomere nicht stabil oder existent sind. Das kommerziell wichtigste Beispiel ist Polyvinylalkohol (PVA). Der hypothetisch zugrunde liegende Vinylalkohol liegt in einem tautomeren Gleichgewicht mit Acetaldehyd vor, wobei die Gleichgewichtlage nahezu vollständig auf Seiten des Aldehyds liegt:
PVA wird hergestellt, indem aus dem stabilen Monomer Vinylacetat zuerst Polyvinylacetat hergestellt wird. Aus diesem wird mit Butanol oder Methanol durch eine Umesterung der Polyvinylalkohol erhalten. Die dabei anfallenden Ester (Butylacetat und Methylacetat) sind wertvolle Lösemittel. Meist wird eine möglichst quantitative Umesterung angestrebt, Es gibt aber auch teilverseifte Polyvinylalkohole, die beispielsweise als Klebstoffe Verwendung finden.[2] Die Löslichkeit in Wasser hängt aber neben dem Hydrolysegrad von anderen Faktoren wie Molmasse und Taktizität ab:[3]
Polyvinylamin
Ähnliches gilt für Polyvinylamin, das Vinylamin läge auch hier mit Ethylidenimin in einem Gleichgewicht vor, in diesem Fall einem Imin-Enamin-Tautomerie-Gleichgewicht, wobei allerdings beide Verbindungen instabil sind.
Polyvinylamin wird aus N-Vinylformamid hergestellt, das zu Polyvinylformamid polymerisiert und durch dessen Verseifung gewonnen wird.
Lineares Polyethylenimin
Mit p-Toluolsulfonsäuremethylester als Initiator lassen sich 2-alkyl-substituierte 2-Oxazoline zu N-substituierten Polyethylenimin polymerisieren. Nach Verseifung entsteht daraus ein lineares Polyethylenimin.[4] Das formale Monomer des Polyethylenimins ist das Aziridin, das zwar stabil existiert und auch polymerisierbar ist, allerdings entsteht bei der ringöffnenden Polymerisation nicht die lineare Form des Polymers, sondern ein stark verzweigtes Polyethylenimin. Die lineare Form kann nur durch den oben beschriebenen Umweg dargestellt werden.
Nachbehandlung von Polymeren
- Polyethylen, Ethylen-Propylen-Copolymere, Polyvinylchlorid und andere Polymere werden nach ihrer Herstellung chloriert um mechanische und chemische Eigenschaften zu verbessern. Zur Verbesserung der Elastomereigenschaften sollte der Chlorgehalt des Polymers 25–40 % betragen, soll das Polymer zur Verbesserung der Schlagfestigkeit mit PVC geblendet werden sollten es > 40 % sein. Hochchlorierte PVC-Typen mit bis zu 65 % Chlor werden in Lacken und Klebstoffen verwendet, wobei deren Verwendung deutlich rückläufig ist, bzw. sich auf Spezialanwendungen reduziert.[5]
- Acrylnitril-Butadien-Kautschuk wird zur Verbesserung der Alterungsbeständigkeit hydriert.[5]
Ionenaustauscher
Ionenaustauscher sind meist vernetzte Polystyrolharze, die anionische oder kationische Gruppen tragen. Als anionische Gruppe dient meist eine Sulfonsäuregruppe, seltener eine Carboxylatgruppe. Die kationischen Gruppen sind je nach Anwendung stark basische quartäre Ammoniumverbindungen, oder tertiäre, sekundäre oder primäre (= schwach basische) Amine.[6]
- Ionenaustauschertypen
-
stark saurer Kationenaustauscher
-
schwach saurer Kationenaustauscher (Carboxymethylcellulose)
-
stark basischer Anionenaustauscher
-
schwach basischer Anionenaustauscher (Diethylaminoethylcellulose)
Reaktivharze
Neben den Ionenaustauscherharzen gibt es eine ganze Reihe (vernetzter) Polymere, die funktionelle Gruppen tragen, mit denen niedermolekulare Verbindungen hergestellt, oder umgesetzt werden können. Basis bilden meist vernetzte Polystyrole. Beispiele sind:[7]
- ~~(p-C6H4)-ICl2 cis-Chlorierung von Olefinen
- ~~(p-C6H4N)-BH3 Hydrierung und Reduktion von Aldehyden, Ketonen und Säurechloriden
- ~~(p-C6H4)-P=CRR' Wittig-Reaktionen von Aldehyden
- ~~N(Cl)-CO~~ Oxidation von Alkoholen
Die Reaktionen an den Reaktivharzen und deren Regeneration erfolgen analog wie bei Ionenaustauscherharzen in Säulen, was durch die großen Konzentrationsgradienten zum Einen die Reaktion wie zum Anderen die Regeneration mit großen Ausbeuten durchführbar machen.
Die Reaktionen verlaufen bei polymer gebundenen Gruppen nicht immer analog zu den Reaktionen monomerer reaktiver Gruppen. So bromiert N-Bromsuccinimid Olefine in der Allylstellung unter Erhalt der Doppelbindung, während das polymer gebundene zu einer Addition von Brom an die Doppelbindung führt.[7]
Leiterpolymere
Durch eine intramolekulare Polymerisartion kann man geeignete Polymere zu Leiterpolymeren umsetzen. Ein geeignetes Grundpolymer ist beispielsweise isotaktisches 1,2-Polybutadien, bei dem die seitenständigen Vinylgruppen cyclisiert werden.[8]
Herstellung von Kohlenstofffasern
Kohlenstofffasern werden zum größten Teil aus Polyacrylnitril (PAN) hergestellt. Dazu wird PAN gesponnenen und verstreckt und diese Fasern in einer polymeranalogen Reaktion zu einem Leiterpolymer umgesetzt. Diese Vorreaktion verläuft in zwei Schritten. Im ersten werden unter sauerstofffreien Bedingungen die CN-Gruppen bei 200–300 °C cyclisiert und in einem zweiten Schritt durch Sauerstoff dieses Polymer aromatisiert. In einem weiteren Schritt wird es unter Eliminierung von HCN oder Stickstoff graphitisiert[9]
Natürliche Polymere
Cellulosederivate
Polymeranaloge Reaktionen bei nativer, oder manchmal auch gezielt abgebauter Cellulose liefern wichtige Produkte der Kunststoffindustrie.
- Cellulosederivate
-
Celluloseacetat
-
Cellulosenitrat
-
Methylcellulose
-
Ethylcellulose
-
Hydroxypropylmethylcellulose
-
Hydroxypropylcellulose
-
Hydroxyetylcellulose
-
Carboxymethylcellulose
-
Diethylaminoethylcellulose
Dargestellt sind teilweise die (idealisierten) vollsubstituierten Produkte. Bei technischen Produkten liegt der Substitutionsgrad meist zwischen zwei und fünf pro Cellobioseeinheit und wird gezielt angestrebt, weil die unterschiedlichen Substitutionsgrade den Derivaten unterschiedliche Eigenschaften verleihen.
Celluloseester
- Celluloseacetat, einer der ältesten Kunststoffe, wird je nach Substitutionsgrad nach unterschiedlichen Verfahren hergestellt, ausführlich werden sie im Hauptartikel dazu beschrieben. Da sich Fasern aus Celluloseacetat ähnlich anfühlen wie Seide und auch im Aussehen ähnlich sind, wird sie in großem Umfang zur Herstellung dieser Fasern und Bekleidung daraus verwendet, zumal diese Stoffe pflegeleichter und unempfindlicher sind als Seide.[10]
- Auch Cellulosenitrat ist ein seit langem verwendeter Kunststoff, wird heute allerdings wegen der großen Brandgefahr nur noch selten verwendet, beispielsweise mit Campher plastifiziert zur Herstellung von Tischtennisbällen.[11][12]
Celluloseether
- Methylcellulose wird durch Umsetzen von Methylchlorid mit alkalisch vorbehandelter Cellulose unter Druck und erhöhter Temperatur hergestellt und als Verdickungsmittel, speziell als Tapetenkleister verwendet.[13]
- Ethylcellulose wird analog zu Methylcellulose hergestellt und auch zu ähnlichen Zwecken eingesetzt, dient aber auch als Bestandteil von Celluloseetherlacken.[14]
- Hydroxypropylmethylcellulose stellt man aus Cellulose mit einer Mischung aus Propylenoxid und Methylchlorid her, die wie bei der Methylcellulose vor der Reaktion alkalisch vorbehandelt hat. Die Verwendung ist vielfältig und wird im Artikel dazu ausführlich beschrieben. Unter anderem wird sie als Verdickungsmittel[15] eingesetzt.
- Hydroxypropylcellulose[16] wird aus alkalisch vorbehandelter Cellulose und Propylenoxid hergestellt. Sie wird als Emulgatoren, Verdickungsmittel und Bindemittel verwendet.
- Hydroxyethylcellulose[17] wird analog zu Hydroxypropylcellulose aus Ethylenoxid und alkalisch behandelter Cellulose hergestellt. Sie wird analog wie Hydroxypropylcellulose eingesetzt, ist aber (bei gleichem Substitutionsgrad) etwas hydrophiler als diese.
- Carboxymethylcellulosen hat ein sehr breites Anwendungsspektrum, so ist sie z. B. als Lebensmittelzusatzstoff zugelassen und hat die Nummer E 466, dort wird es als Ve3rdicker und zur Verbesserung der Konsistenz eingesetzt. In der Pharmazie nutzt man sie als Tablettensprengmittel. Diese und weitere Anwendungen sind hier aufgelistet.[18]
- Diethylaminoethylcellulose wird als schwach basischer Ionenaustauscher verwendet, speziell für Trennung von Proteinen.[19]
Bei der Herstellung von Hydroxypropylmethylcellulose, Hydroxypropylcellulose und Hydroxyethylcellulose kommt es immer zur Bildung von mehrgliedrigen Seitenketten aus Polyethylenoxid bzw. Polypropylenoxid kommen, noch bevor alle OH-Gruppen der Cellulose substituiert sind. Reaktionstechnisch lässt sich nicht vermeiden, dass ein relativ uneinheitliches Produkt entsteht.
Stärkederivate
Im Gegensatz zu Cellulose ist Stärke und viele ihrer Derivate von Menschen verdaubar und daher gibt es eine Vielzahl von Stärkederivaten, die in großem Maß in der Lebensmitteltechnologie zur Modifikation von Lebensmitteln.[20][21] sowie bei der Papierherstellung[22] eingesetzt werden. Die Verdaulichkeit nimmt mit steigendem Substitutionsgrad allerdings ab und einige sehr hoch substituierte Derivate sind unverdaulich. Meist wird keine native Stärke, sondern abgebaute eingesetzt, weil die Molmassen nativer Stärken speziell bei Amylopektinen oft so hoch sind, dass die Löslichkeit schlecht, oder die Lösungsviskositäten sehr hoch sind, dass Derivatisierungen stark erschwert werden.
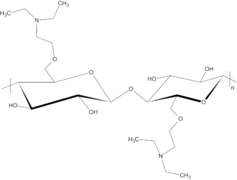
Kationische Stärke
kationische Stärke wird in großem Umfang für die Herstellung von Papier eingesetzt. Dort dient sie u. a. als Retentionsmittel und zur Trockenverfestigung.[23] Aufgesprühte kationische Stärke verbessert die Bedruckbarkeit.[22] Im Gegensatz zu anderen Stärkederivaten haben kationische Stärken einen sehr niedrigen Substitutionsgrad, der typischerweise zwischen 0,03 und 0,1 liegt.[23]
Stärkeester
- Stärkesulfate waren eine Zeit lang als Substitut für Heparin im Gespräch[24]
- Stärkenitrate haben ähnliche Eigenschaften wie Cellulosenitrate, aber eine weit geringere technische und wirtschaftliche Bedeutung.[25]
- Stärkexanthogenate werden in der Papierindustrie zur Papierverfestigung und zur Herstellung von Elastomeren verwendet[24]
- Stärkecitrate werden in der Lebensmitteltechnologie bei Tiefkühlware eingesetzt[24]
- Stärkesuccinate und Stärkeadipate bilden kaltquellende, hochviskose Lösungen[24]
- Monostärkephosphat[26] Stärkephosphate werden speziell bei säurehaltigen Lebensmitteln, die stark erwärmt (steriliesiert) werden eingesetzt.[27]
- Stärkeacetate[28] bilden klare und stabile Lösungen. Sie werden zur Stabilisierung von Tiefkühllebensmittel und Milcherzeugnissen verwendet.
- Stärkenatriumoctenylsuccinat[29] quillt bereits in kaltem Wasser und wirkt als Emulgator, der Wasser/Öl-Emulsionen stabilisiert. Zudem bildet es stabile, gefrierstabile Schäume.
Stärkeether
- Hydroxypropylstärke[30] wird als hitzestabiles Verdickungsmittel verwendet, speziell für Nahrungsmittel, die sterilisiert werden.
- Hydroxyethylstärke[31] wird für die Papierherstellung und als Textilhilfstoff verwendet. Bis 2013 auch als Plasmaersatzstoff, momentan ist es aber für diesen Zweck nicht mehr zugelassen.[32]
- Carboxymethylstärke[22] bildet hochviskose Lösungen, ohne Gelbildung. Sie ist ein Grundstoff für abbaubare Tenside[33]
Posttranslationale Modifikationen
Posttranslationale Proteinmodifikationen (PTM) sind Veränderungen von Proteinen, die nach der Translation stattfinden. Auf diesem Weg können Aminosäuren in Proteine eingebaut werden, die kein eigenes Kodon besitzen. So besitzt Hydroxyprolin kein Kodon und kann nicht direkt in Proteine eingebaut werden, sondern wird in Kollagen durch Prolyl-4-Hydroxylase aus Prolin hergestellt.
Posttranslationale Modifikation lassen sich in folgende Gruppen einteilen
- Abspaltungen
- Einfügung von Anorganischen Gruppen
- Einfügung von Organischen Gruppen
- Einfügung von Lipidgruppen (als Sonderfall)
- Einfügen von Bindungen
- Bindung an größere Moleküle
- Veränderung einzelner Aminosäuren
- Andere Reaktionen
Bei dieser Einteilung gibt es allerdings Überschneidungen und Uneindeutigkeiten, weil es eine empireische und nicht streng systematische Einteilung ist und nicht alle Posttranslationale Modifikationen sind Polymeranaloge Reaktionen.[34]
Ohne Posttranslationale Modifikationen könnten viele Proteine ihre Aufgaben nicht erfüllen, weil sie sonst eine andere als die geforderte Konfiguration hätten, zu hydrophil, oder hydrophob wären, oder andere Eigenschaften nicht erfüllten. Die meisten Posttranslationale Modifikationen sind enzymkatalysierte Reaktionen und keine, die durch DNA/RNA gesteuert werden. Sie können an unterschiedlichen Stellen der Zellen stattfinden, nicht nur in den Ribosomen.
Andere natürliche Polymere
Chitosan wird aus Chitin durch Verseifung oder enzymatischer Deacetylierrung hergestellt. Auch Chitosan hat eine sehr breite Anwendung.[35]
Abgrenzung zu Polymeranalogen Reaktionen
Das Vulkanisieren (Quervernetzen) von Kautschuk zu Gummi zählt nicht zu den Polymeranalogen Reaktionen, sondern zu den Vernetzungen.[36]
Distärkephosphat[37] und Phosphatiertes Distärkephosphat[38] gehören zu den vernetzten Polymeren, weil die Phosphatgruppen mehrere Ketten miteinander verbinden. Auch die Stärkesuccinate und Stärkeadipate gehören teilweise zu den vernetzten Polymeren.[24]
Mischsysteme
Es gibt Systeme, bei denen sowohl polymeranaloge Reaktionen, als auch Vernetzungen stattfinden. Ein Beispiel ist die Herstellung von Polyamidoamin-epichlorhydrinharzen, die als Nassfestmittel bei der Papierproduktion Anwendung finden. Hier wird aus Adipinsäure und Diethylentriamin (oder anderen Polyaminen) durch Polykondensation ein Prepolymer hergestellt, das in einer polymeranalogen Reaktion mit Epichlorhydrin zu einem reaktiven Prepolymer umgesetzt wird, das anschließend vernetzt werden kann.[39]
Einzelnachweise
- ↑ a b Hans-Georg Elias, Makromoleküle, Band 1, 6. Auflage, Wiley, Weinheim, 1999, S. 554 ff; ISBN 3-527-29872-X.
- ↑ Produktliste teilverseifter Polyvinylalkohole der Firma Kuraray abgerufen am 25. März 2016.
- ↑ Karl Oberbach (Hrsg.): Saechtling Kunststoff-Taschenbuch. Carl Hanser Verlag, München/ Wien 2004, ISBN 3-446-22670-2, S. 458.
- ↑ Blandine Brissaul, et al.: Synthesis of Linear Polyethylenimine Derivatives for DNA Transfection, In: Bioconjugate Chem. 2003 14, S. 581–587.
- ↑ a b Hans-Georg Elias, Makromoleküle, Band 1, 6. Auflage, Wiley, Weinheim, 1999, S. 558–559 ; ISBN 3-527-29872-X.
- ↑ Ionenaustausch für Laien, eine Beschreibung der Firma Rohm und Haas abgerufen am 15. März 2016.
- ↑ a b Hans-Georg Elias, Makromoleküle, Band 1, 6. Auflage, Wiley, Weinheim, 1999, S. 564; ISBN 3-527-29872-X.
- ↑ Hans-Georg Elias, Makromoleküle, Band 1, 6. Auflage, Wiley, Weinheim, 1999, S. 561; ISBN 3-527-29872-X.
- ↑ Präsentation der Firma Toho Tenax zu Eigenschaften und Herstellung von Kohlenstofffasern s. 15 - 17 abgerufen am 30. März 2016.
- ↑ Eintrag zu Acetatseide. In: Römpp Online. Georg Thieme Verlag
- ↑ | Tischtennisregeln A, Punkt 3.3abgerufen am 11. März 2016.
- ↑ Eintrag zu Celluloid. In: Römpp Online. Georg Thieme Verlag
- ↑ | Technisches Merkblatt Metylan Normal Seite 3. abgerufen am 11. März 2016.
- ↑ Ethylcellulose auf der Seite der Ashland Inc. abgerufen am 14. März 2016.
- ↑ Eintrag zu Verdickungsmittel. In: Römpp Online. Georg Thieme Verlag
- ↑ Eintrag zu Hydroxypropylcellulosen. In: Römpp Online. Georg Thieme Verlag
- ↑ Eintrag zu Hydroxyethylcellulosen. In: Römpp Online. Georg Thieme Verlag
- ↑ Verschiedene Anwendungen von Carboxymethylcellulose abgerufen am 14. März 2016.
- ↑ Datenblatt 2,3-Diethylaminoethylcellulose bei Sigma-Aldrich (PDF).
- ↑ Stärkederivate für die Lebensmittelindustrie Iabgerufen am 15. März 2016.
- ↑ Stärkederivate für die Lebensmittelindustrie II abgerufen am 15. März 2016.
- ↑ a b c Übersicht über kationische Stärken, die in der Papierherstellung verwendet werden abgerufen am 15. März 2016.
- ↑ a b Übersichtsartikel des Einsatzes von Stärken bei der Papierherstellung abgerufen am 19. März 2016.
- ↑ a b c d e Eintrag zu Stärkeester. In: Römpp Online. Georg Thieme Verlag
- ↑ Eintrag zu Stärkenitrate. In: Römpp Online. Georg Thieme Verlag
- ↑ Monostärkephosphat – Eintrag im Lexikon der Ernährung abgerufen am 15. März 2016.
- ↑ Eintrag zu Stärkephosphate. In: Römpp Online. Georg Thieme Verlag
- ↑ Stärkeacetat – Eintrag im Lexikon der Ernährung abgerufen am 15. März 2016.
- ↑ Stärkenatriumoctenylsuccinat – Eintrag im Lexikon der Ernährung abgerufen am 15. März 2016.
- ↑ Hydroxypropylstärke – Eintrag in Lebensmittellexikon.de abgerufen am 15. März 2016.
- ↑ Eintrag zu Hydroxyethylstärken. In: Römpp Online. Georg Thieme Verlag
- ↑ Deutsches Ärzteblatt vom 14. Juni 2013 abgerufen am 18. März 2016.
- ↑ Eintrag zu Stärkeether. In: Römpp Online. Georg Thieme Verlag
- ↑ Joachim Rassow et al. Biochemie. Thieme Verlag 2008 doi:10.1055/b-0034-88959
- ↑ Beschreibung von Chitosan von der HS Emden Leer abgerufen am 14. März 2016.
- ↑ Beschreibung der Vulkanisation auf der Seite von Prof. Blume abgerufen am 14. März 2016.
- ↑ Distärkephosphat – Eintrag im Lexikon der Ernährung abgerufen am 15. März 2016.
- ↑ Phosphatiertes Distärkephosphat – Eintrag im Lexikon der Ernährung abgerufen am 15. März 2016.
- ↑ Andreas Pingel-Keuth Papierproduktion: Von Zellstoff zu Filtertüte, Schreibpapier, … Chemie in unserer Zeit Volume 39, Heft 6, S. 402–409, doi:10.1002/ciuz.200500234.