tert-Butylperoxybenzoat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | tert-Butylperoxybenzoat | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C11H14O3 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 194,23 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt | ||||||||||
| Dampfdruck | ||||||||||
| Löslichkeit | ||||||||||
| Brechungsindex | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
tert-Butylperoxybenzoat (TBPB) ist ein Perester der allgemeinen Struktur R1-C(O)OO-R2 mit einer Phenylgruppe als R1 und einer tert-Butylgruppe als R2, der häufig als Radikalstarter für die Polymerisation von z. B. Ethylen zu LDPE und für die Vernetzung von z. B. ungesättigten Polyesterharzen eingesetzt wird.
Vorkommen und Darstellung
Ein Standardverfahren zur Darstellung von Perestern ist die Acylierung von tert-Butylhydroperoxid mit Benzoylchlorid,[5]

wobei ein großer Überschuss von tert-Butylhydroperoxid eingesetzt, der entstehende Chlorwasserstoff im Vakuum entfernt und so eine praktisch quantitative Ausbeute erzielt wird.
Eigenschaften
tert-Butylperoxybenzoat ist eine klare hellgelbe Flüssigkeit, die in Wasser wenig, in vielen organischen Lösungsmitteln, wie z. B. Ethanol oder Phthalat[6] löslich ist.
Als Peroxoverbindung enthält TBPB ca. 8,16 Gewichtsprozent Aktivsauerstoff und hat eine so genannte selbst beschleunigende Zersetzungstemperatur (SADT, self accelerating decomposition temperature) von ca. 60 °C. Die SADT ist die tiefste Temperatur, bei der innerhalb einer Woche selbst beschleunigende Zersetzung in der Transportverpackung auftreten kann und die bei Lagerung und Transport nicht überschritten werden darf.[7]
TBPB sollte daher zwischen minimal 10 °C (darunter Verfestigung) und maximal 50 °C gelagert werden. Verdünnung mit einem hochsiedenden Lösungsmittel erhöht die SADT. Die Halbwertszeit von TBPB, bei der 50 % des Peroxyesters zersetzt sind, beträgt 10 Stunden bei 104 °C, eine Stunde bei 124 °C und eine Minute bei 165 °C. Amine, Metallionen, starke Säuren und Basen, sowie starke Reduktions- und Oxidationsmittel beschleunigen bereits in geringen Konzentrationen die Zersetzung von TBPB.[7]
Gleichwohl gehört tert-Butylperoxybenzoat in der Handhabung zu den sichersten Perestern bzw. organischen Peroxiden.[8] Die Hauptzerfallsprodukte von TBPB sind Kohlendioxid, Aceton, Methan, tert-Butanol, Benzoesäure und Benzol. [9]
Anwendungen
Die Schutzgruppe 2-Trimethylsilylethansulfonylchlorid (SES-Cl) für primäre und sekundäre Aminogruppen ist durch Umsetzung von Vinyltrimethylsilan mit Natriumhydrogensulfit und tert-Butylperoxy-benzoat zum Natriumsalz der Trimethylsilylethansulfonsäure und anschließende Reaktion mit Thionylchlorid zum entsprechenden Sulfonylchlorid zugänglich.[8]

tert-Butylperoxybenzoat wird zur Einführung der Benzoyloxygruppe in Allylstellung ungesättigter Kohlenwasserstoffe eingesetzt.[10]

Aus Cyclohexen entsteht mit TBPB in Gegenwart von katalytischen Mengen Kupfer(I)-bromid in 71 bis 80%iger Ausbeute 3-Benzoyloxycyclohexen.
Diese auch als Kharasch-Sosnovsky-Oxidation bezeichnete allylische Oxidation von Alkenen

erzeugt in Gegenwart katalytischer Mengen von Kupfer(I)-bromid racemische allylische Benzoate.[11]
Eine Abwandlung der Reaktion nutzt Kupfer(II)-trifluormethansulfonat als Katalysator – sowie DBN oder DBU als Basen – und erzielt Ausbeuten bis 80 % bei der Umsetzung acyclischer Olefine mit TBPB zu allylischen Benzoaten.[12]
Substituierte Oxazoline und Thiazoline können in einer modifizierten Kharasch-Sosnovsky-Oxidation mit tert-Butylperoxy-benzoat und einer Mischung von Cu(I)- und Cu(II)-Salzen in brauchbaren Ausbeuten zu den entsprechenden Oxazolen und Thiazolen oxidiert werden.[13]

Für das Gelingen der Reaktion ist die Carboalkoxygruppe an C-4-Position essentiell.
Benzol und Furane können in einer oxidativen Kupplung unter Palladiumsalz-Katalyse mit Olefinen alkyliert werden, wobei tert-Butylperoxybenzoat als Wasserstoffakzeptor fungiert.[14]
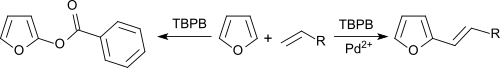
In Abwesenheit von Pd2+-Salzen erfolgt Benzoxylierung der Aromaten.
Hauptanwendung von tert-Butylperoxybenzoat ist als Radikalstarter, der die Polymerisation von Monomeren zu Polymeren, wie z. B. von Ethylen zu LDPE, Vinylchlorid zu PVC, Styrol zu Polystyrol oder Acrylsäureestern zu Polyacrylaten initiiert und als so genannter Warmhärter für ungesättigte Polyesterharze (engl. unsaturated polyester resins, UP resins).[6] Die Einsatzmengen für die Härtung von UP-Harzen liegen bei ca. 1–2 %.[6]
Nachteilig, insbesondere bei der Herstellung von Polymeren für Anwendungen im Lebensmittel- oder Kosmetikbereich ist die mögliche Bildung von Benzol als Zerfallsprodukt, das aus dem Polymer (z. B. einer LDPE-Verpackungsfolie) herausdiffundieren kann.
Einzelnachweise
- ↑ a b c d e f g Datenblatt tert-Butylperoxybenzoat bei Sigma-Aldrich (PDF).
- ↑ a b c d e f g h i Eintrag zu tert-Butylperbenzoat in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Arkema, GPS Safety Summary, Substance Name: Tert-Butyl peroxybenzoate
- ↑ a b Datenblatt tert-Butyl peroxybenzoate, 98% bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ N.A. Milas, D.G. Orphanos, R.J. Klein: The solvolysis of acid chlorides with t-alkyl hydroperoxides. In: J. Org. Chem. Band 29, Nr. 10, 1964, S. 3099–3100, doi:10.1021/jo01033a525.
- ↑ a b c United Initiators, Technisches Datenblatt, TBPB
- ↑ a b Organic Peroxide Producers Safety Division, SAFETY AND HANDLING OF ORGANIC PEROXIDES The Society of the Plastics Industry, 2012 edition
- ↑ a b S.M. Weinreb, C.E. Chase, P. Wipf, S. Venkatraman: 2-Trimethylsilylethanesulfonyl chloride (SES-Cl) In: Organic Syntheses. 75, 1998, S. 161, doi:10.15227/orgsyn.075.0161 (PDF).
- ↑ PERGAN GmbH: Organische Peroxide für die Polymerisation
- ↑ K. Pedersen, P. Jakobsen, S.-O. Lawesson: 3-Benzoyloxycyclohexene In: Organic Syntheses. 48, 1968, S. 18, doi:10.15227/orgsyn.048.0018; Coll. Vol. 5, 1973, S. 70 (PDF).
- ↑ M.S. Kharasch, G. Sosnovsky: The reactions of t-butyl perbenzoate and olefins – a stereospecific reaction. In: J. Amer. Chem. Soc. Band 80, Nr. 3, 1958, S. 756–756, doi:10.1021/ja01536a062.
- ↑ G. Sakar, A. DattaGupta, V.K. Singh: Cu(OTf)2 – DBN/DBU complex as an efficient catalyst for allylic oxidation of olefins with tert-butyl perbenzoate. In: Tetrahedron Lett. Band 37, Nr. 46, 1996, S. 8435–8436, doi:10.1016/0040-4039(96)01911-9.
- ↑ A.I. Meyers, F.X. Tavares: Oxidation of Oxazolines and Thiazolines to Oxazoles and Thiazoles. Application of the Kharasch−Sosnovsky Reaction. In: J. Org. Chem. Band 61, Nr. 23, 1996, S. 8207–8215, doi:10.1021/jo.9613491.
- ↑ J. Tsuji, H. Nagashima: Palladium-catalyzed oxidative coupling of aromatic compounds with olefins using t-butyl perbenzoate as a hydrogen accepter. In: Tetrahedron. Band 40, Nr. 14, 1984, S. 2699–2702, doi:10.1016/S0040-4020(01)96888-7.


