Basalzellkarzinom
| Klassifikation nach ICD-10 | |
|---|---|
| C44 | Sonstige bösartige Neubildungen der Haut |
| ICD-10 online (WHO-Version 2019) | |
Das Basalzellkarzinom (Basalzellenkrebs; Epithelioma basocellulare; veraltet Basaliom; englisch basal cell carcinoma, basalioma, basal cell epithelioma) ist eine bösartige Krebserkrankung der Haut, die sich aus Stammzellen im Bereich der Haarfollikel sowie interfollikulär in den basalen Schichten der Epidermis entwickelt.[1] Bevorzugte Lokalisationen sind der Sonne ausgesetzte Gesichtsregionen wie Stirn, Nase oder Ohren. Manchmal wird der Basalzellenkrebs als Abgrenzung zum „schwarzen Hautkrebs“ (malignes Melanom) auch „heller Hautkrebs“ oder „weißer Hautkrebs“ genannt. Diese irreführende Bezeichnung berücksichtigt jedoch nicht, dass auch pigmentierte (gefärbte) Wachstumsformen des Basalioms sowie unpigmentierte (amelanotische) Melanome[2] auftreten können, und wird deshalb unter Medizinern nicht verwendet. Das Basalzellkarzinom kann wie ein bösartiger Tumor das umliegende Gewebe schädigen und sogar Knochen infiltrieren, bildet aber extrem selten (0,03 % der Fälle) Metastasen. Er wird deshalb, zumal im höheren Lebensalter, manchmal auch als semimaligne – teilweise bösartig – bezeichnet.
Epidemiologie
Basaliome treten in der Humanmedizin vor allem bei Personen zwischen dem 60. und 70. Lebensjahr auf. Sie stellen mit 65 % den größten Anteil der malignen Hauttumoren und kommen etwa zehnmal häufiger als Spinaliome (Plattenepithelkarzinome der Haut) vor. Die Prävalenz schwankt je nach Sonneneinstrahlung zwischen 20 und 50 (Mitteleuropa) und 250 (Australien) Erkrankungen auf 100.000 Einwohner. In Deutschland sind es ca. 171.000 Neuerkrankungen pro Jahr.[3]
Bei immunsupprimierten (z. B. HIV-Infizierten oder Transplantationspatienten) überwiegt hingegen das Spinaliom.
Im Rahmen einiger Syndrome treten Basaliome besonders häufig auf, so bei dem Gorlin-Goltz-Syndrom, dem Rombo-Syndrom oder dem Bazex-Dupre-Christol-Syndrom.
Risikofaktoren und Pathogenese
Der größte Risikofaktor für die Entstehung eines Basalzellkarzinoms ist die langjährige Einwirkung von Sonnenstrahlen. Daher entstehen Basaliome bevorzugt im Gesicht – 80 % entstehen in den Bereichen um die Augen, also Stirn, Wangen, Nase, Oberlippe – wie auch im Nacken sowie auf dem dünnbehaarten oder kahlen Kopf. Im Unterschied zum malignen Melanom verursachen nicht häufige Sonnenbrände die Tumoren, sondern die andauernde Belastung der Haut durch UV-Strahlen.[4]
Der langwellige Anteil des UV-Lichts, UV-A (320–400 nm Wellenlänge), ist durch eine größere Eindringtiefe ausschlaggebend für die Entstehung eines Basalioms. Die kurzwellige UV-B-Strahlung wird zum größten Teil bereits in den oberen Hautschichten absorbiert und verursacht bevorzugt Schäden in den oberflächlichen Epithelzellen der Haut, wie beim Plattenepithelkarzinom der Haut.
Neben der Lichtexposition sind genetische Veranlagung und Umweltfaktoren mit verantwortlich. Eine helle Haut (Hauttyp I oder II) ist ein wichtiger Risikofaktor. Außerdem sind genetische Störungen wie Xeroderma pigmentosum und das Basalzellnävus-Syndrom[5] in seltenen Fällen an der Entstehung beteiligt. Eine wichtige chemische Noxe ist Arsen. Die Exposition kann noch nach Jahren zu Basaliomen führen.[6]
Formen und klinischer Verlauf
Man unterscheidet acht verschiedene Formen von Basaliomen:[7]
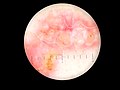
- Knotiges solides Basaliom: Ein meist gelblich-rötlicher oder bräunlich-grauer, derber langsam wachsender Knoten oder Knötchen mit glasiger Oberfläche und Teleangiektasien und der Neigung zu Blutungen und Ulzerationen. (Halb)kugeliges Erscheinungsbild.
- Im Falle eines ulzerierenden Prozesses (exulzerierend wachsendes Basaliom, auch Ulcus rodens genannt – von lateinisch rodere = ‚nagen‘) bildet sich der charakteristische derbe, perlschnurartige Randwall.
- Bei tiefer gelegenen ulzerierenden und zerstörerisch wirkenden Prozessen spricht man von einem destruierend wachsenden Basaliom, auch Ulcus terebrans genannt – von lateinisch terebrare = ‚bohren‘.
- Superfizielles-multizentrisches Basaliom: Häufig an der Rumpfhaut lokalisiert, daher auch Rumpfhautbasaliom genannt, oft vergesellschaftet mit Psoriasis und bei älteren Patienten, die eine Exposition mit Arsen in der Anamnese aufweisen. Rundlich-ovale, makulös bis plaqueförmige Herde von rötlicher Farbe mit feiner Schuppung und scharfer Begrenzung. Die Oberfläche ist leicht gefaltet, die Läsion neigt zu Erosionen und Ulzerationen. Bei ulzerierenden Prozessen ist der perlschnurartige Randwall zu sehen.
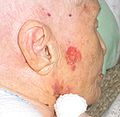
- Pigmentiertes Basaliom: Dieses kann leicht mit einem malignen Melanom verwechselt werden.
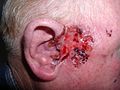
- Infiltratives sklerodermiformes Basaliom: Diese Variante hat einen weißlich-gelblichen, porzellanweißen Aspekt, der durch die unterschiedlich stark ausgeprägte Fibrosierung zustande kommt und entsprechend die recht derbe Konsistenz bestimmt. Es ist daher mit bloßem Auge oft nicht von normaler Haut abzugrenzen und schwer zu entfernen. Flache Form mit horizontaler Ausdehnung, wobei auch klinisch nicht betroffene Hautareale einbezogen sein können, was bei einer Exzision die mikroskopische Schnittrandkontrolle zwingend notwendig macht. Besonders hohes Rezidivrisiko.
- Infiltratives nichtsklerodermiformes Basaliom: Die klinische Unterscheidung besteht in der geringen bis fehlenden Fibrosierung. Die Konsistenz ist weicher, die Farbveränderung der Haut fehlt.
- Keratotisches Basalzellkarzinom
- Adenoides Basalzellkarzinom
- Basalzellkarzinom mit seboglandulärer Differenzierung
-
Knotiges solides (noduläres) Basaliom[8]
-
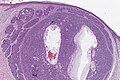
Histologie eines nodulären Basalioms
-
Pigmentiertes Basaliom[8]
-
Sklerodermiformes Basaliom (Morphea-Basaliom)[8]
-
Histologie eines sklerodermiformen Basalioms
-
Dermatoskopie eines nodulären Basalzellkarzinoms
-
Dermatoskopie eines superfiziellen Basalzellkarzinoms
Sonderformen
- Verwildertes Basaliom (Synonym Basosquamöses (metatypisches oder auch intermediäres) Basalzellkarzinom): Klinisch identisch mit einem nodulären Basalzellkarzinom. Histologische Zelldifferenzierung hinsichtlich keratotischer, bowenoider oder squamöser Art, die aggressiv zerstörerisch (destruktiv) wachsen und in der unmittelbaren Umgebung (lokal) metastasieren. Die Prognose für diese Erkrankungsform ist entsprechend schlechter, weil dieser Typ metastasieren kann.[9]
- Infundibulozystisches Basalzellkarzinom: Infundibulumzysten-ähnliche Strukturen mit Ansammlung basaloider Zellen ohne ausgereifte follikuläre Papille. Klinisch imponiert die Läsion als Knötchen mit glatter Oberfläche meistens im Gesicht älterer Menschen.
- Genodermatosen mit Basalzellkarzinomen
Der weitaus größte Teil der Basaliome beim Menschen findet sich im sogenannten zentrofazialen Bereich, einem Streifen vom Haaransatz bis zur Oberlippe. Etwa 15 % der Basaliome sind an der Ohrmuschel, an der behaarten Kopfhaut und im unteren Gesichtsdrittel zu finden. Nur etwa 5 % der Basaliome liegen am Stamm oder an den Extremitäten.
Basaliome wachsen sehr langsam über einige Jahre und machen sie damit differentialdiagnostisch unterscheidbar zum innerhalb von Wochen entstehenden und reizlos abheilenden Keratoakanthom. Den Beginn stellt meist ein kleiner, harter Knoten („Basaliomperle“) oder eine umschriebene Verhärtung (Induration) dar. Oft finden sich am Rand der Läsion sehr feine, neu gebildete Blutgefäße, die zart durch die Haut schimmern, die sog. Teleangiektasien, sowie perlschnurartige Verdickungen am Rand des Tumors. Die das Basaliom bedeckende Epithelschicht schimmert perlmuttartig und ist ein weiterer wichtiger differentialdiagnostischer Aspekt.
Lange Zeit findet ein Wachstum in horizontaler und vertikaler Richtung statt. Entstehung von Geschwüren (Ulzerationen) und zerstörerisches Wachstum (Destruktionen) kommen in späteren Stadien vor und sind je nach klinischer Form unterschiedlich stark ausgeprägt.
Prognose
Die Prognose ist allgemein gut, da in den meisten Fällen keine Metastasierungsneigung besteht. Patienten mit aggressiven Formen (Basalioma terebrans und Basalioma exulcerans) haben je nach Organbefall eventuell eine schlechtere Prognose.
Therapie
Zahlreiche Behandlungsformen stehen zur Verfügung:
Die Behandlungsform mit der geringsten Rückfallquote bei Basaliomen insbesondere im Gesicht ist die chirurgische Behandlung mit histologischer (mikroskopisch kontrollierter) Schnittrandkontrolle („Tübinger Torte“). Andere Behandlungsformen kommen meist nur dann als alleinige Therapie zum Einsatz, wenn die Operation nicht möglich ist wie beispielsweise aufgrund von Alter oder Vorerkrankungen des Patienten, der Lokalisation des Tumors oder ähnlichem. Wegen des langfristig zerstörerischen (destruierenden) Wachstums sollten Basaliome frühzeitig im Ganzen operativ entfernt werden, um eine Schädigung tieferliegender Gewebebereiche zu vermeiden. Ein Wiederauftreten des Tumors (Rezidive) ist jedoch immer möglich.
Große oder nichtoperable Basaliome bei älteren Menschen werden erfolgreich mit Röntgenweichstrahlen therapiert. Über die erste Heilung eines Hautepithelioms durch Röntgenbestrahlung berichteten 1899 Tage Sjögren (1859–1939) und Thor Stenbeck.[10] Weitere Behandlungsverfahren sind die Kürettage mit lokaler chemochirurgischer Nachbehandlung, die Vereisungsbehandlung (Kryotherapie) insbesondere bei oberflächlichen Basaliomen, sowie die medikamentöse örtliche Krebsimmuntherapie (s. u.) oder eine topische Chemotherapie mit Anwendung einer 5-Fluorouracil-haltigen Creme.
Neben den zuvor genannten Röntgenweichstrahlen kommen auch Formen der Brachytherapie zum Einsatz. Diese eignen sich insbesondere für schwierig zu operierende Lokalisationen oder wenn durch eine Operation die Funktionalität beeinträchtigt wird und/oder das ästhetische Ergebnis von besonderer Bedeutung ist. Ein Vertreter dieser Therapien ist die Rhenium-SCT. Diese macht sich die Betastrahlung des Radioisotopes 188Re (Rhenium) zunutze. Dabei wird die Aktivität mittels eines Compounds auf eine dünne Schutzfolie direkt über der Läsion appliziert, wodurch umliegendes Gewebe geschont wird.[11]
Seit Juli 2004 ist eine neue Behandlungsmethode für das oberflächliche Basaliom zugelassen: Der Wirkstoff Imiquimod wird mit einer Creme über mehrere Wochen vom Patienten selbst aufgetragen. Imiquimod aktiviert lokal das körpereigene Immunsystem der Haut, welches dann die Tumorzellen gezielt angreift. Diese Wirkung zeigt sich in Form einer Entzündung, welche mehr oder weniger ausgeprägt verlaufen kann. Der Vorteil ist, dass sich hierdurch auch noch nicht sichtbare Tumorareale darstellen können und gleich mitbehandelt werden. Häufige Nebenwirkung der Entzündungsreaktion sind Juckreiz, Brennen oder leichte Schmerzen, Krustenbildung und Nässen. Sehr selten kommt es hingegen auch zu einem grippeähnlichen Gefühl, in diesem Fall wird empfohlen, die Therapie zu pausieren. Sofern der Patient die Krusten ohne weitere Manipulation abheilen lässt, ist eine Narbenbildung nicht zu erwarten.
Seit August 2013 ist das Medikament Vismodegib (Handelsname Erivedge) für die Behandlung von Basalzellkarzinom in Deutschland zugelassen, wenn bisher übliche Maßnahmen (OP, Bestrahlung) nicht möglich sind bzw. nicht wirksam sind. In verschiedenen Veröffentlichungen (JEJM, PZ-Online) wird die Substanz als „Sprunginnovation“ bezeichnet.[12] Ein weiteres Medikament aus der Wirkstoffklasse der Hedgehog-Signalweg-Inhibitoren ist Sonidegib (Handelsname: Odomzo) von Novartis. In den USA wurde es im Juli 2015 zugelassen; in Europa erfolgte die Zulassung im August 2015.[13][14] Der Gemeinsame Bundesausschuss hat Vismodegib 2016 im Rahmen der frühen Nutzenbewertung einen geringen Zusatznutzen für die Behandlung des lokal fortgeschrittenen Basaliom zugesprochen[15].
Eine weitere Methode zur Behandlung oberflächlicher Basaliomformen ist die photodynamische Therapie mit einer Methyl-5-amino-4-oxopentanoat-Creme (MAOP). Diese setzt in den neoplastischen Zellen Protoporphyrin IX frei. Nach einer derartigen Sensibilisierung werden die Zellen durch eine anschließende Behandlung mit speziellem Rotlicht selektiv zerstört, da Protoporphyrin IX unter Lichteinstrahlung Sauerstoffradikale bildet, welche zum Absterben dieser Zellen führen. Diese Behandlungsoption zeichnet sich durch eine Kombination von guten medizinischen und kosmetischen Ergebnissen aus, wie besonders im Gesichtsbereich erwünscht. Bei narbig-flachen (sklerodermiformen) Basaliomen ist die Rezidivgefahr sehr hoch, für knotige Basaliome wird die Option ebenfalls aufgrund der nur geringen Eindringtiefe nicht empfohlen.
-
Sklerodermiformes Basaliom
-
Knotiges Basaliom
-
Knotiges Basaliom
-
Ulcus terebrans
-
Cornu cutaneum
-
Sklerodermiformes Basalzellkarzinom
-
Noduläres Basalzellkarzinom
-
nodulären Basalzellkarzinom Schnittführung
Siehe auch
Literatur
- Ingrid Moll: Dermatologie. 6. Auflage. Thieme, Stuttgart 2005, ISBN 3-13-126686-4 (= Duale Reihe).
- H. Domarus, P. J. Stevens: Metastatic basal cell carcinoma. Report of five cases and review of 170 cases in the literature. In: Journal of the American Academy of Dermatology, 10, 1984, S. 1043–1060.
- Seite des Dermatologischen Informations-Systems (DermIS)
- Dirk Hasselmann: Heller Hautkrebs – Und wie Sie ihn in den Schatten stellen. 2. Auflage 2018. ISBN 978-3-7407-4964-4
Weblinks
Einzelnachweise
- ↑ Shelby C. Peterson, Markus Eberl, Alicia N. Vagnozzi, Abdelmadjid Belkadi, Natalia A. Veniaminova: Basal Cell Carcinoma Preferentially Arises from Stem Cells within Hair Follicle and Mechanosensory Niches. In: Cell Stem Cell. Band 16, Nr. 4, April 2015, S. 400–412, doi:10.1016/j.stem.2015.02.006, PMID 25842978, PMC 4387376 (freier Volltext) – (elsevier.com [abgerufen am 26. Oktober 2019]).
- ↑ Peter Altmeyer, Martina Bacharach-Buhles: Melanom amelanotisches C43.L. In: altmeyers.org. Abgerufen am 11. Juli 2017.
- ↑ Hautkrebs. Umdenken! Dem Krebs aktiv vorbeugen. In: krebshilfe.de. Deutsche Krebshilfe, archiviert vom (nicht mehr online verfügbar) am 12. November 2011; abgerufen am 14. April 2011.
- ↑ I. Moll: Duale Reihe – Dermatologie. 2005, S. 319 ff.
- ↑ Konrad Bork, Walter Burgdorf, Nikolaus Hoede: Mundschleimhaut- und Lippenkrankheiten: Klinik, Diagnostik und Therapie. Atlas und Handbuch. Schattauer Verlag, 2008, ISBN 978-3-7945-2486-0, S. 361–362.
- ↑ Carlos Thomas: Spezielle Pathologie. Schattauer Verlag, 1996, ISBN 3-7945-2110-2, S. 85–86.
- ↑ H. Kerl, Claus Garbe, L. Cerroni: Histopathologie der Haut. Hrsg.: H. Wolff. 1. Auflage. Springer, Berlin Heidelberg 2003, ISBN 3-540-41901-2.
- ↑ a b c M. Sand, D. Sand, C. Thrandorf, V. Paech, P. Altmeyer, F. G. Bechara: Cutaneous lesions of the nose. In: Head & face medicine, Band 6, 2010, S. 7, ISSN 1746-160X. doi:10.1186/1746-160X-6-7. PMID 20525327. PMC 290354 (freier Volltext). (Review).
- ↑ C. Thomas: Spezielle Pathologie. Schattauer Verlag, 1996, ISBN 3-7945-2110-2, S. 87, (online)
- ↑ Paul Diepgen, Heinz Goerke: Aschoff: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 52.
- ↑ Paolo Castellucci, F. Savoia, A. Farina, G. M. Lima, A. Patrizi: High dose brachytherapy with non sealed 188Re (rhenium) resin in patients with non-melanoma skin cancers (NMSCs): single center preliminary results. In: European Journal of Nuclear Medicine and Molecular Imaging. 2. November 2020, ISSN 1619-7070, doi:10.1007/s00259-020-05088-z (springer.com [abgerufen am 8. Dezember 2020]).
- ↑ pharmazeutische-zeitung.de doi:10.1056/NEJMoa1113713 (NEJM).
- ↑ FDA approves new treatment for most common form of advanced skin cancer. ( vom 27. Juli 2015 im Internet Archive) FDA, Pressemitteilung, 24. Juli 2015; abgerufen am 27. Juli 2015.
- ↑ European Public Assessment Report Odomzo. ema.europa.eu; abgerufen am 7. Oktober 2015.
- ↑ https://www.g-ba.de/downloads/39-261-2672/2016-08-04_AM-RL-XII_Vismodegib_D-213_BAnz.pdf
![Knotiges solides (noduläres) Basaliom[8]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/48/BCC_Nodular_type.jpg/79px-BCC_Nodular_type.jpg)
![Pigmentiertes Basaliom[8]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c4/Pigmented_BCC.jpg/120px-Pigmented_BCC.jpg)
![Sklerodermiformes Basaliom (Morphea-Basaliom)[8]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0d/Scar-like_morphea-like_BCC.jpg/120px-Scar-like_morphea-like_BCC.jpg)