4-Pentensäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 4-Pentensäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H8O2 | |||||||||||||||
| Kurzbeschreibung |
farblose bis hellgelbe[1] Flüssigkeit mit unangenehmem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 100,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,4283 (20 °C, 589 nm)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
4-Pentensäure ist eine lineare, ungesättigte Carbonsäure mit endständiger Doppelbindung, die stark nach Käse riecht und als Aromastoff verwendet wird.[4]
Zukünftig könnte 4-Pentensäure (neben den isomeren 2-Pentensäure und 3-Pentensäure) als Ausgangsstoff für cellulosebasierte Biotreibstoffe Bedeutung erlangen.[6]
Bei aktuellen Überlegungen zur Gewinnung von Adipinsäure, dem Zwischenprodukt für Polyamid 6.6, aus lignocellulosehaltiger Biomasse spielt 4-Pentensäure[7] und ihr Methylester Methyl-4-pentenoat eine bedeutende Rolle.[8][9]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Klassische Laborverfahren zur Darstellung von 4-Pentensäure sind die Malonestersynthese und die Acetessigestersynthese mit Allylbromid[10] oder aus 1,2,3-Tribrompropan (praktisch quantitativ aus Allylbromid und Brom)[11] als modifizierte Malonestersynthese.

Die alkalische Hydrolyse des substituierten Malonesters liefert den substituierten Malonester, wobei das zweite endständiges Bromatom durch das Malonesteranion als Bromwasserstoff abgespalten wird. Hydrolyse und Decarboxylierung führt zum Natriumsalz der 4-Brom-4-pentensäure, die durch Einwirkung von Ethanol und Natrium zur 4-Pentensäure reduziert wird.[12]
Oxidation von 4-Pentenal (aus Cyclopenten[13] oder Acetaldehyddiallylacetal[14]) mit Sauerstoff erzeugt ebenfalls 4-Pentensäure in relativ bescheidenen Ausbeuten (bis 38 %). 4-Pentensäure wird auch bei der Umsetzung von Propiolacton mit Vinylmagnesiumbromid in Gegenwart von Kupfer(I)-chlorid als Katalysator in einer Ausbeute von 59 % erhalten.[15]

Allylalkohol reagiert mit dem Orthoester Trimethylorthoacetat unter Säurekatalyse mit Propionsäure in der Johnson-Variante der Claisen-Umlagerung zum 4-Pentensäuremethylester, der nach alkalischer Hydrolyse und Ansäuern 4-Pentensäure in 70%iger Ausbeute ergibt.[16]
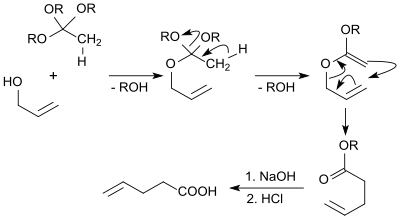
Von technischem Interesse ist die kontinuierliche Isomerisierung insbesondere von 3-Pentensäuremethylester zum 4-Pentensäuremethylester.[17] und Hydrolyse zur 4-Pentensäure. Der erforderliche 3-Pentensäuremethylester fällt in Ausbeuten von >90 % (als ca. 70 % 3-(E)-trans- und 30 % 3-(Z)-cis-Gemisch) bei der Carbonylierung von 1,3-Butadien mit CO und Methanol in Pyridin/3-Picolin-Gemisch mit Dicobaltoctacarbonyl als Katalysator an.[18] Isomerisierung mit Palladium auf sauren Ionenaustauschern oder Zeolithen liefert Isomerengemische mit bis zu 10 Gewichtsprozent 4-Pentensäureester, der destillativ aus dem Gemisch entfernt wird.[19] Die 3-Ester im Destillationssumpf werden in die Isomerisierungsreaktion zurückgeführt.

Trotz Rückführung der unveränderten 3-Pentensäureester ist dieser Weg zu 4-Pentensäure kaum wirtschaftlich.
4-Pentensäure ist eine Komponente des bei der ringöffnenden sauren Hydrolyse von γ-Valerolacton entstehenden Pentensäuregemisches aus insgesamt fünf Isomeren: 4-Pentensäure, 3-Pentensäure (in cis- und trans-Konfiguration) und der thermisch stabilsten 2-Pentensäure (cis und trans).[20] Unter etwas milderen Bedingungen und vollständigem Umsatz der Edukte erfolgt die Reaktion eines γ-Valerolacton/Methanol-Gemisches zu den isomeren Pentensäureestern,[9] aus denen nach Hydrolyse 4-Pentensäure isoliert werden kann.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]4-Pentensäure wirkt korrosiv und verströmt einen strengen Käsegeruch.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Bromverbindungen, wie z. B. N-Bromsuccinimid[21] oder Iod[22] bzw. Iodchlorid[23] überführen 4-Pentensäure praktisch quantitativ in die entsprechenden Halogenmethyl-butyrolactone.

Aus dem Iodmethyl-butyrolacton wird durch Dehydrohalogenierung mittels Diazabicycloundecen DBU das 5-Methylenbutyrolacton erhalten.[16]

4-Pentensäure dient zur Synthese des Monomers 2-(3-Butenyl)-2-oxazolin,

an dessen terminaler Doppelbindung in Homo- und Copolymeren in so genannten Thiol-En-Click-Additionsreaktionen sehr schonend und effizient thiolfunktionalisierte Moleküle addiert werden können.[24]
Durch Einbau von 4-Pentensäure in das neutrale thermoresponsive Polymer N-Isopropylacrylamid werden copolymere sphärische Mikrogele erhalten, deren Durchmesser sich bei pH-Verschiebung drastisch verändern.[25]
4-Pentensäure reagiert mit Schwefelsäure[12] oder Eisentriflat[26] unter intramolekularer Cyclisierung zu γ-Valerolacton.

Die Reaktion ist reversibel und liefert Gemische der isomeren Pentensäuren.
Als Folgeprodukt insbesondere der alkalischen Hydrolyse von γ-Valerolacton, einer Plattformchemikalie aus nachwachsenden Rohstoffen, hat 4-Pentensäure in jüngerer Zeit größere Aufmerksamkeit geweckt. Durch Decarboxylierung an sauren Zeolithen entstehen n-Butene,[27] die an sauren Ionenaustauschern (Amberlyst 70) in einer Gesamtausbeute von 77 % zu C8+-Alkenen di- bzw. oligomerisiert werden können.[6][28] Die erhaltenen Alkene sind nach Hydrierung als biogener Benzin- bzw. Dieselkraftstoff verwendbar.

Die bei der sauren Hydrolyse von γ-Valerolacton anfallenden isomeren Pentensäuren können zu Valeriansäure hydriert und mit Alkoholen zu den entsprechenden Estern umgesetzt werden. Der Valeriansäureethylester hat benzinartige Eigenschaften, die höheren Ester sind als Dieselersatz verwendbar.[29]
Zukunftspotential könnte die Umsetzung der isomeren Pentensäure- bzw. Pentensäureestergemische aus der Hydrolyse von γ-Valerolacton für die Herstellung des Polyamid 6-Monomeren ε-Caprolactam (nach Hydroformylierung zu 5-Formylvaleriansäure[30] und reduktiver Aminierung) bzw. des Polyamid-6.6-Bausteins Adipinsäure[31] durch Carbonylierung in Gegenwart von Wasser mit Palladiumacetat und dem Phosphinligand 1,2-Bis(di-tert-butylphosphinomethyl)benzol unter Verschiebung der Doppelbindung von der 2- und 3- in die 5-Position[7] oder Adipinsäuredimethylester durch Methoxycarbonylierung in Gegenwart von Methanol und dem Hydroformylierungskatalysatorensystem Dicarbonylacetylacetonato-rhodium(I) [Rh(acac)CO)2]/Tris(natrium-meta-sulfonatophenyl)phosphan.[30] Aus dem Adipinsäureester ist die Diolkomponente 1,6-Hexandiol für Polyester oder von Hexamethylendiamin, dem Diaminbaustein für Polyamid 6.6, zugänglich.

In Versuchen an Tieren und an Zellorganellen konnte die Hemmung der Fettsäureoxidation und die blutzuckersenkende Wirkung von 4-Pentensäure nachgewiesen werden.[32][33]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu 4-Pentenoic Acid bei TCI Europe, abgerufen am 15. Mai 2017.
- ↑ a b c d e f g h i j Eintrag zu 4-Pentensäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ Datenblatt 4-Pentenoic Acid bei Sigma-Aldrich, abgerufen am 15. Mai 2017 (PDF).
- ↑ a b c 4-Pentenoic acid. In: thegoodscentcompany.com. The Good Scent Co., abgerufen am 15. Mai 2017 (englisch).
- ↑ R. Madsen, B. Fraser-Reid: 4-Pentenoic Acid. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2002, doi:10.1002/047084289X.ru00128.
- ↑ a b P. Palkovits: Pentensäure als Wegbereiter für cellulosebasierte Biotreibstoffe. In: Angew. Chem. Band 122, Nr. 26, 2010, S. 4434–4436, doi:10.1002/ange.201002061.
- ↑ a b Patent WO2012134397A1: Synthesis of diacids. Angemeldet am 28. März 2012, veröffentlicht am 4. Oktober 2012, Anmelder: Agency for Science, Technology and Research, Singapore, Erfinder: P.K. Wong et al..
- ↑ P.J. Deuss, K. Barta, J.G. de Vries: Homogeneous catalysis for the conversion of biomass and biomass-derived platform chemicals. In: Catal. Sci. Technol. Band 4, 2014, S. 1174–1196, doi:10.1039/C3CY01058A (rsc.org).
- ↑ a b Patent WO2012131027A1: Process for the preparation of alkanoic acid esters in a carbonylation process using palladium bidentate bisphosphonate ligands. Angemeldet am 30. März 2012, veröffentlicht am 4. Oktober 2012, Anmelder: DSM IP Assets B.V., Erfinder: J.G. de Vries, N. Sereinig, E.W.M. van de Vordervoort, M.C.C. Janssen.
- ↑ A. Messerschmidt: Untersuchungen über die ungesättigten Säuren. Ueber die Allylessigsäure und das Valerolacton. In: Justus Liebigs Ann. Chem. Band 208, Nr. 1–2, 1881, S. 92–104, doi:10.1002/jlac.18812080107.
- ↑ J.R. Johnson, W.L. McEwen: 1,2,3-Tribromopropane In: Organic Syntheses. 5, 1925, S. 99, doi:10.15227/orgsyn.005.0099; Coll. Vol. 1, 1941, S. 209 (PDF).
- ↑ a b F.C. Whitmore: Organic Chemistry, Volume 1, reissued 2012. Van Nostrand, New York 1951, ISBN 978-0-486-31115-9, S. 12.
- ↑ Patent US8362296B2: Process for preparing 4-pentenoic acid. Angemeldet am 19. August 2010, veröffentlicht am 29. Januar 2013, Anmelder: BASF SE, Erfinder: J.H. Teles, M. Schelper, K. Gumlich, M. Chabanas, C. Müller, A. Meier.
- ↑ S. Günther: Synthese von Polymeren ausgehend vom nachwachsenden Rohstoff Glycerin, Dissertation. Universität Hamburg 2012 (uni-hamburg.de [PDF]).
- ↑ T. Sato, T. Kawara, M. Kawashima, T. Fujisawa: Copper-catalyzed reaction of Grignard reagents with β-propiolactones: A convenient method for the synthesis of β-substituted propionic acids. In: Chem. Lett. Band 9, Nr. 5, 1980, S. 571–574, doi:10.1246/cl.1980.571.
- ↑ a b V. Jäger, H.J. Günther: Synthesis of γ-methylene butyrolactones (4-penten-4-olides). In: Tetrahedron Lett. Band 18, Nr. 29, 1977, S. 2543–2546, doi:10.1016/S0040-4039(01)83815-6.
- ↑ Patent EP0266689B1: Verfahren zur Herstellung von 4-Pentensäureestern. Angemeldet am 30. Oktober 1987, veröffentlicht am 2. Januar 1992, Anmelder: BASF AG, Erfinder: W. Hoelderich, H. Aichinger, F. Naeumann, R. Fischer.
- ↑ Patent DE3040432A1: Verfahren zur Herstellung von 3-Pentensäureestern. Angemeldet am 27. Oktober 1980, veröffentlicht am 19. Mai 1981, Anmelder: Mitsubishi Gas Chemical Co., Inc., Erfinder: N. Isogai, M. Hosokawa, T. Okawa, N. Wakui, T. Watanabe.
- ↑ Patent EP0157311A2: Verfahren zur Abtrennung von 4-Pentensäuremethylester aus solchen und 3-Pentensäuremethylester enthaltenden Gemischen. Angemeldet am 22. März 1985, veröffentlicht am 9. Oktober 1985, Anmelder: BASF AG, Erfinder: H.-W. Schneider, R. Kummer, D. Zimmerling.
- ↑ Patent WO2012134397A1: Synthesis of diacids. Angemeldet am 28. März 2012, veröffentlicht am 4. Oktober 2012, Anmelder: Agency for Science, Technology and Research, Erfinder: P.K. Wong et al..
- ↑ Y.A. Cheng et al.: Efficient medium ring size bromolactonization using a sulfur-based zwitterionic catalyst. In: J. Am. Chem. Soc. Band 134, Nr. 40, 2012, S. 16492–16495, doi:10.1021/ja307210n.
- ↑ R.D. Crouch, A. Tucker-Schwartz, K. Barker: Iodolactonization of 4-pentenoic acid. In: J. Chem. Educ. Band 83, Nr. 6, 2006, S. 921, doi:10.1021/ed083p921.
- ↑ N. Windmon, V. Dragojlovic: Phase-vanishing halolactonization of neat substances. In: Beilstein J. Org. Chem. Band 4, 2008, S. 29, doi:10.3762/bjoc.4.29.
- ↑ A. Gress, A. Völkel, H. Schlaad: Thio-click modification of poly[2-(3-butenyl)-2-oxazoline]. In: Macromolecules. Band 40, Nr. 22, 2007, S. 7928–7933, doi:10.1021/ma71357r.
- ↑ M. Karg, I. Pastoriza-Santos, B. Rodriguez-Gonzá, R. von Klitzing, S. Wellert, T. Hellweg: Temperature, pH, and ionic strength induced changes in the swelling behavior of PNIPAM-Poly(allyl acetic acid) copolymer microgels. In: Langmuir. Band 24, Nr. 12, 2008, S. 6300–6306, doi:10.1021/la702996p.
- ↑ K. Komeyama, Y. Mieno, S. Yukawa, T. Morimoto, K. Takaki: Cationic iron-catalyzed addition of carboxylic acids to olefins. In: Chem. Lett. Band 36, Nr. 6, 2007, S. 752–753, doi:10.1246/cl.2007.752.
- ↑ J.Q. Bond, D. Wang, D.M. Alonso, J.A. Dumesic: Interconversion between γ-valerolactone and pentenoic acid combined with decarboxylation to form butene over silica/alumina. In: J. Catal. Band 281, Nr. 2, 2011, S. 290–299, doi:10.1016/j.jcat.2011.05.011.
- ↑ J.Q. Bond, D.M. Alonso, D. Wang, R.M. West, J.A. Dumesic: Integrated catalytic conversion of γ-valerolactone to liquid alkenes for transportation fuels. In: Science. Band 327, Nr. 5969, 2010, S. 1110–1114, doi:10.1126/science.1184362.
- ↑ J.-P. Lange, R. Price, P.M. Ayoub, J. Louis, L. Petrus, L. Clark, H. Gosselink: Valeric biofuels: A platform of cellulosic transportation fuels. In: Angew. Chem. Band 122, Nr. 26, 2010, S. 4581–4585, doi:10.1002/ange.201000655.
- ↑ a b Patent WO2014111446A1: Process for the preparation of formylvaleric acid and adipic acid. Angemeldet am 16. Januar 2014, veröffentlicht am 24. Juli 2014, Anmelder: DSM IP Assets B.V., Erfinder: R.F.M.J. Parton, M.C.C. Janssen, B. Engendahl, J.G. de Vries.
- ↑ J.-P. Lange, J.Z. Vestering, R.J. Haan: Towards 'bio-based' Nylon: Conversion of γ-valerolactone to methyl pentenoate under catalytic distillation conditions. In: Chem. Commun. Band 33, 2007, S. 3488–3490, doi:10.1039/B705782B.
- ↑ C. Corredor, K. Brendel, R. Bressler: Studies on the mechanism of the hypoglycemic action of 4-pentenoic acid. In: Proc. Natl. Acad. Sci. USA. Band 58, Nr. 6, 1967, S. 2299–2306, PMC 223835 (freier Volltext).
- ↑ H. Schulz: Metabolism of 4-pentenoic acid and inhibition of thiolase by metabolites of 4-pentenoic acid. In: Biochemistry. Band 22, Nr. 8, 1983, S. 1827–1832, doi:10.1021/bi00277a013.

