PyBOP
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | PyBOP | ||||||||||||||||||
| Andere Namen |
Benzotriazol-1-yl-oxytripyrrolidinophosphoniumhexafluorophosphat | ||||||||||||||||||
| Summenformel | C18H28F6N6OP2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 520,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest, kristallin | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Dichlormethan[1], Chloroform, Dimethylformamid, Dimethylsulfoxid, N-Methylpyrrolidon, Tetrahydrofuran, Acetonitril, Aceton[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
PyBOP (Benzotriazol-1-yl-oxytripyrrolidinophosphonium-hexafluorophosphat) zählt zu den organischen Phosphoniumsalzen und wird als Kupplungsreagenz in der Peptidsynthese eingesetzt. Diese von der Gruppe um Castro 1990 eingeführte[1] Verbindung stellt eine Weiterentwicklung des Phosphoniumsalzes BOP dar, welche nicht wie letztere hochgradig toxisches HMPT nach erfolgter Kupplung freisetzt.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Die ursprüngliche Synthese von PyBOP geht aus von Tripyrrolidinophosphinoxid, welches mittels Phosgen in das Chlorophosphoniumsalz überführt wird. Im Anschluss wird mit dem Triethylammoniumsalz des 1-Hydroxybenzotriazols (HOBt) umgesetzt, welches aus HOBt und Triethylamin (Et3N) zugänglich ist, wodurch ein Chlorid gegen OBt substituiert wird. Den letzten Schritt bildet der Austausch des Chlorid-Anions gegen ein schwach koordinierendes Hexafluorophosphat-Anion.[4] Anstelle von gasförmigem Phosgen kann auch festes Triphosgen[5], oder Phosphorylchlorid[1] eingesetzt werden.
Das strukturverwandte BOP lässt sich ebenso über diesen Weg darstellen.[4] Im BOP sind lediglich die Pyrrolidino- bzw. Pyrrolidin-1-id- durch Dimethylamidgruppen substituiert.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Die Verbindung ist thermisch instabil. Eine DSC-Messung zeigt ab 121 °C eine sehr stark exotherme Zersetzungsreaktion mit einer Wärmetönung von −1020 kJ·kg−1 bzw. −530,8 kJ·mol−1.[6]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Kupplungsreagenz[Bearbeiten | Quelltext bearbeiten]
PyBOP wird in der Peptidsynthese als Kupplungsreagenz eingesetzt. Hierbei wird die Aktivierung über das Phosphoniumsalz 2 oder den OBt-Aktivester 3 realisiert. Letzterer ist dafür bekannt, Racemisierung zu unterdrücken, reagiert aber auch langsamer mit einem Amin 4 zum Peptid bzw. allgemein zum Amid. Eine Triebkraft der Reaktion stellt die Bildung von stabilem Phosphorsäuretriamid 5 dar.[7]
B steht in diesem Schema für Base. Meist wird PyBOP zusammen mit DIPEA eingesetzt.
Andere Reaktionen[Bearbeiten | Quelltext bearbeiten]
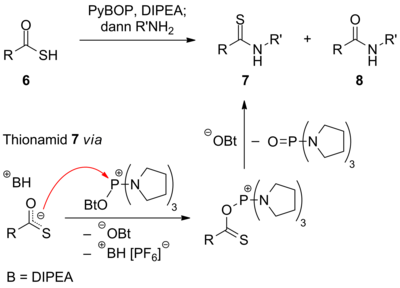
Mittels PyBOP lassen sich auch Thiolsäureester 6 mit Aminen verknüpfen, wobei jedoch neben dem Amid 8 das Thionamid 7 gebildet wird, wodurch ein einfacher Zugang zu dieser Stoffklasse geschaffen wird. Die typische Synthese von Thionamiden verläuft unter Reaktion eines Amids mit Lawessons Reagenz. Der Grund für die hier dargestellte O/S-Selektivität liegt in der stärkeren Bindung von Phosphor an Sauerstoff.[8]
Durch Reaktion von Amiden mit PyBOP/DIPEA lassen sich Nitrile darstellen. Auch hier greift der Sauerstoff der Carbonylgruppe nucleophil das Phosphoratom des PyBOPs an. In Gegenwart von Base werden das Hexafluorophosphat-Anion, HOBt und das Phosphorsäuretriamid abgespalten. Die Abstraktion des Imin-Wasserstoffatoms kann durch das OBt-Anion (im Schema gezeigt) oder direkt durch die Base geschehen.[9]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e J. Coste, D. Le-Nguyen, B. Castro: PyBOP®: A new peptide coupling reagent devoid of toxic by-product. In: Tetrahedron Lett. 31. Jahrgang, Nr. 2, 1990, S. 205–208, doi:10.1016/S0040-4039(00)94371-5.
- ↑ e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für (1H-Benzotriazol-1-yloxy)tripyrrolidinophosphonium Hexafluorophosphate, abgerufen am 1. Juli 2014.
- ↑ a b Datenblatt (Benzotriazol-1-yloxy)tripyrrolidinophosphonium hexafluorophosphate, 98% bei Sigma-Aldrich, abgerufen am 3. Mai 2013 (PDF).
- ↑ a b J.-R. Dormoy, B. Castro: The reaction of hexamethyl phosphoric triamide (HMPT) with phosphoryl chloride: A reexamination. Application to a novel preparation of BOP reagent for peptide coupling. In: Tetrahedron Lett. 20. Jahrgang, Nr. 35, 1979, S. 3321–3322, doi:10.1016/S0040-4039(01)95397-3.
- ↑ I. A. Rivero, R. Somanathan, L. H. Hellberg: Improved Syntheses of Peptide Coupling Reagents BOP and PyBOP Using Triphosgene. In: Synth. Commun. 25. Jahrgang, Nr. 14, 1995, S. 2185–2188, doi:10.1080/00397919508015899.
- ↑ Sperry, J.B.; Minteer, C.J.; Tao, J.; Johnson, R.; Duzguner, R.; Hawksworth, M.; Oke, S.; Richardson, P.F.; Barnhart, R.; Bill, D.R.; Giusto, R.A.; Weaver, J.D.: Thermal Stability Assessment of Peptide Coupling Reagents Commonly Used in Pharmaceutical Manufacturing in Org. Process Res. Dev. 22 (2018) 1262–1275, doi:10.1021/acs.oprd.8b00193.
- ↑ E. Frérot, J. Coste, A. Pantaloni, M.-N. Dufour, P. Jouin: PyBOP® and PyBroP: Two reagents for the difficult coupling of the α,α-dialkyl amino acid, Aib. In: Tetrahedron. 47. Jahrgang, Nr. 2, 1991, S. 259–270, doi:10.1016/S0040-4020(01)80922-4.
- ↑ T. Høeg-Jensen, C. E. Olsen, A. Holm: Thioacylation Achieved by Activation of a Monothiocarboxylic Acid with Phosphorus Reagents. In: J. Org. Chem. 59. Jahrgang, Nr. 6, 1994, S. 1257–1263, doi:10.1021/jo00085a010.
- ↑ D. S. Bose, A. V. Narsaiah: Use of PyBOP as a Convenient Activator for the Synthesis of Nitriles from Primary Amides. In: Synthesis. Nr. 3, 2001, S. 373–375, doi:10.1055/s-2001-11447.