Senfgas
| Dieser Artikel wurde in der Redaktion Chemie zur Verbesserung eingetragen. Hilf mit, ihn zu bearbeiten, und beteilige dich an der Diskussion! |
Folgendes muss noch verbessert werden:
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||
| Name | Senfgas | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C4H8Cl2S | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 159,07 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
1,2741 g·cm−3 (20 °C) [3] | |||||||||
| Schmelzpunkt |
13–14 °C [3] | |||||||||
| Siedepunkt |
216,8 °C [3] | |||||||||
| Dampfdruck |
9,33 Pa (20 °C) [3] | |||||||||
| Löslichkeit |
0,48 g·l−1 in Wasser (20 °C) [3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK |
Für krebserzeugende Stoffe wird generell kein MAK-Wert vergeben. [3] | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Lost ist ein Trivialname für die Chemikalie Bis(2-chlorethyl)sulfid, ein hautschädigender chemischer Kampfstoff, der besonders unter dem Namen Senfgas bekannt wurde. Weitere Bezeichnungen sind Schwefellost, S-Lost, Gelbkreuzgas, Yperit oder Schwefelyperit. Der NATO-Code lautet HD.
Geschichte
Die Herstellung gelang erstmals im Jahr 1822 durch den belgischen Chemiker César-Mansuète Despretz, der beim Experimentieren mit Ethen und Schwefeldichlorid die Entstehung einer übelriechenden Flüssigkeit beobachtete. Dem Franzosen Alfred Riche gelang 1854 die Herstellung aus Chlor und Diethylsulfid. Im Jahr 1886 wurde die Chemikalie von dem deutschen Chemiker Victor Meyer erstmals vollständig beschrieben. Der Vorschlag zur Verwendung als Giftgas kam von den beiden deutschen Chemikern Lommel und Steinkopf, beides Mitarbeiter von Fritz Haber am Kaiser-Wilhelm-Institut, im Jahr 1916. Der Name Lost entstand aus den beiden ersten Buchstaben ihrer Nachnamen.
Erster Weltkrieg
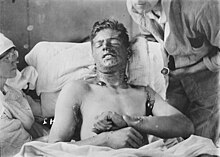
Am 12. Juli 1917 setzten die deutschen Truppen das erste Mal Senfgas ein, um die Ausgangslage für den erwarteten britischen Angriff bei Ypern zu verbessern (daher der Name Yperit). Senfgas wurde wegen der entstellenden Verletzungen, die es verursacht, im letzten Jahr des Ersten Weltkrieges zu einer der gefürchtetsten Waffen. Allerdings wurden durch Senfgas weitaus weniger Soldaten getötet als durch Phosgen.
Zweiter Weltkrieg
Während des Zweiten Weltkrieges wurden Senfgasbomben, soweit bekannt, nur ein einziges Mal eingesetzt. Dies geschah bei der Sprengung einer Brücke und dem Verminen einer Straßensperre durch polnische Truppen in der Nähe von Jasło. Dabei wurden am 8. September 1939 zwei deutsche Soldaten getötet und zwölf verwundet. Man geht aber davon aus, dass dies die Entscheidung eines einzelnen polnischen Offiziers war. Aus diesem Grund unterblieben von Seiten der deutschen Truppen Vergeltungsmaßnahmen. [6]
Am 2. Dezember 1943 bombardierte die deutsche Luftwaffe den italienischen Hafen von Bari. Dabei wurde der unter anderem mit Senfgasgranaten beladene US-Frachter John Harvey getroffen und versenkt. Ein Teil der Ladung lief ins Wasser, ein anderer Teil wurde durch die Explosionen und die Brände in der Luft verteilt. Da auf Grund der Geheimhaltung nur wenige Personen in Bari von der Existenz dieser Ladung wussten und diese allesamt umkamen, konnten die Verwundeten zunächst nicht richtig behandelt werden. Genaue Zahlen über die Opfer existieren nicht. Es wird geschätzt, dass über 600 Soldaten und Angehörige der Handelsmarine verätzt wurden, von denen etwa 100 starben. Die Zahl der getöteten Zivilisten dürfte um die 1000 betragen. Dieser Vorfall hätte beinahe eine weitere Eskalation des Krieges ausgelöst, da die Alliierten zunächst davon ausgingen, dass das Giftgas von den Deutschen abgeworfen worden war. Eine im Hafenbecken gefundene Gasbombe wurde aber noch rechtzeitig als amerikanisches Modell identifiziert, so dass die Alliierten keinen "Gegenschlag" durchführten.
Während der NS-Zeit wurde bis 1942 in Munster[7] und in Ammendorf bei Halle von der Firma ORGACID GmbH S-Lost produziert, kam aber im Zweiten Weltkrieg nicht zum Einsatz. Unter dem ehemaligen Ammendorfer Firmengelände an der heutigen Camillo-Irmscher-Straße liegen acht weitverzweigte grüngeflieste Zisternen, die auf Grund fehlender Baupläne nur schwer zu entgiften waren und nach der Wende hermetisch versiegelt worden sind. Im Jahre 1990 wurden noch 30 Tonnen Giftstoffe durch das Grundwasser an die Oberfläche transportiert.
Nach 1945
Nach den beiden Weltkriegen wurde ein Großteil der verbliebenen deutschen Senfgasbestände in der Ostsee versenkt. Da das Lost aber allmählich aus den mittlerweile lecken Fässern austritt, finden sich an Stränden der Ostsee immer wieder kleine Lost-Klumpen, die Bernstein ähnlich sehen, aber ziemlich weich sind. Bei Hautkontakt können sich Verätzungen bilden. Der nicht versenkte Teil wird seit einigen Jahren durch die Gesellschaft des Bundes für Kampfmittelbeseitigung (GEKA) in einer Delaborierungs- und Verbrennungsanlage in Munster entsorgt.
Einsätze in weiteren Konflikten
Lost wurde in folgenden Konflikten eingesetzt: [8]
- England während einer Intervention im Russischen Bürgerkrieg im Jahre 1919
- Spanien gegen Marokko in den Jahren 1923 bis 1926
- Italien gegen Libyen im Jahre 1930
- Sowjetunion in Xinjiang, einer Provinz der Republik China, im Jahre 1930
- Italien gegen Äthiopien in den Jahren 1935 bis 1940
- Polen gegen Deutschland im Jahr 1939 [6]
- Japan gegen die Republik China in den Jahren 1937 bis 1945
- Ägypten gegen Nordjemen in den Jahren 1963 bis 1967
- Irak gegen Iran in den Jahren 1983 bis 1988
- Irak gegen Kurden bei dem Giftgasangriff auf Halabdscha im Jahre 1988
Eigenschaften
Loste sind keine Gase, sondern Flüssigkeiten. N-Lost, hier HN-3, wird allerdings im Allgemeinen als Hydrochlorid, also als Feststoff, eingesetzt. Diese werden durch die Zerlegerladung (bei Granaten) oder eine geeignete Sprühvorrichtung in Form von Flüssig-Aerosolen oder, im Fall von N-Lost-Hydrochlorid, in Feststoff-Aerosole freigesetzt. Vermutlich wurde nach dem Ersteinsatz von Chlorgas der Begriff Giftgas unterschiedslos für alle anderen Kampfstoffe übernommen. Sowohl S-Lost als auch N-Lost wurden auf Grund der Kennzeichnung der damit gefüllten Munition als Gelbkreuzkampfstoffe bezeichnet. Lost durchdringt poröses Material und manche Gummi- und Kunststoffarten. Teilweise werden die Kampfstoffe mit Wachsen, Harzen oder Kunststoffen angereichert, um Zäh-Lost zu schaffen, welches an Materialien haften bleibt und somit schwieriger zu entgiften ist.
Alle nachfolgend genannten Lost-Arten sind in der Anlage 1 der Ausführungsverordnung zum Chemiewaffenübereinkommen gelistet.[9]
Schwefelloste (S-Lost)
Die Gruppe der Schwefelloste umfasst 9 Chemikalien:
| Chemikalie | Code | Trivialname | CAS-Nr. | PubChem | Struktur |
|---|---|---|---|---|---|
| Bis(2-chlorethyl)sulfid | H/HD | Lost, Senfgas | 505-60-2 | 10461 | |
| 1,2-Bis-(2-chlorethylthio)-ethan | Q | Sesqui-Yperit | 3563-36-8 | 19092 | |
| Bis-(2-chlorethylthioethyl)-ether | T | Oxol-Lost | 63918-89-8 | 45452 | |
| 2-Chlorethylchlormethylsulfid | 2625-76-5 | ||||
| Bis-(2-chlorethylthio)-methan | HK | 63869-13-6 | |||
| Bis-1,3-(2-chlorethylthio)-n-propan | 63905-10-2 | ||||
| Bis-1,4-(2-chlorethylthio)-n-butan | 142868-93-7 | ||||
| Bis-1,5-(2-chlorethylthio)-n-pentan | 142868-94-8 | ||||
| Bis-(2-chlorethylthiomethyl)-ether | 63918-90-1 |
Reines S-Lost ist geruch- und farblos; der typische knoblauchähnliche Geruch entsteht, da S-Lost im Allgemeinen aus praktischen Gründen nur in technischer Qualität synthetisiert wird und die hierin in Spuren vorhandenen Neben- und Zersetzungsprodukte geruchlich dem Duftstoff von Knoblauch (Allicin) ähneln. Weiterhin ist das technische Produkt meist mit kolloidal gelöstem Schwefel verunreinigt und erscheint deswegen milchig bis gelblich.[2]
Während des ersten Weltkrieges wurde festgestellt, dass im Oxol-Verfahren gewonnener Rohlost giftiger als anders gewonnener Reinlost war. Die Ursache dafür waren geringe Mengen Oxol-Lost, welches deutlich giftiger ist. Dies wurde erst nach Ende des Krieges nachgewiesen.
Neben dem normalen S-Lost wurde während des 1. Weltkrieges auch das sogenannte Winterlost hergestellt. Um den Gefrierpunkt zu senken gab man dem S-Lost z. B. Arsinöl hinzu oder vermischte es mit anderen Losten.
Als weitere Mischungen sind u. a. bekannt:
- HL (HD + Lewisit (L))
- HT (HD + T)
- HM (HT + Q + Phenylarsindichlorid (PD))
- HQ (H + Q + Arsinöl)
- HS (HD + HN)
Stickstoffloste (N-Lost)
N-Loste (oder Stickstoffloste) gehören ebenfalls zu den Hautkampfstoffen. Im Gegensatz zum bekannteren S-Lost basiert das chemische Grundgerüst der N-Loste aber nicht auf Schwefel, sondern auf Stickstoff. N-Loste wirken weniger korrosiv als S-Loste. Im Allgemeinen verläuft die Heilung von N-Lost-Wunden besser als die von S-Lost-Wunden.
Die Gruppe der Stickstoffloste umfasst 3 Chemikalien:
| Chemikalie | Code | Trivialname | CAS-Nr. | PubChem | Struktur |
|---|---|---|---|---|---|
| Bis-(2-chlorethyl)-ethylamin | HN-1 | Ethyl-S | 538-07-8 | 10848 | 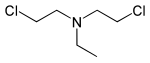
|
| Bis-(2-chlorethyl)-methylamin | HN-2 | Mechlorethamin, Chlormethin | 51-75-2 | 4033 | 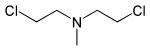
|
| Tris-(2-chlorethyl)-amin | HN-3 | Trichlormethin | 555-77-1 | 5561 | 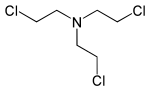
|
HN-1 wurde Anfang der 1930er Jahre als Warzenentferner entwickelt; erst später stellte sich seine militärische Nutzbarkeit heraus.
HN-2 wurde zunächst als Kampfstoff entwickelt. Später stellte man daraus ein Medikament gegen Lymphknotenkrebs her (Chlormethin, CAS 55-86-7)[10]
Toxizität
Hauptexpositionswege der Loste sind die perkutane oder die inhalatorische Aufnahme von Dämpfen (nur bei S-Lost). Lost ist ein starkes Hautgift und erwiesenermaßen krebserregend. Die Wirkung auf die Haut ist vergleichbar mit starken Verbrennungen oder Verätzungen. Es bilden sich große, stark schmerzende Blasen. Die Verletzungen heilen schlecht. Das Gewebe wird nachhaltig zerstört und die Zellteilung gehemmt. Großflächig betroffene Gliedmaßen müssen meistens amputiert werden. Werden die Dämpfe eingeatmet, so werden die Bronchien zerstört.
Eine Entgiftung der Haut kann durch eine sofortige Behandlung durch Abwaschen mit starker Seifenlauge oder durch Besprühen der betroffenen Stellen mit Chlorkalk erfolgen. Ein Abdecken der betroffenen Körperregionen, beispielsweise durch Kleidung oder Decken, ohne vorherige Entgiftung, verschlimmert die Symptome zusätzlich.
Die toxische Wirkung beider Lost-Varianten kommt durch die Bildung von hochreaktiven Verbindungen durch einen intramolekularen SN1-Angriff des Stickstoffs oder Schwefels auf das an das Chlor gebundene Kohlenstoffatom zustande (Nachbargruppeneffekt). Dabei bildet sich im Falle von N-Lost ein Aziridiniumion oder Thiiran im Falle des S-Lost. In beiden Fällen bildet sich zusätzlich Chlorwasserstoff, welcher mit Wasser zu Salzsäure reagiert.
Das Auge reagiert am empfindlichsten auf S-Lostdampf. Die Folge ist eine im glimpflichen Fall vorübergehende Erblindung, da das massive Lidödem eine aktive Augenöffnung verhindert. Die Augen sind bis zu einem gewissen Grad in der Lage, sich zu regenerieren. Daher bestehen oftmals gute Heilungschancen und Aussicht auf das Wiedererlangen der Sehkraft, allerdings kann das einige Monate dauern.
Herstellung von S-Lost
Ursprüngliches Verfahren
S-Lost entsteht durch die elektrophile Addition von Schwefeldichlorid an Ethen. (Das S2Cl2 wird zu SCl2 und Schwefel).

Bei der großtechnischen Herstellung benutzte man größtenteils gusseiserne, mit Blei ausgekleidete Behälter mit eingebautem Rührwerk. Man füllte sie mit S2Cl2 und blies durch ein Rohr am Boden unter Rührung Ethen ein. Nach Beendigung der Reaktion ließ man das Dichlordiethylsulfid durch ein Absetzbecken laufen, um den entstandenen Schwefel zu entfernen. Eine weitere Konzentrierung fand nicht statt.
Modernes Verfahren
Durch die Umsetzung von Natriumhydrogensulfid mit Ethylenoxid wird als Zwischenprodukt ein Dihydroxythioether erhalten. Dieser wird dann mit in weiterem Reaktionsschritt Thionylchlorid zu Lost chloriert.

Lagerbestände
Stand 2003 (AC-Schutzzentrum Spiez):
- Russland: 40.000 t (militärisch nicht mehr einsetzbar; Vernichtungsprogramm in den Anfängen)
- USA: 31.500 t (davon ca. 25 % zerstört)
- Indien: mehrere tausend Tonnen (aktives Vernichtungsprogramm)
- Iran: mehrere hundert Tonnen
- Südkorea: mehrere tausend Tonnen (aktives Vernichtungsprogramm)
- Nordkorea: mehrere tausend Tonnen
Schutzmaßnahmen
Wegen der hohen Hautgängigkeit und des verzögerten Wirkungseintritts kommt dem Schutz der Körperoberfläche besondere Bedeutung zu. Die Aufnahme durch die Haut erfolgt leicht und ohne auffällige Anzeichen wie Nässe- oder Kältegefühl. Das Opfer bemerkt in der Regel die Vergiftung nicht.
Die Fähigkeit, normale Textilien zu durchdringen, macht diese Stoffe besonders gefährlich. Die gängigen Schutzmittel – Maske und Schutzanzug – bieten jedoch über einen Zeitraum von derzeit mindestens 6 Stunden, zukünftig 24 Stunden, sicheren Schutz vor der Einwirkung.
Für die Dekontamination können unter anderem Oxidationsmittel (z. B. Chlorkalk oder Calciumhypochlorit), alkalische Lösungen und nichtwässrige Medien, z. B. Aminoalkoholate, verwendet werden, da Lost zum einen empfindlich gegenüber Oxidationsmitteln ist und zum anderen die Hydrolyse einmal gelösten Losts sehr schnell verläuft.
Nutzung von Lost-Derivaten in der Medizin
Die Erfahrungen mit der die Zellteilung hemmenden Wirkung von Senfgas führten dazu, dass nach dem Ersten Weltkrieg die ersten Zytostatika auf der Basis von Stickstofflost entwickelt und in der Krebstherapie eingesetzt wurden. Allerdings waren die originalen Kampfgase für die medizinische Verwendung noch viel zu giftig. Beispiele für erfolgreiche Krebsmedikamente auf Lost-Basis sind Cyclophosphamid, Ifosfamid und Chlorambucil.
Siehe auch
Einzelnachweise
- ↑ MSDS bei Castleview
- ↑ a b wissenschaft-online: Eintrag zum Bis(2-chlorethyl)sulfid im Lexikon der Biologie/Chemie
- ↑ a b c d e f Eintrag zu Bis(2-chlorethyl)sulfid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Günter Hommel: Handbuch der gefährlichen Güter. Transport - Gefahrenklassen, Merkblatt 2298, 2002, Springer-Verlag, ISBN 3540203486
- ↑ a b Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Günther W. Gellermann: Der Krieg, der nicht stattfand. Bernard&Graefe Verlag, Koblenz 1986, ISBN 3-7637-5804-6
- ↑ http://www.lostplaces.de/cms/content/view/108/33/
- ↑ http://www.fas.org/bwc/papers/review/cwtable.htm
- ↑ http://bundesrecht.juris.de/cw_v/index.html
- ↑ http://www.tiscali.co.uk/lifestyle/healthfitness/health_advice/netdoctor/archive/100001771.html
Weblinks
- Sicherheitsdatenblatt zu Lost/Senfgas (englisch)
- Datenblatt zu HN-1
- Fact-Sheet (LABOR SPIEZ) (PDF)
- Mustard: An Ambiguous Term (englisch; PDF)
- Henning Sietz: Es riecht nach Senf! Auf Einladung der Sowjets erprobten deutsche Militärs zwischen 1926 und 1933 an der Wolga chemische Kampfstoffe. In: Die Zeit Nr. 26 vom 22. Juni 2006.
- Senfgas in Medicine-Worldwide (Archiv)
- Abbauprodukte für die Wirkungspfade Boden-Mensch und Boden-Gewässer (PDF)
- Bundesamt für Zivilschutz: Zivilschutz-Forschung – Das Verhalten von Umweltchemikalien in Boden und Grundwasser (PDF)
- Beschreibung der deutschen Produktionsanlagen in Munster
- Übersichtsartikel zu den med. Aspekten von S-Lostvergiftungen] (englisch); PMID 16084004