Glyoxal
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Glyoxal | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C2H2O2 | ||||||||||||||||||
| Kurzbeschreibung |
gelbe Flüssigkeit mit charakteristischem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 58,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[2] | ||||||||||||||||||
| Dichte |
1,14 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (600 g·l−1 bei 20 °C, Glyoxalhydrat)[3] | ||||||||||||||||||
| Brechungsindex |
1,3826 (20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Glyoxal (nach IUPAC-Nomenklatur: Oxalaldehyd oder auch Ethandial) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Aldehyde. Aufgrund seiner Bifunktionalität dient es als vielseitiges chemisches Zwischenprodukt mit zahlreichen Anwendungen. Als Bulkware kommt Glyoxal als 40%ige wässrige Lösung in den Handel.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Glyoxal kommt als Spurengas in der Atmosphäre vor, als Abbauprodukt von Kohlenwasserstoffen.[6] Die troposphärischen Konzentrationen liegen hierbei bei üblicherweise 0–200 pptv, in verschmutzten Regionen bis zu 1 ppbv.[7]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die großtechnische Herstellung von Glyoxal erfolgt heute praktisch ausschließlich durch zwei verschiedene Verfahren, die sich in den Aspekten Umsatz, Selektivität, Ausbeute und Rentabilität durchgesetzt haben.
Laporte-Verfahren[Bearbeiten | Quelltext bearbeiten]
Im Laporte-Prozess wird Ethylenglycol durch Gasphasenoxidation mit Sauerstoff in Gegenwart von metallischen Silber- oder Kupferkatalysatoren bei Temperaturen von 400–600 °C zu Glyoxal und Wasser umgesetzt. Die Ausbeute beträgt bei diesem Verfahren ca. 70–80 %. Die komplette Reaktion wird in Rohrreaktoren durchgeführt. Die Aufarbeitung erfolgt mithilfe einer mehrstufigen Destillation in Rektifikationskolonnen, um Nebenprodukte wie Formaldehyd abzutrennen.[8]

Salpetersäure-Oxidation[Bearbeiten | Quelltext bearbeiten]
Das zweite, industriell bedeutende Verfahren zur Herstellung von Glyoxal geht von Acetaldehyd aus, das durch Salpetersäure bei 40 °C zu Glyoxal oxidiert wird. Dabei werden Ausbeuten von ca. 70 % erreicht. Die Aufarbeitung erfolgt mithilfe Ionentauscherharzen, um Essigsäure, Ameisensäure sowie Glyoxylsäure abzutrennen.[8]
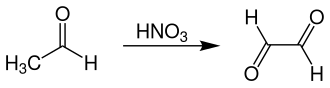
Des Weiteren sind noch andere Methoden zur Synthese bekannt, wie etwa die Oxidation von Acetaldehyd mit Seleniger Säure, Selendioxid oder Luftsauerstoff mit Palladium-Katalysatoren.[2]
Die Chemische Industrie handelt und vertreibt Bulkware von Glyoxal ausschließlich als 40%ige wässrige Lösung. Weltweit größter Hersteller ist die BASF SE mit ihrer Glyoxalanlage am Verbundstandort in Ludwigshafen in Deutschland. Diese hat eine Jahreskapazität von ca. 80.000 Tonnen Glyoxal, das in Tankcontainern sowie als Fass- und IBC-Ware angeboten wird.[9]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Glyoxal hat als Reinstoff eine Dichte von 1,14 g·cm−3 bei 20 °C, eine relative Gasdichte von 2,00 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und einen Dampfdruck von 293 hPa bei 20 °C. Eine 40%ige wässrige Lösung hat bei 20 °C eine Dichte von 1,27 g·cm−3 und einen Dampfdruck von 24 hPa. Flüssiges und festes Glyoxal ist gelb; die Dämpfe sind grün.[10][2]
Chemische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Glyoxal ist eine Flüssigkeit aus der Stoffgruppe der (zweiwertigen) Aldehyde. Bei 20 °C in wasserfreier Form ist er flüssig, unterhalb des Schmelzpunktes bildet er gelbe Kristalle. Aufgrund seiner Bifunktionalität neigt er zu Polymerisationsreaktionen. Aus diesem Grund wird Glyoxal ausschließlich als 40%ige wässrige Lösung gehandelt, bei der er als Gemisch von Dihydrat und verschiedenen Oligomeren vorliegt. Außerdem geht Glyoxal die für Aldehyde typische Reaktionen ein und kann so durch Oxidationsmittel zu Glyoxylsäure sowie anschließend zu Oxalsäure umgesetzt werden. Mit Reduktionsmitteln zerfällt es wieder in seine Ausgangsverbindungen Ethylenglycol oder Acetaldehyd. Mit alkalischen Verbindungen geht Glyoxal eine intramolekulare Cannizzaro-Reaktion ein und bildet Glycolate, also Salze der Glycolsäure. Mit Ammoniak, Aminen und Amiden sowie sonstigen Stickstoffverbindungen reagiert Glyoxal ebenfalls. Bei einer Reaktion mit Harnstoff entstehen Imidazol-Derivate.[2] Bei 20 °C weist eine 40%ige wässrige Lösung einen pH-Wert von 2,1–2,7 auf.[3]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Glyoxal findet aufgrund seiner Bifunktionalität breite Anwendung als Zwischenprodukt in der chemischen und weiterverarbeitenden Industrie. Er wird oft für Kondensations- und Vernetzungsreaktionen mit Stärke, Cellulose, Keratin, Casein, Tierleim und mineralischen Baustoffen eingesetzt. Außerdem dient er als Intermediat bei der Synthese von heterozyklischen Verbindungen und vielen weiteren Chemikalien. Bei Polymeren verbessert Glyoxal das Löse- und Emulgierverhalten (z. B. bei Celluloseethern und Methylcellulose).[2] Ferner wird er auch in Kosmetika und Körperpflegemitteln verwendet. Glyoxal wird weiter in der Textil-, Papier- und Lederveredlung sowie die Mineralölindustrie als H2S-Fänger, Wasseraufbereiter, Biozid oder Ölfeldchemikalie eingesetzt. In der Gesundheitspflege und Veterinärhygiene dient Glyoxal zur Formulierung von Desinfektionsmitteln.[9]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Glyoxal wird hauptsächlich über die Atemwege und die Haut aufgenommen. Dabei kann es zu Reizwirkungen auf Schleimhäute und Haut kommen. Außerdem wurde eine hautsensibilisierende Wirkung, die chronisch zu Reizwirkungen und bleibenden Hautschäden führen kann, festgestellt. Bei längerer Exposition oder direkter oraler Aufnahme hoher Konzentrationen sind Nierenfunktionsstörungen und Pankreasschäden nachgewiesen. Zur Gentoxizität an Prokaryoten und Eukaryoten zeigte sich eine mutagene Wirkung, eine Kanzerogenität wird daher streng vermutet, ist aber bis jetzt noch nicht offiziell bestätigt worden. Mit einer Zündtemperatur von 285 °C der 40%igen wässrigen Lösung fällt der Stoff in die Temperaturklasse T3.[2][3]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu GLYOXAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Mai 2021.
- ↑ a b c d e f g Eintrag zu Glyoxal. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. Februar 2019.
- ↑ a b c d e f g h i j k l m n o Eintrag zu Glyoxal, wässrige Lösung in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-270.
- ↑ Eintrag zu Glyoxal im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 8. Januar 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ M. Vrekoussis, F. Wittrock, A. Richter, J. P. Burrows: Temporal and spatial variability of glyoxal as observed from space. In: Atmos. Chem. Phys. 9, 2009, S. 4485–4504, doi:10.5194/acp-9-4485-2009.
- ↑ Rainer Volkamer et al.: A missing sink for gas‐phase glyoxal in Mexico City: Formation of secondary organic aerosol. In: Geophysical Research Letters. 34, 19, 2007, doi:10.1029/2007GL030752.
- ↑ a b Georges Mattioda, Alain Blanc: Glyoxal. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. October 2011, S. 3, doi:10.1002/14356007.a12_491.pub2 (Abschnitt „4. Production“).
- ↑ a b Glyoxal 40%. BASF SE, 2014, abgerufen am 8. Januar 2019.
- ↑ Beyer-Walter, Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998 ISBN 3-7776-0808-4

