2-Ethylacrolein
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Ethylacrolein | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H8O | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,12 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, löslich in Alkohol[1] | ||||||||||||||||||
| Brechungsindex |
1,4271 (20 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Ethylacrolein ist als Homologes des Methacroleins ein ungesättigter C5-Aldehyd und ein Struktur-isomeres des Tiglinaldehyds. Das Alkenal 2-Ethylpropenal ist Ausgangsstoff (engl. building block) für Di(trimethylolpropan) Di-TMP, 2-Ethylacrylsäure, alkylierte Pyridincarbonsäuren und Chinolincarbonsäuren, sowie für eine (von vielen) Synthesevarianten zur Terpenvorstufe Isopren.[4]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Zur Darstellung von 2-Ethylacrolein wird n-Butyraldehyd mit Formaldehyd-Lösung (40 % in Wasser) in Gegenwart von Diethanolamin-oxalat in einer Aldolkondensation zur Reaktion gebracht, wobei nach Destillation das Reinprodukt in 94,5 %iger Ausbeute erhalten wird.[5][6]

In Gegenwart von schwach saurem Dimethylaminhydrochlorid entsteht 2-Ethylacrolein in 73 % Ausbeute.[7]
Die Reaktion kann auch in der Gasphase bei Temperaturen von 275 bis 300 °C an einem Wolframoxid-Kontakt mit hoher Selektivität durchgeführt werden.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Ethylacrolein ist ein klare, stechend riechende Flüssigkeit[1], die sich in Wasser praktisch nicht löst, aber in Alkoholen und Alkylbenzolen, wie Toluol oder Ethylbenzol[9] löslich ist. Wegen ihrer Oxidationsempfindlich-keit ist die Verbindung mit Hydrochinon stabilisiert. Im Ames-Test mit Salmonella Typhimurium-Bakterien erwies sich 2-Ethylacrolein als mutagen.[10]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Die Isomerisierung von 2-Ethylpropenal zu Tiglinaldehyd[9] durch Erhitzen in Gegenwart eines Palladium-Kontakts erfolgt in Lösung oder in der Gasphase, wobei die Zuführung von Wasserstoff die Reaktion erheblich beschleunigt und die Ausbeute erhöht. Dabei werden Gemische mit bis zu 75 % Tiglinaldehyd (A) und 22 % des gesättigten Aldehyds 2-Methylbutanal (B) erhalten werden.

Der trans-isomere Tiglinaldehyd (trans-2-Methyl-2-butenal) ist eine der flüchtigen Hauptkomponenten von Koriander und von Olivenöl.
Das bei der Hydrierung von 2-Ethylacrolein gebildete 2-Methylbutanal kann bei 400 °C an Caesiumcarbonat-dotierten Zeolithen zu Isopren dehydratisiert werden.[11]
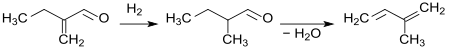
Mit hohen Selektivitäten (bis > 90 %), jedoch bei nur mittleren Umsätzen (< 50 %) und hoher Temperatur hat sich dieser Syntheseweg zu Isopren im industriellen Maßstab nicht durchsetzen können.
Aus 2-Ethylacrolein ist auch in einer mehrstufigen Synthese 2-Ethylbutadien zugänglich,[7]
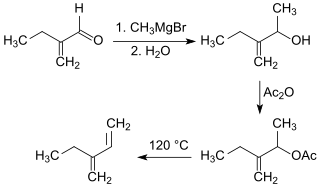
das mit stereospezifischen Katalysatoren für die Isoprenpolymerisation, wie z. B. Titantetrachlorid (TiCl4) / Triethylaluminium [Al(C2H5)3] / Bortrifluorid-Phenol-Komplex (1:2) praktisch ausschließlich (98 %) zu hochmolekularen cis-1,4-Polymeren, mit Vanadium(V)-oxidtrichlorid (VOCl3) / Triethylaluminium überwiegend (80 %) zu trans-1,4-Strukturen polymerisiert werden kann. Die cis-1,4-Polymeren zeigen Gummielastizität und können wie Polyisopren mit Schwefel vulkanisiert werden.[7]
Die Oxidation von 2-Ethylacrolein zu 2-Ethylacrylsäure erfolgt mit 90 %igem Wasserstoffperoxid (H2O2) und Selendioxid (SeO2) als Katalysator in tert-Butanol als Lösungsmittel in guten Ausbeuten.[12]
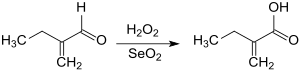
2-Ethylacrylsäure kann mit dem Radikalstarter Azobis(isobutyronitril) AIBN in Substanz zu Poly(2-Ethylacrylsäure) polymerisiert werden.[13]
Bei der Reaktion von 2-Ethylacrolein mit überschüssigem 1,1,1-Trimethylolpropan und Formaldehyd in Gegenwart von Triethylamin entsteht durch Aldolreaktion und anschließende gekreuzte Cannizzaro-Reaktion der vierwertige Alkohol Di(trimethylolpropan) Di-TMP als Hauptprodukt.[14]

Die Doebner-Miller-Reaktion von 2-Ethylacrolein mit 2-Aminophenol und 4-Nitrophenol erzeugt 3-Ethyl-8-hydroxychinolin[15].[16][17]

In ähnlicher Weise können andere, in 8-Stellung substituierte, 3-Ethylchinoline dargestellt werden.[16]
Die Ausgangsverbindung für das in der EU nicht zugelassene Herbizid Imazethapyr aus der Gruppe der Imidazolinone ist 5-Ethyl-2,3-pyridindicarbonsäurediethylester[18], der praktisch quantitativ aus 2-Chlor-3-oxobernsteinsäurediethylester (einem Oxalessigester der CAS-Nr. 34034-87-2) – durch Claisen-Kondensation von Diethyloxalat mit Chloressigsäureethylester einfach zugänglich – und 2-Ethylacrolein mit Ammoniumacetat als Stickstofflieferant erhalten wird.[19]

Einen Zugang zu alkoxymethylierten Malonsäuren eröffnet die Reaktion von 2-Ethylacrolein mit Formaldehyd und Methanol in Gegenwart von Triethylamin (NEt3), wobei zunächst 2-Methoxymethyl-2-hydroxymethylbutanal gebildet wird (67 % Ausbeute). Die Hydroxymethylgruppe und die Aldehydgruppe können mit konzentrierter Salpetersäure (HNO3) in Gegenwart von Mangan(II)-chlorid (MnCl2) zu Carboxygruppen oxidiert werden.

Nach Veresterung mit Dimethylsulfat, Ringschluss mit Methylhydrazin zum Pyrazolderivat und Umsetzung mit Dimethylcarbamoylchlorid erhält man ein Pyrazolinon mit Carbamatstruktur, das insektizide Eigenschaften aufweist.[20]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Datenblatt 2-Ethylacrolein bei Alfa Aesar, abgerufen am 15. Juni 2020 (Seite nicht mehr abrufbar).
- ↑ a b c d e Datenblatt 2-Ethylacrolein bei Sigma-Aldrich, abgerufen am 14. Juni 2020 (PDF).
- ↑ a b c Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 71.
- ↑ Hans Martin Weitz, Eckhard Loser: Isoprene. In: Ullmann's encyclopedia of industrial chemistry, 2012, Wiley-VC, Band 20, S. 86. doi:10.1002/14356007.a14_627.
- ↑ Patent EP0058927A1: Verfahren zur Herstellung von alpha-Alkylacroleinen. Angemeldet am 17. Februar 1982, veröffentlicht am 1. September 1982, Anmelder: BASF AG, Erfinder: F. Merger, H.-J. Förster.
- ↑ Patent EP0092097A1: Verfahren zur Herstellung von alpha-Alkylacroleinen. Angemeldet am 5. April 1983, veröffentlicht am 26. Oktober 1983, Anmelder: BASF AG, Erfinder: G. Dümbgen, G. Fouquet, R. Krabetz, E. Lucas, F. Merger, F. Nees.
- ↑ a b c R. Ohno, Y. Tanaka, M. Kawakami: Synthesis and characterization of 2-alkyl butadiene polymers. II. Stereospecific polymerization of 2-ethyl-2-n-propyl-, 2-isopropyl-, and 2-n-butyl butadienes. In: Polymer J. Band 4, Nr. 1, 1973, S. 56–60, doi:10.1295/polymj.4.56.
- ↑ G. Albanesi, P. Moggi: Formation of 2-ethyl acrolein by gas phase aldol condensation. In: Appl. Catal. Band 37, 1988, S. 315–322, doi:10.1016/S0166-9834(00)80769-1.
- ↑ a b Patent US4605779: Method for the production of tiglic aldehyde. Angemeldet am 24. Juli 1985, veröffentlicht am 12. August 1986, Anmelder: Sumitomo Chemical Co., Erfinder: T. Matsuda, S. Shimizu, M. Iwasa.
- ↑ T. Neudecker, E. Eder, C. Deiniger, D. Henschler: Mutagenicity of 2-methylacrolein, 2-ethylacrolein and 2-propylacrolein in Salmonella typhimurium TA 100. A comparative study. In: Mutat. Res. Band 264, Nr. 4, 1991, S. 193–196, doi:10.1016/0165-7992(91)90077-h.
- ↑ Patent EP219042A2: Verfahren zur Herstellung von Dienen durch Dehydratisierung von Aldehyden. Angemeldet am 7. Oktober 1986, veröffentlicht am 22. April 1987, Anmelder: BASF AG, Erfinder: W. Hölderich, P. Hettinger, F. Merger.
- ↑ Patent US2744929: Production of unsaturated carboxylic acids. Angemeldet am 26. September 1952, veröffentlicht am 8. Mai 1956, Anmelder: Shell Development Co., Erfinder: C.W. Smith, R.T. Holm.
- ↑ M. Ferritto, D.A. Tirrell: Poly(2-Ethylacrylic Acid). In: Macromolecular Syntheses. Band 11, 1992, S. 59–62 (pslc.ws [PDF]).
- ↑ Patent US5840994: Process for producing ditrimethylolpropane. Angemeldet am 19. März 1997, veröffentlicht am 24. November 1998, Anmelder: Mitsubishi Gas Chemical Co., Erfinder: T. Ninomiya, T. Watanabe, T. Igele, A. Iwamoto.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-Ethyl-8-hydroxychinolin: CAS-Nr.: 111470-98-5, PubChem: 11789692, ChemSpider: 9964366, Wikidata: Q82002630.
- ↑ a b Patent EP0247277A2: Verfahren zur Herstellung von 5-Alkylchinolinsäuren und Mittel zur Durchführung des Verfahrens. Angemeldet am 4. Februar 1987, veröffentlicht am 2. Dezember 1987, Anmelder: Rütgerswerke AG, Erfinder: E. Pastorek, W. Orth, G. Jeromin, W. Fickert.
- ↑ Patent EP0259687A2: Process for the preparation of pyridine-2,3-carboxylic acids. Angemeldet am 25. August 1987, veröffentlicht am 16. März 1988, Anmelder: American Cyanamid Co., Erfinder: W.F. Rieker, W.A. Daniels.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 5-Ethyl-2,3-pyridindicarbonsäurediethylester: CAS-Nr.: 105151-39-1, PubChem: 10857926, ChemSpider: 9033217, Wikidata: Q72477065.
- ↑ C. Cheng, X. Ma, Z. Wei: Synthesis of diethyl 5-ethyl-2,3-pyridinedicarboxylate. In: Asian J. Chem. Band 26, Nr. 3, 2014, S. 918–920, doi:10.14233/ajchem.2014.16235.
- ↑ Patent US4537901: Insecticidal carbamates. Angemeldet am 14. Juni 1984, veröffentlicht am 27. August 1985, Anmelder: BASF AG, Erfinder: A. Lange, F. Merger, P. Hettinger, H. Adolphi.

