Adalimumab
| Adalimumab | ||
|---|---|---|
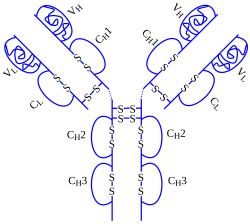
| ||
| Masse/Länge Primärstruktur | 144,2 kDa | |
| Bezeichner | ||
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | L04AB04 | |
| DrugBank | BTD00049 | |
| Wirkstoffklasse | Immunsuppressivum, Monoklonaler Antikörper | |
Adalimumab ist ein therapeutischer humaner monoklonaler Antikörper gegen den Tumornekrosefaktor-α und wird daher auch als TNF-Blocker bezeichnet. Es gehört zur Wirkstoffklasse der krankheitsmodifizierenden Antirheumatika (DMARDs). Adalimumab wird zur Behandlung von rheumatoider Arthritis, Schuppenflechte (Plaque-Psoriasis), Psoriasis-Arthritis, axialer Spondyloarthritis einschließlich Spondylitis ankylosans, Hidradenitis suppurativa (Acne inversa), Uveitis, juveniler idiopathischen Arthritis und der chronisch entzündlichen Darmerkrankungen Morbus Crohn und Colitis ulcerosa eingesetzt.
Das 2002 in den USA und 2003 in der EU eingeführte Originatorpräparat Humira galt 2018 als weltweit umsatzstärkstes Medikament.
Klinische Angaben[Bearbeiten | Quelltext bearbeiten]
Anwendung[Bearbeiten | Quelltext bearbeiten]
Adalimumab ist in der Europäischen Union[1][2] und teilweise in der Schweiz[3] zugelassen in folgenden Anwendungsgebieten:
für Erwachsene zur Behandlung
- der rheumatoiden Arthritis
- in mäßiger bis schwerer aktiver Form bei unzureichendem Ansprechen auf krankheitsmodifizierende Antirheumatika (DMARDs) einschließlich MTX oder
- in schwerer, aktiver und progressiver Form in Kombination mit MTX bei Erwachsenen, die zuvor nicht mit Methotrexat behandelt worden sind,
- jeweils entweder in Kombination mit MTX oder in Monotherapie (im Falle einer Unverträglichkeit gegenüber MTX oder wenn die weitere Behandlung mit MTX nicht sinnvoll ist),
- der axialen Spondyloarthritis
- in Form der schweren aktiven ankylosierenden Spondylitis bei unzureichendem Ansprechen auf eine konventionelle Therapie,
- in Form der schweren axialen Spondyloarthritis ohne Röntgennachweis einer AS (nr-axSpA), aber mit objektiven Anzeichen der Entzündung durch erhöhtes C-reaktives Protein und/oder MRT, bei unzureichendem Ansprechen auf nichtsteroidale Antirheumatika (NSAR) oder wenn eine Unverträglichkeit gegenüber diesen vorliegt,
- der aktiven und progressiven Psoriasisarthritis (Arthritis psoriatica) bei unzureichendem Ansprechen auf eine vorherige Basistherapie,
- der mittelschweren bis schweren chronischen Plaque-Psoriasis, sofern eine systemische Therapie (in der Schweiz: oder eine PUVA-Therapie) infrage kommt,
- der mittelschweren bis schweren aktiven Hidradenitis suppurativa (Acne inversa) bei unzureichendem Ansprechen auf eine konventionelle systemische Therapie,
- des mittelschweren bis schweren, aktiven Morbus Crohn, wenn trotz einer vollständigen und adäquaten Therapie mit einem Kortikosteroid und/oder einem Immunsuppressivum kein ausreichendes Ansprechen erfolgt oder wenn eine Unverträglichkeit gegenüber einer solchen Therapie vorliegt oder wenn eine solche Therapie kontraindiziert ist,
- der mittelschweren bis schweren aktiven Colitis ulcerosa, wenn das Ansprechen auf eine konventionelle Therapie unzureichend war oder bei Unverträglichkeit gegenüber einer solchen Therapie haben oder wenn eine solche Therapie kontraindiziert ist,
- der nicht infektiösen Uveitis (Uveitis intermedia, Uveitis posterior und Panuveitis) bei unzureichendem Ansprechen auf Kortikosteroide, wenn eine Kortikosteroid-sparende Behandlung benötigt wird oder wenn eine Behandlung mit Kortikosteroiden nicht geeignet ist.
für Kinder und Jugendliche zur Behandlung
- der aktiven polyartikulären juvenilen idiopathischen Arthritis bei Kindern und Jugendlichen ab 2 Jahren (in der Schweiz: ab 4 Jahren), die nur unzureichend auf ein oder mehrere krankheitsmodifizierende Antirheumatika (DMARDs) angesprochen haben, entweder in Kombination mit Methotrexat (MTX) oder als Monotherapie (im Falle einer Unverträglichkeit gegenüber MTX oder wenn die weitere Behandlung mit MTX nicht sinnvoll ist),
- der Enthesitis-assoziierten Arthritis bei Kindern und Jugendlichen ab 6 Jahren, die nur unzureichend auf eine konventionelle Therapie angesprochen haben oder die eine Unverträglichkeit gegenüber einer solchen Therapie haben (in der Schweiz nicht zugelassen),
- der schweren chronischen Plaque-Psoriasis bei Kindern und Jugendlichen ab 4 Jahren (in der Schweiz: ab 6 Jahren), die nur unzureichend auf eine topische Therapie (in der Schweiz stattdessen: systemische Vortherapien) und PUVA-Therapie angesprochen haben oder für die diese Therapien nicht geeignet sind,
- der mittelschweren bis schweren aktiven Hidradenitis suppurativa (Acne inversa) bei Jugendlichen ab 12 Jahren, die unzureichend auf eine konventionelle systemische Therapie ansprechen (in der Schweiz nicht zugelassen),
- des mittelschweren bis schweren, aktiven Morbus Crohn bei Kindern und Jugendlichen ab 6 Jahren, die nur unzureichend auf eine konventionelle Therapie angesprochen haben oder die eine Unverträglichkeit gegenüber einer solchen Therapie haben oder bei denen eine solche Therapie kontraindiziert ist,
- mittelschweren bis schweren aktiven Colitis ulcerosa bei Kindern und Jugendlichen ab 6 Jahren, die nur unzureichend auf eine konventionelle Therapie angesprochen haben oder die eine Unverträglichkeit gegenüber einer solchen Therapie haben oder bei denen eine solche Therapie kontraindiziert ist (in der Schweiz nicht zugelassen),
- der chronischen nicht infektiösen Uveitis anterior bei Kindern und Jugendlichen ab 2 Jahren, die unzureichend auf eine konventionelle Therapie angesprochen haben oder die eine Unverträglichkeit gegenüber einer solchen Therapie haben oder für die eine konventionelle Therapie nicht geeignet ist (in der Schweiz nicht zugelassen).
In der Regel wird bei Erwachsenen Adalimumab jede zweite Woche subkutan injiziert. Oft führen die Patienten dies nach entsprechender Einweisung selbständig durch. Ein Ansprechen der Behandlung sollte innerhalb von zwölf Wochen zu beobachten sein. In klinischen Studien wurden Patienten bis zu fünf Jahre lang mit Adalimumab behandelt.
Gegenanzeigen und andere Anwendungsbeschränkungen[Bearbeiten | Quelltext bearbeiten]
Gegenanzeigen sind eine Überempfindlichkeit gegen Adalimumab, ferner schwere Infektionen wie aktive Tuberkulose, Sepsis und opportunistische Infektionen sowie Herzinsuffizienz. Infektionen sind deshalb so kritisch, weil aufgrund des immunsupprimierenden Wirkungsmechanismus von Adalimumab die körpereigene Abwehr gegen die Infektion geschwächt wird.
Bei Monotherapie mit Adalimumab ist die Wahrscheinlichkeit erhöht, dass Antikörper gegen Adalimumab gebildet werden. Dadurch wird die Clearance erhöht und es resultiert eine verminderte Wirksamkeit von Adalimumab. Bei der gleichzeitigen Anwendung von Adalimumab und Etanercept wurden schwere Infektionen beobachtet, ohne dass die Kombinationstherapie einen zusätzlichen Nutzen aufwies; deshalb wird diese Kombination nicht empfohlen.
Die Wirkungen von Adalimumab bei schwangeren Frauen sind nicht bekannt, deshalb wird die Anwendung während der Schwangerschaft nicht empfohlen. Ob Adalimumab in die Muttermilch übergeht, ist ebenfalls nicht bekannt, deshalb sollte während und bis fünf Monate nach der Behandlung nicht gestillt werden. Adalimumab wurde noch nicht bei Patienten mit Leber- oder Nierenfunktionsstörungen untersucht.
Unerwünschte Wirkungen[Bearbeiten | Quelltext bearbeiten]
Die häufigsten unerwünschten Wirkungen sind Reaktionen an der Einstichstelle, wie Schmerzen, Schwellungen, Rötung oder Juckreiz. Ferner können Kopfschmerzen, Schmerzen in Muskeln und Knochen, Übelkeit und Erbrechen und Hautausschläge, Appetitlosigkeit, Veränderungen im Blutbild (z. B. Erhöhung/Verringerung der weißen Blutkörperchen oder Anämie) und erhöhte Leberenzymwerte auftreten. Da Adalimumab die Immunabwehr unterdrückt, ist das Risiko erhöht, an opportunistischen Infektionen zu erkranken, die unter Umständen einen schweren Verlauf bis hin zur Sepsis nehmen können. Es können maligne Lymphome auftreten. Aufgrund dessen ist es wichtig, eine engmaschige Kontrolle (Untersuchungen beim Hautarzt, Frauenarzt etc.) durchzuführen.
Pharmakologische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Wirkungsmechanismus[Bearbeiten | Quelltext bearbeiten]
Adalimumab ist ein humaner monoklonaler Antikörper vom Typ IgG1, der hoch spezifisch an das Zytokin Tumornekrosefaktor-alpha (TNF-α) bindet und seine Wirkung neutralisiert. TNF-α ist ein wichtiger Signalstoff des Immunsystems, der in Zellen unter anderem die Bildung von Entzündungsmediatoren auslösen kann. Bei entzündlichen Erkrankungen wie rheumatoider Arthritis liegt TNF-α in erhöhter Konzentration vor; die Neutralisierung von TNF-α durch Adalimumab führt zu einer raschen Besserung verschiedener Entzündungsparameter wie C-reaktives Protein und Interleukin-6. In placebokontrollierten Studien konnte gezeigt werden, dass Patienten nach Adalimumab-Behandlung deutlich verbessertes Ansprechen entsprechend den Kriterien des American College of Rheumatology (ACR) zeigten. Auch ein verzögertes Fortschreiten der Erkrankung und eine verbesserte Lebensqualität konnte festgestellt werden. Die Verbesserung wurde bis zu drei Jahre lang bestimmt und hielt über diesen Zeitraum an.
Aufnahme und Verteilung im Körper[Bearbeiten | Quelltext bearbeiten]
Die Resorption und Verteilung von Adalimumab nach subkutaner Injektion einer Einzeldosis ist sehr langsam; die maximale Plasmakonzentration wurde nach fünf Tagen beobachtet. Die absolute Bioverfügbarkeit liegt bei 64 Prozent.
Toxikologie[Bearbeiten | Quelltext bearbeiten]
Eine dosisbegrenzende Toxizität wurde während der klinischen Studien nicht beobachtet. In Tierversuchen mit Nagetieren war eine fast 2000fache Überdosis gut verträglich. In Versuchen mit Javaneraffen wurde für Adalimumab ein NOAEL von 32 mg/kg bestimmt.
Entwicklung und Vermarktung[Bearbeiten | Quelltext bearbeiten]
Adalimumab ist ein rekombinanter humaner monoklonaler Antikörper, der in CHO-Zellen produziert wird. Der Antikörper wird mit Hilfsstoffen zu einer wässrigen Injektionslösung mit 40 mg Adalimumab in 0,4 ml oder 0,8 ml Lösung verarbeitet.
Adalimumab wurde in Zusammenarbeit zwischen dem britischen Biotechnologieunternehmen Cambridge Antibody Technology (heute Teil von AstraZeneca) und dem Pharmaunternehmen BASF-Knoll Pharma, heute AbbVie, entwickelt. Im Gegensatz zu vielen anderen Antikörpern wurde Adalimumab durch Phagen-Display aus einer Bank humaner Immunglobulinsequenzen identifiziert. Adalimumab ist somit ein „vollständig humaner“ Antikörper. Das bedeutet, dass die codierenden Sequenzen keine klonierten Elemente aus anderen Spezies enthalten.[4] Die Struktur des Vorbilds, IgG1, wurde jedoch in vitro stark modifiziert, um die Avidität des Antikörpers für sein Target zu optimieren.[5]
Die Markteinführung von Humira war im Dezember 2002 in den USA; die Zulassung für die Europäische Union wurde im September 2003 erteilt. Im Jahr der Markteinführung war Humira deutlich teurer als andere TNF-α-Blocker wie Enbrel (Etanercept) oder Remicade (Infliximab) und kostete ein Vielfaches des Basisantirheumatikums Methotrexat.[6] 2013 ist Humira mit 10,7 Milliarden US-$ Jahresumsatz einer der kommerziell erfolgreichsten monoklonalen Antikörper.[7] 2018 erzielte Abbvie mit Humira ca. 61 % seiner Nettoumsatzerlöse, was etwa 19,9 Mrd. US-Dollar entspricht[8] und gilt als weltweit umsatzstärkstes Medikament. Mit der Markteinführung von Biosimilars kam es zu Preisreduktionen für Adalimumab.[9]
Adalimumab wurde in der EU auch unter dem Markennamen Trudexa zugelassen, aber nie unter diesem Namen in den Verkehr gebracht. 2007 hat Abbott die Marktzulassung für Trudexa freiwillig aus kommerziellen Gründen aufgegeben.[10] 2017 wurden in der EU eine Reihe Biosimilars zugelassen.[11]
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
Humira (AbbVie Ltd. – EU, USA, CH, CA, JP)
- Biosimilars
- EU: Amgevita (Amgen), Cyltezo (Boehringer Ingelheim), Hulio (Mylan), Hyrimoz (Sandoz/Hexal), Idacio (Fresenius Kabi), Imraldi (Biogen/Samsung Bioepis), Solymbic (Amgen), Yuflyma (Celltrion Healthcare)
- USA: Amjevita, Cyltezo, Hyrimoz, Yuflyma
- IN: Adfrar (Torrent Pharmaceuticals), Exemptia (Cadila Healthcare)
Siehe auch[Bearbeiten | Quelltext bearbeiten]
- Nomenklatur der monoklonalen Antikörper: Konvention zur Benennung von Antikörpern
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Adalimumab
Literatur[Bearbeiten | Quelltext bearbeiten]
- Jasvinder A. Singh, Robin Christensen, George A. Wells, Maria E. Suarez-Almazor, Rachelle Buchbinder, Maria Angeles Lopez-Olivo, Elizabeth Tanjong Ghogomu, Peter Tugwell: Biologics for rheumatoid arthritis: an overview of Cochrane reviews. In: Cochrane Database of Systematic Reviews. Nr. 4, 2009, Article-Nr. CD007848, doi:10.1002/14651858.CD007848.pub2, PMID 19821440.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Europäische Arzneimittel-Agentur (EMA): Humira: Zusammenfassung der Merkmale des Arzneimittels (Fachinformation). (PDF) 14. September 2021, abgerufen am 5. Juni 2022. (PDF; 5,7 MB)
- ↑ Europäische Arzneimittel-Agentur (EMA): Übersicht über Humira und warum es in der EU zugelassen ist. (PDF) 9. Dezember 2020, abgerufen am 5. Juni 2022. (PDF; 0,1 MB)
- ↑ Fachinfo Humira. In: compendium.ch. März 2022, abgerufen am 5. Juni 2022.
- ↑ Europäische Arzneimittelagentur: Initial scientific discussion for the approval of Humira (PDF; 354 kB).
- ↑ A. Vollmar, I. Zündorf, T. Dingermann: Immunologie. WVG Stuttgart, 2. Auflage, 2013. S. 308
- ↑ Adalimumab (Humira) - Dritter TNF-α-Blocker gegen rheumatoide Arthritis, arznei-telegramm a-t 20.03; 34: 91-2.
- ↑ FirstWord Pharma: FirstWord Lists – Biosimilar MAb targets, 13. April 2014.
- ↑ AbbVie Geschäftsbericht 2018 ("Form K"). S. 2, 13.
- ↑ Ev Tebroke: Erste Biosimilars unter Rabattvertrag, Pharmazeutische Zeitung, 8. November 2018.
- ↑ EMEA/H/C/482 Trudexa® (Zulassung zurückgezogen), (englisch, pdf; 33 kB).
- ↑ Adalimumab-Biosimilars in Deutschland eingeführt. In: Pro Biosimilars. 17. Oktober 2018 (probiosimilars.de [abgerufen am 26. November 2018]).