Mesoxalsäurediethylester
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mesoxalsäurediethylester | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H10O5 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 174,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt |
−30 °C[3] | ||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
sehr gut löslich in Wasser, löslich in Ethanol, Diethylether, Chloroform[3] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Mesoxalsäurediethylester ist der Diethylester der Mesoxalsäure (Ketomalonsäure), der einfachsten Oxodicarbonsäure und damit der erste Vertreter (n = 0) einer homologen Reihe HOOC–CO–(CH2)n–COOH mit den höheren Homologen Oxalessigsäure (n = 1), α-Ketoglutarsäure (n = 2) und α-Ketoadipinsäure (n = 3), einem Metaboliten der Aminosäure Lysin.
Diethylmesoxalat reagiert wegen seiner stark polarisierten Ketogruppe als Elektrophil in Additionsreaktionen und ist ein hochaktiver Reaktand in pericyclischen Reaktionen, wie z. B. in Diels-Alder-Reaktionen, Cycloadditionen oder En-Reaktionen.[1]
An feuchter Luft lagert Mesoxalsäurediethylester Wasser an zum 2,2-Dihydroxymalonsäure-diethylester (Diethylmesoxalat-Hydrat), das grüngelbe Öl wandelt sich spontan um in weiße Kristalle.[5]
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
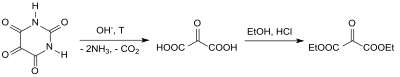
Im Jahr 1892 stellten Richard Anschütz und Mitarbeiter erstmals den von ihm so genannten Oxomalonsäureäthylester, ausgehend vom Bariumsalz des Alloxans, dessen Zersetzung zur Mesoxalsäure und Veresterung mit Ethanol in Gegenwart von Chlorwasserstoff, in reiner Form dar.[6]
Louis Bouveault und Mitarbeiter gelangten über die Nitrosierung von Malonsäurediethylester mit Nitrosylschwefelsäure zum Isonitrosoester, der mit Distickstofftetroxid N2O4 („peroxyde d’azote“) zum Diethylmesoxalat oxidiert wird.[7] Die als Öl erhaltene Ketoverbindung reagiert mit Wasser zum kristallinen Dihydrat.
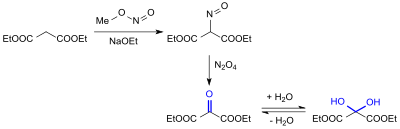
In einer abgewandelten Variante der Synthese mit N2O4[8] wurde Mesoxalsäurediethylester in 90%iger Rohausbeute erhalten.
Statt Distickstofftetroxid kann auch Distickstofftrioxid N2O3 (aus Arsen(III)-oxid mit Salpetersäure erhältlich) als Oxidationsmittel eingesetzt werden.[9] Die Ausbeute in der Endstufe beträgt 74–76 %; der Syntheseweg ist aber apparativ aufwendig und wegen der Toxizität und Kanzerogenität des As2O3 untauglich.
Die Oxidation von Malonester mit Selendioxid SeO2 ist mit einer Ausbeute an Esterhydrat von 23 % unergiebig,[5] ebenso wie die als „verbesserte Synthese“ angegebene Reaktion über das Malonesterdibromid und Bromidabspaltung mit Kaliumacetat mit einer Ausbeute von 41 bis 47 %.[10]
Mehrere Verfahren zur Herstellung von Mesoxalsäureethylester bedienen sich der Oxidation von Malonsäurediethylester bzw. seiner Enamine mit Sauerstoff oder Ozon. So liefert die Ozonolyse von Diethylethylidenmalonat (aus Malonester und Acetaldehyd in ca. 80%iger Ausbeute) bei −78 °C nur 62 % Diethylmesoxalat,[11] die elektrochemische Oxidation von Cyanmalonsäurediethylester (aus Cyanessigsäureethylester und Chloressigsäureethylester mithilfe von Sauerstoff 77 % Ausbeute) in der letzten Oxidationsstufe[12] und die von Lutz Friedjan Tietze am Beispiel des Dimethylesters angegebene Ozonolyse von Dialkylbenzalmalonaten 76 % des Dimethylmesoxalats.[13]
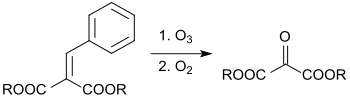
Wegen der Risiken bei der Handhabung von Ozon ist die Ozonolyse im Wesentlichen auf den Labormaßstab (bis etwa 150 g Produkt) beschränkt.
Die Photooxidation des aus Dimethylformamid-dimethylacetal und Malonsäurediethylester in praktisch quantitativer Ausbeute entstehenden Enamins erzeugt Diethyloxomalonat-hydrat in 84%iger Ausbeute.[14]
Eine neuere Patentschrift[15] beschreibt die Synthese von Mesoxalsäurediethylester aus der einfachen Vorstufe Malonsäurediethylester durch Oxidation mit wässriger Natriumchlorit (NaClO2)-Lösung bei pH 4,4 in 97%iger Ausbeute.
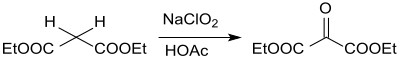
Der Ester fällt zunächst als Hydrat an, das durch Azeotropdestillation mit Toluol zum Endprodukt entwässert wird.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Mesoxalsäurediethylester ist ein grünlich-gelbes niedrigviskoses Öl mit schwachem Geruch, das mit Wasser rasch zum festen Dihydrat in groben weißen Prismen kristallisiert.[6]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Das elektronenarme Dienophil Diethylketomalonat eignet sich als Kohlendioxid-Äquivalent für Diels-Alder-Reaktionen mit elektronenreichen 1,3-Dienen, wie z. B. mit Isopren oder 2,3-Dimethylbutadien in einer [4+2]-Cycloaddition zum geminalen Dihydropyrandiester, der alkalisch zur gem-Disäure hydrolysiert, mit Oxalylchlorid zum gem-Disäuredichlorid halogeniert, mit Natriumazid in das gem-Disäurediazid überführt und dieses in einer Curtius-Reaktion zu einem Dihydropyranon abgebaut werden kann.[16][17]

In einer Aldoladdition reagiert Diethylmesoxalat mit dem Morpholinenamin von 3-Pentanon zu einem α-Hydroxy-γ-ketodiester, der mit Phosphorpentoxid/Methansulfonsäure-Gemisch ein substituiertes Butenolid bildet.[18]

Mit Guanidin entsteht in 85%iger Ausbeute ein funktionalisiertes Imidazolon.[19]

Diethylketomalonat ist ein vielseitiger Reaktand in der Baylis-Hillman-Reaktion und bildet mit Acrylsäureestern, Acrylnitril oder Methylvinylketon unter Katalyse mit DABCO die entsprechenden multifunktionellen Verbindungen.[20]

Mit der aus 1-Iod-2-chlormethylbenzol und Isopropylmagnesiumchlorid gebildeten Grignard-Verbindung reagiert Mesoxalsäurediethylester unter Bildung von 2-bis-carboxyethyl-isobenzofuran.[21]

Diethylmesoxalat addiert sich in einer En-Reaktion an terminale Doppelbindungen von Alkenen unter Bildung von 1-Hydroxy-1-alkylmalonestern.[22]

Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c T.F. Tietze, C. Schneider, D.J. Coughlin: Diethyl Oxomalonate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2009, doi:10.1002/047084289X.rd207m.pub2.
- ↑ a b c d e Datenblatt Diethyl ketomalonate bei Sigma-Aldrich, abgerufen am 15. November 2017 (PDF).
- ↑ a b c W.M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–178.
- ↑ Datenblatt Diethyl ketomalonate bei Alfa Aesar, abgerufen am 15. November 2017 (Seite nicht mehr abrufbar).
- ↑ a b R. Müller: Zur Kenntnis der spezifischen Oxydationswirkung des Selendioxyds. In: Ber. Dtsch. Chem. Ges. Band 66, Nr. 11, 1933, S. 1668–1670, doi:10.1002/cber.19330661111.
- ↑ a b R. Anschütz, E. Parlato: Ueber den Oxomalonsäureäthylester. In: Ber. Dtsch. Chem. Ges. Band 25, Nr. 2, 1892, S. 3614–3617, doi:10.1002/cber.189202502245.
- ↑ L. Bouveault, A. Wahl: Sur les éthers isonitrosomalonique et leur transformation en éthers mésoxaliques. In: C. R. Acad. Sci. Band 138, 1903, S. 196–198.
- ↑ E. Gilman, T.B. Johnson: The synthesis of mesoxalates by interaction of nitrogen tetroxide with esters of malonic acid. In: J. Am. Chem. Soc. Band 50, Nr. 12, 1928, S. 3341–3348, doi:10.1021/ja01399a028.
- ↑ A.W. Dox: Ethyl oxomalonate In: Organic Syntheses. 4, 1925, S. 27, doi:10.15227/orgsyn.004.0027; Coll. Vol. 1, 1941, S. 266 (PDF).
- ↑ S.N. Pardo, R.G. Salomon: Diethyl malonate. An improved synthesis. In: J. Org. Chem. Band 46, Nr. 12, 1981, S. 2598–2599, doi:10.1021/ja00325a039.
- ↑ M.E. Jung, K. Shishido, L.H. Davis: Simple syntheses of diethyl oxomalonate and alkyl glyoxylate. In: J. Org. Chem. Band 47, Nr. 5, 1982, S. 891–892, doi:10.1021/jo00344a028.
- ↑ M. Sugawara, M.M. Baizer: Electrogenerated bases VII. Novel syntheses of ethyl glyoxalate and diethyl ketomalonate via electrogenerated superoxide. In: Tetrahedron Lett. Band 24, Nr. 22, 1983, S. 2223–2226, doi:10.1016/S0040-4039(00)81889-4.
- ↑ L.F. Tietze, M. Bratz: Dialkyl mesoxalates by ozonolysis of dialkyl benzalmalonates: Dimethyl mesoxalate In: Organic Syntheses. 71, 1993, S. 214, doi:10.15227/orgsyn.071.0214; Coll. Vol. 9, 1998, S. 314 (PDF).
- ↑ H.H. Wasserman, W.T. Han: Vicinal tricarbonyl products from singlet oxygen reactions.: Application to the synthesis of carbacephams. In: Tetrahedron Lett. Band 25, Nr. 34, 1984, S. 3743–3746, doi:10.1016/0040-4039(84)80120-3.
- ↑ Patent US8859803B2: Process for production of ketomalonic acid compounds or hydrates thereof. Angemeldet am 25. Juni 2010, veröffentlicht am 14. Oktober 2014, Anmelder: Ihara Chemical Industry Co., Ltd., Erfinder: S. Tani.
- ↑ R.A. Ruden, R. Bonjouklian: Carbon dioxide equivalent for the Diels-Alder reaction. In: J. Am. Chem. Soc. Band 97, Nr. 23, 1975, S. 6892–6893, doi:10.1021/ja00856a063.
- ↑ R. Bonjouklian, R.A. Ruden: Versatile allene and carbon dioxide equivalents for the Diels-Alder reaction. In: J. Org. Chem. Band 42, Nr. 25, 1977, S. 4095–4103, doi:10.1021/jo00445a024.
- ↑ A.G. Schultz, Y.K. Yee: Synthesis of α-carbalkoxy-γ-alkylidene-Δα,β-butenolide. In: J. Org. Chem. Band 41, Nr. 3, 1976, S. 561–563, doi:10.1021/jo00865a035.
- ↑ C. Quirosa-Guillou, D.Z. Renko, C. Thal: Réaction des guanidines avec les composés tricarbonylés vicinaux : nouvel accès aux composés à squelette 2-aminoimidazolique. In: Tetrahedron. Band 48, Nr. 31, 1992, S. 6385–6392, doi:10.1016/S0040-4020(01)88228-4.
- ↑ D. Basavaiah, V.V.L. Gownswari: Diethyl ketomalonate: A fast reacting substrate for Baylis-Hillman reaction. In: Synth. Commun. Band 19, Nr. 13–14, 1989, S. 2461–2465, doi:10.1080/00397918908052648.
- ↑ B.N. Rocke, E.L. Conn, S.A. Eisenbeis, R.B. Ruggeri: 1,4-Addition of an aryllithium reagent to diethyl ketomalonate. Scalable synthesis of ethyl 1-(hydroxymethyl)-1,3-dihydroisobenzofuran-1-carboxylate. In: Tetrahedron Lett. Band 53, Nr. 41, 2012, S. 5467–5470, doi:10.1016/j.tetlet.2012.05.052.
- ↑ Patent US6730747B1: Carbonyl containing compounds. Angemeldet am 4. Januar 2000, veröffentlicht am 4. Mai 2004, Anmelder: Infineum USA L.P., Erfinder: S.J. Brois.