Kolorektales Karzinom
| ICD-10-Code Darmkrebs | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|

(1) Aufsteigender Grimmdarm (Colon ascendens)
(2) Querverlaufender Grimmdarm (Colon transversum)
(3) Absteigender Grimmdarm (Colon descendens)
(4) Sigma (Colon sigmoideum)
(5) Mast- oder Enddarm (Rectum) und Anus.
Es fehlt die Markierung für den in der linken unteren Bildhälfte befindlichen Blinddarm (Coecum) mit anhängendem Wurmfortsatz (Appendix).
Als Darmkrebs bezeichnet man alle bösartigen (malignen) Tumore des Darmes. Dieser Artikel befasst sich mit den kolorektalen Karzinomen, die mehr als 95 % der bösartigen Darmtumore ausmachen. Darmkrebs ist in Deutschland bei Männern und Frauen die zweithäufigste Krebserkrankung, an der mehr als sechs Prozent aller Deutschen im Laufe ihres Lebens erkranken. Kolorektale Karzinome verursachen zunächst sehr selten Symptome, sie entstehen fast immer aus anfangs gutartigen Darmpolypen. Die Heilungschancen durch Operation und Chemotherapie mit 5-Jahres-Überlebensrate von 40–60 % im Mittel hängen entscheidend vom Krankheitsstadium ab, in dem der Darmkrebs entdeckt wird. Seit 2002 übernehmen die Krankenkassen in Deutschland für alle Versicherten ab dem 55. Lebensjahr die Kosten einer Darmspiegelung („Vorsorge-Koloskopie“), um durch Entfernung etwaiger Polypen dem kolorektalen Karzinom vorzubeugen.
Tumorarten und Verteilung
85 bis 90 % der bösartigen Darmtumore sind Adenokarzinome des Dickdarmes, die sich aus den Drüsen der Darmschleimhaut ableiten. Oft findet man bei Entdeckung des Tumors bereits ein zentrales Geschwür (Ulcus) und Gewebsuntergang (Nekrose). Histologisch kommen neben Adenokarzinomen vor allem muzinöse Adenokarzinome (5 bis 10 %) und Siegelringkarzinome (1 %) vor.
Andere bösartige Erkrankungen des Darms wie Karzinoide, vor allem im Wurmfortsatz und im Dünndarm, Leiomyosarkome und gastrointestinale Stromatumoren (GIST), die sich aus der glatten Muskulatur bzw. dem Bindegewebe der Darmschleimhaut ableiten, sind selten und machen zusammen weniger als 2 % aller Darmkrebsfälle aus. Deshalb wird im Folgenden nur auf das Adenokarzinom des Blinddarms (Coecum), Grimmdarms (Colon) oder Enddarms (Rectum) eingegangen, das in der medizinischen Fachwelt als kolorektales Karzinom bezeichnet wird.
Die einzelnen Darmabschnitte sind ungleich häufig betroffen, 60 % der Tumore befinden sich im linken Anteil des Dickdarms (jenseits der linken Colonflexur) und 25 % im Coecum und dem übrigen rechten Dickdarm. Von den linksseitigen bösartigen Dickdarmtumoren sind etwa 55 % in der Sigmaschlinge (Colon sigmoideum) und im Rectum lokalisiert.
Vorkommen
In den Industrieländern hat die Anzahl Darmkrebsneuerkrankungen in den letzten 30 Jahren deutlich zugenommen. Mit einer jährlichen Anzahl von Neuerkrankungen (Inzidenz) in Höhe von 30–35 pro 100.000 Einwohner ist er einer der häufigsten bösartigen Erkrankungen in Mitteleuropa und ist für etwa 15 % aller Krebstodesfälle verantwortlich. Die weltweite Inzidenz wird auf 1 Million Neuerkrankungen pro Jahr geschätzt. Männer sind etwas häufiger betroffen als Frauen, dies betrifft vor allem Rectumkarzinome (Geschlechtsverhältnis 60:40). In Deutschland stellt Darmkrebs sowohl bei den Neuerkrankungen als auch beim Krebstod bei Männern wie Frauen die zweithäufigste Krebsform dar. 90 % der kolorektalen Karzinome treten nach dem 50. Lebensjahr auf. Das Durchschnittsalter bei Erstdiagnose liegt bei 65 Jahren. In Deutschland sterben etwa 24.000 Patienten pro Jahr an Darmkrebs. Das Risiko eines Deutschen, in seinem Leben an Darmkrebs zu erkranken, beträgt etwa 6 %, daran zu versterben etwa 2,5–3 %.
Risikofaktoren
Die wichtigsten Risikofaktoren sind hohes Alter und das Vorkommen von Darmpolypen. Diese entarten häufig. Weitere, seltene Risikofaktoren sind genetische Vorbelastung (Familienmitglieder mit Darmkrebs in direkter Linie haben ein etwa dreifach erhöhtes Erkrankungsrisiko) sowie genetische Syndrome, die mit einem erhöhten Risiko für die Entwicklung von Darmkrebs einhergehen.
Krankheiten und Syndrome
Die familiäre adenomatöse Polyposis ist eine seltene obligate Präkanzerose (Erkrankung die zwangsläufig zur Krebsentstehung führt), bei der schon in jungen Jahren der Dickdarm mit Darmpolypen überwuchert wird. Diese Erkrankung hat einen autosomal-dominanten Erbgang. Ursache für die Entstehung von bis zu 1000 Polypen im Dickdarm ist eine Störung des normalen Zellzyklus (die Mutation des APC-Tumorsuppressorgens). Eine totale operative Entfernung des Dickdarmes (Kolektomie) wird bis zum 20. Lebensjahr empfohlen.
Weitere Syndrome mit deutlich erhöhtem Risiko sind das Gardner-Syndrom, eine erbliche Erkrankung, bei der es neben vielen Polypen im Darm auch zum Auftreten von gutartigen Tumoren der Haut, der Unterhaut, des Knochens sowie des Bindegewebes kommt, und das Turcot-Syndrom, ebenfalls eine seltene genetische Erkrankung, bei der neben Polypen im Darm auch Hirntumore vorkommen. Seltener entarten Polypen beim Peutz-Jeghers-Syndrom, einer seltenen genetischen Erkrankung, bei neben Polypen im Magen-Darm-Trakt auch Pigmentflecken im Gesicht und an der Mundschleimhaut vorkommen und bei der juvenilen Polyposis, der häufigsten Polypenart im Kindesalter, bei der die Polypen meist im Enddarm lokalisiert sind.
Eine weitere erbliche Erkrankung, die mit einem deutlichen erhöhten Risiko für die Entwicklung von Darmkrebs einhergeht, ist das hereditäre non-polypöse kolorektale Karzinom (HNPCC). Bei dieser autosomal-dominant vererbten Erkrankung kommt es neben der Entwicklung von bösartigen Darmtumoren auch gehäuft zu Brustkrebs, Endometriumkarzinomen und Eierstockkrebs. Der Darmkrebs tritt bei den Patienten mit HNPCC bereits um das 45. Lebensjahr auf und ist am häufigsten im aufsteigenden Teil des Dickdarmes (Colon ascendens) lokalisiert.
Ebenfalls mit einem erhöhten Entartungsrisiko (fakultative Präkanzerose) behaftet ist die Colitis ulcerosa insbesondere bei Befall des gesamten Dickdarms. Auch Patienten mit Morbus Crohn tragen im Vergleich zur Gesamtbevölkerung ein geringgradig erhöhtes Darmkrebsrisiko.
Weitere Risikofaktoren
Außerhalb dieser seltenen Syndrome ist der wichtigste Risikofaktor eine Fehlernährung mit übermäßiger Kalorienzufuhr sowie eine fett- und fleischreiche Kost mit niedrigem Anteil an Ballaststoffen. Insbesondere der tägliche Genuss von rotem Fleisch oder Fleischprodukten erhöht das Darmkrebsrisiko um mindestens 50 %, täglicher Fischgenuss hingegen senkt es auf etwa die Hälfte(1). Bis vor kurzem stand auch der Mangel an ballaststoffreicher Kost im Verdacht, das Darmkrebsrisiko zu erhöhen, dies konnte aber nicht sicher erhärtet werden. Grundlage der Ernährungshypothese ist das erhöhte Darmkrebsrisiko von in die USA eingewanderten Japanern: Während das Darmkrebsrisiko in Japan, wo traditionell ballaststoffreich und fleischarme Kost konsumiert wird, deutlich geringer ist als in der westlichen Hemisphäre, steigt das Risiko der japanischen Einwanderer innerhalb von 20 Jahren auf den amerikanischen Durchschnitt. Dies würde – neben dem gestiegenen Altersdurchschnitt – auch die gestiegene Inzidenz des Darmkrebs erklären.
Andererseits steigt auch mit zunehmendem Lebensalter das Risiko für Darmkrebs, so dass die gestiegene Inzidenz für Darmkrebs lediglich Folge der gestiegenen Lebenserwartung sein könnte. 13 neuere Studien mit beinahe 750.000 Teilnehmern deuten darauf hin, dass die Ernährung mit ballaststoffarmer Kost eher nicht mit einer höheren Inzidenz für Darmkrebs korreliert (Frankfurter Allgemeine Sonntagszeitung 2005 Nr. 50 S. 69). Weitere Faktoren, wie zum Beispiel die fischreiche Kost in Japan mit hohem Anteil an Omega-3-Fettsäuren oder der hohe Zinkgehalt dieser Ernährung sind in weiteren Studien zu untersuchen. Möglicherweise gibt es andere noch nicht entdeckte Umweltfaktoren, die das Darmkrebsrisiko mindern könnten.
Häufig wird auch folgende Theorie postuliert: Ballaststoffarme Ernährung führt zu verlängerten Passagezeiten im Darmtrakt. Auf diese Weise können kanzerogene Stoffwechselprodukte (z. B. Nitrosamine) der Darmbakterien länger auf das Gewebe einwirken und begünstigen so die Entstehung kolorektaler Tumoren.
Fragliche Risikofaktoren sind das Rauchen und Infektionen mit Streptokokkus bovis sowie Übergewicht und Bewegungsmangel.
Selten sind auch vorangegangene operative Eingriffe ein Risikofaktor für das kolorektale Karzinom. Beispielsweise können nach einer Ableitung der Harnwege in den Dickdarm (Ureterosigmoidostomie) die harnpflichtige Substanzen wie Phenole und Kresole als mutagene Faktoren auf die Dickdarmschleimhaut wirken.
Pathogenese

Das molekularbiologische Wissen über die Entstehung des Darmkrebs hat in den letzten zwei Jahrzehnten enorm zugenommen. Meist entwickelt sich der Darmkrebs über gutartige Vorstufen, die Dickdarmadenome (sog. Polypen). Für die Entwicklung eines bösartigen Tumors bedarf es mehrerer genetischer Veränderungen. Dieses Modell der Entwicklung von bösartigen Tumoren aus gutartigen Vorstufen nennt man Adenom-Karzinom-Sequenz nach Vogelstein. Ob sich aus einem Adenom ein bösartiger Tumor entwickelt, ist von drei Faktoren abhängig:
- Größe (Adenome mit einer Größe von unter einem Zentimeter entarten praktisch nie)
- histologischer Typ (bei der feingeweblichen (histologischen) Untersuchung werden drei Arten von Adenomen des Dickdarms unterschieden: tubuläre Adenome, tubulovillöse Adenome und villöse Adenome; tubuläre Adenome haben das geringste Risiko zur bösartigen Entartung und villöse Adenome das höchste)
- Grad der Entdifferenzierung (Dysplasie)
Das vermehrte Wissen über die Pathogenese des Darmkrebs hat zur Identifizierung neuer spezifischer molekularer Zielstrukturen geführt und so die Entwicklung neuer pharmakologischer Substanzen für Therapie und Prävention ermöglicht.
Symptome
Darmkrebs ist häufig sehr lange symptomlos. Erst wenn der Tumor in größerem Maße blutet, oder wenn er das Darmlumen nennenswert einengt, kommt es zu Symptomen. Typische Symptome sind dann Blut oder Schleim im Stuhl, Darmkrämpfe, Bleistift- oder Ziegenköttelstühle, Durchfälle und Verstopfungen, sowie häufig quälende Flatulenz. Durch den Blutverlust kann es zur Anämie (Blutarmut) mit den dazugehörigen Symptomen Leistungsabfall, Müdigkeit und allgemeine Schwäche kommen. Infolge der Tumorerkrankung kommt es häufig auch zu einem Gewichtsverlust eventuell bis hin zur Entwicklung einer Kachexie (Auszehrung).
Das einzige Frühsymptom sind unsichtbare (okkulte) Blutungen, die mit Stuhltests (z. B. Hämoccult®) festgestellt werden können. In einigen Ländern wird dieser Test als Screening für Darmkrebs benutzt.
Komplikationen
Typische Komplikationen beim Darmkrebs sind der Darmverschluss (Ileus) durch den Tumor und der Durchbruch durch die Darmwand (Perforation) mit Entwicklung einer Bauchfellentzündung (Peritonitis). Sowohl der Ileus als auch die Perforation sind Zeichen eines fortgeschrittenen Tumorleidens, dennoch können es die ersten Symptome beim Darmkrebs sein. Weitere Komplikationen sind Fisteln oder der Einbruch in Nachbarorgane, Zeichen des Leberversagens auf Grund von Lebermetastasen sowie Kompression von anderen Organen.
Diagnostik

An erster Stelle stehen Erhebung der Krankengeschichte (Anamnese), eine allgemeine körperliche Untersuchung einschließlich einer digital-rektalen Untersuchung (Untersuchung des Enddarms mit dem Finger) und ein Test auf verstecktes Blut im Stuhl. Bei Verdacht auf Darmtumoren wird als diagnostisches Mittel der Wahl eine Darmspiegelung (Koloskopie) durchgeführt. Im Rahmen dieser Untersuchung werden bei entsprechendem Verdacht kleine Gewebsproben so genannte Biopsien entnommen, die dann feingeweblich (histologisch) von einem Pathologen untersucht werden. Die Koloskopie dient auch der Vorsorge, weil mit ihr gleich gutartige Polypen entfernt werden können, die ein Entartungsrisiko besitzen. Aus diesem Grund wird in Deutschland die regelmäßige Koloskopie ab dem 55. Lebensjahr zur Darmkrebsprophylaxe von den Krankenkassen bezahlt. In anderen europäischen Ländern wird die jährliche Untersuchung auf okkultes Blut als Darmkrebsscreening bevorzugt.
Weitere, inzwischen weniger gebräuchliche Untersuchungsmethoden sind die Rekto- oder Sigmoidoskopie, die Untersuchung des Enddarms mit einem starren oder flexiblen beziehungsweise die Untersuchung des End- und Grimmdarms mit einem flexiblen Endoskop, sowie die inzwischen durch die Computertomografie weitgehend verdrängte Röntgenkontrastmittelaufnahme. In Zukunft wird eventuell die auf einer Spiral-Computertomographie basierte Colonographie als nicht-invasive Methode die Koloskopie ersetzen, momentan ist diese Methode aber noch in der Entwicklungsphase und bei kleinen Polypen oder Karzinomen ist sie in ihrer Aussagekraft der Koloskopie noch unterlegen.
Sollten sich aus der Koloskopie Hinweise auf das Vorliegen eines Darmkrebs ergeben, werden in der Regel folgende Untersuchungen zur Bestimmung des Tumorstadiums (Tumorstaging) veranlasst:
- Abdomensonografie zum Ausschluss von Lebermetastasen
- Röntgen-Thorax im Stehen in zwei Ebenen zum Ausschluss von Lungenmetastasen
- Computertomografie oder Magnetresonanztomografie der Bauchhöhle, der Brusthöhle und des Schädels zur Erfassung der Tumorgröße und zum Ausschluss von Lymphknotenmetastasen und Fernmetastasen der Leber, der Lunge und des Gehirns. Eine Computertomographie der Bauchhöhle oder der Brusthöhle wird nur bei begründetem Verdacht auf eine Fernmetastasierung durchgeführt, in der Regel ist eine Sonographie des Bauches sowie ein konventioneller Röntgen-Thorax zum Staging ausreichend, und beide Methoden sind deutlicher geringer strahlenbelastend als die Computertomografie.
- Skelettszintigrafie zum Ausschluss von Knochenmetastasen bei begründetem Verdacht
- bei bösartigen Tumoren des Rektums Endosonographie zur Erfassung der Eindringtiefe des Tumors und zum Nachweis vergrößerter Lymphknoten in der Umgebung
Zur Verlaufskontrolle stehen Tumormarker (CEA und CA 19-9) zur Verfügung. Diese eignen sich allerdings nicht zur Screening-Untersuchung, da sie bei vielen Tumoren negativ sind und es häufig falsch-positive Befunde gibt.
Differentialdiagnose
Unterschiedliche Erkrankungen können ein ähnliches klinisches Bild wie Dickdarmkrebs verursachen. Neben den chronisch entzündlichen Darmerkrankungen Morbus Crohn und Colitis ulcerosa sind dies Resorptionsstörungen wie Sprue oder Milcheiweiß-Intoleranz. Erst wenn diese Erkrankungen und ein Tumor des Darmes ausgeschlossen sind, darf die Diagnose Reizdarmsyndrom gestellt werden. Eine Koloskopie mit Gewinnung von histologischem Material dient der Sicherung der Diagnose des Reizdarmsyndroms.
Pathologie
-
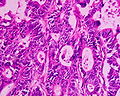
Histologische Untersuchung eines gut differenzierten Adenokarzinoms des Colon.
-
Mäßig differenziertes Adenokarzinom des Rektums.
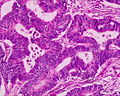
-
Gut differenziertes Adenokarzinom des Rektums.
Makroskopische und mikroskopische Pathologie des Darmkrebs
Aus morphologischer Sicht werden drei makroskopische Wachstumsformen beim Dickdarmkrebs unterschieden:
- polypös-exophytischer Typ: blumenkohlartiger Tumor, der zur gesunden Darmschleimhaut scharf begrenzt ist
- schüsselförmig-exulzerierter Typ: mit zentraler Ulzeration und kraterartig aufgeworfenen Rändern
- diffus-infiltrierender Typ
Histologisch liegt in 95 % der Darmkrebsfälle ein Adenokarzinom vor, das aus tubulären, kribiformen, azinären und papillären Strukturen besteht und abhängig vom Differenzierungsgrad des Tumors auch eine Schleimsekretion aufweist. Zwei Sonderformen des Darmkrebs sind das muzinöse Adenokarzinom, das durch eine massive Schleimproduktion gekennzeichnet ist sowie das Siegelringkarzinom, das durch eine intrazelluläre Schleimansammlung in diffus aneinander liegenden Zellen gekennzeichnet ist.
Metastasierung
Metastasen bezeichnen Absiedlungen eines Tumors in entfernte Gewebe. Es gibt verschiedene Wege über die Metastasen in andere Organe gelangen können.
Per continuitatem
Per continuitatem, d. h. direkt vom Primärtumor ausgehend infiltriert der Tumor das angrenzende perikolische (neben dem Colon liegende) beziehungsweise perirektale (neben dem Rektum liegende) Fettgewebe. Nur selten kommt es zu einer Infiltration in die Nachbarorgane.
Lymphogene Metastasierung
Die lymphogene Metastasierung bezeichnet die Ausbreitung der Erkrankung über das Lymphsystem. Beim Dickdarmkrebs findet man eine unipolare Metastasenstraße beim Colon ascendens und Colon transversum entlang der Arteria mesenterica superior und beim Colon descendens entlang der Arteria mesenterica inferior, d. h. Lymphknotenmetastasen treten zunächst in den Lymphknoten entlang des Verlaufs dieser Arterien auf. Eine Ausnahme bildet der mittlere Bereich des Colon transversum: aufgrund einer zweifachen arteriellen Versorgung dieses Bereiches durch die Arteria mesenterica superior und die Arteria mesenterica inferior können Karzinome in beide Richtungen metastasieren (Riolan-Anastomose, Cannon-Böhm-Punkt).
Hämatogene Metastasierung
Unter hämatogener Metastasierung wird die Absiedelung von Metastasen über die Blutbahn verstanden. Tiefsitzende Rektumkarzinome zeigen ein Metastasierungsverhalten vom Cavatyp, das bedeutet, hämatogene Metastasen treten hier zuerst in der Lunge auf, da der venöse Abfluss aus diesem Gebiet über die Vena cava inferior erfolgt. Die Tumorzellverschleppung erfolgt demzufolge über die Vena cava inferior zum rechten Herzen und von dort in die Lunge. Alle anderen kolorektalen Karzinome weisen ein Metastasierungsverhalten vom Pfortadertyp auf, hämatogene Metastasen treten hier zuerst in der Leber auf. Der Grund hierfür ist, dass der venöse Abfluss und damit die Tumorzellverschleppung primär über die Pfortader in die Leber erfolgt. In einem zweiten Schritt können von der Leber aus Tumorzellen über die Lebervenen in die Vena cava inferior gelangen und von dort in die Lunge.
TNM-Klassifikation des Colonkarzinoms
Die TNM-Klassifikation dient der Charakterisierung des Tumors (sog. Staging). TNM ist eine Abkürzung für
- T= Tumor: Ausdehnung des Primärtumors
- N= Nodus: Lymphknoten, Fehlen bzw. Vorhandensein von regionalen Lymphknotenmetastasen
- M= Metastasen: Fehlen bzw. Vorhandensein von Fernmetastasen
| T1 | Infiltration der Tela submucosa |
| T2 | Infiltration der Tunica muscularis |
| T3 | Infiltration der Subserosa |
| T4 | Infiltration von Nachbarorganen oder des Bauchfells (Peritoneum viscerale) |
| N1 | Metastasen in ein bis drei perikolischen (perirektalen) Lymphknoten |
| N2 | Metastasen in mehr als drei perikolischen (perirektalen) Lymphknoten |
| N3 | Metastasen entlang eines benannten Gefäßstamms und/oder apikale Lymphknotenmetastasen |
| M1 | Fernmetastasen (meist Leber gefolgt von Peritoneum, Lunge, seltener Skelett, Nebennieren oder Gehirn) |
UICC-Klassifikation des Colonkarzinoms
Aus diesen Angaben kann eine Stadieneinteilung (UICC-Stadien) vorgenommen werden. Diese wurde von der „Union internationale contre le cancer“ (UICC) eingeführt und basiert auf statistischen Untersuchungen, die zum Beispiel nachweisen, dass sich ab einer bestimmten Größe eines Tumors die Prognose der Erkrankung verschlechtert. Die Einstufung einer Tumorerkrankung erlaubt daher prognostische Aussagen und bestimmt häufig auch die weitere Therapie.
| Stadium Ia | Beschränkung der Tumorinfiltration auf die Mukosa und Tela submucosa (Dukes A) |
| Stadium Ib | Beschränkung der Tumorinfiltration bis in die Tunica muscularis (Dukes A) |
| Stadium II | T3 oder T4 ohne Lymphknotenmetastasierung (Dukes B) |
| Stadium III | Lymphknotenmetastasierung (Dukes C) |
| Stadium IV | Fernmetastasen (Dukes D) |
Therapie
Die Therapie richtet sich wie bei vielen Krebserkrankungen vor allem nach der Tumorlokalisation und dem Tumorstadium. In der Regel wird eine vollständige operative Resektion (Entfernung) des tumortragenden Darmabschnittes mit Entfernung des zugehörigen Lymphabflussgebietes angestrebt. Die Heilungschancen sind in frühen Stadien sehr gut. Die Operation wird meist offen-chirurgisch durchgeführt, mittlerweile gibt es aber auch Techniken zur laparaskopischen beziehungsweise laparaskopisch-assistierten chirurgischen Therapie des Dickdarmkrebs.
Chirurgie
Die chirurgische Entfernung des Tumors ist bei Darmkrebs auch im fortgeschrittenem Stadium oder beim Vorliegen von Metastasen die Therapie der Wahl, schon um die Entstehung von quälenden Komplikationen wie beispielsweise eines Darmverschlusses (Ileus) zu vermeiden. In manchen Stadien werden zuvor die Chemotherapie (so genannte neoadjuvante Chemotherapie) und die kombinierte Chemo-Strahlentherapie eingesetzt, um das Behandlungsergebnis zu verbessern.
Als standardisierte Eingriffe werden Tumoren des Colon ascendens als rechtsseitige Hemikolektomie und des Colon descendens als linksseitige Hemikolektomie entfernt. Diese Eingriffe können bei Befall des Überganges auf andere Abschnitte auch als erweiterte Hemikolektomie vorgenommen werden. Ein künstlicher Darmausgang muss dabei normalerweise nicht angelegt werden.
Beim Rektumkarzinom (Enddarmkrebs) musste noch vor wenigen Jahren in der Regel ein künstlicher Darmausgang angelegt werden. Heute können moderne Operationsverfahren wie z. B. die Transanale Endoskopische Mikrochirurgie (TEM) oder die Totale Mesorektale Exzision (TME) bei Rektumkarzinomen im Anfangsstadium diesen künstlichen Darmausgang oft verhindern. Besonders bei Enddarmkrebs ist die Wahl einer spezialisierten Klinik und eines erfahrenen Chirurgen wichtig, da der Operationserfolg entscheidend vom Geschick des Operateurs abhängt.
Bei den bereits oben erläuterten Präkanzerosen Familiäre adenomatöse Polyposis und Gardner-Syndrom sollte eine prophylaktische Kolektomie erfolgen nach Möglichkeit mit Anlage eines ileoanalen Pouch.
Chemotherapie
Moderne Zytostatika werden heutzutage meist in Kombinationen verabreicht. So können die einzelnen Wirkstoffe geringer dosiert und die Wirksamkeit erhöht werden. Im Wesentlichen werden dabei drei Therapieziele unterschieden:
- Bei der neoadjuvanten Behandlung wird die Chemotherapie genutzt, um einen großen Tumor oder Metastasen vor der Resektion zu verkleinern und so besser operieren zu können.
- Bei einer adjuvanten (d. h. unterstützenden oder vorbeugenden) Behandlung wird die Chemotherapie eingesetzt, um nach einer Operation eventuell im Körper verbliebene Krebszellen abzutöten und so Rückfälle zu verhindern. Indikation für eine adjuvante Chemotherapie ist ein UICC Stadium III und IV. In der adjuvanten Situation wird meist eine Chemotherapie mit 5-Fluorouracil (5-FU) in Kombination mit Folinsäure durchgeführt. Neuere Studien belegen eine niedrigere Rezidivrate, wenn ein Kombinationstherapie aus 5-FU, Folinsäure und Oxaliplatin durchgeführt wird. Jedoch ist die hohe Nebenwirkungsrate von Oxaliplatin zu beachten, das Medikament löst insbesondere Nebenwirkungen am Nervensystem in Form einer Neuropathie aus. Der Einsatz von monoklonalen Antikörpern in der adjuvanten Therapiesituation ist Gegenstand der aktuellen Forschung (klinische Studien, Phase III)
- Die palliative (d. h. Beschwerden lindernde) Chemotherapie kann bei fortgeschrittenen Erkrankungen (z. B. inoperable Metastasen) eingesetzt werden, um die Lebensqualität zu erhalten und das Leben zu verlängern.
Häufige Behandlungsschemata sind unter anderem FOLFOX und FOLFIRI. Die Kombination mit dem VEGF (Vascular Endothelial Growth Factor) blockierenden monoklonalen Antikörper Bevacizumab (Avastin®) ist seit Frühjahr 2004 zugelassen. Weitere alternative Therapiemöglichkeiten bieten die Xelox und 5FUFS Schemata sowie eine Kombinationstherapie mit dem monoklonalen Antikörper Cetuximab (Erbitux®).
Die alleinige Strahlentherapie ist bei Darmkrebs in der Regel nicht indiziert. Allerdings hat die kombinierte Strahlen-Chemotherapie einen festen Platz in der palliativen, adjuvanten und neoadjuvanten Behandlung eines Rektumkarzinoms.
Prognose
Die Prognose ist von der Tiefe der Infiltration in die Darmwand und dem Vorhandensein von Lymphknoten- und Fernmetastasen abhängig; die 5-Jahres-Überlebensrate liegt im Mittel bei etwa 40–60 %.
| Stadium I | ca. 85 % |
| Stadium II | ca. 50–60 % |
| Stadium III | ca. 30 % |
| Stadium IV | ca. 5 % |
Aufgrund dieser Zahlen werden Vorsorgeuntersuchungen zur Früherkennung angeboten.
Vorsorgeuntersuchungen
Zur Prophylaxe von Darmkrebs besteht die Möglichkeit, an Vorsorgeuntersuchungen teilzunehmen. Dazu gehört die regelmäßige digital-rektale Untersuchung im Rahmen der allgemeinen körperlichen Untersuchung. Da über die Hälfte der Tumoren im Mast- oder Enddarm lokalisiert sind, kann Darmkrebs oftmals über den After „ertastet“ werden (rektale Untersuchung). Die Untersuchung des Stuhls auf verborgenes Blut alle ein bis zwei Jahre ist in vielen europäischen Ländern Screening-Methode der Wahl, da Darmkrebs frühzeitig durch geringe und mit dem bloßen Auge nicht erkennbare Blutungen auffallen kann.
In Deutschland werden seit 2002 die Kosten für eine Darmspiegelung als Vorsorgeuntersuchung für alle Personen ab dem 55. Lebensjahr, für Patienten aus Risikofamilien ab dem 35. Lebensjahr, von den Krankenkassen übernommen. Dem liegt die Erkenntnis zu Grunde, dass Darmkrebs sich fast immer über einen längeren Zeitraum aus gutartigen Polypen entwickelt, die so genannte Adenom-Karzinom-Sequenz.
Mittlerweile gibt es weltweit eine Reihe von Chemopräventionsstudien, bei denen getestet wurde, ob verschiedene Medikamente oder Nahrungsergänzungsmittel den Darmkrebs beziehungsweise seine Vorläuferstufen, die Adenome, verhindern können.
Literatur
- T. Norat u. a.: Meat, Fish, and Colorectal Cancer Risk: The European Prospective Investigation into Cancer and Nutrition. Journal of the National Cancer Institute, 2005, 97:906–916. PMID 15956652.
- D. P. Kelson u. a. (Hrsg.): Gastrointestinal Oncology – Principles and Practice. Lippincott Williams & Wilkins; 1. Aufl. 2001. ISBN 0781722306 .
- E. D. Courtney, D. M. Melville, R. J. Leicester: Review article: chemoprevention of colorectal cancer. Aliment Pharmacol Ther, 2004, 19: 1–24. PMID 14687163.
- Chir Gastroenterol 2005; Vol. 21, No. 2 (Hauptthema: Behandlung des kolorektalen Karzinomes), auch erhältlich als ISBN 3-8055-7955-1.
Weblinks
- www.dmoz.org – Darmkrebs im Open Directory Project
- www.medicoconsult.de – Medizinische Fachinformationen zum Kolonkarzinom
- Patientenleitlinie Dickdarmkrebs Evidenzbasierte Patientenleitlinie der Universität Witten/Herdecke
- Vorbeugung von Darmkrebs umfassende Abhandlung mit Erfahrungsberichten – Gesundheitsinformation.de