N-Hydroxyphthalimid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | N-Hydroxyphthalimid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C8H5NO3 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 163,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
löslich in Wasser (50,5 g·l−1 bei 25 °C) und in Essigsäure, Acetonitril und Ethylacetat[7] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
N-Hydroxyphthalimid (NHPI) ist das N-Hydroxyderivat des Phthalimids. Die Verbindung wird u. a. als Katalysator für Oxidationsreaktionen, insbesondere für die selektive Oxidation von u. a. Alkanen zu Alkoholen mit molekularem Sauerstoff unter milden Bedingungen eingesetzt.[8][9]
Vorkommen und Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Synthese von N-Hydroxyphthalimid (als „Phthalylhydroxylamin“ bezeichnet) aus Phthaloylchlorid und Hydroxylamin-hydrochlorid in Gegenwart von Natriumcarbonat in wässriger Lösung wurde erstmals 1880 von Lassar Cohn berichtet.[10]
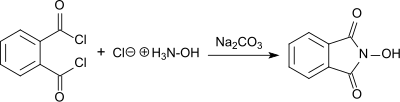
Dabei entsteht das rote Natriumsalz in basischer Lösung, aus der durch Ansäuern die weiße Form des NHPI in 55%iger Ausbeute ausfällt.
Die Umsetzung von Diethylphthalat mit Hydroxylamin-hydrochlorid in Gegenwart von Natriumethanolat führt ebenfalls zu N-Hydroxyphthalimid.[5]
Die Reaktion von Phthalsäureanhydrid mit Hydroxylamin-hydrochlorid und Na2CO3 in Wasser bei 95 °C liefert N-Hydroxyphthalimid als schwach gelbliche Nadeln in 95%iger Rohausbeute, aus dem durch Umkristallisation aus Wasser nahezu farbloses NHPI in 76%iger Reinausbeute erhalten wird.[11]
Mikrowellenbestrahlung von Phthalsäureanhydrid und Hydroxylamin-hydrochlorid in Pyridin erzeugt NHPI in 81%iger Ausbeute.[12]
Auch ohne Zugabe einer Base reagiert Phthalsäureanhydrid und Hydroxylamin-phosphat beim Erhitzen auf 130 °C in 86%iger Ausbeute zu N-Hydroxyphthalimid.[13]

Eigenschaften[Bearbeiten | Quelltext bearbeiten]
N-Hydroxyphthalimid ist ein farbloses bis gelbes, geruchloses kristallines Pulver, das in Wasser und organischen Lösungsmitteln, wie Essigsäure, Essigsäureethylester und Acetonitril, löslich ist.[7] Die Verbindung existiert in zwei verschiedenfarbigen monoklinen Kristallformen. Bei der farblos-weißen Form ist die N-OH-Gruppe um ca. 1,19° aus der Molekülebene gedreht, bei der gelben nur um ca. 0,06°.[14]
Die Farbbildung bei der Synthese des NHPI hängt von der Art des verwendeten Lösungsmittels ab, der Farbübergang von weiß nach gelb ist irreversibel.[15] Mit Alkali- und Schwermetallen, Ammoniak und Aminen bildet NHPI stark gefärbte, meist gelbe oder rote Salze.[6] Die Hydrolyse von NHPI durch Zugabe starker Alkalien erzeugt Phthalsäure-monohydroxamsäure.[5]
NHPI-Ether sind hingegen farblos und liefern bei der alkalischen Hydrolyse oder Spaltung mittels Hydrazinhydrat O-Alkylhydroxylamine.
Die seit der ersten Beschreibung von N-Hydroxyphthalimid als „Phthalylhydroxylamin“ im Jahr 1880 bis zur Mitte der 1950er Jahre unbestimmte und kontrovers diskutierte Molekülstruktur zwischen Phthalsäureanhydrid-monooxim („Phthaloxim“) (I), 2,3-Benzoxazin-1,4-dion (II) und N-Hydroxyphthalimid (III)[16][15][17]

konnte durch Darstellung und Analyse von Umsetzungsprodukten zugunsten des N-Hydroxphthalimids (III) entschieden werden.
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Mit N-Hydroxyphthalimid lassen sich wie mit N-Hydroxysuccinimid (HOSu) mit Carbonsäuren und einem Carbodiimid, wie z. B. Dicyclohexylcarbodiimid, unter Wasserabspaltung so genannte Aktivester bilden,

die in der Peptidsynthese im Vergleich zu den HOSu-Estern wegen deren höheren Wasserlöslichkeit und Reaktivität keine weite Verbreitung gefunden haben.[18][19]
Ester von N-Hydroxyphthalimid mit aktivierten Sulfonsäuren, wie z. B. Trifluormethansulfonsäureanhydrid oder p-Toluolsulfonsäurechlorid werden als so genannte Photosäuren (englisch photoacids), die bei UV-Bestrahlung Protonen abspalten, eingesetzt.

Die erzeugten Protonen dienen dem gezielten lokalen Abbau säureempfindlicher Photoresists.[20]
N-Hydroxyphthalimid kann mit Vinylacetat in Gegenwart von Palladium(II)-acetat mit 75%iger Ausbeute in das N-Vinyloxyphthalimid überführt werden, das quantitativ zum N-Ethoxyphthalimid hydriert wird und durch Spaltung mit Hydroxylaminsulfat mit 83%iger Ausbeute O-Ethylhydroxylamin (Ethoxyamin) liefert.[21]

Eine Vielzahl unterschiedlicher Funktionen in organischen Molekülen können mit dem durch Abstraktion eines Wasserstoffatoms aus NHPI entstehenden Nitroxid-Radikal (Phthalimide-N-oxyl, PINO)[22] – ähnlich wie mit dem Piperidin-Derivat 2,2,6,6-Tetramethylpiperidinyloxyl (TEMPO) – unter schonenden Bedingungen oxidiert werden.[8]
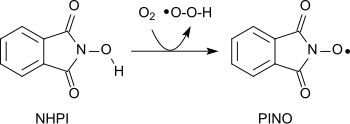
So können mit molekularem Sauerstoff Alkane zu Alkoholen, sekundäre Alkohole zu Ketonen, Acetale zu Estern, oder auch Alkene zu Epoxiden oxidiert werden.[23][24][25]
Amide können mit NHPI und Kobalt(II)-salzen unter milden Bedingungen in Carbonylverbindungen überführt werden.[26]

Von technischem Interesse sind effiziente Oxidationsreaktionen von Vorstufen wichtiger Basischemikalien, wie z. B. ε-Caprolactam, mithilfe von NHPI aus dem bei der Oxidation von Cyclohexan anfallenden sogenannten KA-Öl („Keton-Alkohol“-Öl – einem Gemisch aus Cyclohexanol und Cyclohexanon) – über Cyclohexanolhydroperoxid, Umsetzung mit Ammoniak zum Peroxydicyclohexylamin und Umlagerung in Gegenwart katalytischer Mengen von Lithiumchlorid zu ε-Caprolactam.[24][27]

Die durch NHPI katalysierte Oxidation von KA-Öl vermeidet die Bildung des bei der konventionellen ε-Caprolactam-Synthese – Beckmann-Umlagerung von Cyclohexanonoxim mit Schwefelsäure – anfallenden unerwünschten Nebenprodukts Ammoniumsulfat.
Alkane werden in Gegenwart von Stickstoffdioxid in Nitroalkane überführt.[28]
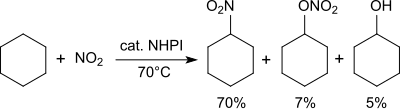
So wird Cyclohexan bei 70 °C mit Stickstoffdioxid/Luft in ein Gemisch von Nitrocyclohexan (70 %), Cyclohexylnitrat (7 %) und Cyclohexanol (5 %) überführt.
Ferner wurden Anwendungen von N-Hydroxyphthalimid als Oxidationsmittel in fotografischen Entwicklern[29] und als Ladungssteuerungsmittel in Tonern[30] in der Patentliteratur beschrieben.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt N-Hydroxyphthalimid bei Sigma-Aldrich, abgerufen am 6. Juni 2017 (PDF).
- ↑ a b Eintrag zu N-Hydroxyphthalimide bei Thermo Fisher Scientific, abgerufen am 22. September 2023.
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 291.
- ↑ a b Eintrag zu N-hydroxyphthalimide bei TCI Europe, abgerufen am 5. August 2016.
- ↑ a b c L. Bauer, S.V. Miarka: The Chemistry of N-Hydroxyphthalimide. In: J. Am. Chem. Soc. Band 79, Nr. 8, 1957, S. 1983–1985, doi:10.1021/ja01565a061.
- ↑ a b A. Porcheddu, G. Giacomelli: The chemistry of hydroxylamines, oximes, and hydroxamic acids, Part 1. Hrsg.: Z. Rappaport, J.F. Lieberman. Wiley, Chichester 2009, ISBN 978-0-470-51261-6, S. 224–226.
- ↑ a b C. Gambarotti, C. Punta, F. Recupero, M. Zlotorzynska, G. Sammis: N-Hydrophthalimide. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2013, doi:10.1002/047084289X.rn00598.pub2.
- ↑ a b F. Recupero, C. Punta: Free Radical Functionalization of Organic Compounds Catalyzed by N-Hydroxyphthalimide. In: Chem. Rev. Band 107, Nr. 9, 2007, S. 3800–3842, doi:10.1021/cr040170k.
- ↑ L. Melone, C. Punta: Metal-free aerobic oxidations mediated by N-hydroxyphthalimide. A concise review. In: Beilstein J. Org. Chem. Band 9, 2013, S. 1296–1310, doi:10.3762/bjoc.9.146.
- ↑ L. Cohn: Phthalylhydroxylamin: Ueberführung der Phthalsäure in Salicylsäure. In: Justus Liebigs Ann. Chem. Band 205, Nr. 3, 1880, S. 295–314, doi:10.1002/jlac.18802050304.
- ↑ H. Gross, I. Keitel: Zur Darstellung von N-Hydroxyphthalimid und N-Hydroxysuccinimid. In: J. prakt. Chem. Band 311, Nr. 4, 1969, S. 692–693, doi:10.1002/prac.19693110424.
- ↑ K. Sugamoto, Y. Matsushita, Y. Kameda, M. Suzuki, T. Matsui: Microwave-assisted synthesis of N-hydroxyphthalimide. In: Synth. Commun. Band 35, Nr. 1, 2005, S. 67–70, doi:10.1081/SCC-200046498.
- ↑ Patent EP1085013: Verfahren zur Herstellung cyclischer N-Hydroxy-dicarboximide. Angemeldet am 31. August 2000, veröffentlicht am 21. März 2001, Anmelder: Consortium für elektrochemische Industrie GmbH, Erfinder: E. Fritz-Langhals.
- ↑ H. Reichelt, C.A. Faunce, H.H. Paradies: Elusive forms and structures of N-hydroxyphthalimide: the colorless and yellow crystal forms of N-hydroxyphthalimide. In: J. Phys. Chem. Band 111, Nr. 13, 2007, S. 2587–2601, doi:10.1021/jp068599y.
- ↑ a b D.E. Ames, T.F. Grey: N-Hydroxy-imides. Part II. Derivatives of homophthalic and phthalic acid. In: J. Chem. Soc. 1955, S. 3518–3521, doi:10.1039/JR9550003518.
- ↑ O.L. Brady, L.C. Baker, R.F. Goldstein, S. Harris: LXVIII. – The isomerism of the oximes. Part XXXIII. The oximes of opianic acid and of phthalic anhydride. In: J. Chem. Soc. 1928, S. 529–539, doi:10.1039/JR9280000529.
- ↑ C.D. Hurd, C.M. Buess, L. Bauer: Succino- and phthalo-hydroxamic acids. In: J. Org. Chem. Band 19, Nr. 7, 1954, S. 1140–1149, doi:10.1021/jo01372a021.
- ↑ G.H.L. Nefkens, G.I. Tesser: A novel activated ester in peptide synthesis. In: J. Am. Chem. Soc. Band 83, Nr. 5, 1961, S. 1263–1263, doi:10.1021/ja01466a068.
- ↑ M. Bodanszky, A. Bodanszky: The practice of peptide synthesis. Springer, Berlin 1984, ISBN 978-3-642-96837-2, S. 124.
- ↑ Patent EP0919867B1: Chemisch verstärkter Resist für die Elektronenstrahllithografie. Angemeldet am 17. November 1998, veröffentlicht am 21. Mai 2003, Anmelder: Infineon Technologies AG, Erfinder: K. Elian, E. Günther, R. Leuschner.
- ↑ Patent WO1995025090: Cyclic N-alkenyloxyimides and a method for the preparation of cyclic N-alkenyloxyimides, the corresponding cyclic N-alkoxyimides and O-alkoxyamines. Angemeldet am 14. März 1995, veröffentlicht am 21. September 1995, Anmelder: DSM N.V., Erfinder: D.M.C. Callant, A.M.C.F. Castelijns, J.G. De Vries.
- ↑ S. Coseri: Phthalimide‐N‐oxyl (PINO) Radical, a Powerful Catalytic Agent: Its Generation and Versatility Towards Various Organic Substrates. In: Catal. Rev. Sci. Eng. Band 51, Nr. 2, 2009, S. 218–292, doi:10.1080/01614940902743841.
- ↑ Y. Ishii, K. Nakayama, M. Takeno, S. Sakaguchi, T. Iwahama, Y. Nishiyama: Novel Catalysis by N-Hydroxyphthalimide in the Oxidation of Organic Substrates by Molecular Oxygen. In: J. Org. Chem. Band 60, Nr. 13, 1995, S. 3934–3935, doi:10.1021/jo00118a002.
- ↑ a b Discovery of a carbon radical producing catalyst and its application to organic synthesis. In: TCIMAIL, number 116. Tokyo Chemical Industry Co. Ltd., April 2003, abgerufen am 11. August 2016.
- ↑ B.B. Wentzel, M.P.J. Donners, P.L. Alsters, M.C. Feiters, R.J.M. Nolte: N-Hydroxyphthalimide/cobalt(II) catalyzed low temperature benzylic oxidation using molecular oxygen. In: Tetrahedron. Band 56, 2000, S. 7797–7803, doi:10.1016/S0040-4020(00)00679-7.
- ↑ F. Minisci, C. Punta, F. Recupero, F. Fontana, G.F. Pedulli: Aerobic Oxidation of N-Alkylamides Catalyzed by N-Hydroxyphthalimide under Mild Conditions. Polar and Enthalpic Effects. In: J. Org. Chem. Band 67, Nr. 8, 2002, S. 2671–2676, doi:10.1021/jo16398e.
- ↑ O. Fukuda, S. Sakaguchi, Y. Ishii: A new strategy for catalytic Baeyer-Villiger oxidation of KA-oil with molecular oxygen using N-hydroxyphthalimide. In: Tetrahedron Lett. Band 42, Nr. 20, 2001, S. 3479–3481, doi:10.1016/S0040-4039(01)00469-5.
- ↑ S. Sakaguchi, Y. Nishiwaki, T. Kitamura, Y. Ishii: Efficient catalytic alkane nitration with NO2 under air assisted by N-hydroxyphthalmide. In: Angew. Chem., Int. Edit. Band 40, Nr. 1, 2001, S. 222–224, doi:10.1002/1521-3773(20010105)40:1<222::AID-ANIE222>3.0.CO;2-W.
- ↑ Patent EP0664479A1: Method of processing silver halide photographic lightsensitive material. Angemeldet am 6. Dezember 1994, veröffentlicht am 26. Juli 1995, Anmelder: Konica Corp., Erfinder: W. Ishikawa, T. Sampei.
- ↑ Patent US5332637: Electrostatographic dry toner and developer compositions with hydroxyphthalimide. Angemeldet am 31. August 1993, veröffentlicht am 26. Juli 1994, Anmelder: Eastman Kodak Co., Erfinder: J.C. Wilson, S.M. Bonser, H.W. Osterhoudt.