Acetylcystein
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
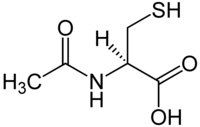
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Acetylcystein | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H9NO3S | |||||||||||||||||||||
| Kurzbeschreibung |
Weißer kristalliner Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Spaltung der Disulfidbrücken des Sekrets in den Bronchien | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 163,20 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser (200 mg·ml−1) und Ethanol (250 mg·ml−1)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Acetylcystein (abgekürzt ACC, NAC; veraltet Mercaptursäure) ist eine synthetisch hergestellte chemische Verbindung. Sie wird als Arzneistoff bei Atemwegserkrankungen mit festsitzendem Auswurf als Hustenlöser eingesetzt; die Wirksamkeit ist allerdings umstritten.[4]
Seine am besten belegte Wirkung hat Acetylcystein als Gegenmittel bei Paracetamolintoxikation. Zudem findet Acetylcystein im Off-Label-Use Anwendung in der Nephrologie, bei Infektionskrankheiten und in der Psychiatrie.
Pharmakologische und toxikologische Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Acetylcystein ist ein Abkömmling der natürlich vorkommenden Aminosäure Cystein. Seine Plasmahalbwertszeit beträgt ca. eine Stunde.[5] Acetylcystein unterliegt nach oraler Gabe einem ausgeprägten First-Pass-Effekt, wobei es zum L-Cystein deacetyliert wird. Dem Wirkstoff und seinem Metaboliten werden eine schleimverflüssigende (sekretolytische bzw. mukolytische) und auswurffördende (sekretomotorische) Wirkung im Bronchialtrakt zugesprochen. Die Wirkung soll durch Spaltung von Disulfidbrücken zustande kommen, die in den Mukopolysacchariden vorkommen, aus denen das in den Bronchien gebildete Sekret besteht. Der in den Bronchien festsitzende zähe Schleim soll durch Verflüssigung besser abgehustet werden können.[5] Als alternativer Wirkungsmechanismus wird eine entzündungshemmende Wirkung diskutiert, die auf der Fähigkeit der reaktiven SH-Gruppe des Acetylcysteins beruhen soll, chemische Radikale zu binden.
Ferner stellt Acetylcystein dem Körper Cystein zur Verfügung, das er zur Bildung von Glutathion benötigt. Glutathion spielt eine wichtige Rolle in der Biotransformation schädlicher Substanzen („Entgiftung“). Speziell beim Abbau von Paracetamol durch Cytochrom P450 entsteht N-Acetyl-p-benzochinonimin, das Leberzellen zerstört und durch Glutathion neutralisiert wird.
Acetylcystein hemmt in vitro die Expression von Prostaglandin-E2 und COX-2[6], was möglicherweise auf seiner Wirkung als Antioxidans[7][8][9] und der damit einhergehenden Beeinflussung des redox-sensiblen Transkriptionsfaktors NF-kB beruht.[10]
Acetylcystein ist weitgehend untoxisch und hat wenig unerwünschte Wirkungen. Dies konnte in präklinischen Studien gezeigt werden.[11][12] So führte beispielsweise die perorale Gabe von 300 mg pro kg Körpergewicht des Wirkstoffs über 52 Wochen bei Hunden zu keinerlei gesundheitlichen Veränderungen.[13]
In einer klinischen Studie am Menschen zeigte sich, dass eine Tagesdosis von 11,6 g Acetylcystein oral über einen Zeitraum von drei Monaten nicht zu schwerwiegenden Nebenwirkungen führt.[5]
Eine Stimulierung der Glutathionproduktion in der Leber durch Gabe von Acetylcystein[14] (als Cysteindonor) wird in einer Stellungnahme der EFSA aus dem Jahr 2004 mit möglichen gesundheitlichen Risiken bei gesunden Kontrollpersonen in Verbindung gebracht.[15]
Bei der intravenösen Acetylcystein-Behandlung der Paracetamol-Vergiftung beim Menschen liegen Erfahrungen mit Tagesmaximaldosen von bis zu 30 g Acetylcystein vor. Die intravenöse Gabe von sehr hohen Acetylcystein-Mengen hat insbesondere bei schneller Applikation zu teilweise irreversiblen anaphylaktoiden Reaktionen geführt. In einem Fall wurden nach massiver intravenöser Überdosierung epileptische Anfälle und Hirnödem mit Todesfolge berichtet.[5]
Derivate des Acetylcysteins sind Abbauprodukte der Kondensationsprodukte von Glutathion mit Fremdstoffen im menschlichen Körper (im Rahmen der Biotransformation) und können im Urin nachgewiesen werden.
Geschichte[Bearbeiten | Quelltext bearbeiten]
1960 wurde herausgefunden, dass Thiole eine schleimlösende Wirkung haben.[16] Besonders ausgeprägt ist die Wirkung in Verbindung mit Cystein. Wegen der Oxidationsempfindlichkeit des Cysteins wurde N-Acetylcystein eingesetzt.
A. L. Sheffner wies die mukolytischen Eigenschaften des N-Acetylcysteins 1963 nach, und Sprince zeigte 1986, dass die Anwendung bei Rauchern eine pulmoprotektive Wirkung hat.[16]
Darstellung[Bearbeiten | Quelltext bearbeiten]
Als Ausgangsstoff dient das oxidationsbeständigere Salz L-Cysteinhydrochlorid, da L-Cystein selbst von Luftsauerstoff leicht zu Cystin oxidiert wird. Als Reaktionsgefäße haben sich emaillierte Stahlbehälter mit 4–10 m³ Inhalt bewährt. Die stark konzentrierte wässrige Lösung des Hydrochlorids wird zunächst unter Stickstoff-Schutzatmosphäre und stetiger Kühlung mit 40%iger Natronlauge auf ca. pH 7,5 neutralisiert (Ausgangs-pH-Wert ca. 1) und anschließend unter gleichzeitiger langsamer Dosierung von Essigsäureanhydrid die Acetylgruppe an das Stickstoffatom gekoppelt. Das Reaktionsgemisch enthält nun hohe Konzentrationen an N-Acetylcystein, NaCl und freier Essigsäure. Um das sehr gut wasserlösliche N-Acetylcystein zu isolieren muss zunächst die Essigsäure im Vakuumverdampfer bei ca. 70 °C abgezogen werden. Dabei erhöht sich die Konzentration an N-Acetylcystein auf mehrere 100 g/l. Schon beim Eindampfen scheidet sich nun der größte Teil des bei der Reaktion gebildeten NaCl ab, dessen Löslichkeit in Wasser im Gegensatz zu N-Acetylcystein mit steigender Temperatur kaum zunimmt.
Das so gebildete Konzentrat wird nun wieder mit etwas Wasser verdünnt, um beim anschließenden Abkühlen das enthaltene NaCl in Lösung zu halten, während das N-Acetylcystein auskristallisiert und anschließend durch Zentrifugation abgetrennt wird.
Das Rohprodukt wird nochmals durch Lösen in heißem reinem Wasser und Filtration über Aktivkohle aufgereinigt und anschließend durch Unterkühlen der Lösung und Einbringen von Impfkristallen hoher Reinheit des Endprodukts auskristallisiert, zentrifugiert, gewaschen und getrocknet. Der Trocknungsschritt ist ausschlaggebend für die Lagerstabilität und Reinheit des Produkts und wird zweckmäßigerweise unter Schutzatmosphäre durchgeführt.
Aufgrund der ausgezeichneten Wasserlöslichkeit von N-Acetylcystein werden die in den Zwischenschritten erhaltenen Mutterlaugen in die einzelnen Prozessschritte zurückgeführt, was erhebliche Anforderungen an die logistische Infrastruktur für die anfallenden Flüssigkeitsmengen stellt. Zudem müssen bei niedrigen Temperaturen große Wassermengen verdampft werden, wofür ein hoher Energieaufwand notwendig ist.
Ebenso problematisch stellt sich die hohe Oxidationsempfindlichkeit von Cystein und N-Acetylcystein dar. Schon geringste Spuren von Eisen(II)-Ionen katalysieren die Oxidation der Thiolgruppe des Cysteins zur Disulfidverbindung Cystin.
Anwendungsgebiete[Bearbeiten | Quelltext bearbeiten]
Atemwegserkrankungen[Bearbeiten | Quelltext bearbeiten]
Acetylcystein ist ein viel verwendeter Wirkstoff zur Schleimverflüssigung und Auswurfförderung bei Husten. Er wird dazu peroral, inhalativ oder parenteral verabreicht.
Die Wirksamkeit hinsichtlich einer schleimverflüssigenden Wirkung von Acetylcystein ist für einfache Atemwegsinfekte nicht belegt.[17] Die therapeutische Wirksamkeit bei Bronchitis ist umstritten, da die aus den 1980er Jahren stammenden Studien heutigen Ansprüchen an ein Studiendesign nicht standhalten.[18] Dementsprechend gibt es nach der DEGAM-Leitlinie auch keine Empfehlung für ACC bei der Behandlung eines grippalen Infektes oder einer akuten Bronchitis, da in randomisierten doppelblinden placebokontrollierten Studien keine signifikanten Effekte auf Lungenfunktion, Bronchialschleim, systemische Oxygenierung und/oder Beatmungsnotwendigkeit nachgewiesen werden konnten. Der Einsatz von ACC als Schleimlöser wird aus medizinischer Sicht deshalb kritisch hinterfragt.[17]
Bei der Mukoviszidose, einer Erkrankung, die mit einer starken Bildung von zähem Schleim in den Bronchien einhergeht, ist die Studienlage unklar. Einerseits scheinen hohe Dosen von Acetylcystein in Einzelstudien eine Besserung der Symptomatik zu bewirken, andererseits konnte in einer systematischen Literaturübersicht keine Wirkung nachgewiesen werden.[19][20]
Antidot bei Überdosierungen[Bearbeiten | Quelltext bearbeiten]
Erwiesen wirksam ist Acetylcystein als Antidot bei Vergiftungen bzw. Überdosierungen mit Paracetamol oder Acrylnitril. Hierbei kommen sehr hohe Dosen bei stationärer Behandlung zum Einsatz,[17] wobei ACC für 72 Stunden oral oder 20 bis 21 Stunden intravenös gegeben wird. Dabei ist die orale Gabe genauso wirksam wie die intravenöse, aber schlechter verträglich, da Übelkeit und Erbrechen auftreten. Zumindest in Europa wird deshalb die intravenöse Gabe bevorzugt. Am effektivsten ist die Therapie, wenn sie in weniger als acht Stunden nach Paracetamolaufnahme begonnen wird. Auch in allen Phasen der Schwangerschaft wird ACC als Antidot empfohlen.[21][22][23][24][25][26]
Aminosäurenzufuhr[Bearbeiten | Quelltext bearbeiten]
Acetylcystein ist häufig als Bestandteil in Infusionslösungen zur parenteralen Aminosäurenzufuhr bei Niereninsuffizienz, Leberinsuffizienz, hepatischer Enzephalopathie und bei Dialyse-Patienten enthalten.[17]
Sonstige (Off-Label-Use)[Bearbeiten | Quelltext bearbeiten]
Nephrologie
Außerhalb zugelassener Anwendungsgebiete, d. h. im Off-Label-Use, wird Acetylcystein bei der Vorbeugung gegen akutes Nierenversagen bei Risikopatienten vor Röntgenverfahren mit Kontrastmitteln eingesetzt. Hier werden jeweils 2 × 600 mg am Tag vor der Untersuchung und am Untersuchungstag gegeben. Die Wirksamkeit dieser Maßnahme ist umstritten. Während einige wenige Studien eine hohe Wirksamkeit der Acetylcystein-Prophylaxe fanden, zeigte sich in der Mehrzahl der Untersuchungen kein signifikanter Effekt.[27]
Infektionskrankheiten
In Tierversuchen an Mäusen hat sich gezeigt, dass ACC die Überlebensrate nach einer Infektion mit Malaria-Erregern – Parasiten der Gattung Plasmodium – von 20 auf 100 Prozent steigert. Der Körper wird in die Lage versetzt, die Leberzellen vor einem Überschuss an freiem Häm zu schützen, das bei der Zerstörung roter Blutkörperchen ins Blut abgegeben wird. Ob der Wirkstoff auch bei einer Malaria-Erkrankung des Menschen hilft, ist nicht durch Studien erwiesen.[28][29]
In einer tierexperimentellen Studie wurde die Wirkung von Acetylcystein als Antioxidans untersucht. Die Autoren folgern aus ihren Untersuchungen, dass ACC einen günstigen Effekt auf unerwünschte Wirkungen bei der Anwendung von Antibiotika haben könnte. Für Chinolon-Antibiotika, Aminoglykoside und Beta-Lactam-Antibiotika stellten sie unter zusätzlicher Gabe von ACC eine verringerte Schädigung von Mitochondrien fest. ACC spielt hierbei anscheinend eine Rolle bei der Aufrechterhaltung des in den Zellen verfügbaren Glutathions, dem wichtigsten körpereigenen Antioxidans, das bei Anwendung der genannten Antibiotika an Mäusen nach 4 Tagen ohne gleichzeitige Gabe von ACC aufgebraucht war. Weitere Studien, mit denen sich die Ergebnisse auch auf den Menschen übertragen ließen, stehen aus.[30][31]
Der Einsatz von Acetylcystein bei HIV- und AIDS-Patienten wurde in kleinen Studien untersucht. Bisher wurden keine signifikanten Auswirkungen einer ACC-Behandlung auf die Surrogatmarker des HIV-Krankheitsverlaufes wie Viruslast oder Anzahl der CD4-Zellen nachgewiesen. Eine Stellungnahme der Fachgesellschaften und eine offizielle Therapieempfehlung zu Acetylcystein existiert bisher nicht.
Der Einsatz von Acetylcystein bei chronischer Prostatitis ist in Forschungskreisen im Gespräch. Mukoproteine bilden einen Hauptbestandteil des Prostatasekretes. Die Verabreichung eines Mukolytikums dient hierbei der Reinigung der Drüsengänge der Prostata. Dies wurde bislang in einigen Einzelfällen mit ACC mit Erfolg erprobt, jedoch noch nicht klinisch nachgewiesen.[32]
Regeneration peripherer Nerven
Es gibt Hinweise darauf, dass Acetylcystein die Regeneration von geschädigten Nerven nicht nur auf biochemischer Ebene (z. B. als Redox-Puffer), sondern auch auf genetischer Ebene positiv beeinflusst, indem es die Aktivität von an der Apoptose beteiligten Genen modifiziert.[33]
Psychiatrie
Auch in der Psychiatrie spielt Acetylcystein aufgrund seiner Wirkung auf den Glutaminstoffwechsel im Gehirn zunehmend eine Rolle. Insbesondere der Einsatz bei Schizophrenie,[34] Zwangsstörungen[35] und Depressionen[36] ist dabei Gegenstand der Forschung.
In der Drogentherapie könnte ACC zukünftig eine Rolle spielen. Tierversuche haben gezeigt, dass kokainsüchtige Ratten durch ACC stärker die Motivation verloren, sich die Droge zu verabreichen, als solche, denen ein Placebo gegeben wurde.[37]
Literatur[Bearbeiten | Quelltext bearbeiten]
- T. Ahola, V. Fellman, R. Laaksonen, J. Laitila, R. Lapatto, P. J. Neuvonen, K. O. Raivio: Pharmacokinetics of intravenous N-acetylcysteine in pre-term new-born infants. In: Eur J Clin Pharmacol., Band 55, 1999, S. 645–650.
- G. K. Isbister, I. K. Bucens, I. M. Whyte: Paracetamol overdose in a preterm neonate. In: Arch Dis Child Fetal Neonatal Ed. Band 85, 2001, S. F70–F2.
Handelsnamen[Bearbeiten | Quelltext bearbeiten]
ACC (D, A, CH, PL), Acemuc (D), Acemucol (CH), Acetyst (D), Aeromuc (A), Dynamucil (CH), Ecomucyl (CH), Fluimucil (D, A, CH), Helvetussin (CH), Mucobene (A), Mucofluid (CH), Myxofat (D), NAC (D), Secresol (CH), Solmucol (CH), diverse Generika (D, CH), Lysox (L)
Kombinationspräparate Alvesin (D), Aminopäd (D), Aminoplasmal (D), Deltamin (D), Infesol (D), Nephrotec (D), Periplasmal (D, A), Pädamin (A), Rinofluimucil (CH), Salviamin (D), Solmucalm (CH)
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Eintrag zu Acetylcystein bei Vetpharm, abgerufen am 25. August 2020.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu ACETYL CYSTEINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 7. August 2020.
- ↑ a b c d e Datenblatt N-Acetyl-L-cysteine bei Sigma-Aldrich, abgerufen am 30. Mai 2022 (PDF).
- ↑ Eintrag zu Acetylcystein. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Januar 2022.
- ↑ Acetylcysteine and carbocysteine to treat acute upper and lower respiratory tract infections in children without chronic broncho-pulmonary disease | Cochrane. 31. Mai 2013, doi:10.1002/14651858.CD003124.pub4 (cochrane.org [abgerufen am 23. Juni 2017]).
- ↑ a b c d Fachinformation NAC Sandoz® Brausetabletten. ( vom 19. Oktober 2013 im Internet Archive; PDF; 43 kB)
- ↑ T. Origuchi, K. Migita, T. Nakashima, S. Honda, S. Yamasaki: Regulation of cyclooxygenase-2 expression in human osteoblastic cells by N-acetylcysteine. In: The Journal of Laboratory and Clinical Medicine. Band 136, Nr. 5, 1. November 2000, S. 390–394, doi:10.1067/mlc.2000.110369, PMID 11079466.
- ↑ Yu Sun, Jie Chen, Basil Rigas: Chemopreventive agents induce oxidative stress in cancer cells leading to COX-2 overexpression and COX-2-independent cell death. In: Carcinogenesis. Band 30, 2008, S. 93–100, doi:10.1093/carcin/bgn242.
- ↑ T. Origuchi, K. Migita, T. Nakashima: Regulation of cyclooxygenase-2 expression in human osteoblastic cells by N-acetylcysteine. In: J Lab Clin Med. Band 136, Nr. 5, Nov 2000, S. 390–394.
- ↑ Erica Hoffer, Yelena Baum, A. Menahem Nahir: N-Acetylcysteine enhances the action of anti-inflammatory drugs as suppressors of prostaglandin production in monocytes. In: Mediators of Inflammation. Nr. 11, 2002, S. 321–323.
- ↑ Michael J Morgan, Zheng-gang Liu: Crosstalk of reactive oxygen species and NF-κB signaling. In: Cell Research. Band 21, Nr. 1, 1. Januar 2011, S. 103–115, doi:10.1038/cr.2010.178, PMID 21187859, PMC 3193400 (freier Volltext).
- ↑ D. C. Plumb: Veterinary Drug Handbook. In: PharmaVet Publishing. White Bear Lake (USA), 1999.
- ↑ R. E. Johnston, H. C. Hawkins, J. H. Weikel Jr: The toxicity of N-acetylcysteine in laboratory animals. In: Semin Oncol. Band 10, Suppl 1, 1983, S. 17–24.
- ↑ H. Keller, A. Faulstich, M. Elker, M. Grell, S. Wuschko, J. H. Rehders: Klinische Studie zur Wirksamkeit und Verträglichkeit von N-Acetylcystein bei der Behandlung der COB/COPD des Pferdes. In: Prakt Tierarzt. Band 82, Nr. 2, 2001, S. 108–117.
- ↑ Reduziertes Glutathion (GSH) oder GSH-Vorstufen wie N-Acetylcystein (NAC)? ( vom 10. Februar 2013 im Internet Archive) Glutathion-News
- ↑ Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food (AFC) on a request from the Commission related to N-Acetyl-L-cysteine for use in foods for particular nutritional uses and in foods for spec. In: EFSA Journal, Nr. 2, 2004, S. 21, doi:10.2903/j.efsa.2004.21.
- ↑ a b Wolf-Dieter Müller-Jahncke, Christoph Friedrich, Ulrich Meyer: Arzneimittelgeschichte. 2., überarbeitete und erweiterte Auflage. Wissenschaftliche Vertragsgesellschaft, Stuttgart 2005, ISBN 3-8047-2113-3, S. 185.
- ↑ a b c d Deniz Cicek u. a.: Fortbildungstelegramm Pharmazie: Acetylcystein. ( vom 6. Oktober 2014 im Internet Archive; PDF) Universität Düsseldorf, 7, 2013, S. 60–74.
- ↑ Arzneiverordnung in der Praxis. ( vom 24. September 2011 im Internet Archive; PDF; 397 kB) Band 33, 3. Ausgabe, Juli 2006.
- ↑ R. Tirouvanziam u. a.: High-dose oral N-acetylcysteine, a glutathione prodrug, modulates inflammation in cystic fibrosis. In: PNAS. Band 103, 2006, S. 4628–4633. PMID 16537378.
- ↑ J. Tam, E. F. Nash, F. Ratjen, E. Tullis, A. Stephenson: Nebulized and oral thiol derivatives for pulmonary disease in cystic fibrosis. In: The Cochrane Database of Systematic Reviews, Nr. 7, 2013, CD007168. doi:10.1002/14651858.CD007168.pub3. PMID 23852992. PMC 8078644 (freier Volltext).
- ↑ H. Kupferschmidt: Therapie der Paracetamolvergiftung. Schweizerisches Toxikologisches Informationszentrum. (PDF; 72 kB).
- ↑ M. J. Smilkstein, G. L. Knapp, K. W. Kulig, B. H. Rumack: Efficacy of oral N-acetylcysteine in the treatment of acetaminophen overdose. Analysis of the national multicenter study (1976 to 1985). In: N. Engl. J. Med. Band 319, Nr. 24, Dezember 1988, S. 1557–1562, PMID 3059186.
- ↑ L. F. Prescott, J. Park, A. Ballantyne, P. Adriaenssens, A. T. Proudfoot: Treatment of paracetamol (acetaminophen) poisoning with N-acetylcysteine. In: The Lancet. Band 2, Nr. 8035, August 1977, S. 432–434, PMID 70646.
- ↑ E. Kozer, G. Koren: Management of paracetamol overdose: current controversies. In: Drug Saf. Band 24, Nr. 7, 2001, S. 503–512, PMID 11444723.
- ↑ B. Bailey: Are there teratogenic risks associated with antidotes used in the acute management of poisoned pregnant women? In: Birth Defects Res Part A-Clin Mol Teratol. Band 67, Nr. 2, Februar 2003, S. 133–140, doi:10.1002/bdra.10007, PMID 12769509.
- ↑ Richard Dekhuijzen: N-Acetylcysteine and cytoprotective effects against bronchopulmonary damage: from in vitro studies to clinical application. In: Roberta Masella, Giuseppe Mazza (Hrsg.): Glutathione and Sulfur Amino Acids in Human Health and Disease. Wiley, 2009, ISBN 978-0-470-17085-4, S. 519–542.
- ↑ Steven Fishbane: N-Acetylcysteine in the Prevention of Contrast-Induced Nephropathy. In: Clin J Am Soc Nephrol. Nr. 3, 2008, S. 281–287 (Volltext, Abstract).
- ↑ E. Seixas, R. Gozzelino, A. Chora u. a.: Heme oxygenase-1 affords protection against noncerebral forms of severe malaria. In: PNAS. Band 106, Nr. 37, September 2009, S. 15837–15842, doi:10.1073/pnas.0903419106, PMID 19706490, PMC 2728109 (freier Volltext).
- ↑ Mit Hustenlöser gegen Malaria. In: wissenschaft.de. 18. August 2009, abgerufen am 9. September 2019.
- ↑ Antibiotika: Langzeitschäden durch oxidative Schädigung von Mitochondrien. ( vom 14. September 2013 im Internet Archive)
- ↑ S. Kalghatgi, C. S. Spina, J. C. Costello, M. Liesa, J. R. Morones-Ramirez, S. Slomovic, A. Molina, O. S. Shirihai, J. J. Collins: Bactericidal Antibiotics Induce Mitochondrial Dysfunction and Oxidative Damage in Mammalian Cells. In: Science Translational Medicine. Nr. 5, 2013, S. 192ra85–192ra85, doi:10.1126/scitranslmed.3006055.
- ↑ zur Hypothese ACC bei chronischer Prostatitis. ( vom 9. Januar 2011 im Internet Archive; PDF; 3,6 MB) In: Laborjournal. 3, 2007, S. 14–18.
- ↑ A. Benga, F. Zor F, A. Korkmaz, B. Marinescu, V. Gorantla: The neurochemistry of peripheral nerve regeneration. Indian Journal of Plastic Surgery 50, 5–15 (2017) doi:10.4103/ijps.IJPS_14_17, Online: 5. 7. 19
- ↑ Michael Berk, David Copolov, Olivia Dean, Kristy Lu, Sue Jeavons, Ian Schapkaitz, Murray Anderson-Hunt, Fiona Judd u. a.: N-Acetyl Cysteine as a Glutathione Precursor for Schizophrenia—A Double-Blind, Randomized, Placebo-Controlled Trial. In: Biological Psychiatry. Band 64, Nr. 5, 2008, S. 361–368.
- ↑ D. L. Lafleur u. a.: N-acetylcysteine augmentation in serotonin reuptake inhibitor refractory obsessive-compulsive disorder. In: Psychopharmacology. Band 184, Nummer 2, Januar 2006, S. 254–256.
- ↑ M. Berk, D. Copolov, O. Dean, K. Lu, S. Jeavons, I. Schapkaitz, M. Andersonhunt, A. Bush: N-Acetyl Cysteine for Depressive Symptoms in Bipolar Disorder—A Double-Blind Randomized Placebo-Controlled Trial. In: Biological Psychiatry. Band 64, Nr. 6, 2008, S. 468–475. doi:10.1016/j.biopsych.2008.04.022. PMID 18534556.
- ↑ Eric Ducret, Mickaël Puaud, Jérôme Lacoste, Aude Belin-Rauscent, Maxime Fouyssac, Emilie Dugast, Jennifer E. Murray, Barry J. Everitt, Jean-Luc Houeto, David Belin: N-Acetylcysteine Facilitates Self-Imposed Abstinence After Escalation of Cocaine Intake. In: Biological Psychiatry. doi:10.1016/j.biopsych.2015.09.019. PMID 26592462.