Leberzirrhose
| Klassifikation nach ICD-10 | |
|---|---|
| K74 | Fibrose und Zirrhose der Leber |
| ICD-10 online (WHO-Version 2019) | |
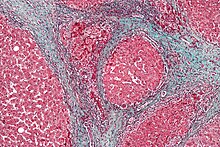
Die Leberzirrhose (Vorlage:ELSneu kírrosis ‚gelb-orange‘, von René Laënnec geprägter Begriff) ist das Endstadium chronischer Leberkrankheiten. Dieses Stadium gilt als irreversibel, auch wenn einzelne Berichte über Heilungen existieren. Typischerweise entwickelt sich eine Zirrhose über Jahre bis Jahrzehnte, seltener sind schnellere Verläufe von unter einem Jahr. Fast alle chronischen Leberkrankheiten führen im Endstadium zu einer Leberzirrhose. In Europa sind Alkoholmissbrauch und chronische Virushepatitis die häufigsten Ursachen.[1]
Durch den chronischen Ablauf von Untergang und Regeneration des Lebergewebes entsteht eine gestörte Gewebearchitektur mit knotigen Veränderungen. Zusätzlich bildet sich übermäßig Bindegewebe (Fibrosierung). Diese narbigen Areale können mehr als 50 % des gesamten Gewebes einer zirrhotischen Leber einnehmen. Dadurch ist die Durchblutung der Leber gestört, im Bereich der Pfortader staut sich das Blut vor der Leber (portale Hypertension).
Die Inzidenz, d. h. die Anzahl der Neuerkrankungen, beträgt in den Industrieländern 250 pro 100.000 Einwohnern und Jahr. Das Verhältnis erkrankter Männer zu Frauen liegt bei 2:1.
Die Leberzirrhose ist nicht zu verwechseln mit der sehr viel häufigeren Fettleber.
Ursachen
Alkoholische Leberzirrhose
Die alkoholische Leberzirrhose ist in Industrieländern mit 50 % die häufigste Ursache. Der massive Alkoholkonsum und die dadurch entstehende hohe Metabolisierungsrate von Ethanol zu Ethanal führen zu einem starken Anstieg des NADH/NAD-Quotienten im Körper. Die Erhöhung des Redoxpotentials der Pyridinnukleotide hemmt den Tricarbonsäurezyklus. Das Acetyl-CoA dient in dieser Situation vor allem in der Leber in erhöhtem Umfang zur Fettsäuresynthese und schließlich zu Anlagerung von Triglyceriden (Fett). Diese Leberverfettung ist anfangs voll reversibel, führt bei fortgesetztem Alkoholkonsum allerdings zu einer Fettleber und damit letztendlich zur Ausbildung einer Leberzirrhose.[2]
Weitere Ursachen
- Leberzirrhose bei chronischer Virushepatitis (in Industrieländern mit 20–25 % zweithäufigste Ursache, in Afrika mit 90 % häufigste)[3] – meist Hepatitis C, die in 85 % chronisch bleibt und in 35 % zur Zirrhose führt
- kryptogene Leberzirrhose (ohne nachweisbare Ätiologie)
- Stauungszirrhose (Cirrhose cardiaque), typisch bei Rechtsherzinsuffizienz
- Autoimmunhepatitis
- Fettleber-Hepatitis (ASH, NASH)
- seltene Zirrhoseformen mit definierter Ätiologie
- Hämochromatose
- Morbus Wilson
- Galaktosämie
- Hereditäre Fruktoseintoleranz
- Mukoviszidose
- Glykogenspeicherkrankheit
- cholangiodysplastische Leberzirrhose
- primär sklerosierende Cholangitis
- Budd-Chiari-Syndrom
- Tropenkrankheiten
- Zirrhose bei Alpha-1-Antitrypsinmangel
- primär biliäre Zirrhose
- sekundär biliäre Zirrhose
- Hepatopathie bei Zöliakie (Gluten-sensitiver Enteropathie)
- Leberzirrhose durch lebertoxische Substanzen wie Tetrachlormethan (Metallverarbeitung) und selten auch durch Medikamente wie beispielsweise Methotrexat
| Prozentuale Verteilung der Ursache[4] | |
| Alkoholabusus | ca. 30–40 % |
| chronische Virushepatitis B, C und D | ca. 30 % |
| nicht-alkoholische Fettleberhepatitis (NASH) | ca. 10 % |
| kryptogene Leberzirrhose | ca. 10 % |
| seltenere Ursachen der Leberzirrhose | ca. 10 % |
Pathogenese
Die Ursache der Zirrhose ist die Nekrose (Absterben) von Leberzellen, verursacht z. B. durch Viren oder Gifte. Die Zellen setzen dabei Zytokine frei, die einerseits Leber-Makrophagen (Kupffer-Zellen) und Fettspeicherzellen der Leber (Ito-Zellen) und andererseits Monozyten und Granulozyten aus dem Blut aktivieren. Durch diese Zellen wird die Organstruktur mit Parenchym-Nekrosen, Herausbildung von Regeneratknoten (Pseudolobuli) und Bindegewebssepten destruktiv umgebaut. Durch diese Bindegewebsknoten werden die Kanäle der Leber unterbrochen, welche die Galle über die Gallenkanälchen (Canaliculi und Ductus) zur Gallenblase bringen, Nährstoffe aus dem portalen Blut in den Körper führen, den Hepatozyten Schadstoffe zum Entgiften anschwemmen und die Leber mit sauerstoffreichem Blut versorgen. Gallenkanäle bilden sich zwar neu aus, enden aber blind. Als Folge entsteht ein Blutstau zwischen Leber und Verdauungstrakt (Portale Hypertension), durch welchen sich Aszites bildet und die Milz sich vergrößert. Im schlimmsten Fall kommt es zu Ösophagusvarizenblutungen. Der Ausfall der Hepatozyten führt zu weiteren Sekundärerkrankungen wie hepatische Enzephalopathie und Leberkoma.[5]
Der Pathologe unterscheidet nach dem äußeren Erscheinungsbild des Organs die mikronoduläre, die makronoduläre und die gemischtknotige Zirrhose. Die Leber schrumpft, ihre Oberfläche wird runzlig und knotig. Mikroskopisch lassen sich aktive oder floride (d. h. voranschreitende) und inaktive Zirrhosen unterscheiden. Die Vorstufe der Leberzirrhose ist die Fettleber.
Symptome
Eine Leberzirrhose beeinträchtigt das subjektive Empfinden des betroffenen Patienten häufig erst in einem recht späten Stadium. Die Leberfunktion kann hinsichtlich der Synthesefunktion (Gerinnungsfaktoren, Albumin) und der Entgiftungsfunktion (Leberkoma) sehr unterschiedlich beeinträchtigt sein. Zusätzlich spielen die Sekundärerkrankungen wie Umgehungskreisläufe, portale Hypertension (daraus folgende Ösophagusvarizen = Krampfadern in der Speiseröhre), Aszites oder Milzvergrößerung (Mangel an Thrombozyten) und hepatische Enzephalopathie oft eine große Rolle. Andere typische Symptome sind Rötungen der Handinnenflächen (Palmarerythem), Caput medusae, Spider-Naevi (Naevus araneus), Rhagaden, Lackzunge und Ödeme. In der sogenannten Child-Pugh-Score-Klassifikation werden mehrere dieser Faktoren einbezogen (Bilirubin, Quick-Wert, Albumin, Enzephalopathie und Aszites) und daraus ein Score errechnet; die daraus resultierende Einteilung in die Stadien A bis C erlaubt eine Aussage über die Prognose der Erkrankung, Patienten im Stadium C nach Child-Pugh haben eine sehr schlechte Prognose hinsichtlich der Überlebenszeit. Die Enzephalopathie und der Aszites werden nur in drei Schweregrade eingeschätzt, was zu mehr oder weniger subjektiven, ungenauen Werten führt. Darum nutzt man seit 2002 auch den MELD-Score, der nach einer bestimmten Formel aus Laborparametern (Kreatinin, Bilirubin und INR) berechnet wird.
Leberzirrhosen gelten als fakultative Präkanzerose, d. h., dass sich auf dem Boden einer Leberzirrhose ein bösartiger Tumor entwickeln kann, das hepatozelluläre Karzinom (HCC).
Als zentrale Symptome der auch als Schrumpfleber bezeichneten Leberzirrhose gelten Leistungsminderung, Konzentrationsschwäche und Müdigkeit. Hinzu treten die so genannten Leberhautzeichen, welche sich unter anderem durch rot gefärbte Kleinfingerballen, durch eine gelbliche Haut (Ikterus) sowie Naevus araneus bemerkbar machen.
Diagnose


Bei der Untersuchung fallen oft ein Ikterus, ein gesteigerter Bauchumfang (Aszites-bedingt), Ödeme, eine Gynäkomastie, Hautblutungen sowie bei einer hepatischen Enzephalopathie ein flapping tremor und Bewusstseinsstörungen auf.
Typisch, allerdings erst spät auftretend, sind die sogenannten Leberhautzeichen: Spider Naevi (Gefäßspinne), „Milchglasnägel“ (Opake Weißverfärbung der Fingernägel mit distaler longitudinaler Rot-braun-Färbung,[6] auch „Terry-Nägel“ genannt), Prurigo (Juckflechte), Lackzunge, Hautatrophie („Geldscheinhaut“) sowie Palmar- bzw. Plantarerytheme (Rötung der Handflächen bzw. der Fußsohle). Diese Zeichen sind allerdings nicht nur für die Leberzirrhose spezifisch, sondern können auch in diskreter Form bei anderen Leberstörungen, wie z. B. der Fettleber, auftreten. Dies kann z. B. auch temporär während einer Schwangerschaft der Fall sein. Weitere Leberzeichen sind Caput medusae, Dupuytren-Kontrakturen sowie eine fehlende Bauchbehaarung beim Mann (Abdominalglatze, „Bauchglatze“).
Im Labor fallen durch die verminderte Syntheseleistung der Leber verminderte Werte für die Cholinesterase, Albumin und einige Gerinnungsfaktoren (erniedrigter Quick-Wert) auf. Die Leberenzyme GOT (AST), GPT (ALT) sowie γ-GT, Bilirubin und Ammoniak können erhöht sein.
Im Ultraschall stellt sich die Leber inhomogen dar. Der Leberrand ist wellig, die Binnengefäße sind rarefiziert. Der Lobus caudatus kann vergrößert sein. Sehr gut können mit dem Ultraschall ein Aszites und eine Milzvergrößerung (Splenomegalie) erkannt werden. Eine verbesserte Form der Sonographie stellt der sogenannte Fibroscan, auch bekannt als transiente Elastografie, dar. Hiermit kann die Fibrosierung, also der Bindegewebsumbau, der Leber ermittelt werden, was ein sehr zuverlässiges Ergebnis zur Diagnosestellung liefert und zukünftig die Leberbiopsie (s. u.) ersetzen könnte. Mit der Farbduplexsonographie lässt sich in den Lebervenen eine verminderte Elastizität der Leber, in der Pfortader ein verminderter Fluss sowie in der Leberarterie ein erhöhter peripherer Widerstand messen.
Die definitive Diagnose wird durch eine Leberbiopsie gestellt.
Aus verschiedenen Untersuchungsbefunden wird der Child-Pugh Score erstellt, der sowohl zur Stadieneinteilung (Child A–C) als auch zur Prognoseabschätzung dient.
Therapie
Die Basis der Therapie bilden ernährungstherapeutische Allgemeinmaßnahmen wie das Weglassen aller potenziell lebertoxischen Substanzen (Alkohol, Medikamente), Ausgleich eines Vitaminmangels (z. B. Vitamin B1 bei Alkoholismus) und eine ausreichende Energiezufuhr, bei hepatischer Enzephalopathie Beschränkung der Proteinaufnahme. Mangelernährte Patienten haben sowohl eine erhöhte Mortalität im spontanen Krankheitsverlauf als auch eine erhöhte Komplikationsrate. Die Nahrungszufuhr sollte bevorzugt als orale Trinknahrung erfolgen, insbesondere Patienten mit fortgeschrittener Leberzirrhose profitieren auch von parenteraler Ernährung. Im frühen Stadium ist dies noch nicht angezeigt.[7] Die Energiezufuhr sollte etwa 145-167 kJ (35–40 kcal) pro Kilogramm Körpergewicht betragen.
Kohlenhydratzufuhr
Eine unzureichende Kohlenhydratzufuhr kann eine bestehende katabole Stoffwechselsituation verschlechtern. Dies ist dadurch zu erklären, dass in dieser Situation neben Fetten auch Proteine zur Energiegewinnung verstoffwechselt werden. Die DDG rät Diabetikern mit Leberzirrhose grundsätzlich von kohlenhydratreduzierten Diäten ab.[7]
Proteinzufuhr
Empfohlen wird eine tägliche Eiweißmenge von 1,2–1,5 g Protein pro kg Körpergewicht. Proteinrestriktion darf ausschließlich bei Patienten mit therapierefraktärer chronischer Enzephalopathie erfolgen. Gegebenenfalls sollte bei diesen Patienten Leucin, Isoleucin und Valin substituiert werden (verzweigtkettige Aminosäuren).[7]
Osteoporoseprophylaxe
Bei allen Patienten sollte frühzeitig eine Osteoporoseprophylaxe eingeleitet werden. Dies geschieht durch Calcium-Substitution (1200–1500 mg/d). Bei Patienten mit cholestatischen Lebererkrankungen wird zusätzlich Vitamin D3 substituiert (400–800 IE/d). Bei Patienten fortgeschrittenen Alters (> 65 Jahre), untergewichtigen Patienten und Rauchern sollte eine Basisdiagnostik früh erfolgen.[7]
Vitaminsubstitution
Eine Vitamin-K-Substitution ist angezeigt bei erhöhtem Blutungsrisiko und niedrigen Quick-Werten. Da die enterale Resorption dieses lipophilen Vitamins bei Cholestase vermindert ist, sollte die Substitution hier in gesteigerter Dosis (10 mg alle 10 Wochen) oral oder parenteral erfolgen. Bei alkoholkranken Patienten liegt zu 50 % ein Vitamin-B1-Mangel vor. Dieses ist – besonders bei fortgesetztem Alkoholkonsum zur Prophylaxe einer Wernicke-Enzephalopathie – ebenfalls zu substituieren.[7]
Nicht-ernährungstherapeutische Maßnahmen
Die Grunderkrankung muss behandelt werden, bei Alkoholismus wird eine Entzugsbehandlung versucht, Patienten mit Autoimmunhepatitis werden mittels Immunsuppression behandelt, bei einer chronischen Hepatitis B kann eine Viruselimination mit Interferonen versucht werden. Bei Hepatitis C führt eine antivirale Therapie bei über 90 % der Betroffenen zur Viruselimination (keine Viren mehr im Blut nachweisbar).
Auf Komplikationen wird mit spezifischen Maßnahmen reagiert: Blutstillung bei Ösophagusvarizenblutung, Shunt-OP bei hepatischer Enzephalopathie, Punktion bei hartnäckigem Aszites.
Wichtig sind regelmäßige Untersuchungen zur Früherkennung eines Leberkarzinoms. Eine Ultima Ratio ist in vielen Fällen die Lebertransplantation.
Wahrscheinlich schützt Koffein die Leber vor der Bildung einer Zirrhose oder verzögert deren Entwicklung.[8]
Die Prognose ist abhängig von der Ursache, der erfolgreichen ursächlichen Behandlung, den Komplikationen und dem Stadium. So sind die Ein-Jahres-Überlebensraten für Patienten im Stadium Child A fast 100 %, bei Child B etwa 85 % und bei Child C 35 %. Mit dem MELD-Score lassen sich Aussagen für das Überleben in den nächsten drei Monaten treffen. So hat ein Patient im Krankenhaus mit einem Score von 20–30 ein Risiko von 25 %, in den nächsten drei Monaten zu sterben. Ein Zirrhotiker mit einem MELD von 40 ist in drei Monaten höchstwahrscheinlich verstorben.[9]
Geschichte
Die erste makroskopische Beschreibung einer Leberzirrhose in der Medizingeschichte findet sich in den Anmerkungen zur Zeichnung del vecchio von Leonardo da Vinci (1452–1519). Die Zeichnungen zur Gefäßanatomie der Leber basieren auf einer Autopsie, die Leonardo da Vinci 1508 in Florenz an einem über 100-Jährigen vornahm.
Literatur
- Herbert Renz-Polster, Steffen Krautzig: Basislehrbuch Innere Medizin. 4. Auflage. 2006, S. 708 ff.
- Gerd Herold: Innere Medizin. 2009, S. 518 ff.
Weblinks
Einzelnachweise
- ↑ Lebertransplantation.de: Leberzirrhose und ihre Komplikationen, 2001, abgerufen am 22. Oktober 2010
- ↑ Gertrud Rehner, Hannelore Daniel: Biochemie der Ernährung. 3. Auflage. Spektrum Akademischer Verlag, 2010, ISBN 978-3-8274-2041-1, S. 491.
- ↑ H. Renz-Polster, S. Krautzig: Basislehrbuch Innere Medizin 4. Aufl., 2006, S. 709.
- ↑ http://www.hepatitisandmore.de/archiv/2011-1/03_Epidemiologie.pdf
- ↑ K. J.Bühling, J. Lepenies, K. Witt: Intensivkurs – Allgemeine und spezielle Pathologie 3. Aufl., 2004, S. 233 ff.
- ↑ Amir M. Nia, Stefan Ederer, Kristina M. Dahlem, Natig Gassanov, Fikret Er: Terry's nails: a window to systemic diseases. In: The American Journal of Medicine. Band 124, Nr. 7. Elsevier, Juli 2011, S. 602–604, doi:10.1016/j.amjmed.2010.11.033, PMID 21683827.
- ↑ a b c d e Hans Konrad Biesalski, Stephan Bischoff, Christoph Puchstein: Ernährungsmedizin. 4., vollständig überarbeitete und erweiterte Auflage. Georg Thieme, Stuttgart 2010, ISBN 978-3-13-100294-5, S. 674 f.
- ↑ Archives of Internal Medicine, 12. Juni 2006: Cirrhosis, and Transaminase Enzymes
- ↑ Christian Müller: Leber und Operationsrisiko. In: Journal für Gastroenterologische und Hepatologische Erkrankungen. Fachzeitschrift für Erkrankungen des Verdauungstraktes. Band 2, Nr. 2. Krause & Pachernegger, 2004, ISSN 1728-6263, S. 36–39 (PDF).