Folsäure
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| Pteroylmonoglutamat (Folsäure, n=1), Pteroylpolyglutamat (n = 2, 3, …), hier die Lactam-Form der zwei möglichen Lactam-Lactim-Tautomere | |||||||||
| Allgemeines | |||||||||
| Trivialname |
| ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C19H19N7O6 | ||||||||
| CAS-Nummer | 59-30-3 | ||||||||
| PubChem | 6037 | ||||||||
| ATC-Code | |||||||||
| Kurzbeschreibung | orangegelbes, kristallines Pulver[2] | ||||||||
| Vorkommen | Weizenkeime, Rinderleber, (Soja-) Bohnen, Kichererbsen, Hefe, Vollkornbrot, Spinat, Grünkohl, Rosenkohl, Spargel, Nüsse, Obst, Fisch und Eigelb | ||||||||
| Physiologie | |||||||||
| Funktion | Übertragung von C1-Gruppen bei biochemischen Reaktionen | ||||||||
| Täglicher Bedarf | |||||||||
| Folgen bei Mangel | Zellteilungsstörungen (als Folge: Megaloblastäre Anämie), Neuralrohrdefekte bei der Embryogenese | ||||||||
| Überdosis | 15 mg/Tag | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 441,40 g · mol−1 | ||||||||
| Aggregatzustand | fest[2] | ||||||||
| Schmelzpunkt | |||||||||
| Löslichkeit | schlecht in Wasser (1,6 mg·l−1 bei 25 °C)[6] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Die Folsäure (von lateinisch folium „Blatt“, wegen des Vorkommens in grünen Pflanzenblättern), auch Vitamin B9, Vitamin M oder (ungebräuchlich) Vitamin B11 und früher auch „Blattsäure“, folic acid, und Folin[7] genannt, ist ein 1941 entdecktes, hitze- und lichtempfindliches Vitamin aus dem B-Komplex. Es setzt sich chemisch aus den Strukturen der L-Glutaminsäure und der Pteroinsäure zusammen, die ihrerseits aus der para-Aminobenzoesäure entsteht. Während die Bezeichnung Folsäure die (industriell hergestellte) synthetische Form des B-Vitamins mit nur einem Glutamatrest (siehe Bild mit n = 1) meint, umfasst der Sammelbegriff Folat alle folatwirksamen Verbindungen, also sowohl solche mit nur einem Glutamatrest (Monoglutamat) als auch solche mit mehreren Glutamatresten (Polyglutamate).
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Nahrungsmittel mit besonders hohen Gehalten an Folsäure sind Hefen mit bis zu 2500 µg je 100 g[8] und Getreidekeime und -kleie (insbesondere Weizenkeime) mit bis zu 600 µg je 100 g Rohgewicht.[9] Weitere natürliche Folsäurelieferanten, die nennenswerte Mengen enthalten, sind Hülsenfrüchte (insbesondere Linsen mit 204 µg je 100 g roh),[10] Kalbs- und Geflügelleber,[11] dunkelgrüne Blattgemüse,[11] Eigelb,[12] Petersilie,[12] Gartenkresse[12] und Sonnenblumenkerne mit jeweils rund 100 µg je 100 g.[13]
Weiterhin weisen Mohnsamen,[12] frisches grünes Gemüse und Nieren einen Folsäuregehalt von 50 bis 100 µg pro 100 g auf,[11] gefolgt von gekochtem Spargel,[12] gekochtem Blattspinat,[12] Tomaten,[12] Brombeeren,[12] Blumenkohl,[12] Orangen,[12] Rindfleisch,[11] Kalbfleisch[11] und Getreideflocken mit 10 bis 50 µg pro 100 g.[11]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Folsäure wird in der chemischen Industrie im Tonnenmaßstab hergestellt. Zunächst wird dazu aus Guanidin und Cyanessigsäureethylester 6-Hydroxy-2,4-diaminopyrimidin synthetisiert, welches mit Salpetriger Säure dann zum 5-Nitro-Derivat umgesetzt und anschließend zu 6-Hydroxy-2,4,5-triaminopyrimidin reduziert wird. Als Reduktionsmittel werden hierfür Zinn(II)-chlorid, Natriumdithionit oder Wasserstoff in Verbindung mit einem Hydrierkatalysator (Palladium auf Kohle) eingesetzt.[14]
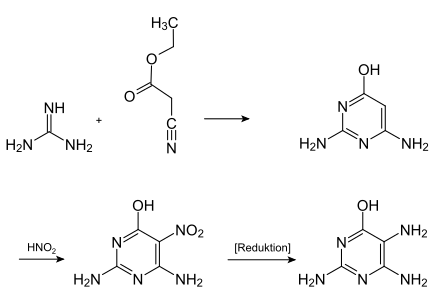
- Synthese von 6-Hydroxy-2,4,5-triaminopyrimidin, einem Ausgangsstoff der industriellen Folsäuresynthese
In einer Dreikomponenten-Reaktion wird 6-Hydroxy-2,4,5-triaminopyrimidin anschließend mit 1,1,3-Trichloraceton und N-(4-Aminobenzoyl)-L-glutaminsäure unter schwach sauren Bedingungen und mit Hilfe von Natriumhydrogensulfit zur Folsäure umgesetzt. Anstelle des Trichloracetons können auch 2,3-Dibrompropionaldehyd oder Methylglyoxal verwendet werden.[14]
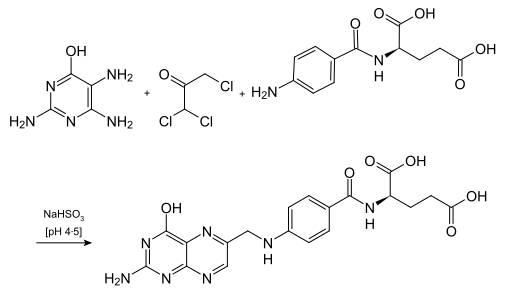
- Industrielle Synthese von Folsäure aus 6-Hydroxy-2,4,5-triaminopyrimidin, 1,1,3-Trichloraceton und N-(4-Aminobenzoyl)-L-glutaminsäure
Chemische und physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]| Tautomere Formen der Folsäure |
|---|
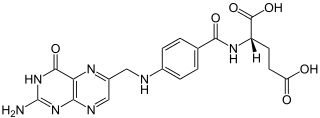 Lactam-Form |
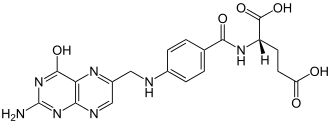 Lactim-Form |
Acidität
[Bearbeiten | Quelltext bearbeiten]Folsäure ist eine dreiprotonige Säure. Die zugehörigen negativen dekadisch logarithmierten Säurekonstanten (pKS-Werte) in Wasser unter Normalbedingungen betragen 4,65; 6,75; 9,00.[15]
Tautomerie
[Bearbeiten | Quelltext bearbeiten]In der Pterin-Teilstruktur des Moleküls tritt Lactam-Lactim-Tautomerie auf, die beiden als Grenzstrukturen formulierbaren Moleküle werden systematisch als (2S)-2-({4-[(2-Amino-4-oxo-1H-pteridin-6-yl)methylamino]benzoyl}amino)pentandisäure (Lactam-Form) und (2S)-N-{4-[(2-Amino-4-hydroxypteridin-6-yl)methylamino]benzoyl}glutaminsäure (Lactim-Form) bezeichnet.
Stabilität
[Bearbeiten | Quelltext bearbeiten]Das Vitamin ist empfindlich gegen Licht (insbesondere UV-Strahlung), Sauerstoff, Schwermetallen, erhöhten Temperaturen sowie (wenn auch sehr gering) gegenüber Wasser.[16] Daher sollten zu intensives Wässern und zu lange Lager- und Kochzeiten von Nahrungsmitteln vermieden werden. Auch auf die menschliche Haut treffende intensive Sonnenstrahlung reduziert die Folsäure im Körper.[17][18] Bei hellhäutigen Menschen ist der Effekt besonders stark.[19]
Biochemie
[Bearbeiten | Quelltext bearbeiten]Folsäure ist die Vorstufe des Coenzyms Tetrahydrofolsäure (THF). Die Reduktion von Folsäure zu Dihydrofolsäure ist Vitamin-C-abhängig[20]. Durch weitere Reduktion entsteht die aktive Form, Tetrahydrofolsäure, die unter physiologischen Bedingungen als Anion Tetrahydrofolat vorliegt. Dieses hat eine zentrale Stellung im C1-Stoffwechsel. THF wirkt besonders als Lieferant von Methyl- (CH3-), Methylen- (CH2=) und Formyl-Gruppen (HCO-) und ist mit an der Synthese von Purinbasen und von desoxy-Thymidinmonophosphat (dTMP) beteiligt, welche für die DNS-Replikation notwendig sind. Außerdem ist THF Coenzym der Methylierung von Homocystein zu Methionin. Geliefert werden die C1-Bausteine des THF u. a. von den Aminosäuren Serin, Glycin und Histidin. Im Aminosäurenstoffwechsel wird als Cofaktor Pyridoxalphosphat benötigt.[20] Ein Belastungstest mit Histidin dient zur Diagnose eines Folsäuremangels. Wegen der Beteiligung an der Synthese von DNS-Bausteinen spielt die Folsäure insbesondere in der Schwangerschaft sowie bei sich häufig teilenden Zellen (z. B. Knochenmark) eine entscheidende Rolle.
Aufnahme und Speicherung
[Bearbeiten | Quelltext bearbeiten]Folsäure ist für den menschlichen Organismus essenziell und kann von ihm selbst nicht hergestellt werden. Deshalb muss Folsäure mit der Nahrung aufgenommen werden. Um zunächst in das Zellinnere zu gelangen, angefangen mit den Darm-Mucosa-Zellen, ist das Folsäuremolekül auf die Anwesenheit des Transportproteins protonengekoppelter Folattransporter angewiesen, der ebenfalls für den Export in die Blutbahn zuständig ist. THF und 5-Derivate des THF benutzen den Folattransporter 1 für den Import, auch und besonders im Darm. Folat, Dihydrofolsäure (DHF) und THF können in die Mitochondrien mittels des mitochondrialen Folattransporters wechseln.
Folat und seine Derivate werden durch Bindung an Polyglutamat im Zytosol und den Mitochondrien der Zellen gespeichert. Nur so können viele der kohlenstoffübertragenden Reaktionen stattfinden. Für die Bindung insbesondere von DHF und THF wird das Enzym Folylpolyglutamat-Synthetase benötigt.[21]
Folatüberschuss führte in Zellkulturen zu einem signifikanten Rückgang der Expression aller folattransportierenden Proteine (PCFT, RFC, Folatrezeptor) in Darmzellen.[22] Durch die starke Abhängigkeit von Vitamin B12- und Folsäurestoffwechsel entwickelt man bei einem Mangel von einem der beiden eine megaloblastäre Anämie;[20] im menschlichen Organismus können Folsäureüberschüsse daher die hämatologischen (nicht aber die neurologischen) Folgen eines Vitamin-B12-Mangels verdecken.
Physiologischer Bedarf
[Bearbeiten | Quelltext bearbeiten]Die empfohlene Tagesdosis nach RDA beträgt 200 µg. Die Referenzwerte für die Nährstoffzufuhr (1. Auflage 2015 der Deutschen Gesellschaft für Ernährung e. V.) empfehlen eine tägliche Aufnahme von 300 µg Folsäure (Frauen mit Kinderwunsch bereits um den Zeitpunkt der möglichen Befruchtung herum 550 µg).[23] Mit Blick auf die zusätzliche Vorbeugung gegen Atherosklerose wurden früher 600 µg für gesunde Erwachsene, 800 µg für Schwangere und für stillende Mütter empfohlen.[24][25] Die Zufuhr von mehr als 1.000 µg Folsäure täglich hat keinen zusätzlichen gesundheitlichen Effekt und führt lediglich zu einem Kreislauf von nicht umsetzbarer Folsäure im Körper.[26] Ursache hierfür ist die außerordentlich begrenzte Aktivität der so genannten Dihydrofolatreduktase (DHFR) und ihrer damit verbundenen raschen Sättigung. Dieses in der Leber vorkommende Enzym hilft, die zugeführte Folsäure in eine für den menschlichen Organismus nutzbare Form (Tetrahydrofolsäure) umzuwandeln. Nach Verabreichung größerer Mengen Folsäure werden diese zum Großteil unverändert als Pteroylmonoglutamat über den Urin ausgeschieden.[5] Die Risiken einer Überversorgung mit Folsäure werden inzwischen allerdings kritisch betrachtet. So kann ein Überschuss von Folsäure einen Vitamin-B12-Mangel verdecken, aus dem eine Schädigung des Nervensystems folgen kann.[27]
Folsäuremangel und Fehlbildungen
[Bearbeiten | Quelltext bearbeiten]Ein Folsäuremangel im menschlichen Körper wirkt sich auf das Blutbild aus, indem er zu einer megaloblastären bzw. hyperchromen makrozytären Anämie führt. Der Mensch kann maximal 12 bis 15 mg Folsäure speichern; dies entspricht einem Vorrat für drei bis vier Monate. Im Normalfall enthält das Blutserum 5 bis 20 μg/l, die Erythrozyten zwischen 160 und 640 μg/l des Vitamins. Bei einem Mangel fällt der Serumspiegel zuerst ab,[28] weshalb dieser meist über Hochleistungsflüssigkeitschromatografie (HPLC) oder über Chemolumineszenz bestimmt wird.[16] Sehr oft tritt ein Folsäuremangel als Folge von erhöhtem Alkoholkonsum, Erkrankungen des Dünndarms oder Lebererkrankungen auf.[28] Bei Frauen ist der Folsäurebedarf bei Einnahme von empfängnisverhütenden Mitteln sowie innerhalb der Schwangerschaft erhöht.[16]
In der Embryonalentwicklung begünstigt ein Folsäuremangel die Entstehung von Neuralrohrdefekten wie eine Spina bifida oder Anenzephalie.[29] Er soll außerdem Einfluss auf eine Frühgeburtlichkeit haben.[30] Jedes Jahr werden in Deutschland etwa 800 Kinder mit einem Neuralrohrdefekt geboren, mithin ist etwa eines von tausend Neugeborenen betroffen; hinzuzurechnen sind wegen Spina bifida abgebrochene Schwangerschaften. Eine ausreichende Folsäureversorgung während der Schwangerschaft scheint darüber hinaus auch im Hinblick auf die Sprachentwicklung des Kindes eine wichtige Rolle zu spielen.[31] Eine prospektive Beobachtungsstudie aus Norwegen zeigt zudem einen Zusammenhang zwischen Folsäuremangel und Autismus, weswegen Folsäure schon beim Wunsch einer Schwangerschaft eingenommen werden sollte.[32][33]
Folsäuremangel führt zu einer megaloblastären Anämie. Die Mitverantwortung der Folsäure an der Zellreifung, -differenzierung und -teilung, insbesondere die der roten und weißen Blutkörperchen und der Schleimhautzellen wird zurzeit in mehreren Universitäten und Forschungslabors untersucht.[34] Bei Erkrankungen des Herz-Kreislauf-Systems, beispielsweise der Arteriosklerose, soll ebenfalls auf ausreichende Folsäureversorgung geachtet werden. Der Wert für die Aminosäure Homocystein im Blut gilt als kardiovaskulärer Risikofaktor. Homocystein wird mit Hilfe der Folsäure und Vitamin B12 in Methionin umgewandelt.[35] Die positiven Auswirkungen erhöhter Folsäuregaben – die unter anderem den Homocystein-Spiegel absenken – auf den Verlauf von Herz-Kreislauf-Erkrankungen sind jedoch nicht gut belegt.
Risiken der Supplementation
[Bearbeiten | Quelltext bearbeiten]Daten aus zwei randomisierten, placebokontrollierten klinischen Doppelblindstudien mit 6837 an Koronarer Herzkrankheit (KHK) leidenden norwegischen Patienten, über einen Zeitraum von 9 Jahren, weisen auf ein erhöhtes Tumorrisiko hin, wenn Präparate, die Folsäure in Kombination mit Vitamin B12 in vielfacher Überdosierung enthalten, eingenommen werden. In der Studie wurde systemisch stark überdosiert und gegenüber der Placebogruppe verglichen (Folsäure: 800 µg = 267 % / Vitamin B12: 400 µg = 16.000 % der empfohlene Tagesdosis[36][37] in Einzeldosen). Gehäuft treten dabei vor allem bösartige Lungentumore auf, die auch zur erhöhten Sterblichkeit von Patienten mit Folsäure-Vitamin-B12-Supplementation beitragen.[38]
Rechtliche Aspekte
[Bearbeiten | Quelltext bearbeiten]Seit der Jahrtausendwende wird in einer zunehmenden Anzahl von Ländern Folsäure den Grundnahrungsmitteln beigefügt, aktuell weltweit in 69 Ländern (Stand 2023), unter anderem in den USA, Kanada und Australien.[39] Jedoch beteiligt sich kein Land der Europäischen Union an einer solchen Aktion.
Deutschland
[Bearbeiten | Quelltext bearbeiten]Da zwei Drittel der Erwachsenen in Deutschland durchschnittlich weniger als 300 µg täglich aufnehmen, fordern einige Kinderärzte und einige Gesundheitspolitiker, dem Grundnahrungsmittel Mehl (wenn es nicht Vollkornmehl ist) Folsäure beizumengen.[40] Auf diese Weise soll insbesondere Fehlbildungen bei der Neuralrohrbildung vorgebeugt werden, die in den ersten drei Schwangerschaftswochen und damit zu einem Zeitpunkt eintreten, zu dem die Schwangerschaft in der Regel noch nicht bekannt ist.[29] Von ärztlichen Befürwortern einer Folsäure-Anreicherung wird argumentiert, dass die Zahl der Schwangerschaften mit Neuralrohrdefekten in Deutschland im internationalen Vergleich besonders hoch sei (12,36 pro 10.000 Geburten; international 7,88 pro 10.000 Geburten).[41] Jährlich gibt es in Deutschland etwa 800 Schwangerschaften mit Neuralrohrdefekten, die in der Mehrheit nach einem positiven Screening-Test abgebrochen werden. Herrmann/Obeid sind der Meinung, dass durch eine perikonzeptionelle Folsäure-Gabe die Häufigkeit von Neuralrohrdefekten um 20 bis 60 % abgesenkt werden könne.[42]
Aus Sicht des Ernährungsministeriums bedarf es in Deutschland keiner Beimengungspflicht.[43] Auch Ernährungsexperten der Verbraucherzentralen u. a. sprechen sich gegen eine Pflichtanreicherung des Mehls mit Folsäure aus, da der Verbraucher auf natürlichem Wege mit Obst, Gemüse und Vollkornbrot ausreichend Folsäure aufnehmen könne und es ihm überdies freistehe, Nahrungsergänzungsmittel oder auch im Handel angebotene, folsäureangereicherte Müsliriegel, Getränke, Milchprodukte oder Kochsalz zu erwerben.
Österreich
[Bearbeiten | Quelltext bearbeiten]Wie in Deutschland wird in Österreich die Versorgung mit Folsäure als unzureichend angesehen. Aus dem Ernährungsbericht 2000 der Deutschen Gesellschaft für Ernährung wird wegen ähnlicher Ernährungsgewohnheiten geschlossen, dass „die empfohlene Folatzufuhr auch in Österreich mit der heute üblichen Ernährungsweise von einem großen Teil der Bevölkerung nicht erreicht wird.“[44] Nach dem Österreichischen Ernährungsbericht 2017 liegt die mittlere Zufuhr von Folat bei beiden Geschlechtern und allen Altersgruppen unter der empfohlenen Zufuhr von 300 μg pro Tag. Nur 27 % der Frauen und 42 % der Männer liegen im Bereich der empfohlenen Zufuhr.[45] Auf der Webseite des Österreichischen Sozialministeriums wird die Thematik nicht behandelt, gesetzliche Verpflichtungen, Folsäure in Lebensmitteln zuzusetzen, gibt es nicht, werden aber in Fachkreisen diskutiert.
Schweiz
[Bearbeiten | Quelltext bearbeiten]Im Januar 2000 begann die Stiftung Folsäure Offensive Schweiz eine nationale Präventionskampagne mit dem Ziel, die Folsäure-Lücke gemäß dem 4. Schweizer Ernährungsbericht 98 des Bundesamtes für Gesundheit zu schließen. Über dreihundert Produkte wurden seither mit Folsäure angereichert, welche mit dem Logo Folsäure-Lebensvitamin ausgezeichnet werden. Dank dieser Kampagne konnte der Bekanntheitsgrad der Folsäure-Prävention von 2000 bis 2010 von 38 % auf 76 % gesteigert werden.[46]
USA und Kanada
[Bearbeiten | Quelltext bearbeiten]In den USA und in Kanada ist seit 1998 ein Folsäurezusatz zum Weizenmehl gesetzlich vorgeschrieben. Seitdem kommen in Kanada nur noch etwa halb so viele Kinder mit Spina bifida zur Welt, Anenzephalie sank um 38 %, Enzephalozele um 31 %. In den USA wurde je nach Bevölkerungsgruppe ein Rückgang zwischen 1 und 34 Prozent (Durchschnitt etwa 20 %) für Spina bifida beobachtet, ähnliche Ergebnisse liegen bei Anenzephalie vor.[47][48]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]- Die obligatorische Folsäurefortifikation von Nahrungsmitteln: Ein in Deutschland kontrovers diskutiertes Thema. In: Deutsches Ärzteblatt, 15. April 2011.
- Gesundheitliche Bedeutung der Folsäurezufuhr. In: Deutsches Ärzteblatt (falsche Maßeinheit im Artikel: Milli-/m- statt Mikro-/µ-!).
- Höchstmengen für Folsäure in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 6. Januar 2022.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu FOLIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d Eintrag zu Folsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 25. Juni 2017. (JavaScript erforderlich)
- ↑ a b c d e f Referenzwert: Folat. DGE, 2018, abgerufen am 30. Juni 2023.
- ↑ a b c d Referenzwerte für die Zufuhr von Folat aktualisiert. DGE, 6. Februar 2019, abgerufen am 30. Juni 2023.
- ↑ a b Eintrag zu Folsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. Mai 2011.
- ↑ a b Eintrag zu Folsäure in der Human Metabolome Database (HMDB), abgerufen am 6. Januar 2024.
- ↑ Viktor Schilling: Einst und jetzt: Über die geschichtliche Entwicklung der Lehre von der Anaemia perniciosa Biermer. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. 79–85, hier: S. 84–85.
- ↑ Leavening agents, yeast, baker’s, active dry ( vom 3. März 2015 im Internet Archive) NDL/FNIC.
- ↑ Food groups: cereal grains and pasta; legumes and legume products. ( vom 3. März 2015 im Internet Archive) NDL/FNIC.
- ↑ National Nutrient Database for Standard Reference Release 28. In: usda.gov. USDA, archiviert vom (nicht mehr online verfügbar) am 17. Mai 2016; abgerufen am 27. Juni 2016.
- ↑ a b c d e f Josef Schormüller: Die Bestandteile der Lebensmittel. Springer-Verlag, 1965, ISBN 978-3-642-46011-1, S. 1009.
- ↑ a b c d e f g h i j Emmo Müller: Folsäure. Georg Thieme Verlag, 2003, ISBN 3-8304-3142-2, S. 70 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Sven-David Müller, Karin Raschke: Das Kalorien-Nährwert-Lexikon. 2004, S. 28.
- ↑ a b Franz von Bruchhausen (Hrsg.); Hermann Hager, Beate Blümer-Schwinum: Hagers Handbuch der pharmazeutischen Praxis. 5. Auflage. Springer, Berlin / Heidelberg / New York 1993, ISBN 3-540-52688-9, S. 284; eingeschränkte Vorschau in der Google-Buchsuche.
- ↑ R. M. C. Dawson: Data for Biochemical Research. 3. Auflage. Oxford University Press, Oxford 1989, ISBN 0-19-855299-8, S. 134.
- ↑ a b c Walter G. Guder, Jürgen Nolte: Das Laborbuch für Klinik und Praxis. Elsevier, 2005, ISBN 978-3-437-23340-1.
- ↑ Nina G. Jablonski, George Chaplin: The evolution of human skin coloration. In: Journal of Human Evolution. Band 39, 2000, S. 57–106, doi:10.1006/jhev.2000.0403, Volltext. (PDF) carleton.ca
- ↑ Nina G. Jablonski, George Chaplin: Skin cancer was not a potent selective force in the evolution of protective pigmentation in early hominins. In: Proceedings of the Royal Society B. Band 281, Nr. 1789, 2014, doi:10.1098/rspb.2014.0517.
- ↑ Inge Kronberg: Geografische Verteilung der Hautfarbe. In: Biologie in unserer Zeit. Band 6, Nr. 2, 2006, S. 76–77.
- ↑ a b c Florian Horn, Silke Berhold, Christian Grillhösl, Gerd Lindenmeier: Biochemie des Menschen. Hrsg.: Florian Horn. 6. Auflage. Thieme, 2015, ISBN 978-3-13-130886-3.
- ↑ Metabolism of folate and pterines. reactome.org
- ↑ B. Ashokkumar, Z. M. Mohammed, N. D. Vaziri, H. M. Said: Effect of folate oversupplementation on folate uptake by human intestinal and renal epithelial cells. In: Am. J. Clin. Nutr. Band 86, Nr. 1, Juli 2007, S. 159–66, PMID 17616776 (englisch).
- ↑ Referenzwerte für die Nährstoffzufuhr: Folat. Abgerufen am 17. April 2016.
- ↑ Mariel Croon: Schwanger werden. Den richtigen Zeitpunkt finden. 2005, S. 67
- ↑ Tanja Saußele: Folsäuresupplementierung vor und während der Schwangerschaft. Medizinische Monatsschrift für Pharmazeuten, 31. Jahrgang, Heft 12, Dezember 2008, S. 469 f.; PMID 19133595.
- ↑ Steven W. Bailey, June E. Ayling: The extremely slow and variable activity of dihydrofolate reductase in human liver and its implications for high folic acid intake. In: Proc Natl Acad Sci USA. 2009, S. Epub, PMID 19706381 (englisch, pnas.org [PDF]).
- ↑ Pressemitteilung. Max Rubner-Institut, 13. März 2012.
- ↑ a b Hanns-Wolf Baenkler: Innere Medizin: 299 Synopsen, 611 Tabellen. Georg Thieme Verlag, 2001, ISBN 3-13-128751-9.
- ↑ a b Nährstoffe in der Schwangerschaft: Folsäure. Medizinfo.
- ↑ Folsäure im Mehl vermeidet Herzfehler. ( vom 22. März 2013 im Internet Archive) aerzteblatt.de
- ↑ Folsäure auch gut gegen Sprachverzögerung. In: Ärzte Zeitung, 15. Oktober 2011.
- ↑ P Surén, C Roth, M Bresnahan et al.: Association Between Maternal Use of Folic Acid Supplements and Risk of Autism Spectrum Disorders in Children. In: JAMA, 2013, 309(6), S. 570–577. doi:10.1001/jama.2012.155925.
- ↑ Prenatal Folic Acid Supplementation Associated With Lower Risk of Autism. jamanetwork.com
- ↑ Olav Jansen, Ulrich Stephani: Fehlbildungen und frühkindliche Schädigungen der ZNS. 2007, ISBN 978-3-13-137591-9, S. 162 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Laura Zimmer: Zusammenhang von Ernährungsfaktoren und Alzheimer-Demenz. 2011, ISBN 978-3-656-03561-9, S. 31 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Folat. Abgerufen am 29. März 2024 (deutsch).
- ↑ EFSA Panel on Dietetic Products, Nutrition, and Allergies (NDA): Scientific Opinion on Dietary Reference Values for cobalamin (vitamin B12). In: EFSA Journal. Band 13, Nr. 7, Juli 2015, doi:10.2903/j.efsa.2015.4150.
- ↑ Marta Ebbing, Kaare Harald Bønaa, Ottar Nygård, Egil Arnesen, Per Magne Ueland: Cancer incidence and mortality after treatment with folic acid and vitamin B12. In: JAMA. Band 302, Nr. 19, 18. November 2009, S. 2119–2126, doi:10.1001/jama.2009.1622, PMID 19920236 (englisch).
- ↑ Map: Count of Nutrients In Fortification Standards. Global Fortification Data Exchange, abgerufen am 30. April 2019 (englisch).
- ↑ Folsaeurevorsorge der deutschen Bevoelkerung (PDF; 1,1 MB).
- ↑ Herrmann, Wolfgang; Obeid, Rima: Die obligatorische Folsäurefortifikation von Nahrungsmitteln – Ein in Deutschland kontrovers diskutiertes Thema. In: Dtsch Arztebl Int (2011), Band 108, Ausgabe 15, S. 249–254. doi:10.3238/arztebl.2011.0249.
- ↑ Wolfgang Herrmann, Rima Obeid: Die obligatorische Folsäurefortifikation von Nahrungsmitteln – ein in Deutschland kontrovers diskutiertes Thema. Deutsches Ärzteblatt 2011;108(15):249–54.
- ↑ Thorsten Denkler: Brot soll per Gesetz Vitamine bekommen. taz, 16. Oktober 2006.
- ↑ Folsäure. Hauptverband der österreichischen Sozialversicherungsträger, abgerufen am 23. März 2019.
- ↑ Petra Rust, Verena Hasenegger, Jürgen König: Österreichischer Ernährungsbericht 2017. Hrsg.: Department für Ernährungswissenschaften der Universität Wien, ISBN 978-3-903099-32-6. S. 17 (sozialministerium.at [abgerufen am 23. März 2019]).
- ↑ SBH-Informationsheft Nr. 4/10. ( vom 7. Juni 2014 im Internet Archive; PDF; 2,6 MB), S. 20.
- ↑ Decline in the Prevalence of Spina Bifida and Anencephaly by Race/Ethnicity: 1995–2002. In: Pediatrics, 2005, 116, S. 580–586.
- ↑ Philippe de Wals, Fassiatou Tairou, Margot I. van Allen, Soo-Hong Uh, R. Brian Lowry, Barbara Sibbald, Jane A. Evans, Michiel C. van den Hof, Pamela Zimmer, Marian Crowley, Bridget Fernandez, Nora S. Lee, Theophile Niyonsenga: Reduction in neural-tube defects after folic acid fortification in Canada. In: N Engl J Med., 12. Juli 2007, 357(2), S. 135–142; PMID 17625125 Volltext nejm.org

