„Orthoebolavirus“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Muck (Diskussion | Beiträge) →Übertragung: Schreibweise einheitlich |
Systematik und Nomenklatur der Virusspezies aktualisiert (vgl. Familie der Filoviridae); Hinweis auf Arbeiten unter Schutzstufe 4; Belege als EN im Artikeltext, z.T. im Abschnitt „Einzelnachweise“ aufgeführt, damit der Quelltext besser lesbar ist |
||
| Zeile 21: | Zeile 21: | ||
}} |
}} |
||
'''Ebolavirus''' ist eine [[Gattung (Biologie)|Gattung]] aus der [[Familie (Biologie)|Familie]] der [[Filoviridae]]. Diese Gattung umfasst fünf [[Art (Biologie)|Spezies]] |
'''Ebolavirus''' ist eine [[Gattung (Biologie)|Gattung]] aus der [[Familie (Biologie)|Familie]] der [[Filoviridae]]. Diese Gattung umfasst fünf [[Art (Biologie)|Spezies]], deren Vertreter behüllte Einzel[[Polarität (Virologie)|(−)-Strang]]-[[RNA]]-Viren sind. Die Ebolaviren verursachen das [[Ebolafieber]]. Neben dem Menschen infizieren sie andere [[Primaten]] ([[Gorillas]], [[Schimpansen]]) und lösen bei ihnen ein [[hämorrhagisches Fieber]] aus. |
||
== Merkmale == |
== Merkmale == |
||
| Zeile 39: | Zeile 39: | ||
== Übertragung == |
== Übertragung == |
||
Eine Übertragung des Virus vom '''Reservoirwirt''' auf den Menschen ist bislang ein eher seltener Vorgang, und der genaue Übertragungsweg ist noch nicht vollends geklärt.<ref>A. Townsend Peterson, John T. Bauer, James N. Mills: [http://www.cdc.gov/ncidod/EID/vol10no1/03-0125.htm ''Ecologic and Geographic Distribution of Filovirus Disease.''] In: ''Emerging infectious diseases.'' Januar 2004, Bd. 10, Nr. 1, S. 40–7, {{ISSN|1080-6040}}, PMID 15078595 ([http://www.cdc.gov/ncidod/EID/vol10no1/pdfs/03-0125.pdf Artikel als PDF-Datei]).</ref><ref>F. A. Murphy, M. P. Kiley, S. P. Fisher-Hoch: ''Filoviridae: Marburg and Ebola viruses.'' In: B. N. Fields, D. M. Knipe (Hrsg.): ''Virology.'' Raven Press, New York 1990, S. 933–42.</ref> Nach Angaben der [[ |
Eine Übertragung des Virus vom '''Reservoirwirt''' auf den Menschen ist bislang ein eher seltener Vorgang, und der genaue Übertragungsweg ist noch nicht vollends geklärt.<ref>A. Townsend Peterson, John T. Bauer, James N. Mills: [http://www.cdc.gov/ncidod/EID/vol10no1/03-0125.htm ''Ecologic and Geographic Distribution of Filovirus Disease.''] In: ''Emerging infectious diseases.'' Januar 2004, Bd. 10, Nr. 1, S. 40–7, {{ISSN|1080-6040}}, PMID 15078595 ([http://www.cdc.gov/ncidod/EID/vol10no1/pdfs/03-0125.pdf Artikel als PDF-Datei]).</ref><ref>F. A. Murphy, M. P. Kiley, S. P. Fisher-Hoch: ''Filoviridae: Marburg and Ebola viruses.'' In: B. N. Fields, D. M. Knipe (Hrsg.): ''Virology.'' Raven Press, New York 1990, S. 933–42.</ref> Nach Angaben der [[Weltgesundheitsorganisation]] (WHO) ist eine Übertragung des Virus auf den Menschen auch durch Körperkontakt mit infizierten kranken oder toten Wildtieren wie [[Affen]], afrikanischen [[Antilope|„Waldantilopen“]] und [[Flughunde]]n aufgetreten.<ref>[http://www.who.int/csr/disease/ebola/en/index.html ''Global Alert and Response (GAR) / Ebola haemorrhagic fever''], WHO. Aufgerufen am 10. Dezember 2010</ref> Eine in Teilen Afrikas gängige Art solcher Kontakte stellt das Jagen, der Handel, die Zubereitung und der Verzehr von als Reservoirwirten in Betracht kommenden Wildtieren („[[Bushmeat|Buschfleisch]]“) dar. Daher wird davon abgeraten.<ref name="ecdceuropaeu">[http://www.ecdc.europa.eu/en/healthtopics/ebola_marburg_fevers/factsheet-for-health-professionals/Pages/factsheet_health_professionals.aspx European Centre for Disease Prevention and Control: ''Factsheet for health professionals.''] Auf: ''ecdc.europa.eu'' vom 21. August 2012, abgerufen am 17. Juli 2014.</ref> |
||
Eine '''Mensch-zu-Mensch-Übertragung''' der Ebolaviren erfolgt durch direkten Körperkontakt und bei Kontakt mit dem Blut, Organen oder anderen [[Körperflüssigkeit]]en infizierter Personen per direkter [[Kontaktinfektion]].<ref name="who_fact_sheet" /> Daher ist eine Übertragung auch durch Geschlechtsverkehr und nach der Geburt (neonatale Transmission) möglich, wobei diese Übertragungswege zahlenmäßig jedoch bislang nur eine untergeordnete Rolle spielen.<!-- Quelle? --> |
Eine '''Mensch-zu-Mensch-Übertragung''' der Ebolaviren erfolgt durch direkten Körperkontakt und bei Kontakt mit dem Blut, Organen oder anderen [[Körperflüssigkeit]]en infizierter Personen per direkter [[Kontaktinfektion]].<ref name="who_fact_sheet" /> Daher ist eine Übertragung auch durch Geschlechtsverkehr und nach der Geburt (neonatale Transmission) möglich, wobei diese Übertragungswege zahlenmäßig jedoch bislang nur eine untergeordnete Rolle spielen.<!-- Quelle? --> |
||
| Zeile 50: | Zeile 50: | ||
== Inkubationszeit == |
== Inkubationszeit == |
||
Die [[Inkubationszeit]] variiert zwischen 2 und 21 Tagen,<ref name="who_fact_sheet" |
Die [[Inkubationszeit]] variiert zwischen 2 und 21 Tagen,<ref name="who_fact_sheet" /> am häufigsten beträgt sie 8–10 Tage.<ref name="cdc_ebola" /> |
||
== Risikogruppe, behördliche Einstufung == |
== Risikogruppe, behördliche Einstufung == |
||
In Deutschland ist in der Verordnung über [[anzeigepflichtige Tierseuche]]n die Ebolavirus-Infektion als anzeigepflichtige Tierseuche aufgeführt ({{§|1|tierseuchanzv|juris}} TierSeuchAnzV). |
In Deutschland ist in der Verordnung über [[anzeigepflichtige Tierseuche]]n die Ebolavirus-Infektion als anzeigepflichtige Tierseuche aufgeführt ({{§|1|tierseuchanzv|juris}} TierSeuchAnzV). In der [[Europäische Union|Europäischen Union]] wird das Ebolavirus durch die [[Richtlinie (EU)|Richtlinie]] 2003/99/EG als [[Zoonose]]erreger klassifiziert.<ref name="trba" /> |
||
Aufgrund der hohen [[Letalität]] (50–90 % |
Aufgrund der hohen [[Letalität]] (50–90 %)<ref name="who_fact_sheet" /> und Infektionsgefahr wird der Erreger in die höchste [[Biologische Schutzstufe#Risikogruppe|Risikogruppe]] 4 nach der [[Biostoffverordnung]] eingeordnet. Die Einstufung gemäß Biostoffverordnung in Verbindung mit der TRBA ([[Technische Regeln]] für Biologische Arbeitsstoffe) 462 gilt für die vier Spezies ''Bundibugyo Ebolavirus'' (früher BEBOV), ''Côte d’Ivoire Ebolavirus'' (früher CIEBOV, aktuelle Bezeichnung ist ''Taï Forest Ebolavirus''), ''Sudan Ebolavirus'' (früher SEBOV) und ''Zaire Ebolavirus'' (früher ZEBOV), während das ''Reston Ebolavirus'' (früher REBOV) der Risikogruppe 2 zugeordnet wird.<ref name="trba" /> |
||
Durch die Biostoffverordnung werden für [[Biologischer Arbeitsstoff|biologische Arbeitsstoffe]] vier Risikogruppen definiert. Das Arbeiten hat unter Berücksichtigung entsprechender Schutzmaßnahmen zu erfolgen, die durch die Biostoffverordnung in vier [[biologische Schutzstufe]]n (englisch: ''biosafety level'', BSL) eingeteilt werden. Demzufolge müssen Arbeiten mit dem Ebolavirus (Ausnahme ''Reston Ebolavirus'', s. o.) unter den strengen Vorgaben der Schutzstufe 4 erfolgen. Weltweit werden Filoviren an 20 Laboratorien erforscht (Stand 2013). Diese müssen daher die Schutzstufe 4 beachten und werden auch als [[Biologische Schutzstufe#Liste von BSL-4-Laboratorien|BSL-4-Laboratorien]] bezeichnet. Für Deutschland trifft dies auf das [[Bernhard-Nocht-Institut für Tropenmedizin]] und das [[Institut für Virologie der Universität Marburg]] zu.<ref name="PMID23358612" /> |
|||
| ⚫ | |||
== |
== Virusspezies == |
||
[[Datei:Filovirus phylogenetic tree.svg|mini|hochkant=1.8|[[Phylogenetischer Baum]] des Ebolavirus und [[ |
[[Datei:Filovirus phylogenetic tree.svg|mini|hochkant=1.8|[[Phylogenetischer Baum]] des Ebolavirus und [[Marburgvirus]] (Stand November 2008)<ref name="DOI10.1371/journal.ppat.1000212" />]] |
||
In der Gattung ''Ebolavirus'' werden fünf [[Art (Biologie)|Spezies]] unterschieden, die jeweils nach den Orten ihres ersten bekannten Auftretens benannt wurden: ''Zaire Ebolavirus'' (früher ZEBOV, 6 [[Subtyp]]en), ''Sudan Ebolavirus'' (früher SEBOV, 3 Subtypen), ''Côte d’Ivoire Ebolavirus'' (früher CIEBOV, 1 Subtyp), ''Bundibugyo Ebolavirus'' (früher BEBOV) und das ''Reston Ebolavirus'' (früher REBOV, 4 Subtypen). |
|||
Die ''[[International Committee on Taxonomy of Viruses|ICTV]] Filoviridae Study Group'' hat 2010 eine aktualisierte [[Systematik (Biologie)|Systematik]] und [[Nomenklatur (Biologie)|Nomenklatur]] der Vertreter der Filoviridae vorgeschlagen,<ref name="PMID21046175" /> die in dem ''9th ICTV Report'' von 2011 umgesetzt wurde.<ref name="ICTV_9th" /><ref name="PMID23358612" /> Demnach soll die folgende Nomenklatur verwendet werden, die auch bereits in entsprechenden Veröffentlichungen der Weltgesundheitsorganisation (WHO)<ref name="who_fact_sheet" /> und der [[Centers for Disease Control and Prevention]] (CDC)<ref name="cdc_ebola" /> Anwendung findet: |
|||
| ⚫ | Die vier |
||
* Gattung ''Ebolavirus'' |
|||
** Spezies ''[[Taï Forest Ebolavirus]]'' |
|||
Diese Spezies ist mit einer Letalitätsrate von 60 bis 90 % die gefährlichste aus der Familie der ''[[Filoviridae]]''. Es werden hier vier Unterstämme unterschieden: [[Eckron (Zaïre-Ebolavirus)|Eckron]], [[Mayinga (Zaïre-Ebolavirus)|Mayinga]] (Letalität 90 %), [[Gabon (Zaïre-Ebolavirus)|Gabon]] und [[Kikwit (Zaïre-Ebolavirus)|Kikwit]]. |
|||
*** Virus: Taï Forest Virus (TAFV) |
|||
** Spezies ''[[Reston Ebolavirus]]'' |
|||
*** Virus: Reston Virus (RESTV) |
|||
** Spezies ''[[Sudan Ebolavirus]]'' |
|||
*** Virus: Sudan Virus (SUDV) |
|||
** Spezies ''[[Zaire-Ebolavirus|Zaire Ebolavirus]]'' |
|||
*** Virus: Ebola Virus (EBOV) |
|||
** Spezies ''[[Bundibugyo Ebolavirus]]'' |
|||
*** Virus: Bundibugyo Virus (BDBV) |
|||
Anmerkungen: Das ''Côte d’Ivoire Ebolavirus'' wurde umbenannt in ''Taï Forest Ebolavirus'', auch die Schreibweise als ''Tai Forest Ebolavirus'' ist zu finden. Die Spezies ''Zaire Ebolavirus'' (auch mit der Schreibweise ''Zaïre Ebolavirus'' zu finden) hat als einzigen Vertreter das Ebola Virus, das als EBOV abgekürzt wird. Im Englischen ist die Schreibweise Ebola virus (nicht kursiv gesetzt), die Getrenntschreibung unterscheidet dieses Virus von der Gattung, die im Englischen ''Ebolavirus'' geschrieben wird. Vom Ebola Virus (EBOV) sind mehrere Varianten bekannt, z. B. Mayinga (abgekürzt als EBOV/May). Hier wird von der zuständigen Expertengruppe geraten, auf die Bezeichnung als „[[Stamm (Systematik)#Bakterienstämme|Stamm]]“ („Virusstamm“) oder „Sybtypus“ zu verzichten und sie stattdessen als Variante (engl. variant) zu benennen.<ref name="PMID21046175" /><ref name="PMID23358612" /> |
|||
==== Struktur ==== |
|||
{{Siehe auch|Filoviridae#Systematik|titel1=Systematik der Familie Filoviridae}} |
|||
| ⚫ | |||
=== Speziesunterschiede === |
|||
| ⚫ | Die vier Spezies ''Taï Forest Ebolavirus'', ''Sudan Ebolavirus'', ''Zaire Ebolavirus'' und ''Bundibugyo Ebolavirus'' verursachen beim Menschen ein [[hämorrhagisches Fieber]] mit einer Letalitätsrate von etwa 50 bis 90 %. In Einzelfällen z. B. bei Erkrankungen durch das Bundibugyo Virus (BDBV), ist die Letalitätsrate auch geringer.<ref name="who_fact_sheet" /> Diese hohe Sterblichkeit deutet wie bei den Marburgviren darauf hin, dass die Ebolaviren mit ihren Varianten noch nicht an den Menschen angepasst und neu in die [[Population (Biologie)|Population]] eingedrungen sind. Die Schädigung seines [[Wirt (Biologie)|Wirts]] bis hin zu seinem Tod ist für ein Virus nicht vorteilhaft, da es zur eigenen Vermehrung auf diesen Wirt angewiesen ist. Die dennoch beim Wirt ausgelösten Symptome sind Nebenwirkungen der Infektion. Die bei den Ebolaviren vorliegende Verbreitungsstrategie des Erregervirus wird als [[Hit and Run (Medizin)|Hit and Run]] bezeichnet. Ist ein Virus besser an seinen Wirt angepasst, ist auch seine Chance größer, sich weiter zu verbreiten, denn von einem solchen Virus wird der Wirt nicht mehr in der akuten Erkrankungsphase getötet. Für den Fall, dass der Wirt nicht sofort wirksame Antikörper entwickelt, welche das Virus neutralisieren, kann das Virus den Wirt viel länger für seine eigene Vermehrung benutzen, wobei es hiermit die sogenannte [[Infect and persist|Infect-and-persist-Strategie]] anwendet. |
||
| ⚫ | Erstmals beobachtet wurde das |
||
=== '' |
=== ''Zaire Ebolavirus'' === |
||
{{Hauptartikel|Zaire-Ebolavirus|titel1=Zaire Ebolavirus}} |
|||
| ⚫ | Diese Spezies löst in [[Makaken]] und Schweinen eine Erkrankung aus. Diese beiden Arten stellen die Hauptwirte des Virus dar. Aufgrund der unterschiedlichen geographischen Verbreitung von infizierten Schweinen und Makaken geht man von zwei unabhängigen Anpassungsschritten des Virus auf die beiden Wirte aus. Beim Menschen findet lediglich eine [[subklinisch]]e [[Infektion]] statt, das heißt, es treten keinerlei Krankheitszeichen auf. Es werden jedoch Antikörper gegen das Virus gebildet.<ref name=" |
||
| ⚫ | Diese Spezies ist mit einer Letalitätsrate von 60 bis 90 % die gefährlichste aus der Familie der ''[[Filoviridae]]''. Wie alle Ebolaviren hat das früher als Subtyp Zaïre bezeichnete Virus einen Durchmesser von etwa 80 nm und eine Länge von 990 bis 1086 nm. Das Genom des Virus besteht aus etwa 19.000 Basen. |
||
| ⚫ | Erstmals beobachtet wurde das Zaire Ebolavirus 1976 in [[Zaire]] (ab 1997 in [[Demokratische Republik Kongo]] umbenannt) und verursachte 280 Tote bei 318 Infizierten (Letalität 88 %). Ein Jahr später erkrankte und verstarb eine weitere Person in Zaire. 1994 erkrankten 52 Menschen, 31 von ihnen verstarben (Letalität 60 %). 1995 infizierten sich 315 Bewohner, 250 von ihnen verstarben (Letalität 81 %). 1996–1997 wurden in [[Gabun]] in zwei Wellen 21 von 37 Menschen (Letalität 57 %) bzw. 45 von 60 (Letalität 75 %) getötet. Dazu kam noch ein Todesfall aus [[Südafrika]]. 2001–2002 kam es wieder in Gabun zu einer [[Epidemie]], der 53 von 65 Menschen zum Opfer fielen (Letalität 82 %). Gleichzeitig kam es auch in der Demokratischen Republik Kongo zu 44 Toten bei 59 Infizierten (Letalität 75 %). 2002–2003 verstarben 128 von 143 Personen an dem Virus, als es in der Demokratischen Republik Kongo erneut zu einer Epidemie kam (Letalität 89 %). Von Dezember 2008 bis Januar 2009 gab es einen Ausbruch in der Demokratischen Republik Kongo. Dort infizierten sich 32 Menschen (Verdachts-, wahrscheinliche und bestätigte Fälle), 15 von ihnen starben (Letalität 46 %).<ref>WHO: 17. Februar 2009 [http://www.who.int/csr/don/2009_02_17/en/index.html ''End of Ebola outbreak in the Democratic Republic of the Congo'']</ref> Im Mai 2011 bestätigte die WHO einen Todesfall in [[Uganda]]. Im Sommer 2014 erkrankten (Stand 13. August 2014) 1975 Menschen in [[Guinea]], [[Liberia]], [[Sierra Leone]] und [[Nigeria]], von welchen 1069 verstarben (Letalität 54 %).<ref>{{internetquelle | titel=Ebola virus disease update - west Africa | url=http://who.int/csr/don/2014_08_13_ebola/en/ | sprache=en | datum=2014-08-13 | zugriff=2014-08-15 | hrsg=WHO – Disease Outbreak News (DONs)}}</ref> |
||
=== ''Reston Ebolavirus'' === |
|||
| ⚫ | Diese Spezies löst in [[Makaken]] und Schweinen eine Erkrankung aus. Diese beiden Arten stellen die Hauptwirte des Virus dar. Aufgrund der unterschiedlichen geographischen Verbreitung von infizierten Schweinen und Makaken geht man von zwei unabhängigen Anpassungsschritten des Virus auf die beiden Wirte aus. Beim Menschen findet lediglich eine [[subklinisch]]e [[Infektion]] statt, das heißt, es treten keinerlei Krankheitszeichen auf. Es werden jedoch Antikörper gegen das Virus gebildet.<ref name="PMID19590002" /> |
||
== Dokumentiertes Auftreten und Epidemien der Ebola-Viruskrankheit == |
== Dokumentiertes Auftreten und Epidemien der Ebola-Viruskrankheit == |
||
| Zeile 379: | Zeile 394: | ||
== Einzelnachweise == |
== Einzelnachweise == |
||
<references |
<references> |
||
<ref name="cdc_ebola">{{Internetquelle | url=http://www.cdc.gov/vhf/ebola/ | titel=Ebola hemorrhagic fever | werk=[http://www.cdc.gov/ Website der Centers for Disease Control and Prevention (CDC)] | datum= 2014-08-10 | zugriff=2014-08-12}}</ref> |
|||
<ref name="DOI10.1371/journal.ppat.1000212">Jonathan S. Towner, Tara K. Sealy u. a.: ''Newly Discovered Ebola Virus Associated with Hemorrhagic Fever Outbreak in Uganda.'' In: ''PLoS Pathogens.'', Band 4, Nr. 11, November 2008, S. e1000212, {{ISSN|1553-7374}}. {{DOI|10.1371/journal.ppat.1000212}}.</ref> |
|||
<ref name="ICTV_9th">{{Literatur | Titel=Family Filoviridae | Autor=J. H. Kuhn, S. Becker u. a. | Herausgeber=A. M. Q. King, M. J. Adams, E. B. Carstens, E. J. Lefkowitz | Sammelwerk=Virus Taxonomy – Ninth Report of the International Committee on Taxonomy of Viruses | Verlag=Elsevier/Academic Press | Ort= London, UK | Jahr=2011 | ISBN=978-0123846846 | Seiten=665–671 | Online=[http://www.ictvonline.org/virusTaxonomy.asp?src=NCBI&ictv_id=19980158 online]}}</ref> |
|||
<ref name="PMID19590002">{{cite journal |author=R. W. Barrette, S. A.Metwally, J. M. Rowland, ''et al.'' |title=Discovery of swine as a host for the Reston ebolavirus |journal=[[Science]] |volume= Bd. 325 |issue=5937 |pages=204–6 |year=2009 |month=July |pmid=19590002 |doi=10.1126/science.1172705 |url=}}</ref> |
|||
<ref name="PMID21046175">J. H. Kuhn, S. Becker u. a.: ''Proposal for a revised taxonomy of the family Filoviridae: classification, names of taxa and viruses, and virus abbreviations.'' In: ''Archives of Virology.'' Band 155, Nr. 12, Dezember 2010, S. 2083–2103, {{ISSN|1432-8798}}. {{DOI|10.1007/s00705-010-0814-x}}. PMID 21046175. {{PMC|3074192}}.</ref> |
|||
<ref name="PMID23358612">J. H. Kuhn, Y. Bao u. a.: ''Virus nomenclature below the species level: a standardized nomenclature for laboratory animal-adapted strains and variants of viruses assigned to the family Filoviridae.'' In: ''Archives of Virology.'' Band 158, Nr. 6, Juni 2013, S. 1425–1432, {{ISSN|1432-8798}}. {{DOI|10.1007/s00705-012-1594-2}}. PMID 23358612. {{PMC|3669655}}.</ref> |
|||
| ⚫ | <ref name="trba">{{Internetquelle | url=http://www.baua.de/de/Themen-von-A-Z/Biologische-Arbeitsstoffe/TRBA/TRBA-462.html | titel=TRBA (Technische Regeln für Biologische Arbeitsstoffe) 462: Einstufung von Viren in Risikogruppen | werk=[http://www.baua.de Website der [[BAuA|Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA)]]] | seiten=4, 27 | datum=2012-04-25 | zugriff=2014-08-09}}</ref> |
||
<ref name="who_fact_sheet">{{Internetquelle | url=http://www.who.int/mediacentre/factsheets/fs103/en/ | titel=Ebola virus disease – WHO Fact Sheet No. 103 | werk=[http://www.who.int/about/en/ Website der [[WHO]]] | datum=April 2014 | zugriff=2014-08-12}}</ref> |
|||
</references> |
|||
{{Normdaten|TYP=s|GND=4233551-6}} |
{{Normdaten|TYP=s|GND=4233551-6}} |
||
Version vom 15. August 2014, 17:16 Uhr
| Ebolavirus | ||||||||
|---|---|---|---|---|---|---|---|---|
Ebolavirus | ||||||||
| Systematik | ||||||||
| ||||||||
| Taxonomische Merkmale | ||||||||
| ||||||||
| Wissenschaftlicher Name | ||||||||
| Ebolavirus | ||||||||
| Links | ||||||||
|
Ebolavirus ist eine Gattung aus der Familie der Filoviridae. Diese Gattung umfasst fünf Spezies, deren Vertreter behüllte Einzel(−)-Strang-RNA-Viren sind. Die Ebolaviren verursachen das Ebolafieber. Neben dem Menschen infizieren sie andere Primaten (Gorillas, Schimpansen) und lösen bei ihnen ein hämorrhagisches Fieber aus.
Merkmale
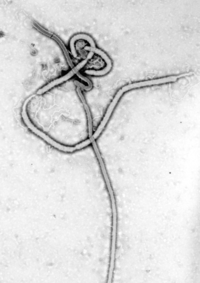
Das Ebolavirus besitzt eine fadenförmige (lateinisch filum ‚Faden‘), manchmal auch bazillusförmige Gestalt. Es kann in seiner Grundstruktur aber auch gelegentlich U-förmig gebogen sein.
In seiner Länge variiert es bis zu maximal 14.000 Nanometer (nm; 14 µm; 0,014 mm), jedoch beträgt der Durchmesser konstant 80 nm und es gehört damit zusammen mit der Gattung Marburgvirus aus derselben Familie zu den größten bekannten RNA-Viren. Als weitere Besonderheit besitzt dieser Erreger auch die Matrixproteine VP40 und VP24.
Ebolaviren sind fähig, sich in fast allen Zellen des Wirtes zu vermehren. Dabei kommt es aufgrund der schnellen Virensynthese zu einem Viruskristall (Crystalloid), der vom Bereich des Zellkerns nach außen dringt und einzelne Viren nach Lyse der Zelle freilässt.
Herkunft allgemein
Die Viren stammen aus den tropischen Regenwäldern Zentralafrikas und Südostasiens (Spezies Reston-Ebolavirus). Von Wissenschaftlern wurden sie zum ersten Mal 1976 in Yambuku, Zaire (ab 1997 Demokratische Republik Kongo) entdeckt; sie traten nahezu gleichzeitig im Sudan auf. Die Gattung wurde nach dem kongolesischen Fluss Ebola benannt, in dessen Nähe es zum ersten allgemein bekannten Ausbruch kam. In 55 Dörfern entlang dieses Flusses erkrankten 318 Menschen, von denen 280 starben, was einer Sterberate von 88 Prozent entspricht. Der erste Fall trat in einem belgischen Missionskrankenhaus auf. Kurz darauf waren fast alle Nonnen und Krankenschwestern – sowie die meisten, die das Krankenhaus besucht hatten oder noch dort waren – erkrankt. Die Schwestern besaßen nur fünf Injektionsnadeln, die sie, ohne sie zwischendurch zu desinfizieren oder zu sterilisieren, für Hunderte Patienten verwendet hatten. Ein mit dem Ebola-Virus verwandtes Virus wurde 1967 mit Affen aus Uganda in wissenschaftliche Labors in Marburg eingeschleppt.
Reservoir
Das natürliche Reservoir der Ebolaviren (Hauptwirt, Reservoirwirt) konnte bisher nicht zweifelsfrei gefunden werden. Fledermausarten gerieten in das Visier der Wissenschaftler, da diese bereits in anderen Kontinenten als mögliche Reservoirwirte für ebenfalls ungewöhnliche Virusinfektionen identifiziert worden waren, so beispielsweise für das Hendra-Virus in Australien[1] und das Nipah-Virus in Malaysia.[2][3] Mittlerweile gibt es starke Hinweise auf verschiedene Arten von Flughunden, die in Afrika weit verbreitet sind und eine Infektion mit Ebola-Viren überleben.[4][5][6]
In einer großangelegten Untersuchung von Fledermäusen haben Wissenschaftler zudem festgestellt, dass sehr wahrscheinlich der Nilflughund (Rousettus aegyptiacus) und der Hammerkopf (Hypsignathus monstrosus) als Reservoirwirte sowohl für das Ebolavirus als auch für das Marburgvirus dienen. Allerdings war Rousettus aegyptiacus die einzige Spezies, in der gleichzeitig Antikörper gegen das Ebola- wie auch gegen das Marburgvirus in hoher Konzentration nachweisbar waren.[4] Vermutlich sind insbesondere in Höhlen lebende Arten betroffen, wobei die weitere Übertragung durch Fallenlassen von angefressenen und anschließend zumeist von Affen verzehrten Früchten als wahrscheinlich erscheint.[4]
Übertragung
Eine Übertragung des Virus vom Reservoirwirt auf den Menschen ist bislang ein eher seltener Vorgang, und der genaue Übertragungsweg ist noch nicht vollends geklärt.[7][8] Nach Angaben der Weltgesundheitsorganisation (WHO) ist eine Übertragung des Virus auf den Menschen auch durch Körperkontakt mit infizierten kranken oder toten Wildtieren wie Affen, afrikanischen „Waldantilopen“ und Flughunden aufgetreten.[9] Eine in Teilen Afrikas gängige Art solcher Kontakte stellt das Jagen, der Handel, die Zubereitung und der Verzehr von als Reservoirwirten in Betracht kommenden Wildtieren („Buschfleisch“) dar. Daher wird davon abgeraten.[10]
Eine Mensch-zu-Mensch-Übertragung der Ebolaviren erfolgt durch direkten Körperkontakt und bei Kontakt mit dem Blut, Organen oder anderen Körperflüssigkeiten infizierter Personen per direkter Kontaktinfektion.[11] Daher ist eine Übertragung auch durch Geschlechtsverkehr und nach der Geburt (neonatale Transmission) möglich, wobei diese Übertragungswege zahlenmäßig jedoch bislang nur eine untergeordnete Rolle spielen.
Auch eine Übertragung durch kontaminierte Gegenstände ist möglich. Das Virus hält seine Infektiösität bei Raumtemperatur und hinunter bis 4 °C stabil über mehrere Tage aufrecht. Bei –70 °C kann es unbegrenzte Zeit überdauern.[12] Daher kann eine Ansteckung auch als Schmierinfektion über Spritzen und andere Gegenstände erfolgen, die mit infektiösen Körperflüssigkeiten kontaminiert wurden.[13][11][14] Nicht auszuschließen ist, dass auch per Tröpfcheninfektion (aerogene Transmission) eine Übertragung erfolgen kann, weswegen Transporte erkrankter Personen vorsichtshalber in „Hochkontagiös-Rettungswagen“ erfolgen, Begleitpersonen Schutzanzüge mit Atemschutz tragen und während der Behandlung eine seuchenhygienische Isolation des Patienten mit „Barrier Nursing“ empfohlen wird.[13]
Auf zellbiologischer Ebene konnte erst kürzlich entschlüsselt werden, wie das Ebolavirus in das Zellinnere eindringt. Das Zaire-Ebolavirus aktiviert über einen bislang unbekannten Membranrezeptor der Rezeptor-Tyrosinkinase-Klasse die sogenannte Phosphoinositid-3-Kinase (PI3K) und bewirkt so seine Internalisierung in die Zelle in Form von Endosomen. Inhibitoren der PI3K und nachgeschalteter Enzyme verhinderten die Infektion in Zellkulturversuchen, was Hoffnung auf zukünftige Behandlungsmöglichkeiten gibt. Weitergehend ist bekannt, dass die Expression des Glykorezeptors „liver and lymph node sinusoidal endothelial cell C-type lectin“ (LSECtin) auf myeloischen Zellen dem Ebolavirus seine Bindungskapazität verleiht.[15][16][17]
In einem Versuch 2012 übertrugen Wildschweine, ohne direkten Kontakt nur durch Tröpfcheninfektion, Ebolaviren an Primaten, ohne dabei selbst tödlich zu erkranken, womit auch sie in Verdacht geraten, größere, alljährliche Epidemien in Afrika auszulösen.[18]
Inkubationszeit
Die Inkubationszeit variiert zwischen 2 und 21 Tagen,[11] am häufigsten beträgt sie 8–10 Tage.[14]
Risikogruppe, behördliche Einstufung
In Deutschland ist in der Verordnung über anzeigepflichtige Tierseuchen die Ebolavirus-Infektion als anzeigepflichtige Tierseuche aufgeführt (§ 1 TierSeuchAnzV). In der Europäischen Union wird das Ebolavirus durch die Richtlinie 2003/99/EG als Zoonoseerreger klassifiziert.[19]
Aufgrund der hohen Letalität (50–90 %)[11] und Infektionsgefahr wird der Erreger in die höchste Risikogruppe 4 nach der Biostoffverordnung eingeordnet. Die Einstufung gemäß Biostoffverordnung in Verbindung mit der TRBA (Technische Regeln für Biologische Arbeitsstoffe) 462 gilt für die vier Spezies Bundibugyo Ebolavirus (früher BEBOV), Côte d’Ivoire Ebolavirus (früher CIEBOV, aktuelle Bezeichnung ist Taï Forest Ebolavirus), Sudan Ebolavirus (früher SEBOV) und Zaire Ebolavirus (früher ZEBOV), während das Reston Ebolavirus (früher REBOV) der Risikogruppe 2 zugeordnet wird.[19]
Durch die Biostoffverordnung werden für biologische Arbeitsstoffe vier Risikogruppen definiert. Das Arbeiten hat unter Berücksichtigung entsprechender Schutzmaßnahmen zu erfolgen, die durch die Biostoffverordnung in vier biologische Schutzstufen (englisch: biosafety level, BSL) eingeteilt werden. Demzufolge müssen Arbeiten mit dem Ebolavirus (Ausnahme Reston Ebolavirus, s. o.) unter den strengen Vorgaben der Schutzstufe 4 erfolgen. Weltweit werden Filoviren an 20 Laboratorien erforscht (Stand 2013). Diese müssen daher die Schutzstufe 4 beachten und werden auch als BSL-4-Laboratorien bezeichnet. Für Deutschland trifft dies auf das Bernhard-Nocht-Institut für Tropenmedizin und das Institut für Virologie der Universität Marburg zu.[20]
Virusspezies

In der Gattung Ebolavirus werden fünf Spezies unterschieden, die jeweils nach den Orten ihres ersten bekannten Auftretens benannt wurden: Zaire Ebolavirus (früher ZEBOV, 6 Subtypen), Sudan Ebolavirus (früher SEBOV, 3 Subtypen), Côte d’Ivoire Ebolavirus (früher CIEBOV, 1 Subtyp), Bundibugyo Ebolavirus (früher BEBOV) und das Reston Ebolavirus (früher REBOV, 4 Subtypen).
Die ICTV Filoviridae Study Group hat 2010 eine aktualisierte Systematik und Nomenklatur der Vertreter der Filoviridae vorgeschlagen,[22] die in dem 9th ICTV Report von 2011 umgesetzt wurde.[23][20] Demnach soll die folgende Nomenklatur verwendet werden, die auch bereits in entsprechenden Veröffentlichungen der Weltgesundheitsorganisation (WHO)[11] und der Centers for Disease Control and Prevention (CDC)[14] Anwendung findet:
- Gattung Ebolavirus
- Spezies Taï Forest Ebolavirus
- Virus: Taï Forest Virus (TAFV)
- Spezies Reston Ebolavirus
- Virus: Reston Virus (RESTV)
- Spezies Sudan Ebolavirus
- Virus: Sudan Virus (SUDV)
- Spezies Zaire Ebolavirus
- Virus: Ebola Virus (EBOV)
- Spezies Bundibugyo Ebolavirus
- Virus: Bundibugyo Virus (BDBV)
- Spezies Taï Forest Ebolavirus
Anmerkungen: Das Côte d’Ivoire Ebolavirus wurde umbenannt in Taï Forest Ebolavirus, auch die Schreibweise als Tai Forest Ebolavirus ist zu finden. Die Spezies Zaire Ebolavirus (auch mit der Schreibweise Zaïre Ebolavirus zu finden) hat als einzigen Vertreter das Ebola Virus, das als EBOV abgekürzt wird. Im Englischen ist die Schreibweise Ebola virus (nicht kursiv gesetzt), die Getrenntschreibung unterscheidet dieses Virus von der Gattung, die im Englischen Ebolavirus geschrieben wird. Vom Ebola Virus (EBOV) sind mehrere Varianten bekannt, z. B. Mayinga (abgekürzt als EBOV/May). Hier wird von der zuständigen Expertengruppe geraten, auf die Bezeichnung als „Stamm“ („Virusstamm“) oder „Sybtypus“ zu verzichten und sie stattdessen als Variante (engl. variant) zu benennen.[22][20]
Speziesunterschiede
Die vier Spezies Taï Forest Ebolavirus, Sudan Ebolavirus, Zaire Ebolavirus und Bundibugyo Ebolavirus verursachen beim Menschen ein hämorrhagisches Fieber mit einer Letalitätsrate von etwa 50 bis 90 %. In Einzelfällen z. B. bei Erkrankungen durch das Bundibugyo Virus (BDBV), ist die Letalitätsrate auch geringer.[11] Diese hohe Sterblichkeit deutet wie bei den Marburgviren darauf hin, dass die Ebolaviren mit ihren Varianten noch nicht an den Menschen angepasst und neu in die Population eingedrungen sind. Die Schädigung seines Wirts bis hin zu seinem Tod ist für ein Virus nicht vorteilhaft, da es zur eigenen Vermehrung auf diesen Wirt angewiesen ist. Die dennoch beim Wirt ausgelösten Symptome sind Nebenwirkungen der Infektion. Die bei den Ebolaviren vorliegende Verbreitungsstrategie des Erregervirus wird als Hit and Run bezeichnet. Ist ein Virus besser an seinen Wirt angepasst, ist auch seine Chance größer, sich weiter zu verbreiten, denn von einem solchen Virus wird der Wirt nicht mehr in der akuten Erkrankungsphase getötet. Für den Fall, dass der Wirt nicht sofort wirksame Antikörper entwickelt, welche das Virus neutralisieren, kann das Virus den Wirt viel länger für seine eigene Vermehrung benutzen, wobei es hiermit die sogenannte Infect-and-persist-Strategie anwendet.
Zaire Ebolavirus
Diese Spezies ist mit einer Letalitätsrate von 60 bis 90 % die gefährlichste aus der Familie der Filoviridae. Wie alle Ebolaviren hat das früher als Subtyp Zaïre bezeichnete Virus einen Durchmesser von etwa 80 nm und eine Länge von 990 bis 1086 nm. Das Genom des Virus besteht aus etwa 19.000 Basen.
Erstmals beobachtet wurde das Zaire Ebolavirus 1976 in Zaire (ab 1997 in Demokratische Republik Kongo umbenannt) und verursachte 280 Tote bei 318 Infizierten (Letalität 88 %). Ein Jahr später erkrankte und verstarb eine weitere Person in Zaire. 1994 erkrankten 52 Menschen, 31 von ihnen verstarben (Letalität 60 %). 1995 infizierten sich 315 Bewohner, 250 von ihnen verstarben (Letalität 81 %). 1996–1997 wurden in Gabun in zwei Wellen 21 von 37 Menschen (Letalität 57 %) bzw. 45 von 60 (Letalität 75 %) getötet. Dazu kam noch ein Todesfall aus Südafrika. 2001–2002 kam es wieder in Gabun zu einer Epidemie, der 53 von 65 Menschen zum Opfer fielen (Letalität 82 %). Gleichzeitig kam es auch in der Demokratischen Republik Kongo zu 44 Toten bei 59 Infizierten (Letalität 75 %). 2002–2003 verstarben 128 von 143 Personen an dem Virus, als es in der Demokratischen Republik Kongo erneut zu einer Epidemie kam (Letalität 89 %). Von Dezember 2008 bis Januar 2009 gab es einen Ausbruch in der Demokratischen Republik Kongo. Dort infizierten sich 32 Menschen (Verdachts-, wahrscheinliche und bestätigte Fälle), 15 von ihnen starben (Letalität 46 %).[24] Im Mai 2011 bestätigte die WHO einen Todesfall in Uganda. Im Sommer 2014 erkrankten (Stand 13. August 2014) 1975 Menschen in Guinea, Liberia, Sierra Leone und Nigeria, von welchen 1069 verstarben (Letalität 54 %).[25]
Reston Ebolavirus
Diese Spezies löst in Makaken und Schweinen eine Erkrankung aus. Diese beiden Arten stellen die Hauptwirte des Virus dar. Aufgrund der unterschiedlichen geographischen Verbreitung von infizierten Schweinen und Makaken geht man von zwei unabhängigen Anpassungsschritten des Virus auf die beiden Wirte aus. Beim Menschen findet lediglich eine subklinische Infektion statt, das heißt, es treten keinerlei Krankheitszeichen auf. Es werden jedoch Antikörper gegen das Virus gebildet.[26]
Dokumentiertes Auftreten und Epidemien der Ebola-Viruskrankheit






| Jahr | Land | Virus-Typ | Fälle | Tote | Letalität in % | |
|---|---|---|---|---|---|---|
| 1976 | Zaire (heute: Demokratische Republik Kongo) | ZEBOV | 318 | 280 | 88 % | Aufgetreten in Yambuku im Bezirk Mongala im Norden des Zaire. Der Ausbruch der Krankheit wurde durch engen persönlichen Kontakt und durch die Verwendung von kontaminierten Nadeln und Spritzen in Krankenhäusern und Kliniken hervorgerufen.[27] |
| 1976 | Sudan (heute: Südsudan) | SEBOV | 284 | 151 | 53 % | Aufgetreten in Nzara und Maridi nahe Yambio. Die Krankheit wurde vor allem durch engen körperlichen Kontakt in den Krankenhäusern verbreitet. Zahlreiche Personen aus dem medizinischen Pflegepersonal wurden infiziert.[28] |
| 1976 | Vereinigtes Königreich | SEBOV | 1 | 0 | 0 % | Labor-Infektion eines Angestellten durch eine Nadelstichverletzung.[29] |
| 1977 | Zaire (heute: Demokratische Republik Kongo) | ZEBOV | 1 | 1 | 100 % | Berichtet wird über einen Ausbruch in Tandala in Süd-Ubangi.[30] |
| 1979 | Sudan (heute: Südsudan) | SEBOV | 34 | 22 | 65 % | Erneuter Ausbruch in Nzara und Maridi nahe Yambio wie im Jahr 1976.[31] |
| 1989 | USA | REBOV | 0 | 0 | 0 % | Virus-Typ wurde bei importierten Affen von den Philippinen in den Quarantäneeinrichtungen in Virginia und Pennsylvania nachgewiesen.[32] |
| 1990 | USA | REBOV | 4 (asymptomatisch) | 0 | 0 % | Virus-Typ REBOV wurde erneut in Quarantäneeinrichtungen in Virginia und Texas festgestellt. Herkunft waren importierte Affen von den Philippinen. Vier Personen entwickelten Antikörper, aber erkrankten nicht.[33] |
| 1989–1990 | Philippinen | REBOV | 3 (asymptomatisch) | 0 | 0 % | Hohe Sterblichkeit bei Javaneraffen in einem Primaten-Anlage. Die Tiere waren für den Export in die USA vorgesehen. Drei Tierpfleger entwickelten Antikörper, aber erkrankten nicht.[34] |
| 1992 | Italien | REBOV | 0 | 0 | 0 % | In der Quarantäneeinrichtung in Siena wurden bei importierten Affen von den Philippinen der Typ REBOV festgestellt.[35] |
| 1994 | Gabun | ZEBOV | 52 | 31 | 60 % | Aufgetreten in Mékouka und weiteren Camps von Goldarbeitern im Regenwald in der Provinz Ogooué-Ivindo. Ursprünglich als Gelbfieber angesehen wurde dieser 1995 als Ebola-Ausbruch identifiziert.[36] |
| 1994 | Elfenbeinküste | CIEBOV | 1 | 0 | 0 % | Ein Wissenschaftler erkrankte nach einer Autopsie an einem wilden Schimpansen im Nationalpark Taï. Der Patient wurde in der Schweiz behandelt.[37] |
| 1995 | Demokratische Republik Kongo | ZEBOV | 315 | 254 | 81 % | Ausgebrochen in Kikwit und Umgebung in der Provinz Bandundu. Nach Recherchen erfolgte der Ausbruch bei Waldarbeitern und ein Ausbruch über die Angehörigen und in Krankenhäusern.[38] |
| Januar–April 1996 | Gabun | ZEBOV | 31 | 21 | 68 % | Ausgebrochen in Mayibout im Minkébé National Park. Ein getöteter Schimpanse wurde im Wald von Menschen auf der Jagd nach Nahrung gegessen. Neunzehn Menschen, die daran direkt beteiligt waren, erkrankten. Zudem traten weitere Fälle bei Familienangehörigen auf.[36] |
| Juli–Dezember 1996 | Gabun | ZEBOV | 60 | 45 | 75 % | Ausgebrochen in Booué und Umgebung in der Provinz Ogooué-Ivindo und beim Patiententransport nach Libreville. Indexpatient war ein Jäger, der in einem Waldlager lebte. Die Krankheit wurde durch engen Kontakt mit infizierten Personen verbreitet.[36] |
| November 1996 | Südafrika | ZEBOV | 2 | 1 | 50 % | Ein Mediziner reiste von Gabun nach Johannesburg, Südafrika, nachdem er in Gabun einen Ebola-Virus-infizierten Patienten behandelt hatte und dabei mit dem Virus in Kontakt gekommen war. Er wurde ins Krankenhaus eingeliefert, wobei sich eine Krankenschwester infizierte und verstarb.[39] |
| 1996 | USA | REBOV | 0 | 0 | 0 % | Virus-Typ wurde bei importierten Affen von den Philippinen in den Quarantäneeinrichtungen in Texas nachgewiesen.[40] |
| 1996 | Philippinen | REBOV | 0 | 0 | 0 % | Virus-Typ wurde bei Affen nachgewiesen, die für den Export in die USA vorgesehen waren.[41] |
| 2000–2001 | Uganda | SEBOV | 425 | 224 | 53 % | Aufgetreten in Gulu, Masindi und Mbarara. Grund für die größere Verbreitung waren unzureichende Schutzmaßnahmen bei Begräbnissen von mit Ebola infizierten Patienten.[42] |
| Oktober 2001–März 2002 | Gabun | ZEBOV | 65 | 53 | 82 % | Ausbruch an der Grenze zur Demokratischen Republik Kongo.[43] |
| Oktober 2001–März 2002 | Demokratische Republik Kongo | ZEBOV | 59 | 44 | 75 % | Ausbruch an der Grenze zu Gabun und erstmals in der Republik Kongo.[43] |
| Dezember 2002–April 2003 | Demokratische Republik Kongo | ZEBOV | 143 | 128 | 89 % | Ausbruch in Mbomo und Kéllé im Département Cuvette-Ouest.[44] |
| November–Dezember 2003 | Demokratische Republik Kongo | ZEBOV | 35 | 29 | 83 % | Ausbruch in Mbomo und im Dorf Mbandza im Département Cuvette-Ouest.[45] |
| 2004 | Sudan (heute: Südsudan) | SEBOV | 17 | 7 | 41 % | Ausbruch in Yambio.[46] |
| 2005 | Demokratische Republik Kongo | ZEBOV | 81 | 11 | 13% | Ausbruch in Etoumbi und Mbomo.[47] |
| Oktober 2007 | Demokratische Republik Kongo | ZEBOV | 264 | 187 | 71 % | Ausbruch in der Provinz Kasai-Occidental.[48] |
| 2007–2008 Dezember–Januar | Uganda | BEBOV | 149 | 37 | 25 % | Ausbruch im Distrikt Bundibugyo im Westen Ugandas.[49] |
| November 2008 | Philippinen | REBOV | 6 (asymptomatisch) | 0 | 0 % | Erstes bekanntes Vorkommen des Ebola-Typs REBOV bei Schweinen. Sechs Arbeiter einer Schweinefarm und zur Verarbeitung von Schlachtabfällen bildeten Antikörper, erkrankten aber nicht.[52][53] |
| Dezember 2008–Februar 2009 | Demokratische Republik Kongo | ZEBOV | 32 | 14 | 44 % | Ausbruch in der Mweka und Luebo in der Provinz Kasai-Occidental.[54] |
| Mai 2011 | Uganda | SEBOV | 1 | 1 | 100% | Ausbruch in Ziroobwe in Distrikt Luweero Uganda[55] |
| Juli und November 2012 | Uganda | SEBOV | 31 | 21 | 57–71 % | Ausbruch im Distrikt Kibaale. Die WHO berichtete von 50 Verdachtsfällen.[56][57] |
| Juni und November 2013 | Demokratische Republik Kongo | BEBOV | 57 | 29 | 51 % | Ausbruch im Distrikt Haut-Uele der Provinz Orientale.[58] |
| seit Februar 2014 | Guinea, Liberia, Sierra Leone, Nigeria (→ Ebola-Epidemie in Westafrika 2014) |
ZEBOV [59] | bisher 1848 (09.08.2014) |
bisher 1013 (09.08.2014)[60] 660 im Labor bestätigt |
55 % | Ausbruch von hämorrhagischem Fieber seit dem 9. Februar 2014 in der Präfektur Macenta und Präfektur Guéckédou. Laut WHO, Gesundheitsministerium Guinea und Ärzte ohne Grenzen Vordringen bis zur Hauptstadt Conakry, sowie nach Sierra Leone und Liberia.[61][62][63][64][65][66][67][68] |
(Legende: BEBOV: Bundibugyo-Ebolavirus, CIEBOV: Cote-d’Ivoire-Ebolavirus, REBOV: Reston-Ebolavirus, SEBOV: Sudan-Ebolavirus und ZEBOV: Zaire-Ebolavirus.)
Literatur
- Hans-Dieter Klenk (Hrsg.): Marburg and Ebola Viruses. In: Current Topics in Microbiology and Immunology. Nr. 235, Springer, 1999, ISBN 3-540-64729-5.
- Jens H. Kuhn & Charles H. Calisher (Hrsg.): Filoviridae: The Marburgviruses and Ebolaviruses. (= Archives of Virology. Supplementa). 1. Auflage. Springer, Wien 2005, ISBN 3-211-20671-X.
- Jens H. Kuhn & Charles H. Calisher (Hrsg.): Filoviruses, A Compendium of 40 Years of Epidemiological, Clinical, and Laboratory Studies. (= Archives of Virology 20) (Gebundene Ausgabe), Springer, 2008, ISBN 978-3-211-20670-6.
- Ebola Hemorrhagic Fever Information Packet Special Pathogens Branch Division of High-Consequence Pathogens and Pathology, Centers for Disease Control and Prevention, 2009, pdf abgerufen am 19. Oktober 2011.
Weblinks
- Ebolavirus-Infektionen Robert-Koch-Institut, rki.de abgerufen am 19. Oktober 2011
- Swiss Institute of Bioinformatics (SIB): Ebolavirus. Auf: viralzone.expasy.org ; abgerufen am 26. Juni 2014.
- Database of the International Committee on Taxonomy of Viruses: ##Virus Taxonomy. 2009 Release, abgerufen am 19. Oktober 2011-
- WHO: Global Alert and Response (GAR) - Ebola; Factsheet – Ebola haemorrhagic fever who.int, abgerufen am 19. Oktober 2011
- Centers for Disease Control and Prevention (CDC): Outbreak of Ebola in Guinea and Liberia. Outbreak Updates.
- Centers for Disease Control and Prevention: Chronology of Ebola Hemorrhagic Fever Outbreaks. in Tabellenform.
- WHO: Global Alert and Response (GAR) - Ebola virus disease (EVD). einschließlich Outbreaks Updates.
- Neue Zürcher Zeitung vom 9. Dezember 2009, Hermann Feldmeier: Flughunde – das Reservoir von Ebola-Viren
- Deutschlandfunk vom 22. August 2007, Suzanne Krause: Tödliche Gefahr durch Fledermäuse / Mediziner erforschen Verbreitung des Marburg-Virus
- Forscherin möglicherweise mit Ebola infiziert. Auf: sueddeutsche.de vom 17. März 2009, zuletzt abgerufen am 2. Mai 2014.
- Impfstoff gegen Ebola-Virus entwickelt. In: Medical Observer Deutschland. vom 6. Dezember 2011, zuletzt abgerufen am 2. Mai 2014.
- Georg Rüschemeyer: Ebola. Im Zweifel tödlich. Auf: faz.net - Wissen, vom 31. März 2014; zuletzt abgerufen am 2. Mai 2014.
- WHO: Outbreak of Ebola in Guinea, Liberia, and Sierra Leone - Ebola; Factsheet – Ebola haemorrhagic fever who.int, abgerufen am 20. Juni 2014
Einzelnachweise
- ↑ K. Halpin, P. L. Young, H. E. Field, J. S. Mackenzie: Isolation of Hendra virus from pteropid bats: a natural reservoir of Hendra virus. In: Journal of General Virology. 2000, Bd. 81, Nr. 8, S. 1927–1932.
- ↑ Outbreak of Hendra-like virus–Malaysia and Singapore, 1998–1999. In: Morbidity and Mortality Weekly Report. (MMWR) 9. April 1999, Bd. 48, Nr. 13, S. 265–269.
- ↑ S. Wacharapluesadee, T. Hemachudha: Duplex nested RT-PCR for detection of Nipah virus RNA from urine specimens of bats. In: Journal of Virological Methods. April 2007, Bd. 141, Nr. 1, S. 97–101, doi:10.1016/j.jviromet.2006.11.023.
- ↑ a b c Xavier Pourrut et al.: Large serological survey showing cocirculation of Ebola and Marburg viruses in Gabonese bat populations, and a high seroprevalence of both viruses in Rousettus aegyptiacus. In: BMC Infectious Diseases. 28. September 2009, Nr. 9, S. 159, doi:10.1186/1471-2334-9-159, (Artikel als PDF-Datei).
- ↑ Eric M. Leroy et al.: Fruit bats as reservoirs of Ebola virus. In: Nature. 1. Dezember 2005, Band 438, S. 575–576, doi:10.1038/438575a.
- ↑ Eric Leroy et al.: Recent Common Ancestry of Ebola Zaire Virus Found in a Bat Reservoir. In: PLoS Pathogens. 27. Oktober 2006, Bd. 2, Nr. 10, S. 885–886, doi:10.1371/journal.ppat.0020090.
- ↑ A. Townsend Peterson, John T. Bauer, James N. Mills: Ecologic and Geographic Distribution of Filovirus Disease. In: Emerging infectious diseases. Januar 2004, Bd. 10, Nr. 1, S. 40–7, ISSN 1080-6040, PMID 15078595 (Artikel als PDF-Datei).
- ↑ F. A. Murphy, M. P. Kiley, S. P. Fisher-Hoch: Filoviridae: Marburg and Ebola viruses. In: B. N. Fields, D. M. Knipe (Hrsg.): Virology. Raven Press, New York 1990, S. 933–42.
- ↑ Global Alert and Response (GAR) / Ebola haemorrhagic fever, WHO. Aufgerufen am 10. Dezember 2010
- ↑ European Centre for Disease Prevention and Control: Factsheet for health professionals. Auf: ecdc.europa.eu vom 21. August 2012, abgerufen am 17. Juli 2014.
- ↑ a b c d e f Ebola virus disease – WHO Fact Sheet No. 103. In: Website der WHO. April 2014, abgerufen am 12. August 2014.
- ↑ Ebola Virus, Pathogen Data Sheet. Auf: www.phac-aspc.gc.ca , letzte Aktualisierung: 1. August 2014, zuletzt abgerufen am 14. August 2014.
- ↑ a b RKI: Ebolavirus-Infektionen, Stand: 11.08.2014
- ↑ a b c Ebola hemorrhagic fever. In: Website der Centers for Disease Control and Prevention (CDC). 10. August 2014, abgerufen am 12. August 2014.
- ↑ M. Shimojima et al.: Tyro3 family-mediated cell entry of Ebola and Marburg viruses. In: Journal of virology. Oktober 2006, Bd. 80, Nr. 20, S. 10109–10116, PMID 17005688, doi:10.1128/JVI.01157-06, PMC 1617303 (freier Volltext).
- ↑ M. F. Saeed et al.: Phosphoinositide-3 Kinase-Akt Pathway Controls Cellular Entry of Ebola Virus. In: PLoS Pathogens. 2008, Bd. 4, Nr. 8, e1000141, doi:10.1371/journal.ppat.1000141 PDF-Datei.
- ↑ A. Dominguez-Soto, L. Aragoneses-Fenoll u.a.: The DC-SIGN-related lectin LSECtin mediates antigen capture and pathogen binding by human myeloid cells. In: Blood Juni 2007, Bd. 109, Nr. 12, S. 5337–5345. doi:10.1182/blood-2006-09-048058, PMID 17339424.
- ↑ Ebola durch Wildschweine übertragen, aerzteblatt.de
- ↑ a b TRBA (Technische Regeln für Biologische Arbeitsstoffe) 462: Einstufung von Viren in Risikogruppen. In: Website der Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA). 25. April 2012, S. 4, 27, abgerufen am 9. August 2014.
- ↑ a b c J. H. Kuhn, Y. Bao u. a.: Virus nomenclature below the species level: a standardized nomenclature for laboratory animal-adapted strains and variants of viruses assigned to the family Filoviridae. In: Archives of Virology. Band 158, Nr. 6, Juni 2013, S. 1425–1432, ISSN 1432-8798. doi:10.1007/s00705-012-1594-2. PMID 23358612. PMC 3669655 (freier Volltext).
- ↑ Jonathan S. Towner, Tara K. Sealy u. a.: Newly Discovered Ebola Virus Associated with Hemorrhagic Fever Outbreak in Uganda. In: PLoS Pathogens., Band 4, Nr. 11, November 2008, S. e1000212, ISSN 1553-7374. doi:10.1371/journal.ppat.1000212.
- ↑ a b J. H. Kuhn, S. Becker u. a.: Proposal for a revised taxonomy of the family Filoviridae: classification, names of taxa and viruses, and virus abbreviations. In: Archives of Virology. Band 155, Nr. 12, Dezember 2010, S. 2083–2103, ISSN 1432-8798. doi:10.1007/s00705-010-0814-x. PMID 21046175. PMC 3074192 (freier Volltext).
- ↑ J. H. Kuhn, S. Becker u. a.: Family Filoviridae. In: A. M. Q. King, M. J. Adams, E. B. Carstens, E. J. Lefkowitz (Hrsg.): Virus Taxonomy – Ninth Report of the International Committee on Taxonomy of Viruses. Elsevier/Academic Press, London, UK 2011, ISBN 978-0-12-384684-6, S. 665–671 (online).
- ↑ WHO: 17. Februar 2009 End of Ebola outbreak in the Democratic Republic of the Congo
- ↑ Ebola virus disease update - west Africa. WHO – Disease Outbreak News (DONs), 13. August 2014, abgerufen am 15. August 2014 (englisch).
- ↑ R. W. Barrette, S. A.Metwally, J. M. Rowland, et al.: Discovery of swine as a host for the Reston ebolavirus. In: Science. Band 325. Jahrgang, Nr. 5937, Juli 2009, S. 204–6, doi:10.1126/science.1172705, PMID 19590002.
- ↑ Ebola haemorrhagic fever in Zaire, 1976. PMID 307456.
- ↑ Ebola haemorrhagic fever in Sudan, 1976. PMID 307455.
- ↑ A case of Ebola virus infection. PMID 890413.
- ↑ Ebola hemorrhagic fever: Tandala, Zaire, 1977-1978. PMID 7441008.
- ↑ Ebola virus disease in southern Sudan: hospital dissemination and intrafamilial spread. PMID 6370486.
- ↑ Preliminary report: isolation of Ebola virus from monkeys imported to USA. PMID 1968529.
- ↑ Update: filovirus infection in animal handlers. PMID 2107388.
- ↑ Seroepidemiological study of filovirus related to Ebola in the Philippines. PMID 1671441.
- ↑ Viral haemorrhagic fever in imported monkeys. PMID 1581179.
- ↑ a b c Ebola hemorrhagic fever outbreaks in Gabon, 1994-1997: epidemiologic and health control issues. PMID 9988167.
- ↑ Isolation and partial characterisation of a new strain of Ebola virus. PMID 7746057.
- ↑ The reemergence of Ebola hemorrhagic fever, Democratic Republic of the Congo, 1995. Commission de Lutte contre les Epidémies à Kikwit. PMID 9988168.
- ↑ Ebola haemorrhagic fever - South Africa. In: Weekly Epidemiological Record. 71. Jahrgang, Nr. 47. World Health Organization, 22. November 1996, ISSN 0049-8114, S. 353–360 (who.int [PDF]).
- ↑ Pierre E. Rollin, R. Joel Williams, David S. Bressler et al.: Ebola (Subtype Reston) Virus among Quarantined Nonhuman Primates Recently Imported from the Philippines to the United States. In: The Journal of Infectious Diseases. Bd. 179, Nr. Supplement 1, S. S108-S114, doi:10.1086/514303.
- ↑ Epidemiology of Ebola (subtype Reston) virus in the Philippines, 1996. PMID 9988174.
- ↑ An outbreak of Ebola in Uganda. PMID 12460399.
- ↑ a b Outbreak(s) of Ebola haemorrhagic fever, Congo and Gabon, October 2001-July 2002. PMID 15571171.
- ↑ Outbreak of Ebola hemorrhagic fever in the Republic of the Congo, 2003: a new strategy? PMID 14579469.
- ↑ Ebola haemorrhagic fever in the Republic of the Congo - Update 6. World Health Organization, 6. Januar 2004, abgerufen am 17. Januar 2013.
- ↑ Outbreak of Ebola haemorrhagic fever in Yambio, south Sudan, April - June 2004. PMID 16285261.
- ↑ Ebola haemorrhagic fever in the Republic of the Congo - update. World Health Organization, 25. Mai 2005, abgerufen am 7. Juli 2014.
- ↑ Outbreak news. Ebola virus haemorrhagic fever, Democratic Republic of the Congo--update. PMID 17918654.
- ↑ Newly discovered ebola virus associated with hemorrhagic fever outbreak in Uganda. PMID 19023410.
- ↑ End of Ebola outbreak in Uganda. World Health Organization, 20. Februar 2008, abgerufen am 29. November 2009.
- ↑ Uganda: Deadly Ebola Outbreak Confirmed - UN. In: UN News Service. 30. November 2007, abgerufen am 29. November 2009.
- ↑ Discovery of swine as a host for the Reston ebolavirus. PMID 19590002.
- ↑ Outbreak news. Ebola Reston in pigs and humans, Philippines. PMID 19219963.
- ↑ Global Alert and Response: End of Ebola outbreak in the Democratic Republic of the Congo. In: Disease Outbreak News. World Health Organization, 17. Februar 2009, abgerufen am 27. Februar 2011.
- ↑ Global Alert and Response: Ebola in Uganda. World Health Organization, 18. Mai 2011, abgerufen am 18. Mai 2011.
- ↑ Seuche wütet in Uganda: Mindestens 19 Menschen sterben am Ebola-Virus. Auf: focus.de vom 3. August 2012; abgerufen am 3. August 2012.
- ↑ Ebola outbreak in Uganda kills two. BBC News, 15. November 2012, abgerufen am 23. März 2014 (englisch).
- ↑ Gefährliches Ebola-Fieber breitet sich aus. Auf: faz.net vom 18. September 2012; abgerufen am 24. März 2014.
- ↑ Outbreak of Ebola in Guinea, Liberia, and Sierra Leone - Ebola. WHO, 16. Juni 2014, abgerufen am 20. Juni 2014 (englisch).
- ↑ Ebola virus disease, West Africa – update. WHO – Disease Outbreak News (DONs), 4. August 2014, abgerufen am 5. August 2014 (englisch).
- ↑ WHO - Regional Office for Africa: Ebola Haemorrhagic Fever in Guinea. vom 23. März 2014, abgerufen am 25. März 2014.
- ↑ Guinea deaths: Ebola blamed for deadly fever outbreak. BBC News, 23. März 2014, abgerufen am 23. März 2014 (englisch).
- ↑ Ebola-Epidemie erreicht Guineas Hauptstadt. Spiegel Online, 23. März 2014, abgerufen am 23. März 2014.
- ↑ Nach Rückkehr aus Westafrika: Ebola-Verdacht bei Mann in Kanada. Spiegel Online, 25. März 2014, abgerufen am 25. März 2014.
- ↑ Ebola: „Die Betroffenen zu isolieren, hat oberste Priorität“. Ärzte ohne Grenzen, 24. März 2014, abgerufen am 25. März 2014.
- ↑ Ebola: 3 Confirmed Dead in Liberia. Liberian Observer, 25. März 2014, abgerufen am 25. März 2014 (englisch).
- ↑ Ebola virus disease, West Africa (Situation as of 1 April 2014). WHO, 1. April 2014, abgerufen am 2. April 2014 (englisch).
- ↑ Tödliches Virus. Ebola-Epidemie in Westafrika ist außer Kontrolle. In: t-online.de. t-online, 2. Juli 2014, abgerufen am 2. Juli 2014.