„Nitrile“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K typo, form |
Weitere Ergänzungen, v. a. Herstellung (Kolbe-Nitrilsynthese). |
||
| Zeile 15: | Zeile 15: | ||
== Herstellung == |
== Herstellung == |
||
Im Labormaßstab können Nitrile durch Umsetzung von Alkalicyaniden ([[Alkalimetall]]-[[Salze]] der Blausäure) mit [[Alkylhalogenid]]en hergestellt werden ([[Kolbe-Nitrilsynthese]]). Dabei entsteht das Alkannitril und ein Alkalihalogenid. |
Im Labormaßstab können Nitrile durch Umsetzung von Alkalicyaniden ([[Alkalimetall]]-[[Salze]] der Blausäure) mit [[Alkylhalogenid]]en hergestellt werden ([[Kolbe-Nitrilsynthese]]). Dabei entsteht in einer S<sub>N</sub>2-Reaktion das Alkannitril und ein Alkalihalogenid. Die Reaktion eignet sich besonders gut zur Umsetzung primärer, sowie allylischer und benzylischer Halogenide. Sekundäre Alkylhalogenide liefern schlechtere Ausbeuten, tertiäre reagieren nur durch Eliminierung. Neben Halogeniden können auch andere Edukte mit anderen guten Abgangsgruppen verwendet werden. Silbercyanid ist im Gegensatz zu Alkalicyaniden nicht als Resgenz geeignet, da mit diesem vorzugsweise Isonitrile gebildet werden.<ref>{{Literatur |Autor=Thomas Laue, Andreas Plagens |Titel=Namen- und Schlagwort-Reaktionen der Organischen Chemie |Sammelwerk=Teubner Studienbücher Chemie |Datum=1994 |ISSN=0941-3677 |DOI=10.1007/978-3-322-94726-0 |Online=http://dx.doi.org/10.1007/978-3-322-94726-0 |Abruf=2023-12-25}}</ref> Ein Beispiel für eine solche Umsetzung ist die Reaktion von [[Methyliodid]] mit [[Natriumcyanid]] zu [[Acetonitril]] und [[Natriumiodid]]:<ref>{{Literatur |Autor=K. R. Lynn, Peter E. Yankwich |Titel=Cyanide Carbon Isotope Fractionation in the Reaction of Cyanide Ion and Methyl Iodide. Carbon Isotope Effect in the Hydrolysis of Methyl Iodide |Sammelwerk=Journal of the American Chemical Society |Band=83 |Nummer=1 |Datum=1961-01 |ISSN=0002-7863 |DOI=10.1021/ja01462a010 |Seiten=53–57 |Online=https://pubs.acs.org/doi/abs/10.1021/ja01462a010 |Abruf=2023-12-25}}</ref> |
||
:<math>\mathrm{CH_3I + NaCN \longrightarrow CH_3CN + NaI}</math> |
:<math>\mathrm{CH_3I + NaCN \longrightarrow CH_3CN + NaI}</math> |
||
Analog kann beispielsweise 1,3-Dibrompropan mit Natriumcyanid zu Pentandinitril umgesetzt werden<ref>{{Literatur |Autor=G. E. Ham, Jane Stevens |Titel=Reaction of 1,2-Dihaloethanes with Sodium Cyanide |Sammelwerk=The Journal of Organic Chemistry |Band=27 |Nummer=12 |Datum=1962-12 |ISSN=0022-3263 |DOI=10.1021/jo01059a504 |Seiten=4638–4639 |Online=https://pubs.acs.org/doi/abs/10.1021/jo01059a504 |Abruf=2023-12-25}}</ref> oder 1-Iodoctan mit Kaliumcyanid zu Nonannitril.<ref>{{Literatur |Autor=Cinzia Chiappe, Daniela Pieraccini, Paola Saullo |Titel=Nucleophilic Displacement Reactions in Ionic Liquids: Substrate and Solvent Effect in the Reaction of NaN 3 and KCN with Alkyl Halides and Tosylates |Sammelwerk=The Journal of Organic Chemistry |Band=68 |Nummer=17 |Datum=2003-08-01 |ISSN=0022-3263 |DOI=10.1021/jo026838h |Seiten=6710–6715 |Online=https://pubs.acs.org/doi/10.1021/jo026838h |Abruf=2023-12-25}}</ref> |
|||
=== Dehydratisierungsreaktionen === |
=== Dehydratisierungsreaktionen === |
||
| Zeile 26: | Zeile 27: | ||
Sowohl Carbonsäureamide als auch Aldoxime können durch Umsetzung mit [[Aluminiumchlorid]] und [[Natriumiodid]] in Acetonitril dehydratisiert werden.<ref name=":5" /> Ebenso können beide Verbindungsklassen mit [[Oxalylchlorid]] und katalytisch [[Dimethylsulfoxid]] dehydratisiert werden, in einer Reaktion, die ähnlich einer [[Swern-Oxidation]] abläuft.<ref>{{Literatur |Autor=Rui Ding, Yongguo Liu, Mengru Han, Wenyi Jiao, Jiaqi Li, Hongyu Tian, Baoguo Sun |Titel=Synthesis of Nitriles from Primary Amides or Aldoximes under Conditions of a Catalytic Swern Oxidation |Sammelwerk=The Journal of Organic Chemistry |Band=83 |Nummer=20 |Datum=2018-10-19 |DOI=10.1021/acs.joc.8b02190 |Seiten=12939–12944}}</ref> Auch die Umsetzung zu Nitrilen unter Katalyse mit siebenwertigem [[Rhenium]] (z. B. [[Perrheniumsäure]] oder [[Trimethylsilylperrhenat]]) gelingt sowohl mit Amiden als auch mit Aldoximen. Als Nebenprodukt anfallendes Wasser kann durch [[azeotrope Destillation]] entfernt werden.<ref>{{Literatur |Autor=Kazuaki Ishihara, Yoshiro Furuya, Hisashi Yamamoto |Titel=Rhenium(VII) Oxo Complexes as Extremely Active Catalysts in the Dehydration of Primary Amides and Aldoximes to Nitriles |Sammelwerk=Angewandte Chemie |Band=114 |Nummer=16 |Datum=2002-08-16 |DOI=10.1002/1521-3757(20020816)114:16<3109::AID-ANGE3109>3.0.CO;2-K |Seiten=3109}}</ref> |
Sowohl Carbonsäureamide als auch Aldoxime können durch Umsetzung mit [[Aluminiumchlorid]] und [[Natriumiodid]] in Acetonitril dehydratisiert werden.<ref name=":5" /> Ebenso können beide Verbindungsklassen mit [[Oxalylchlorid]] und katalytisch [[Dimethylsulfoxid]] dehydratisiert werden, in einer Reaktion, die ähnlich einer [[Swern-Oxidation]] abläuft.<ref>{{Literatur |Autor=Rui Ding, Yongguo Liu, Mengru Han, Wenyi Jiao, Jiaqi Li, Hongyu Tian, Baoguo Sun |Titel=Synthesis of Nitriles from Primary Amides or Aldoximes under Conditions of a Catalytic Swern Oxidation |Sammelwerk=The Journal of Organic Chemistry |Band=83 |Nummer=20 |Datum=2018-10-19 |DOI=10.1021/acs.joc.8b02190 |Seiten=12939–12944}}</ref> Auch die Umsetzung zu Nitrilen unter Katalyse mit siebenwertigem [[Rhenium]] (z. B. [[Perrheniumsäure]] oder [[Trimethylsilylperrhenat]]) gelingt sowohl mit Amiden als auch mit Aldoximen. Als Nebenprodukt anfallendes Wasser kann durch [[azeotrope Destillation]] entfernt werden.<ref>{{Literatur |Autor=Kazuaki Ishihara, Yoshiro Furuya, Hisashi Yamamoto |Titel=Rhenium(VII) Oxo Complexes as Extremely Active Catalysts in the Dehydration of Primary Amides and Aldoximes to Nitriles |Sammelwerk=Angewandte Chemie |Band=114 |Nummer=16 |Datum=2002-08-16 |DOI=10.1002/1521-3757(20020816)114:16<3109::AID-ANGE3109>3.0.CO;2-K |Seiten=3109}}</ref> |
||
Aldoxime können außerdem mit [[Cyanurchlorid]] dehydratisiert werden,<ref>{{Literatur |Autor=Jiban K. Chakrabarti, Terrence M. Hotten |Titel=A new route to nitriles. Dehydration of aldoximes using 2,4,6-trichloro-s-triazine (cyanuric chloride) |Sammelwerk=Journal of the Chemical Society, Chemical Communications |Nummer=22 |Datum=1972 |DOI=10.1039/c39720001226 |Seiten=1226}}</ref> mit dem [[Burgess-Reagenz]],<ref>{{Literatur |Titel=Mild and Efficient Dehydration of Oximes to Nitriles Mediated by the Burgess Reagent |Sammelwerk=Synlett |Band=2000 |Nummer=08 |Datum=2000 |ISSN=0936-5214 |DOI=10.1055/s-2000-6752 |Seiten=1169–1171 |Online=http://www.thieme-connect.de/DOI/DOI?10.1055/s-2000-6752 |Abruf=2023-12-25}}</ref> sowie mit einer Kombination von [[Trifluormethansulfonsäureanhydrid]] und Triphenylphosphin, wobei letzteres zu [[Triphenylphosphanoxid|Triphenylphosphinoxid]] oxidiert wird.<ref>{{Literatur |Autor=Ziad Moussa, Saleh A. Ahmed, Ahmad S. ElDouhaibi, Shaya Y. Al-Raqa |Titel=NMR Studies and electrophilic properties of triphenylphosphine–trifluoromethanesulfonic anhydride; a remarkable dehydrating reagent system for the conversion of aldoximes into nitriles |Sammelwerk=Tetrahedron Letters |Band=51 |Nummer=14 |Datum=2010-04 |DOI=10.1016/j.tetlet.2010.01.119 |Seiten=1826–1831}}</ref> Auch eine katalytische Dehydrierung ist möglich, beispielsweise mit [[Eisen(III)-triflat]],<ref>{{Literatur |Autor=Kengo Hyodo, Saki Kitagawa, Masayuki Yamazaki, Kingo Uchida |Titel=Iron‐Catalyzed Dehydration of Aldoximes to Nitriles Requiring Neither Other Reagents Nor Nitrile Media |Sammelwerk=Chemistry – An Asian Journal |Band=11 |Nummer=9 |Datum=2016-05-06 |DOI=10.1002/asia.201600085 |Seiten=1348–1352}}</ref> mit [[Kupfer(II)-acetat]],<ref>{{Literatur |Autor=Philipp Rommelmann, Tobias Betke, Harald Gröger |Titel=Synthesis of Enantiomerically Pure N -Acyl Amino Nitriles via Catalytic Dehydration of Oximes and Application in a de Novo Synthesis of Vildagliptin |Sammelwerk=Organic Process Research & Development |Band=21 |Nummer=10 |Datum=2017-10-20 |DOI=10.1021/acs.oprd.7b00169 |Seiten=1521–1527}}</ref> mit einem gemischten Hydroxid von [[Zinn]] und [[Wolfram]]<ref name=":7">{{Literatur |Autor=Kazuya Yamaguchi, Hiroshi Fujiwara, Yoshiyuki Ogasawara, Miyuki Kotani, Noritaka Mizuno |Titel=A Tungsten–Tin Mixed Hydroxide as an Efficient Heterogeneous Catalyst for Dehydration of Aldoximes to Nitriles |Sammelwerk=Angewandte Chemie |Band=119 |Nummer=21 |Datum=2007-05-18 |DOI=10.1002/ange.200605004 |Seiten=3996–3999}}</ref> oder mit einem bimetallischen Palladium-[[Mangan]]-Katalysator.<ref>{{Literatur |Autor=Dongliang Zhang, Yaping Huang, Erlei Zhang, Rong Yi, Chao Chen, Lei Yu, Qing Xu |Titel=Pd/Mn Bimetallic Relay Catalysis for Aerobic Aldoxime Dehydration to Nitriles |Sammelwerk=Advanced Synthesis & Catalysis |Band=360 |Nummer=4 |Datum=2018-02-15 |DOI=10.1002/adsc.201701154 |Seiten=784–790}}</ref> |
Aldoxime können außerdem mit [[Cyanurchlorid]] dehydratisiert werden,<ref>{{Literatur |Autor=Jiban K. Chakrabarti, Terrence M. Hotten |Titel=A new route to nitriles. Dehydration of aldoximes using 2,4,6-trichloro-s-triazine (cyanuric chloride) |Sammelwerk=Journal of the Chemical Society, Chemical Communications |Nummer=22 |Datum=1972 |DOI=10.1039/c39720001226 |Seiten=1226}}</ref> mit dem [[Burgess-Reagenz]],<ref>{{Literatur |Titel=Mild and Efficient Dehydration of Oximes to Nitriles Mediated by the Burgess Reagent |Sammelwerk=Synlett |Band=2000 |Nummer=08 |Datum=2000 |ISSN=0936-5214 |DOI=10.1055/s-2000-6752 |Seiten=1169–1171 |Online=http://www.thieme-connect.de/DOI/DOI?10.1055/s-2000-6752 |Abruf=2023-12-25}}</ref> sowie mit einer Kombination von [[Trifluormethansulfonsäureanhydrid]] und Triphenylphosphin, wobei letzteres zu [[Triphenylphosphanoxid|Triphenylphosphinoxid]] oxidiert wird.<ref>{{Literatur |Autor=Ziad Moussa, Saleh A. Ahmed, Ahmad S. ElDouhaibi, Shaya Y. Al-Raqa |Titel=NMR Studies and electrophilic properties of triphenylphosphine–trifluoromethanesulfonic anhydride; a remarkable dehydrating reagent system for the conversion of aldoximes into nitriles |Sammelwerk=Tetrahedron Letters |Band=51 |Nummer=14 |Datum=2010-04 |DOI=10.1016/j.tetlet.2010.01.119 |Seiten=1826–1831}}</ref> Auch eine katalytische Dehydrierung ist möglich, beispielsweise mit [[Eisen(III)-triflat]],<ref>{{Literatur |Autor=Kengo Hyodo, Saki Kitagawa, Masayuki Yamazaki, Kingo Uchida |Titel=Iron‐Catalyzed Dehydration of Aldoximes to Nitriles Requiring Neither Other Reagents Nor Nitrile Media |Sammelwerk=Chemistry – An Asian Journal |Band=11 |Nummer=9 |Datum=2016-05-06 |DOI=10.1002/asia.201600085 |Seiten=1348–1352}}</ref> mit [[Kupfer(II)-acetat]],<ref>{{Literatur |Autor=Philipp Rommelmann, Tobias Betke, Harald Gröger |Titel=Synthesis of Enantiomerically Pure N -Acyl Amino Nitriles via Catalytic Dehydration of Oximes and Application in a de Novo Synthesis of Vildagliptin |Sammelwerk=Organic Process Research & Development |Band=21 |Nummer=10 |Datum=2017-10-20 |DOI=10.1021/acs.oprd.7b00169 |Seiten=1521–1527}}</ref> mit einem gemischten Hydroxid von [[Zinn]] und [[Wolfram]]<ref name=":7">{{Literatur |Autor=Kazuya Yamaguchi, Hiroshi Fujiwara, Yoshiyuki Ogasawara, Miyuki Kotani, Noritaka Mizuno |Titel=A Tungsten–Tin Mixed Hydroxide as an Efficient Heterogeneous Catalyst for Dehydration of Aldoximes to Nitriles |Sammelwerk=Angewandte Chemie |Band=119 |Nummer=21 |Datum=2007-05-18 |DOI=10.1002/ange.200605004 |Seiten=3996–3999}}</ref> oder mit einem bimetallischen Palladium-[[Mangan]]-Katalysator.<ref>{{Literatur |Autor=Dongliang Zhang, Yaping Huang, Erlei Zhang, Rong Yi, Chao Chen, Lei Yu, Qing Xu |Titel=Pd/Mn Bimetallic Relay Catalysis for Aerobic Aldoxime Dehydration to Nitriles |Sammelwerk=Advanced Synthesis & Catalysis |Band=360 |Nummer=4 |Datum=2018-02-15 |DOI=10.1002/adsc.201701154 |Seiten=784–790}}</ref> Schließlich ist auch die enzymatische Dehydratisierung von Aldoximen mit [[Aldoxim-Dehydratasen]] möglich. Dabei handelt es ich um Enzyme, die in verschiedenen Bakterien vorkommen, beispielsweise in ''[[Pseudomonas chlororaphis]]'', und die schon verschiedentlich zur Synthese von Nitrilen verwendet wurden.<ref>{{Literatur |Autor=Tobias Betke, Jun Higuchi, Philipp Rommelmann, Keiko Oike, Taiji Nomura, Yasuo Kato, Yasuhisa Asano, Harald Gröger |Titel=Biocatalytic Synthesis of Nitriles through Dehydration of Aldoximes: The Substrate Scope of Aldoxime Dehydratases |Sammelwerk=ChemBioChem |Band=19 |Nummer=8 |Datum=2018-04-16 |ISSN=1439-4227 |DOI=10.1002/cbic.201700571 |Seiten=768–779 |Online=https://chemistry-europe.onlinelibrary.wiley.com/doi/10.1002/cbic.201700571 |Abruf=2023-12-25}}</ref> |
||
=== Herstellung aus Aldehyden und Ketonen === |
=== Herstellung aus Aldehyden und Ketonen === |
||
[[Aldehyde]] können mit [[Hydroxylaminhydrochlorid]] in Oxime überführt werden und dann weiter zu Nitrilen dehydratisiert werden (beispielsweise mit [[Oxalylchlorid]]).<ref>{{Literatur |Autor=Liyuan Lan, Shuai Huang, Yongguo Liu, Baoguo Sun, Hongyu Tian |Titel=Preparation and odor characteristics of nitriles derived from aldehydes |Sammelwerk=Flavour and Fragrance Journal |Band=35 |Nummer=4 |Datum=2020-07 |DOI=10.1002/ffj.3581 |Seiten=425–434}}</ref> Auch direkte Umsetzungen von Aldehyden zu Nitrilen sind bekannt, beispielsweise mittel [[Hydroxylamin-O-sulfonsäure|Hydroxylamin-''O''-sulfonsäure]]<ref>{{Literatur |Autor=Dylan J. Quinn, Graham J. Haun, Gustavo Moura-Letts |Titel=Direct synthesis of nitriles from aldehydes with hydroxylamine-O-sulfonic acid in acidic water |Sammelwerk=Tetrahedron Letters |Band=57 |Nummer=34 |Datum=2016-08 |DOI=10.1016/j.tetlet.2016.07.047 |Seiten=3844–3847}}</ref> oder [[O-(4-Trifluormethylbenzoyl)hydroxylamin|''O''-(4-Trifluormethylbenzoyl)hydroxylamin]].<ref>{{Literatur |Autor=Xiao-De An, Shouyun Yu |Titel=Direct Synthesis of Nitriles from Aldehydes Using an O -Benzoyl Hydroxylamine (BHA) as the Nitrogen Source |Sammelwerk=Organic Letters |Band=17 |Nummer=20 |Datum=2015-10-16 |DOI=10.1021/acs.orglett.5b02547 |Seiten=5064–5067}}</ref> Eine solche Umsetzung ist auch mit Hydroxylamin möglich, wenn ein gemischtes Hydroxid von Zinn und Wolfram als Katalysator verwendet wird<ref name=":7" /> oder [[Sulfurylfluorid]] als zusätzliches Reagenz verwendet wird.<ref>{{Literatur |Autor=Jitendra Gurjar, Jorick Bater, Valery V. Fokin |Titel=Sulfuryl Fluoride Mediated Conversion of Aldehydes to Nitriles |Sammelwerk=Chemistry – A European Journal |Band=25 |Nummer=8 |Datum=2019-02-06 |DOI=10.1002/chem.201805175 |Seiten=1906–1909}}</ref> [[Tosylmethylisocyanid]] (auch Van-Leusen-Reagenz genannt) ermöglicht die direkte Umwandlung eines Ketons in ein Nitril, was als [[Van-Leusen-Reaktion]] bezeichnet wird. Dabei wird die gesamte Nitrilgruppe und damit auch ein zusätzliches Kohlenstoffatom eingeführt.<ref>{{Literatur |Autor=Albert M. van Leusen, Piet G. Oomkes |Titel=One-Step Conversion of Aldehydes to Nitriles. Introduction of a One-Carbon Unit |Sammelwerk=Synthetic Communications |Band=10 |Nummer=5 |Datum=1980-01 |DOI=10.1080/00397918008061830 |Seiten=399–403}}</ref><ref>{{Literatur |Autor=Otto H. Oldenziel, Daan Van Leusen, Albert M. Van Leusen |Titel=Chemistry of sulfonylmethyl isocyanides. 13. A general one-step synthesis of nitriles from ketones using tosylmethyl isocyanide. Introduction of a one-carbon unit |Sammelwerk=The Journal of Organic Chemistry |Band=42 |Nummer=19 |Datum=1977-09 |DOI=10.1021/jo00439a002 |Seiten=3114–3118}}</ref><ref>{{Literatur |Autor=Niamh Disney, Megan Smyth, Scott Wharry, Thomas S. Moody, Marcus Baumann |Titel=A cyanide-free synthesis of nitriles exploiting flow chemistry |Sammelwerk=Reaction Chemistry & Engineering |Datum=2024 |DOI=10.1039/D3RE00458A}}</ref> |
[[Aldehyde]] können mit [[Hydroxylaminhydrochlorid]] in Oxime überführt werden und dann weiter zu Nitrilen dehydratisiert werden (beispielsweise mit [[Oxalylchlorid]]).<ref>{{Literatur |Autor=Liyuan Lan, Shuai Huang, Yongguo Liu, Baoguo Sun, Hongyu Tian |Titel=Preparation and odor characteristics of nitriles derived from aldehydes |Sammelwerk=Flavour and Fragrance Journal |Band=35 |Nummer=4 |Datum=2020-07 |DOI=10.1002/ffj.3581 |Seiten=425–434}}</ref> Auch direkte Umsetzungen von Aldehyden zu Nitrilen sind bekannt, beispielsweise mittel [[Hydroxylamin-O-sulfonsäure|Hydroxylamin-''O''-sulfonsäure]]<ref>{{Literatur |Autor=Dylan J. Quinn, Graham J. Haun, Gustavo Moura-Letts |Titel=Direct synthesis of nitriles from aldehydes with hydroxylamine-O-sulfonic acid in acidic water |Sammelwerk=Tetrahedron Letters |Band=57 |Nummer=34 |Datum=2016-08 |DOI=10.1016/j.tetlet.2016.07.047 |Seiten=3844–3847}}</ref> oder [[O-(4-Trifluormethylbenzoyl)hydroxylamin|''O''-(4-Trifluormethylbenzoyl)hydroxylamin]].<ref>{{Literatur |Autor=Xiao-De An, Shouyun Yu |Titel=Direct Synthesis of Nitriles from Aldehydes Using an O -Benzoyl Hydroxylamine (BHA) as the Nitrogen Source |Sammelwerk=Organic Letters |Band=17 |Nummer=20 |Datum=2015-10-16 |DOI=10.1021/acs.orglett.5b02547 |Seiten=5064–5067}}</ref> Eine solche Umsetzung ist auch mit Hydroxylamin möglich, wenn [[Titan(IV)-chlorid]] oder ein gemischtes Hydroxid von Zinn und Wolfram oder als Katalysator verwendet wird<ref name=":7" /><ref>{{Literatur |Autor=Antonella Leggio, Emilia Lucia Belsito, Sonia Gallo, Angelo Liguori |Titel=One-pot conversion of aldehydes to nitriles mediated by TiCl 4 |Sammelwerk=Tetrahedron Letters |Band=58 |Nummer=15 |Datum=2017-04 |DOI=10.1016/j.tetlet.2017.03.007 |Seiten=1512–1514 |Online=https://linkinghub.elsevier.com/retrieve/pii/S0040403917302939 |Abruf=2023-12-25}}</ref> oder wenn [[Sulfurylfluorid]] oder [[Selendioxid|Selenoxid]] als zusätzliches Reagenz verwendet wird.<ref>{{Literatur |Titel=Lewis Acid Reagents Edited by H. Yamamoto. Oxford University Press: Oxford, UK. 1999. 270 pp. £75.00. ISBN 0 19 850099 8. |Sammelwerk=Organic Process Research & Development |Band=3 |Nummer=4 |Datum=1999-04-15 |ISSN=1083-6160 |DOI=10.1021/op990022+ |Seiten=292–292 |Online=http://dx.doi.org/10.1021/op990022+ |Abruf=2023-12-25}}</ref><ref>{{Literatur |Autor=Jitendra Gurjar, Jorick Bater, Valery V. Fokin |Titel=Sulfuryl Fluoride Mediated Conversion of Aldehydes to Nitriles |Sammelwerk=Chemistry – A European Journal |Band=25 |Nummer=8 |Datum=2019-02-06 |DOI=10.1002/chem.201805175 |Seiten=1906–1909}}</ref> [[Tosylmethylisocyanid]] (auch Van-Leusen-Reagenz genannt) ermöglicht die direkte Umwandlung eines Ketons in ein Nitril, was als [[Van-Leusen-Reaktion]] bezeichnet wird. Dabei wird die gesamte Nitrilgruppe und damit auch ein zusätzliches Kohlenstoffatom eingeführt.<ref>{{Literatur |Autor=Albert M. van Leusen, Piet G. Oomkes |Titel=One-Step Conversion of Aldehydes to Nitriles. Introduction of a One-Carbon Unit |Sammelwerk=Synthetic Communications |Band=10 |Nummer=5 |Datum=1980-01 |DOI=10.1080/00397918008061830 |Seiten=399–403}}</ref><ref>{{Literatur |Autor=Otto H. Oldenziel, Daan Van Leusen, Albert M. Van Leusen |Titel=Chemistry of sulfonylmethyl isocyanides. 13. A general one-step synthesis of nitriles from ketones using tosylmethyl isocyanide. Introduction of a one-carbon unit |Sammelwerk=The Journal of Organic Chemistry |Band=42 |Nummer=19 |Datum=1977-09 |DOI=10.1021/jo00439a002 |Seiten=3114–3118}}</ref><ref>{{Literatur |Autor=Niamh Disney, Megan Smyth, Scott Wharry, Thomas S. Moody, Marcus Baumann |Titel=A cyanide-free synthesis of nitriles exploiting flow chemistry |Sammelwerk=Reaction Chemistry & Engineering |Datum=2024 |DOI=10.1039/D3RE00458A}}</ref> |
||
=== Herstellung aus Aminen === |
=== Herstellung aus Aminen === |
||
Version vom 25. Dezember 2023, 19:07 Uhr

Nitrile sind eine Gruppe chemischer Verbindungen mit der allgemeinen Formel R–C≡N. Die funktionelle Gruppe aus Kohlenstoff und dreifach gebundenem Stickstoff wird als Nitril- oder Cyanogruppe bezeichnet.[1] Die Nitrile leiten sich formal von der Blausäure (HCN) durch Austausch des Wasserstoffatoms gegen einen organischen Rest ab. Die Isomere mit der Formel R–N≡C nennt man Isonitrile.
Geschichte
Nitrile waren bereits im 19. Jahrhundert bekannt. Beispielsweise stellten Friedrich Wöhler und Justus von Liebig schon 1832 Benzonitril her, indem sie Benzamid mit Bariumoxid dehydratisierten.[2]
Nomenklatur

nach IUPAC: Butannitril (blau markiertes C-Atom zählt zur Hauptkette),
formal auch Propancarbonitril (blau markiertes C-Atom zählt zum Substituenten)
Ist das Nitril die funktionelle Gruppe höchster Rangordnung, so wird die Endung „-nitril“ an den Namen der Ausgangsverbindung angehängt, die Benennung erfolgt als „Alkannitril“. Das dreifach gebundene Kohlenstoffatom wird, wie immer, für die Benennung des Grundgerüsts mitgezählt.[3] Alternativ kann (analog zu -carbonsäure), die Endung „-carbonitril“ verwendet werden, hier wird das Kohlenstoffatom nicht zum Grundgerüst gezählt.[4]
Ist die Nitrilfunktion nicht von höchster Rangordnung im Molekül, so wird die Vorsilbe „Cyan-“ mit entsprechender Positionsbezeichnung verwendet. Auch hier wird das dreifach gebundene Kohlenstoffatom nicht zum Grundgerüst gezählt.
Entsprechend ihrer Verwandtschaft mit den Carbonsäuren (der Nitrilkohlenstoff hat die gleiche Oxidationsstufe wie der Carboxylkohlenstoff) werden viele Nitrile trivial als „Carboxylonitrile“ bezeichnet, beispielsweise Acetonitril, Propionitril, Butyronitril oder Mandelonitril.
Herstellung
Im Labormaßstab können Nitrile durch Umsetzung von Alkalicyaniden (Alkalimetall-Salze der Blausäure) mit Alkylhalogeniden hergestellt werden (Kolbe-Nitrilsynthese). Dabei entsteht in einer SN2-Reaktion das Alkannitril und ein Alkalihalogenid. Die Reaktion eignet sich besonders gut zur Umsetzung primärer, sowie allylischer und benzylischer Halogenide. Sekundäre Alkylhalogenide liefern schlechtere Ausbeuten, tertiäre reagieren nur durch Eliminierung. Neben Halogeniden können auch andere Edukte mit anderen guten Abgangsgruppen verwendet werden. Silbercyanid ist im Gegensatz zu Alkalicyaniden nicht als Resgenz geeignet, da mit diesem vorzugsweise Isonitrile gebildet werden.[5] Ein Beispiel für eine solche Umsetzung ist die Reaktion von Methyliodid mit Natriumcyanid zu Acetonitril und Natriumiodid:[6]
Analog kann beispielsweise 1,3-Dibrompropan mit Natriumcyanid zu Pentandinitril umgesetzt werden[7] oder 1-Iodoctan mit Kaliumcyanid zu Nonannitril.[8]
Dehydratisierungsreaktionen
Carbonsäureamide und Aldoxime können durch Dehydratisierung (Abspaltung eines Wassermoleküls) zu Nitrilen umgesetzt werden, wofür eine große Zahl an Reagenzien und Methoden bekannt ist.[2][9][10] Auch für die Herstellung von Nitrilen durch die Dehydratisierung von Nitroalkanen sind Methoden bekannt.[11]
Ein Reagenz für die Dehydratisierung von Carbonsäureamiden, das schon Mitte des 19. Jahrhunderts bekannt war, ist Phosphorpentoxid.[2] Amide können außerdem durch Umsetzung mit verschiedenen dreiwertigen Phosphorreagenzien wie Phosphortrichlorid oder Triphenylphosphit dehydratisiert werden[10] sowie mit Diethylchlorphosphat.[12] Bei Einsatz eines geeigneten Katalysators (z. B. bestimmte Palladium-Komplexe) kann Acetonitril als Dehydratisierungsreagenz wirken, um ein Amid in ein Nitril zu überführen, wobei es selbst zu Acetamid reagiert. Analog kann auch Dichloracetonitril verwendet werden.[13][14] Ähnliche Methoden verwenden Eisen(II)-chlorid-Tetrahydrat, Zinktriflat oder Uranylnitrat-Hexahydrat als Katalysator und N-Methyl-N-trimethylsilyltrifluoracetamid als Dehydratisierungsreagenz.[15][16][17] Auch mittels eines Reaktionssystems aus Triphenylphosphin, Iod und N-Methylmorpholin können Carbonsäureamide dehydriert werden.[18] Eine weitere Methode stellt die Dehydratisierung bei hohen Temperaturen (220-240 °C) in Hexamethylphosphorsäuretrisamid (HMPT) dar.[19]
Sowohl Carbonsäureamide als auch Aldoxime können durch Umsetzung mit Aluminiumchlorid und Natriumiodid in Acetonitril dehydratisiert werden.[9] Ebenso können beide Verbindungsklassen mit Oxalylchlorid und katalytisch Dimethylsulfoxid dehydratisiert werden, in einer Reaktion, die ähnlich einer Swern-Oxidation abläuft.[20] Auch die Umsetzung zu Nitrilen unter Katalyse mit siebenwertigem Rhenium (z. B. Perrheniumsäure oder Trimethylsilylperrhenat) gelingt sowohl mit Amiden als auch mit Aldoximen. Als Nebenprodukt anfallendes Wasser kann durch azeotrope Destillation entfernt werden.[21]
Aldoxime können außerdem mit Cyanurchlorid dehydratisiert werden,[22] mit dem Burgess-Reagenz,[23] sowie mit einer Kombination von Trifluormethansulfonsäureanhydrid und Triphenylphosphin, wobei letzteres zu Triphenylphosphinoxid oxidiert wird.[24] Auch eine katalytische Dehydrierung ist möglich, beispielsweise mit Eisen(III)-triflat,[25] mit Kupfer(II)-acetat,[26] mit einem gemischten Hydroxid von Zinn und Wolfram[27] oder mit einem bimetallischen Palladium-Mangan-Katalysator.[28] Schließlich ist auch die enzymatische Dehydratisierung von Aldoximen mit Aldoxim-Dehydratasen möglich. Dabei handelt es ich um Enzyme, die in verschiedenen Bakterien vorkommen, beispielsweise in Pseudomonas chlororaphis, und die schon verschiedentlich zur Synthese von Nitrilen verwendet wurden.[29]
Herstellung aus Aldehyden und Ketonen
Aldehyde können mit Hydroxylaminhydrochlorid in Oxime überführt werden und dann weiter zu Nitrilen dehydratisiert werden (beispielsweise mit Oxalylchlorid).[30] Auch direkte Umsetzungen von Aldehyden zu Nitrilen sind bekannt, beispielsweise mittel Hydroxylamin-O-sulfonsäure[31] oder O-(4-Trifluormethylbenzoyl)hydroxylamin.[32] Eine solche Umsetzung ist auch mit Hydroxylamin möglich, wenn Titan(IV)-chlorid oder ein gemischtes Hydroxid von Zinn und Wolfram oder als Katalysator verwendet wird[27][33] oder wenn Sulfurylfluorid oder Selenoxid als zusätzliches Reagenz verwendet wird.[34][35] Tosylmethylisocyanid (auch Van-Leusen-Reagenz genannt) ermöglicht die direkte Umwandlung eines Ketons in ein Nitril, was als Van-Leusen-Reaktion bezeichnet wird. Dabei wird die gesamte Nitrilgruppe und damit auch ein zusätzliches Kohlenstoffatom eingeführt.[36][37][38]
Herstellung aus Aminen
Primäre Amine (R-CH2-NH2) können mittels verschiedener Methoden zu Nitrilen oxidiert werden. Beispielsweise sind mehrere Verfahren bekannt, die Nitroxylradikale wie TEMPO und dessen Derivat 4-Acetamido-TEMPO als katalytisches Oxidationsmittel verwenden. Diese können beispielsweise durch Oxone als stöchiometrisches Oxidationsmittel regeneriert werden oder elektrochemisch durch Anlegen einer Spannung.[39][40] Eine andere Methode verwendet Kupfer(I)-chlorid oder Kupfer(II)-chlorid als Katalysator, Sauerstoff als stöchiometrisches Oxidationsmittel und zusätzlich ein Molsieb zum Abfangen des entstehenden Wassers.[41]
Sonstige Herstellungsverfahren
Carbonsäuren können durch Umsetzung mit Indium(III)-chlorid in Acetonitril bei 200 °C in die entsprechenden Nitrile überführt werden. Dabei wirkt Acetonitril sowohl als Lösungsmittel als auch als Quelle für Stickstoffatome und wird bei der Reaktion zu Essigsäure umgesetzt. Die Reaktion verläuft über mehrere Mumm-Umlagerungen.[42]
Acrylnitril, ein wichtiger Ausgangsstoff zur Herstellung verschiedener Polymere (siehe Abschnitt Verwendung), überwiegend durch Ammoxidation von Propylen hergestellt. Dabei reagiert Propylen mit Ammoniak und Luft zu Acrylnitril, wobei Wasser als Nebenprodukt anfällt.[43]
Herstellung von aromatischen Nitrilen

Die Herstellung von Arylnitrilen gelingt durch die
- Sandmeyer-Reaktion (Diazotierung von Anilin-Derivaten und Reaktion mit Kupfer(I)-cyanid)
- Rosenmund-von Braun-Reaktion (direkte Umsetzung eines Arylbromids mit Kupfer(I)-cyanid)
- Reduktive Aromatisierung von silylierten Cyanohydrinen (Umsetzung von Chinonen mit Trimethylsilylcyanid und anschließende Aromatisierung mit PBr3)[44]
- Umsetzung von Metallthiocyanaten mit Carbonsäuren, bekannt als Letts-Nitrilsynthese.
Enantioselektive Synthese chiraler Nitrile
Die enantioselektive Synthese von Nitrilen findet zunehmende Beachtung, weil sterisch einheitliche chirale Nitrile als Arzneistoffe (Vildagliptin, Saxagliptin) angewandt werden.[45]
Reaktionen
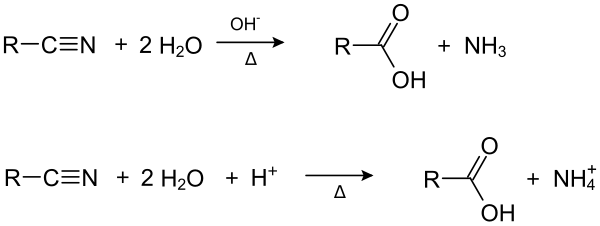
Durch Hydrolyse von Nitrilen kann man Carbonsäuren herstellen.
Des Weiteren kann man durch Reduktion (Hydrierung) eines Nitrils ein Amin herstellen.
Eine wichtige Bedeutung von Nitrilen liegt darin, dass man in einer chemischen Synthese diese Gruppe leicht einführen und dann in andere funktionelle Gruppen (Aminosäuren oder Amine) umwandeln kann. Das Verfahren zur Herstellung von α-Aminosäuren aus Aldehyden, bei der Nitrile als Zwischenprodukte auftreten, ist als Strecker-Synthese bekannt.
Verwendung
Acrylnitril ist ein wichtiger Ausgangsstoff zur Herstellung von Nitril-Polymeren. Acetonitril ist ein wichtiges Lösungsmittel. Weitere Nitrile werden beispielsweise als Duftstoffe und chemische Reagenzien eingesetzt. Außerdem spielt die Nitrilgruppe eine wichtige Rolle in der Entwicklung von pharmazeutischen Wirkstoffen und ist in diversen solcher Wirkstoffen enthalten.
Kunststoffherstellung
Diverse weitverbreitete Polymere enthalten Acrylnitril als Monomer und weisen daher Nitrilgruppen auf. Reines Polyacrylnitril (PAN) lässt sich schlecht verarbeiten, weshalb Polyacrylnitril neben 85 bis 99 % Acrylnitril fast immer kleine Mengen anderer Monomere enthält.[43] Verwendet werden daneben auch Copolymere, die zwischen 35 und 85 % Acrylnitril als Monomer enthalten, neben anderen Monomeren wie Vinylacetat und Methylmethacrylat.[43][46] Diese verschiedenen Polymere sind neben Polyestern und Polyamiden eines der wichtigsten vollsynthetischen Materialien für Textilfasern.[43][47] Diese Fasern werden als Acrylfasern bezeichnet und in einer Größenordnung von mehreren Millionen Tonnen pro Jahr hergestellt, beispielsweise etwa 2,7 Millionen Tonnen im Jahr 2000.[43][48] Verwendet werden Acrylfasern unter anderem in Bekleidung (z. B. Socken und Pullover) sowie für Decken, Teppiche und Strickgarn.[43][49] PAN ist außerdem der wichtigste Ausgangsstoff zur Herstellung von Carbonfasern, die als extrem leichtes aber gleichzeitig stabiles Material zum Beispiel für Autos und Flugzeuge verwendet werden.[43][46][50][51]

Acrylnitril-Butadien-Copolymere werden als Nitrilkautschuk bezeichnet und haben verschiedene vorteilhafte Eigenschaften wie hohe Zugfestigkeit und Abriebfestigkeit, sowie Beständigkeit gegen Kohlenwasserstoffe (z. B. Öl und Treibstoffe). Sie werden daher beispielsweise für Dichtungsringe und Öl- und Treibstoffschläuche verwendet.[43] Eine weitere wichtige Anwendung von Nitrilkautschuk sind Schutzhandschuhe, die oft statt Handschuhen aus Latex im Gesundheitswesen verwendet werden, da letztere regelmäßig Allergien verursachen.[52] Solche Handschuhe werden außerdem oft bei der Arbeit mit gefährlichen Chemikalien (z. B. organischen Lösungsmitteln) verwendet.[53]
Ein weiteres wichtiges Polymer ist das Terpolymer aus Acrylnitril, Butadien und Styrol (ABS). Dieses ist eines der wichtigsten Materialien für Außenhüllen von elektronischen Geräten (z. B. Computer, Bildschirme und Tastaturen).[54] Weitere Verwendungen sind Plastikteile von Autos (z. B. an Scheinwerfern und Spiegeln); Einsätze für Kühlschränke; Außenhüllen von Küchengeräten, Staubsaugern und Elektrowerkzeugen; sowie Koffer und Vesperdosen.[55] Ein weiterer Anwendungsbereich sind Spielzeuge, darunter beispielsweise Lego-Steine.[56][57] Auch ABS wird in der Größenordnung von mehreren Millionen Tonnen pro Jahr produziert, beispielsweise etwa 2,7 Millionen Tonnen im Jahr 1992.[55]
Polyamid 6.6 (Nylon) ist kein Nitril, allerdings ist ein Schlüsselintermediat zu seiner Herstellung das Adiponitril. Adiponitril wird durch Hydrocyanierung von Butadien oder durch Dimerisierung von Acrylnitril hergestellt und durch katalytische Hydrierung zu Hexamethylendiamin umgesetzt, welches eines der Monomere für Nylon ist. Das zweite Monomer, Adipinsäure wird durch Oxidation von Cyclohexan gewonnen.[58][59]
Chemisch-pharmazeutische Industrie und Labore
Acetonitril findet als Lösungsmittel Verwendung, insbesondere in der pharmazeutischen Industrie.[60] Es ist außerdem eines der wichtigsten Lösungsmittel für Analysen mittels HPLC.[60][61] Die Zersetzung von Azobisisobutyronitril (AIBN) und verwandten Verbindungen (z. B. Azobiscyclohexancarbonitril) ergibt vergleichsweise stabile Radikale, weshalb diese Verbindungen als Radikalstarter für verschiedene Reaktionen (v. a. Polymerisationen) verwendet werden.[62] Das Chinon DDQ, das über zwei Nitrilgruppen verfügt, ist ein weitverbreitetes Oxidationsmittel, das auch in der pharmazeutischen Industrie verwendet wird.[63]
Nitrile in der Medizin
Eine größere Zahl an Nitrilen werden als pharmazeutische Wirkstoffe eingesetzt. Beispielsweise wurde zwischen 2010 und 2020 jedes Jahr mindestens ein Wirkstoff mit Nitrilfunktion von der FDA zugelassen. Die Nitrilgruppe hat charakteristische physikalische und chemische Eigenschaften, die im Design von pharmazeutischen Wirkstoffen eine wichtige Rolle spielen. Die Nitrilgruppe hat eine lineare Geometrie und beansprucht nur sehr wenig Raum, etwa ein Achtel im Vergleich zu einer Methylgruppe, wodurch sie gut geeignet ist, um die Form eines Wirkstoffmoleküls an die Bindungstasche eines Zielproteins anzupassen. Die Einführung einer Nitrilgruppe in ein Molekül führt im Allgemeinen zu einem geringen Octanol-Wasser-Verteilungskoeffizienten, also besserer Wasserlöslichkeit, was verschiedene Vorteile wie eine höhere Bioverfügbarkeit und eine höhere Halbwertszeit bringt. Durch ihren starken elektronenziehenden Effekt kann sie die Elektronendichte in aromatischen Ringen beeinflussen, die dadurch unter Umständen zusätzliche Interaktionen mit dem Zielproteinen eingehen können. Zudem ist die Nitrilgruppe isoster zur Carbonylgruppe, der Hydroxylgruppe und zum Chloratom. Sie hat also ähnliche elektronische und geometrische Eigenschaften wie diese und kann gegen diese ausgetauscht werden um die Moleküleigenschaften leicht zu variieren. In einigen Fällen dient die Nitrilgruppe als Warhead für einen kovalenten Inhibitor, also eine Gruppe, durch die Wirkstoffmolekül und Zielprotein kovalent verbunden werden.[64]
Verapamil ist ein Calciumkanal-Blocker, der bei Herz-Kreislauf-Erkrankungen, beispielsweise Bluthochdruck und Angina pectoris, eingesetzt wird.[65] Die Nitrilgruppe im Molekül koordiniert an ein Calciumion, das an einer bestimmten Position des Proteins vorliegt, was wichtig für die Bindungseigenschaften ist.[66]
Sonstige Verwendungen
Eine zweistellige Anzahl an Nitrilen wird als Duftstoffe für Kosmetika verwendet. Dazu gehören unter anderem Zimtsäurenitril, Dodecannitril und Benzonitril.[67][68]
Nitrile finden Verwendung als Elektrolytzusatzmittel in Lithiumbatterien. So bewirkt beispielsweise der Zusatz von 1,3,6-Hexantricarbonitril eine signifikante Zunahme der Leistung gegenüber einer entsprechenden Batterie ohne Zusatz. Die Wirkweise der Nitrilzusätze ist noch nicht vollständig geklärt.[69][70]
Einzelnachweise
- ↑ Hans Beyer und Wolfgang Walter: Organische Chemie, S. Hirzel Verlag, Stuttgart, 22. Auflage, 1991, ISBN 3-7776-0485-2, S. 266–269.
- ↑ a b c Muthupandian Ganesan, Paramathevar Nagaraaj: Recent developments in dehydration of primary amides to nitriles. In: Organic Chemistry Frontiers. Band 7, Nr. 22, 2020, S. 3792–3814, doi:10.1039/D0QO00843E.
- ↑ Eintrag zu nitriles. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.N04151 – Version: 2.3.3.
- ↑ Eintrag zu carbonitriles. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00838 – Version: 2.3.3.
- ↑ Thomas Laue, Andreas Plagens: Namen- und Schlagwort-Reaktionen der Organischen Chemie. In: Teubner Studienbücher Chemie. 1994, ISSN 0941-3677, doi:10.1007/978-3-322-94726-0 (doi.org [abgerufen am 25. Dezember 2023]).
- ↑ K. R. Lynn, Peter E. Yankwich: Cyanide Carbon Isotope Fractionation in the Reaction of Cyanide Ion and Methyl Iodide. Carbon Isotope Effect in the Hydrolysis of Methyl Iodide. In: Journal of the American Chemical Society. Band 83, Nr. 1, Januar 1961, ISSN 0002-7863, S. 53–57, doi:10.1021/ja01462a010 (acs.org [abgerufen am 25. Dezember 2023]).
- ↑ G. E. Ham, Jane Stevens: Reaction of 1,2-Dihaloethanes with Sodium Cyanide. In: The Journal of Organic Chemistry. Band 27, Nr. 12, Dezember 1962, ISSN 0022-3263, S. 4638–4639, doi:10.1021/jo01059a504 (acs.org [abgerufen am 25. Dezember 2023]).
- ↑ Cinzia Chiappe, Daniela Pieraccini, Paola Saullo: Nucleophilic Displacement Reactions in Ionic Liquids: Substrate and Solvent Effect in the Reaction of NaN 3 and KCN with Alkyl Halides and Tosylates. In: The Journal of Organic Chemistry. Band 68, Nr. 17, 1. August 2003, ISSN 0022-3263, S. 6710–6715, doi:10.1021/jo026838h (acs.org [abgerufen am 25. Dezember 2023]).
- ↑ a b Dilip Konwar, Monalisa Boruah, Gautom Kumar Sarmah, Nayan Kamal Bhattacharyya, Naleen Borthakur, Birendra Nath Goswami, Kumar Ranjan Boruah: Aluminium Chloride and Sodium Iodide (AlCl3-NaI): A Versatile Dehydrating Agent. In: Journal of Chemical Research. Band 2001, Nr. 11, November 2001, S. 490–492, doi:10.3184/030823401103168604.
- ↑ a b Imen Talbi, Mohamed Lotfi Efrit, Soufiane Touil: Efficient New Protocols for Converting Primary Amides into Nitriles Initiated by P(NMe 2 ) 3 , PCl 3 , or P(OPh) 3. In: ACS Omega. Band 3, Nr. 5, 31. Mai 2018, S. 5078–5082, doi:10.1021/acsomega.8b00544, PMID 31458722, PMC 6641971 (freier Volltext).
- ↑ Muthupandian Ganesan: Methods for Direct Conversion of Primary Nitroalkanes to Nitriles. In: Current Organic Chemistry. Band 25, Nr. 24, 22. Dezember 2021, S. 2990–3003, doi:10.2174/1385272825666211126124835.
- ↑ Z. Shahsavari-Fard, A. R. Sardarian: Diethyl chlorophosphate: A new alternative reagent for dehydration of primary amides to nitriles in solvent and solvent-free conditions. In: Journal of the Iranian Chemical Society. Band 8, Nr. 1, März 2011, S. 204–208, doi:10.1007/BF03246217.
- ↑ Mohammed H. Al‐Huniti, Mitchell P. Croatt: Metal‐Catalyzed Dehydration of Primary Amides to Nitriles. In: Asian Journal of Organic Chemistry. Band 8, Nr. 10, Oktober 2019, S. 1791–1799, doi:10.1002/ajoc.201900343.
- ↑ Hiroyuki Okabe, Asuka Naraoka, Takahiro Isogawa, Shunsuke Oishi, Hiroshi Naka: Acceptor-Controlled Transfer Dehydration of Amides to Nitriles. In: Organic Letters. Band 21, Nr. 12, 21. Juni 2019, S. 4767–4770, doi:10.1021/acs.orglett.9b01657.
- ↑ Stephan Enthaler: Straightforward Iron‐Catalyzed Synthesis of Nitriles by Dehydration of Primary Amides. In: European Journal of Organic Chemistry. Band 2011, Nr. 25, September 2011, S. 4760–4763, doi:10.1002/ejoc.201100754.
- ↑ Stephan Enthaler: Straightforward Uranium‐Catalyzed Dehydration of Primary Amides to Nitriles. In: Chemistry – A European Journal. Band 17, Nr. 34, 16. August 2011, S. 9316–9319, doi:10.1002/chem.201101478.
- ↑ Stephan Enthaler, Shigeyoshi Inoue: An Efficient Zinc‐Catalyzed Dehydration of Primary Amides to Nitriles. In: Chemistry – An Asian Journal. Band 7, Nr. 1, 2. Januar 2012, S. 169–175, doi:10.1002/asia.201100493.
- ↑ Shekharappa, L. Roopesh Kumar, C. Srinivasulu, Vommina V. Sureshbabu: Dehydration of Chiral α-Amides to Chiral α-Nitriles Under the Appel Reaction Conditions. In: International Journal of Peptide Research and Therapeutics. Band 27, Nr. 1, März 2021, S. 497–502, doi:10.1007/s10989-020-10101-y.
- ↑ Richard S. Monson, Deggary N. Priest: Dehydration of Amides to Nitriles Initiated by Hexamethylphosphoric Triamide. In: Canadian Journal of Chemistry. Band 49, Nr. 17, 1. September 1971, S. 2897–2898, doi:10.1139/v71-480.
- ↑ Rui Ding, Yongguo Liu, Mengru Han, Wenyi Jiao, Jiaqi Li, Hongyu Tian, Baoguo Sun: Synthesis of Nitriles from Primary Amides or Aldoximes under Conditions of a Catalytic Swern Oxidation. In: The Journal of Organic Chemistry. Band 83, Nr. 20, 19. Oktober 2018, S. 12939–12944, doi:10.1021/acs.joc.8b02190.
- ↑ Kazuaki Ishihara, Yoshiro Furuya, Hisashi Yamamoto: Rhenium(VII) Oxo Complexes as Extremely Active Catalysts in the Dehydration of Primary Amides and Aldoximes to Nitriles. In: Angewandte Chemie. Band 114, Nr. 16, 16. August 2002, S. 3109, doi:10.1002/1521-3757(20020816)114:16<3109::AID-ANGE3109>3.0.CO;2-K.
- ↑ Jiban K. Chakrabarti, Terrence M. Hotten: A new route to nitriles. Dehydration of aldoximes using 2,4,6-trichloro-s-triazine (cyanuric chloride). In: Journal of the Chemical Society, Chemical Communications. Nr. 22, 1972, S. 1226, doi:10.1039/c39720001226.
- ↑ Mild and Efficient Dehydration of Oximes to Nitriles Mediated by the Burgess Reagent. In: Synlett. Band 2000, Nr. 08, 2000, ISSN 0936-5214, S. 1169–1171, doi:10.1055/s-2000-6752 (thieme-connect.de [abgerufen am 25. Dezember 2023]).
- ↑ Ziad Moussa, Saleh A. Ahmed, Ahmad S. ElDouhaibi, Shaya Y. Al-Raqa: NMR Studies and electrophilic properties of triphenylphosphine–trifluoromethanesulfonic anhydride; a remarkable dehydrating reagent system for the conversion of aldoximes into nitriles. In: Tetrahedron Letters. Band 51, Nr. 14, April 2010, S. 1826–1831, doi:10.1016/j.tetlet.2010.01.119.
- ↑ Kengo Hyodo, Saki Kitagawa, Masayuki Yamazaki, Kingo Uchida: Iron‐Catalyzed Dehydration of Aldoximes to Nitriles Requiring Neither Other Reagents Nor Nitrile Media. In: Chemistry – An Asian Journal. Band 11, Nr. 9, 6. Mai 2016, S. 1348–1352, doi:10.1002/asia.201600085.
- ↑ Philipp Rommelmann, Tobias Betke, Harald Gröger: Synthesis of Enantiomerically Pure N -Acyl Amino Nitriles via Catalytic Dehydration of Oximes and Application in a de Novo Synthesis of Vildagliptin. In: Organic Process Research & Development. Band 21, Nr. 10, 20. Oktober 2017, S. 1521–1527, doi:10.1021/acs.oprd.7b00169.
- ↑ a b Kazuya Yamaguchi, Hiroshi Fujiwara, Yoshiyuki Ogasawara, Miyuki Kotani, Noritaka Mizuno: A Tungsten–Tin Mixed Hydroxide as an Efficient Heterogeneous Catalyst for Dehydration of Aldoximes to Nitriles. In: Angewandte Chemie. Band 119, Nr. 21, 18. Mai 2007, S. 3996–3999, doi:10.1002/ange.200605004.
- ↑ Dongliang Zhang, Yaping Huang, Erlei Zhang, Rong Yi, Chao Chen, Lei Yu, Qing Xu: Pd/Mn Bimetallic Relay Catalysis for Aerobic Aldoxime Dehydration to Nitriles. In: Advanced Synthesis & Catalysis. Band 360, Nr. 4, 15. Februar 2018, S. 784–790, doi:10.1002/adsc.201701154.
- ↑ Tobias Betke, Jun Higuchi, Philipp Rommelmann, Keiko Oike, Taiji Nomura, Yasuo Kato, Yasuhisa Asano, Harald Gröger: Biocatalytic Synthesis of Nitriles through Dehydration of Aldoximes: The Substrate Scope of Aldoxime Dehydratases. In: ChemBioChem. Band 19, Nr. 8, 16. April 2018, ISSN 1439-4227, S. 768–779, doi:10.1002/cbic.201700571 (wiley.com [abgerufen am 25. Dezember 2023]).
- ↑ Liyuan Lan, Shuai Huang, Yongguo Liu, Baoguo Sun, Hongyu Tian: Preparation and odor characteristics of nitriles derived from aldehydes. In: Flavour and Fragrance Journal. Band 35, Nr. 4, Juli 2020, S. 425–434, doi:10.1002/ffj.3581.
- ↑ Dylan J. Quinn, Graham J. Haun, Gustavo Moura-Letts: Direct synthesis of nitriles from aldehydes with hydroxylamine-O-sulfonic acid in acidic water. In: Tetrahedron Letters. Band 57, Nr. 34, August 2016, S. 3844–3847, doi:10.1016/j.tetlet.2016.07.047.
- ↑ Xiao-De An, Shouyun Yu: Direct Synthesis of Nitriles from Aldehydes Using an O -Benzoyl Hydroxylamine (BHA) as the Nitrogen Source. In: Organic Letters. Band 17, Nr. 20, 16. Oktober 2015, S. 5064–5067, doi:10.1021/acs.orglett.5b02547.
- ↑ Antonella Leggio, Emilia Lucia Belsito, Sonia Gallo, Angelo Liguori: One-pot conversion of aldehydes to nitriles mediated by TiCl 4. In: Tetrahedron Letters. Band 58, Nr. 15, April 2017, S. 1512–1514, doi:10.1016/j.tetlet.2017.03.007 (elsevier.com [abgerufen am 25. Dezember 2023]).
- ↑ Lewis Acid Reagents Edited by H. Yamamoto. Oxford University Press: Oxford, UK. 1999. 270 pp. £75.00. ISBN 0 19 850099 8. In: Organic Process Research & Development. Band 3, Nr. 4, 15. April 1999, ISSN 1083-6160, S. 292–292, doi:10.1021/op990022+ (doi.org [abgerufen am 25. Dezember 2023]).
- ↑ Jitendra Gurjar, Jorick Bater, Valery V. Fokin: Sulfuryl Fluoride Mediated Conversion of Aldehydes to Nitriles. In: Chemistry – A European Journal. Band 25, Nr. 8, 6. Februar 2019, S. 1906–1909, doi:10.1002/chem.201805175.
- ↑ Albert M. van Leusen, Piet G. Oomkes: One-Step Conversion of Aldehydes to Nitriles. Introduction of a One-Carbon Unit. In: Synthetic Communications. Band 10, Nr. 5, Januar 1980, S. 399–403, doi:10.1080/00397918008061830.
- ↑ Otto H. Oldenziel, Daan Van Leusen, Albert M. Van Leusen: Chemistry of sulfonylmethyl isocyanides. 13. A general one-step synthesis of nitriles from ketones using tosylmethyl isocyanide. Introduction of a one-carbon unit. In: The Journal of Organic Chemistry. Band 42, Nr. 19, September 1977, S. 3114–3118, doi:10.1021/jo00439a002.
- ↑ Niamh Disney, Megan Smyth, Scott Wharry, Thomas S. Moody, Marcus Baumann: A cyanide-free synthesis of nitriles exploiting flow chemistry. In: Reaction Chemistry & Engineering. 2024, doi:10.1039/D3RE00458A.
- ↑ M. F. Semmelhack, Christopher R. Schmid: Nitroxyl-mediated electro-oxidation of amines to nitriles and carbonyl compounds. In: Journal of the American Chemical Society. Band 105, Nr. 22, Oktober 1983, S. 6732–6734, doi:10.1021/ja00360a042.
- ↑ Kyle M. Lambert, James M. Bobbitt, Sherif A. Eldirany, Liam E. Kissane, Rose K. Sheridan, Zachary D. Stempel, Francis H. Sternberg, William F. Bailey: Metal‐Free Oxidation of Primary Amines to Nitriles through Coupled Catalytic Cycles. In: Chemistry – A European Journal. Band 22, Nr. 15, 4. April 2016, S. 5156–5159, doi:10.1002/chem.201600549.
- ↑ Yasunari Maeda, Takahiro Nishimura, Sakae Uemura: Copper-Catalyzed Oxidation of Amines with Molecular Oxygen. In: Bulletin of the Chemical Society of Japan. Band 76, Nr. 12, Dezember 2003, S. 2399–2403, doi:10.1246/bcsj.76.2399.
- ↑ Laurent Vanoye, Ahmad Hammoud, Hélène Gérard, Alexandra Barnes, Régis Philippe, Pascal Fongarland, Claude de Bellefon, Alain Favre-Réguillon: Direct Synthesis of Nitriles from Carboxylic Acids Using Indium-Catalyzed Transnitrilation: Mechanistic and Kinetic Study. In: ACS Catalysis. Band 9, Nr. 11, 1. November 2019, S. 9705–9714, doi:10.1021/acscatal.9b02779.
- ↑ a b c d e f g h Polyacrylonitrile. In: Handbook of Thermoplastics. CRC Press, 2016, ISBN 978-0-429-10162-5, S. 157–186.
- ↑ Florian Glöcklhofer, Markus Lunzer, Johannes Fröhlich: Facile Synthesis of Cyanoarenes from Quinones by Reductive Aromatization of Cyanohydrin Intermediates. In: Synlett. Band 26, Nr. 07, 1. April 2015, S. 950–952, doi:10.1055/s-0034-1380150.
- ↑ Harald Gröger, Yasuhisa Asano: Cyanide-Free Enantioselective Catalytic Strategies for the Synthesis of Chiral Nitriles. In: The Journal of Organic Chemistry. doi:10.1021/acs.joc.9b02773.
- ↑ a b Arman Sedghi, Reza Eslami Farsani, Ali Shokuhfar: The effect of commercial polyacrylonitrile fibers characterizations on the produced carbon fibers properties. In: Journal of Materials Processing Technology. Band 198, Nr. 1-3, März 2008, S. 60–67, doi:10.1016/j.jmatprotec.2007.06.052.
- ↑ Md Abdullah Al Faruque, Rechana Remadevi, Joselito Razal, Xungai Wang, Maryam Naebe: Investigation on structure and characteristics of alpaca‐based wet‐spun polyacrylonitrile composite fibers by utilizing natural textile waste. In: Journal of Applied Polymer Science. Band 137, Nr. 7, 15. Februar 2020, doi:10.1002/app.48370.
- ↑ B. E. Geller: [No title found]. In: Fibre Chemistry. Band 34, Nr. 3, 2002, S. 151–161, doi:10.1023/A:1020525628197.
- ↑ P. Bajaj, Surya Kumari: Modification of Acrylic Fibers: An Overview. In: Journal of Macromolecular Science, Part C: Polymer Reviews. Band 27, Nr. 2, Mai 1987, S. 181–217, doi:10.1080/07366578708081915.
- ↑ T.A. Adegbola, O. Agboola, O.S.I. Fayomi: Review of polyacrylonitrile blends and application in manufacturing technology: recycling and environmental impact. In: Results in Engineering. Band 7, September 2020, S. 100144, doi:10.1016/j.rineng.2020.100144.
- ↑ Xing Jin, Chunfang Feng, Claudia Creighton, Nishar Hameed, Jyotishkumar Parameswaranpillai, Nisa V. Salim: On the structural evolution of textile grade polyacrylonitrile fibers during stabilization and carbonization: Towards the manufacture of low‐cost carbon fiber. In: Polymer Degradation and Stability. Band 186, 1. April 2021, S. 109536, doi:10.1016/j.polymdegradstab.2021.109536.
- ↑ J. Sawyer: Comparing the Level of Dexterity offered by Latex and Nitrile SafeSkin Gloves. In: Annals of Occupational Hygiene. Band 50, Nr. 3, 12. Dezember 2005, S. 289–296, doi:10.1093/annhyg/mei066.
- ↑ Keh-Ping Chao, Pak-Hing Lee, Min-Jet Wu: Organic solvents permeation through protective nitrile gloves. In: Journal of Hazardous Materials. Band 99, Nr. 2, April 2003, S. 191–201, doi:10.1016/S0304-3894(03)00042-6.
- ↑ L. B. Brennan, D. H. Isaac, J. C. Arnold: Recycling of acrylonitrile–butadiene–styrene and high‐impact polystyrene from waste computer equipment. In: Journal of Applied Polymer Science. Band 86, Nr. 3, 17. Oktober 2002, S. 572–578, doi:10.1002/app.10833.
- ↑ a b Acrylonitrile-butadiene-styrene copolymers. In: Encyclopedic Dictionary of Polymers. Springer New York, New York, NY 2006, S. 22–22.
- ↑ Francesca Sabatini, Silvia Pizzimenti, Irene Bargagli, Ilaria Degano, Celia Duce, Laura Cartechini, Francesca Modugno, Francesca Rosi: A Thermal Analytical Study of LEGO® Bricks for Investigating Light-Stability of ABS. In: Polymers. Band 15, Nr. 15, 31. Juli 2023, S. 3267, doi:10.3390/polym15153267.
- ↑ Zhijuan Wang, Hongyan Li, Tao Li, Qing Zhang, Yaqi Cai, Hua Bai, Qing Lv: Application of validated migration models for the risk assessment of styrene and acrylonitrile in ABS plastic toys. In: Ecotoxicology and Environmental Safety. Band 252, März 2023, S. 114570, doi:10.1016/j.ecoenv.2023.114570.
- ↑ Alex Tullo: Industry braces for nylon 6,6 shortage. In: C&EN Global Enterprise. Band 96, Nr. 40, 8. Oktober 2018, S. 22–23, doi:10.1021/cen-09640-feature3.
- ↑ Younghyun Lee, Sung Woo Lee, Hyung Ju Kim, Yong Tae Kim, Kun-Yi Andrew Lin, Jechan Lee: Hydrogenation of Adiponitrile to Hexamethylenediamine over Raney Ni and Co Catalysts. In: Applied Sciences. Band 10, Nr. 21, 26. Oktober 2020, S. 7506, doi:10.3390/app10217506.
- ↑ a b Ian F. McConvey, Dean Woods, Moira Lewis, Quan Gan, Paul Nancarrow: The Importance of Acetonitrile in the Pharmaceutical Industry and Opportunities for its Recovery from Waste. In: Organic Process Research & Development. Band 16, Nr. 4, 20. April 2012, S. 612–624, doi:10.1021/op2003503.
- ↑ Cristiano Soleo Funari, Renato Lajarim Carneiro, Manish M. Khandagale, Alberto José Cavalheiro, Emily F. Hilder: Acetone as a greener alternative to acetonitrile in liquid chromatographic fingerprinting. In: Journal of Separation Science. Band 38, Nr. 9, Mai 2015, S. 1458–1465, doi:10.1002/jssc.201401324.
- ↑ Ladislav Androvič, Jan Bartáček, Miloš Sedlák: Recent advances in the synthesis and applications of azo initiators. In: Research on Chemical Intermediates. Band 42, Nr. 6, Juni 2016, S. 5133–5145, doi:10.1007/s11164-015-2351-4.
- ↑ Bao Li, Alison E. Wendlandt, Shannon S. Stahl: Replacement of Stoichiometric DDQ with a Low Potential o -Quinone Catalyst Enabling Aerobic Dehydrogenation of Tertiary Indolines in Pharmaceutical Intermediates. In: Organic Letters. Band 21, Nr. 4, 15. Februar 2019, S. 1176–1181, doi:10.1021/acs.orglett.9b00111, PMID 30702297, PMC 6413530 (freier Volltext).
- ↑ Xi Wang, Yuanxun Wang, Xuemin Li, Zhenyang Yu, Chun Song, Yunfei Du: Nitrile-containing pharmaceuticals: target, mechanism of action, and their SAR studies. In: RSC Medicinal Chemistry. Band 12, Nr. 10, 2021, S. 1650–1671, doi:10.1039/D1MD00131K, PMID 34778767, PMC 8528211 (freier Volltext).
- ↑ Natalija Popović, Nicanor Morales-Delgado, David Vidal Mena, Antonia Alonso, María Pascual Martínez, María Caballero Bleda, Miroljub Popović: Verapamil and Alzheimer’s Disease: Past, Present, and Future. In: Frontiers in Pharmacology. Band 11, 5. Mai 2020, doi:10.3389/fphar.2020.00562, PMID 32431612, PMC 7214748 (freier Volltext).
- ↑ Ricky C.K. Cheng, Denis B. Tikhonov, Boris S. Zhorov: Structural Model for Phenylalkylamine Binding to L-type Calcium Channels. In: Journal of Biological Chemistry. Band 284, Nr. 41, Oktober 2009, S. 28332–28342, doi:10.1074/jbc.M109.027326, PMID 19700404, PMC 2788883 (freier Volltext).
- ↑ David R Bickers, Peter Calow, Helmut A Greim, Jon M Hanifin, Adrianne E Rogers, Jean-Hilaire Saurat, I Glenn Sipes, Robert L Smith, Hachiro Tagami: The safety assessment of fragrance materials. In: Regulatory Toxicology and Pharmacology. Band 37, Nr. 2, April 2003, S. 218–273, doi:10.1016/S0273-2300(03)00003-5.
- ↑ S.P. Bhatia, V.T. Politano, A.M. Api: Evaluation of genotoxicity of nitrile fragrance ingredients using in vitro and in vivo assays. In: Food and Chemical Toxicology. Band 59, September 2013, S. 784–792, doi:10.1016/j.fct.2013.04.040.
- ↑ Wie ein gewöhnlicher Zusatzstoff Lithium-Ionen-Batterien einen Schub verleiht. Chemie.de, 28. September 2022, abgerufen am 29. September 2022.
- ↑ Chao Tang, Yawei Chen, Zhengfeng Zhang, Wenqiang Li, Junhua Jian, Yulin Jie, Fanyang Huang, Yehu Han, Wanxia Li, Fuping Ai, Ruiguo Cao, Pengfei Yan, Yuhao Lu, Shuhong Jiao: Stable cycling of practical high-voltage LiCoO2 pouch cell via electrolyte modification. In: Nano Research. 2022, doi:10.1007/s12274-022-4955-5.