„Serotonin“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K →Geschichte: typo |
→Vorkommen: +Pflanzenphysiologie |
||
| Zeile 41: | Zeile 41: | ||
== Vorkommen == |
== Vorkommen == |
||
[[Datei:Juglans regia Echte Walnußfrucht 3.JPG|thumb|left|Walnüsse enthalten viel Serotonin<ref name="pmid2413754"/>]] |
[[Datei:Juglans regia Echte Walnußfrucht 3.JPG|thumb|left|Walnüsse enthalten viel Serotonin<ref name="pmid2413754"/>]] |
||
Serotonin ist in der Natur weit verbreitet. Bereits einzellige Organismen wie [[Amöben]] können Serotonin produzieren.<ref name="pmid6308760">{{cite journal |author=McGowan K, Kane A, Asarkof N, ''et al.'' |title=Entamoeba histolytica causes intestinal secretion: role of serotonin |journal=Science |volume=221 |issue=4612 |pages=762–4 |year=1983 |month=August |pmid=6308760 |doi= |url=http://www.sciencemag.org/cgi/pmidlookup?view=long&pmid=6308760}}</ref> Als Produzenten gelten ebenso [[Pflanzen]] und Höhere [[Pilz]]e.<ref name="pmid19704574"/><ref name="pmid19694188">{{cite journal |author=Muszyńska B, Sułkowska-Ziaja K, Ekiert H |title=Indole compounds in fruiting bodies of some selected Macromycetes species and in their mycelia cultured in vitro |journal=Pharmazie |volume=64 |issue=7 |pages=479–80 |year=2009 |month=July |pmid=19694188 |doi= |url=}}</ref> In den [[Brennhaar]]en der [[Brennnessel]] ist Serotonin für deren bekannte Wirkung mitverantwortlich. Zu den serotoninreichsten pflanzlichen Lebensmitteln zählen [[Walnuss|Walnüsse]], die über 300 µg/g Serotonin enthalten können. Aber auch [[Kochbanane]]n, [[Ananas]], [[Banane]]n, [[Kiwi]]s, [[Pflaume]]n,[[Tomate]]n, [[Kakao]] und davon abgeleitete Produkte, wie beispielsweise [[Schokolade]], enthalten Serotonin im ppm-Bereich.<ref name="pmid2413754">{{cite journal |author=Feldman JM, Lee EM |title=Serotonin content of foods: effect on urinary excretion of 5-hydroxyindoleacetic acid |journal=Am. J. Clin. Nutr. |volume=42 |issue=4 |pages=639–43 |year=1985 |month=October |pmid=2413754 |doi= |url=http://www.ajcn.org/cgi/pmidlookup?view=long&pmid=2413754}}</ref><ref name="pmid11052752">{{cite journal |author=Herraiz T |title=Tetrahydro-beta-carbolines, potential neuroactive alkaloids, in chocolate and cocoa |journal=J. Agric. Food Chem. |volume=48 |issue=10 |pages=4900–4 |year=2000 |month=October |pmid=11052752 |doi= |url=http://dx.doi.org/10.1021/jf000508l}}</ref> |
Serotonin ist in der Natur weit verbreitet. Bereits einzellige Organismen wie [[Amöben]] können Serotonin produzieren.<ref name="pmid6308760">{{cite journal |author=McGowan K, Kane A, Asarkof N, ''et al.'' |title=Entamoeba histolytica causes intestinal secretion: role of serotonin |journal=Science |volume=221 |issue=4612 |pages=762–4 |year=1983 |month=August |pmid=6308760 |doi= |url=http://www.sciencemag.org/cgi/pmidlookup?view=long&pmid=6308760}}</ref> Als Produzenten gelten ebenso [[Pflanzen]] und Höhere [[Pilz]]e.<ref name="pmid19704574"/><ref name="pmid19694188">{{cite journal |author=Muszyńska B, Sułkowska-Ziaja K, Ekiert H |title=Indole compounds in fruiting bodies of some selected Macromycetes species and in their mycelia cultured in vitro |journal=Pharmazie |volume=64 |issue=7 |pages=479–80 |year=2009 |month=July |pmid=19694188 |doi= |url=}}</ref> In den [[Brennhaar]]en der [[Brennnessel]] ist Serotonin für deren bekannte Wirkung mitverantwortlich. Zu den serotoninreichsten pflanzlichen Lebensmitteln zählen [[Walnuss|Walnüsse]], die über 300 µg/g Serotonin enthalten können. Aber auch [[Kochbanane]]n, [[Ananas]], [[Banane]]n, [[Kiwi]]s, [[Pflaume]]n,[[Tomate]]n, [[Kakao]] und davon abgeleitete Produkte, wie beispielsweise [[Schokolade]], enthalten Serotonin im ppm-Bereich.<ref name="pmid2413754">{{cite journal |author=Feldman JM, Lee EM |title=Serotonin content of foods: effect on urinary excretion of 5-hydroxyindoleacetic acid |journal=Am. J. Clin. Nutr. |volume=42 |issue=4 |pages=639–43 |year=1985 |month=October |pmid=2413754 |doi= |url=http://www.ajcn.org/cgi/pmidlookup?view=long&pmid=2413754}}</ref><ref name="pmid11052752">{{cite journal |author=Herraiz T |title=Tetrahydro-beta-carbolines, potential neuroactive alkaloids, in chocolate and cocoa |journal=J. Agric. Food Chem. |volume=48 |issue=10 |pages=4900–4 |year=2000 |month=October |pmid=11052752 |doi= |url=http://dx.doi.org/10.1021/jf000508l}}</ref> Der ungewöhnlich hohe Serotoningehalt, speziell bei Walnüssen, wird mit einem spezifischen Abbaumechanismus von entstehenden [[Ammoniak]] versucht zu erklären.<ref name="pmid10721112">{{cite journal |author=Schröder P, Abele C, Gohr P, Stuhlfauth-Roisch U, Grosse W |title=Latest on enzymology of serotonin biosynthesis in walnut seeds |journal=Adv. Exp. Med. Biol. |volume=467 |issue= |pages=637–44 |year=1999 |pmid=10721112 |doi= |url=}}</ref> Für Abkömmlinge des Serotonis, wie [[Feruloylserotonin]] und [[4-Cumaroylserotonin]], wird eine Funktion als [[Phytoalexin]]e angenommen. |
||
Im Tierreich ist Serotonin in nahezu allen Vertretern anzutreffen. Es ist hier einer der [[Phylogenese|phylogenetisch]] ältesten Neurotransmitter und kommt, wie auch seine [[Rezeptor]]en, im Nervensystem bereits so einfacher Vertreter wie dem [[Fadenwurm]] ''[[C. elegans]]'' vor.<ref name="pmid18050501">{{cite journal |author=Chase DL, Koelle MR |title=Biogenic amine neurotransmitters in C. elegans |journal=WormBook |volume= |issue= |pages=1–15 |year=2007 |pmid=18050501 |doi=10.1895/wormbook.1.132.1 |url=http://dx.doi.org/10.1895/wormbook.1.132.1}}</ref> |
Im Tierreich ist Serotonin in nahezu allen Vertretern anzutreffen. Es ist hier einer der [[Phylogenese|phylogenetisch]] ältesten Neurotransmitter und kommt, wie auch seine [[Rezeptor]]en, im Nervensystem bereits so einfacher Vertreter wie dem [[Fadenwurm]] ''[[C. elegans]]'' vor.<ref name="pmid18050501">{{cite journal |author=Chase DL, Koelle MR |title=Biogenic amine neurotransmitters in C. elegans |journal=WormBook |volume= |issue= |pages=1–15 |year=2007 |pmid=18050501 |doi=10.1895/wormbook.1.132.1 |url=http://dx.doi.org/10.1895/wormbook.1.132.1}}</ref> |
||
Version vom 30. November 2009, 21:47 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
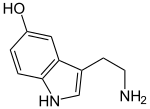
| ||||||||||
| Allgemeines | ||||||||||
| Name | Serotonin | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C10H12N2O | |||||||||
| Kurzbeschreibung |
hygroskopische, lichtempfindliche Kristalle (als Hydrochlorid)[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 176,22 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
löslich in Wasser (20 g·l−1 bei 27 °C) [2] und Ethanol (3 g·l−1, als Hydrochlorid)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Serotonin, auch 5-Hydroxytryptamin (5-HT), oder Enteramin, ist ein Gewebshormon und Neurotransmitter, das unter anderem im Zentralnervensystem, Darmnervensystem, Herz-Kreislauf-System und im Blut vorkommt. Der Name dieses biogenen Amins leitet sich von seiner Wirkung auf den Blutdruck ab: Serotonin ist eine Komponente des Serums, die den Tonus (Spannung) der Blutgefäßen reguliert. Es wirkt außerdem auf die Magen-Darm-Tätigkeit und die Signalübertragung im Zentralnervensystem.
Geschichte
Das Vorkommen eines Stoffes im Blut, der die Blutgefäße kontrahiert, wurde bereits Mitte des 19. Jahrhunderts von Carl Ludwig angenommen.[4] Vittorio Erspamer isolierte in den 1930er Jahren einen Stoff aus der Schleimhaut des Magen-Darm-Trakts, der die glatte Muskulatur kontrahiert. Er nannte ihn „Enteramin“. 1948 isolierten Maurice Rapport, Arda Green und Irvine Page eine Blutgefäße kontrahierende Substanz und gaben ihr den Namen „Serotonin“.[5] Die Struktur dieser Substanz, die Maurice Rapport postulierte,[6] konnte 1951 durch Synthese bestätigt werden.[7]. Kurz darauf konnte Vittorio Erspamer zeigen, dass das von ihm gefundene Enteramin und Rapports Serotonin identisch sind.[8] Irvine Page und Betty Twarog gelang 1953 mit dem Nachweis von Serotonin im Gehirn eine weitere wichtige Entdeckung.[9]
Die für die Wirkung von Serotonin verantwortlichen Rezeptoren wurden in den folgenden Jahren intensiv untersucht. John Gaddum führte eine Unterscheidung in „D“- und „M“-Rezeptoren ein.[10] Doch erst mit der Etablierung molekularbiologischer Methoden in den 1990er Jahren wurde die große Anzahl verschiedener Serotonin-Rezeptoren des Menschen offensichtlich, die für seine vielfältigen Wirkungen verantwortlich sind.[11]
Vorkommen

Serotonin ist in der Natur weit verbreitet. Bereits einzellige Organismen wie Amöben können Serotonin produzieren.[13] Als Produzenten gelten ebenso Pflanzen und Höhere Pilze.[14][15] In den Brennhaaren der Brennnessel ist Serotonin für deren bekannte Wirkung mitverantwortlich. Zu den serotoninreichsten pflanzlichen Lebensmitteln zählen Walnüsse, die über 300 µg/g Serotonin enthalten können. Aber auch Kochbananen, Ananas, Bananen, Kiwis, Pflaumen,Tomaten, Kakao und davon abgeleitete Produkte, wie beispielsweise Schokolade, enthalten Serotonin im ppm-Bereich.[12][16] Der ungewöhnlich hohe Serotoningehalt, speziell bei Walnüssen, wird mit einem spezifischen Abbaumechanismus von entstehenden Ammoniak versucht zu erklären.[17] Für Abkömmlinge des Serotonis, wie Feruloylserotonin und 4-Cumaroylserotonin, wird eine Funktion als Phytoalexine angenommen.
Im Tierreich ist Serotonin in nahezu allen Vertretern anzutreffen. Es ist hier einer der phylogenetisch ältesten Neurotransmitter und kommt, wie auch seine Rezeptoren, im Nervensystem bereits so einfacher Vertreter wie dem Fadenwurm C. elegans vor.[18]
Im menschlichen Organismus kommt die größte Menge an Serotonin in Magen-Darm-Trakt vor. Etwa 90% des gesamten menschlichen Serotonins sind hier in den enterochromaffinen Zellen gespeichert. Das Serotonin im Blut ist fast ausschließlich auf die Thrombozyten verteilt. Dieses Serotonin wird von den enterochromaffinen Zellen des Magen-Darm-Trakts produziert und von den Thrombozyten nach Abgabe in das Blut aufgenommen. Auch basophile Granulozyten und Mastzellen können Serotonin speichern und freisetzen. Im Zentralnervensystem befindet sich Serotonin insbesondere in den Neuronen der Raphe-Kerne. Eine pathologisch vermehrte Produktion, Speicherung und Freisetzung von Serotonin kann häufig bei neuroendokrinen Tumoren des Magen-Darm-Trakts, den Karzinoiden, beobachtet werden und ist für dessen charakteristische Begleitsymptomatik verantwortlich.
Biochemie
Biosynthese
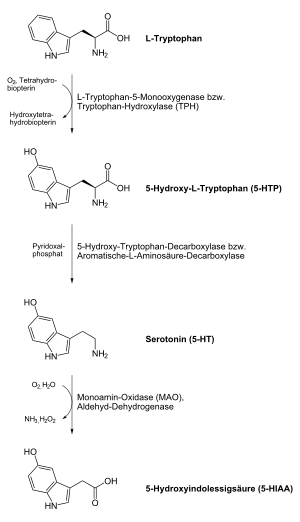
Beim Menschen und bei Tieren wird Serotonin aus der Aminosäure L-Tryptophan in einer Zwei-Schritt-Reaktion unter Beteiligung der Enzyme Aromatische-L-Aminosäure-Decarboxylase aufgebaut. Im ersten Schritt entsteht als Zwischenprodukt die nicht-proteinogene Aminosäure 5-Hydroxytryptophan. Im zweiten Schritt erfolgt eine Decarboxylierung zum Endprodukt Serotonin. Wichtige Produktionsorte von Serotonin sind das Zentralnervensystem, die Leber, die Milz und die enterochromaffinen Zellen der Darmschleimhaut.
Die Biosynthese von Serotonin in Pflanzen weicht in der Reihenfolge ihrer Schritte von der in Tieren ab. Unter Beteiligung der Tryptophandecarboxylase wird im ersten Schritt L-Tryptophan zum Zwischenprodukt Tryptamin decarboxyliert. Im zweiten Schritt erfolgt eine Hydroxylierung mit Hilfe der Tryptamin-5-Hydroxylase zum Endprodukt Serotonin.[14]
Abbau
Neuronales Serotonin wird nach seiner Freisetzung in den synaptischen Spalt aktiv mit Hilfe des Serotonin-Transporters SERT, einem Transportprotein, rückresorbiert und wiederverwertet. Der Abbau von Serotonin erfolgt vorrangig über das Enzym Monoaminooxidase (MAO) vom Typ A und in einem deutlich geringeren Maß über MAO Typ B. Das Produkt 5-Hydroxy-Indolyl-Acetaldehyd wird von der Aldehyddehydrogenase 2 (ALDH-2) weiter zu 5-Hydroxy-Indolyl-Essigsäure (5-HIAA) abgebaut. 5-Hydroxy-Indolyl-Essigsäure, das im Urin nachgewiesen werden kann, ist das Hauptausscheidungsprodukt von Serotonin.
Funktionen
Im menschlichen Organismus besitzt Serotonin vielfältige Funktionen insbesondere auf das Herz-Kreislauf-System, den Magen-Darm-Trakt und das Nervensystem. Auf molekularer Ebene werden die Funktionen des Serotonins über die mindestens 14 verschiedenen Serotonin-Rezeptoren (5-HT-Rezeptoren) vermittelt, die in 7 Familien zusammengefasst werden: 5-HT1 bis 5-HT7. Die 5-HT3-Rezeptoren bestehen aus Ionenkanälen, alle übrigen bekannten 5-HT-Rezeptoren sind G-Protein-gekoppelte Rezeptoren.[19] Intrazellulär vermag Serotonin darüber hinaus über eine als Serotonylierung bezeichnete Modifikation von Proteinen Signaltransduktionsprozesse zu steuern.[20]
Herz-Kreislauf-System
Die Wirkungen von Serotonin auf das Herz-Kreislauf-System sind komplex und umfassen sowohl die Kontraktion als auch die Relaxation von Blutgefäßen. Während in der Lunge und in den Nieren des Menschen die blutgefäßverengende Wirkung im Vordergrund steht, dominiert in der Skelettmuskulatur die blutgefäßerweiternde Wirkung. Eine intravaskuläre Serotonin-Injektion verursacht eine triphasische Veränderung des Blutdrucks. Nach einem initialen Blutdruckabfall kommt es nach wenigen Sekunden zu einem Blutdruckanstieg um letztendlich in einer langanhaltenden Hypotonie zu enden.[21]
Für diese Effekte sind die Rezeptoren 5-HT1B, 5-HT2A, 5-HT2B und 5-HT7 hauptverantwortlich.[22] Je nach Blutgefäß führen sie zu einer direkten Kontraktion (über 5-HT1B, 5-HT2A und 5-HT2B) oder Relaxation der Blutgefäße (über 5-HT7). Alternativ können Blutgefäße indirekt über die Beteiligung des Endothels (über 5-HT1B und 5-HT2B) relaxiert werden.[23]
Blutgerinnung
Serotonin hat sowohl mittelbare als auch unmittelbare Auswirkungen auf Blutgerinnung. Die Thrombozyten, auch Blutplättchen genannt, deren Aggregation ein wichtiger Bestandteil der Blutgerinnung ist, dienen nicht nur der Speicherung und Freisetzung von Serotonin, sondern tragen selbst Serotoninrezeptoren vom Typ 5-HT2A. Dank dieser führt Serotonin zu einer Entleerung der Granula der Thrombozyten und verstärkt die durch andere Botenstoffe, wie Adenosindiphosphat oder Thrombin, hervorgerufene Thrombozytenaggregation. In kleineren Blutgefäßen trägt es zudem durch Vasokonstriktion zur Wundheilung bei.[24]
Magen-Darm-System
Serotonin regt die Darmperistaltik an. Sein Normalspiegel im Darmgewebe liegt bei 1-5 ppb. Wesentlich erhöhte Werte liegen vor bei einem Tumor enterochromaffiner Zellen, also bei einem Dünndarm-Karzinoid. Dieser Umstand wird diagnostisch genutzt. Cisaprid als Serotonin-Agonist wird als Prokinetikum genutzt, also die Förderung der Propulsivmotorik des Magens, Dünndarms bzw. Dickdarms. Erst kürzlich wurde entdeckt, dass enterochromaffine Zellen Aromastoffe in der Nahrung detektieren und daraufhin Serotonin freisetzen.[25]
Im Magen-Darm-Trakt besitzen die Rezeptoren 5-HT3 und 5-HT4 eine besondere Rolle bei der Regulation der gastrointestinalen Motilität.
Zentralnervensystem
In den Raphe-Kernen befinden sich die Somata (Zellkörper) serotoninerger Nervenbahnen, deren Axone in alle Teile des Gehirns ausstrahlen. An ihren Endigungen wird das Serotonin diffus als Neurohormon ausgeschüttet. Diese Gehirnstruktur der Raphe liegt im Stammhirn im Medianbereich zwischen dem verlängerten Rückenmark (Medulla oblongata) und dem Mittelhirn (Mesencephalon) und besteht aus kreuzenden Nervenfasern. Die sog. Hypnogene Zone der Raphe ist zuständig für die Auslösung des synchronen Schlafes, ihre Zerstörung führt zu völliger Schlaflosigkeit.
Auf der postsynaptischen Membran von Nervenzellen kann Serotonin erregend wirken oder hemmend. Durch unterschiedliche Beschickung der verschiedenen Gehirnregionen mit Serotonin kann die Raphe das globale Erregungsmuster im Gehirn beeinflussen. Ein antagonistisches System hierzu ist die Ausschüttung von Noradrenalin durch Neuronen des Locus coeruleus.
Dieses diffuse Steuerungssystem versetzt das Gehirn z. B. in die für den Schlaf notwendigen Zustände der Aktivitätsverteilung.
Auch in Stresszuständen wird die diffuse Ausschüttung von Serotonin in den verschiedenen Gehirnteilen verändert. In der Großhirnrinde ist sie dann erhöht, im Stammhirn und Zwischenhirn dagegen vermindert. Es wird angenommen, dass diese Umverteilung schnellere, wenn auch weniger durchdachte, Reaktionen in einer Gefahrensituation ermöglicht und damit die Überlebenschance statistisch erhöht.
Ob Depressionen, bipolare Störungen und Angststörungen mit einem regelrechten Mangel an Serotonin im Gehirn einhergehen bzw. durch einen solchen verursacht werden, ist nicht unumstritten. Gesichert ist jedoch, dass die Symptomatik dieser Störungen durch eine Steigerung des aktuellen Serotoninspiegels deutlich gelindert werden kann.
Ein veränderter Serotonin-Spiegel wird auch bei Verliebten behauptet. Ein ausgeglichener bzw. leicht erhöhter Serotonin-Spiegel soll Wohlbefinden bzw. ein Gefühl der Zufriedenheit bewirken, weshalb Serotonin populär als „Glückshormon“ bezeichnet wird. Dies entspricht unmittelbar der genannten antidepressiven Wirkung.
Studien haben ergeben, dass ein erhöhter Serotonin-Spiegel im Gehirn von Menschen und Ratten zu einer Erhöhung der Schwelle zur Ejakulation führt. Des Weiteren konnte eine Beeinträchtigung männlicher Sexualität den serotonergen Neuronen der medialen Raphe-Kerne zugeschrieben werden.[26]
Pharmakologisch lässt sich der Serotoninspiegel im Gehirn auf vielfältige Weise beeinflussen. MAOI-A oder SSRI erhöhen im allgemeinen den Spiegel und sind somit wirksame Antidepressiva. Die Serotonin-Vorläufersubstanzen L-Tryptophan und 5-Hydroxy-Tryptophan können antidepressive Effekte haben und mit den genannten Antidepressiva kombiniert werden, allerdings ist dabei große Vorsicht geboten, um ein Serotonin-Syndrom zu vermeiden.
Serotonin selbst passiert nicht die Blut-Hirn-Schranke. Ein Mangel an Serotonin kann durch stark verminderte Verfügbarkeit von L-Tryptophan in der Gehirnflüssigkeit (Liquor cerebrospinalis) entstehen.
Um eine Unterversorgung des Gehirns mit L-Tryptophan zu vermeiden, wird gelegentlich die Rolle von Süßigkeiten ins Gespräch gebracht. Dem liegt der Zusammenhang zugrunde, dass durch die Aufnahme von Zucker das Hormon Insulin ins Blut ausgeschüttet wird. Es bewirkt nicht nur die Aufnahme des Zuckers in Muskulatur und Leber, sondern ermöglicht auch den Übertritt von Tryptophan an der Blut-Hirn-Schranke. Jedoch führen alle Kohlenhydrate zu einer Insulinausschüttung, da sie alle zu Zucker verdaut werden, so dass längerkettigere Kohlenhydrate (wie z. B. (Vollkorn)getreide) die gleiche Wirkung ohne die schädlichen Nebenwirkungen von (kurzkettigem) Zucker haben.
Bei normaler Verfügbarkeit von Tryptophan steuert das Gehirn die Synthese von Serotonin, entsprechend der Aktivität der Raphe-Neuronen, selbst. Deshalb führt ein (z. B. durch Süßigkeiten) erhöhter Tryptophan-Spiegel im Gehirn keineswegs automatisch zu mehr Serotonin.
Pharmakologie
Arzneistoffe, welche die Freisetzung, die Wirkung, die Wiederaufnahme und den Abbau von Serotonin beeinflussen, werden in vielfältiger Weise in der Therapie eingesetzt. Arzneistoffe mit einer Wirkung auf das Serotonin-System werden insbesondere als Psychopharmaka eingesetzt. In der Behandlung von Depressionen besitzen Selektive Serotonin-Wiederaufnahmehemmer (SSRI), wie beispielsweise Fluoxetin, einen hohen Stellenwert. Sie sind Hemmstoffe des Serotonintransporters und führen zu einer erhöhten Konzentration und einem verlängerten Verbleib von Serotonin im synaptischen Spalt. Auch die Wirkung der älteren trizyklischen Antidepressiva beruht, zumindest zum Teil, auf einer Hemmung des Serotonintransporters. Die ebenfalls als Antidepressiva genutzten MAO-Hemmer, wie Tranylcypromin und Moclobemid, verdanken ihre Wirksamkeit einer Hemmung des Serotonin-abbauenden Enzyms Monoaminooxidase.
In der Therapie akuter Migräneattacken finden insbesondere 5-HT1B/1D-Rezeptoragonisten aus der Gruppe der Triptane, wie beispielsweise Sumatriptan, Anwendung. In der Migräneprophylaxe wurden hingegen, zumindest bis zum Siegeszug der Betablocker, Serotoninantagonisten wie Methysergid und Pizotifen genutzt.
Als Antihypertensiva finden Ketanserin und Urapidil zur Behandlung erhöhten Blutdrucks Anwendung. Ihre blutdrucksenkende Wirkung wird jedoch vielmehr mit einer zusätzlichen Interaktion mit Adrenozeptoren erklärt.[27]
Der 5-HT2A-Antagonist Sarpogrelat wird als Thrombozytenaggregationshemmer eingesetzt.[28]
Zur Behandlung des Erbrechens, insbesondere im Zusammenhang mit einer Chemotherapie werden Setrone, wie Ondansetron und Tropisetron eingesetzt. Alosetron und Tegaserod finden in der Behandlung des Reizdarmsyndroms Anwendung.
Einzelnachweise
- ↑ a b Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ a b Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Sicherheitsdatenblatt Sigma-Aldrich
- ↑ Ludwig C., Schmidt A.: Das Verhalten der Gase, welche mit dem Blut durch den reizbaren Säugethiermuskel strömen. In: Arbeiten aus der Physiologischen Anstalt zu Leipzig. 1868, S. 1–61 (mpg.de).
- ↑ Rapport M.M., Green A.A., Page I.H.: Serum vasoconstrictor, serotonin; isolation and characterization. In: J. Biol. Chem. 176. Jahrgang, Nr. 3, Dezember 1948, S. 1243–51, PMID 18100415.
- ↑ Rapport MM: Serum vasoconstrictor (serotonin) the presence of creatinine in the complex; a proposed structure of the vasoconstrictor principle. In: J. Biol. Chem. 180. Jahrgang, Nr. 3, Oktober 1949, S. 961–9, PMID 18139191.
- ↑ Hamlin K.E., Fischer F.E.: The synthesis of 5-hydroxytryptamine. In: J. Amer. Chem. Soc. 3. Jahrgang, 1951, S. 5007.
- ↑ Erspamer V., Asero B.: Identification of enteramine, the specific hormone of the enterochromaffin cell system, as 5-hydroxytryptamine. In: Nature. 169. Jahrgang, Nr. 4306, Mai 1952, S. 800–1, PMID 14941051.
- ↑ Twarog B.M., Page I.H.: Serotonin content of some mammalian tissues and urine and a method for its determination. In: Am. J. Physiol. 175. Jahrgang, Nr. 1, Oktober 1953, S. 157–61, PMID 13114371 (physiology.org).
- ↑ Gaddum J.H., Picarelli Z.P.: Two kinds of tryptamine receptor. In: Br J Pharmacol Chemother. 12. Jahrgang, Nr. 3, September 1957, S. 323–8, PMID 13460238, PMC 1509685 (freier Volltext).
- ↑ Peroutka SJ: 5-Hydroxytryptamine receptors in vertebrates and invertebrates: why are there so many? In: Neurochem. Int. 25. Jahrgang, Nr. 6, Dezember 1994, S. 533–6, PMID 7894329.
- ↑ a b Feldman JM, Lee EM: Serotonin content of foods: effect on urinary excretion of 5-hydroxyindoleacetic acid. In: Am. J. Clin. Nutr. 42. Jahrgang, Nr. 4, Oktober 1985, S. 639–43, PMID 2413754 (ajcn.org).
- ↑ McGowan K, Kane A, Asarkof N, et al.: Entamoeba histolytica causes intestinal secretion: role of serotonin. In: Science. 221. Jahrgang, Nr. 4612, August 1983, S. 762–4, PMID 6308760 (sciencemag.org).
- ↑ a b Kang K, Kang S, Lee K, Park M, Back K: Enzymatic features of serotonin biosynthetic enzymes and serotonin biosynthesis in plants. In: Plant Signal Behav. 3. Jahrgang, Nr. 6, Juni 2008, S. 389–90, PMID 19704574, PMC 2634310 (freier Volltext).
- ↑ Muszyńska B, Sułkowska-Ziaja K, Ekiert H: Indole compounds in fruiting bodies of some selected Macromycetes species and in their mycelia cultured in vitro. In: Pharmazie. 64. Jahrgang, Nr. 7, Juli 2009, S. 479–80, PMID 19694188.
- ↑ Herraiz T: Tetrahydro-beta-carbolines, potential neuroactive alkaloids, in chocolate and cocoa. In: J. Agric. Food Chem. 48. Jahrgang, Nr. 10, Oktober 2000, S. 4900–4, PMID 11052752 (doi.org).
- ↑ Schröder P, Abele C, Gohr P, Stuhlfauth-Roisch U, Grosse W: Latest on enzymology of serotonin biosynthesis in walnut seeds. In: Adv. Exp. Med. Biol. 467. Jahrgang, 1999, S. 637–44, PMID 10721112.
- ↑ Chase DL, Koelle MR: Biogenic amine neurotransmitters in C. elegans. In: WormBook. 2007, S. 1–15, doi:10.1895/wormbook.1.132.1, PMID 18050501 (doi.org).
- ↑ Millan MJ, Marin P, Bockaert J, la Cour CM: Signaling at G-protein-coupled serotonin receptors: recent advances and future research directions. In: Trends Pharmacol. Sci. 29. Jahrgang, Nr. 9, September 2008, S. 454–64, doi:10.1016/j.tips.2008.06.007, PMID 18676031 (elsevier.com).
- ↑ Walther DJ, Peter JU, Winter S, et al.: Serotonylation of small GTPases is a signal transduction pathway that triggers platelet alpha-granule release. In: Cell. 115. Jahrgang, Nr. 7, Dezember 2003, S. 851–62, PMID 14697203 (elsevier.com).
- ↑ Saxena PR, Lawang A: A comparison of cardiovascular and smooth muscle effects of 5-hydroxytryptamine and 5-carboxamidotryptamine, a selective agonist of 5-HT1 receptors. In: Arch Int Pharmacodyn Ther. 277. Jahrgang, Nr. 2, Oktober 1985, S. 235–52, PMID 2933009.
- ↑ Ullmer C, Schmuck K, Kalkman HO, Lübbert H: Expression of serotonin receptor mRNAs in blood vessels. In: FEBS Lett. 370. Jahrgang, Nr. 3, August 1995, S. 215–21, PMID 7656980 (elsevier.com).
- ↑ Watts SW, Cohen ML: Vascular 5-HT receptors: pharmacology and pathophysiology of 5-HT1B, 5-HT1D, 5-HT1F, 5-HT2B und 5-HT7 receptors. In: Neurotransmissions. 15. Jahrgang, 1999, S. 3–15.
- ↑ Josef Prchal; Lichtman, Marshall A; Williams, William A.; Beutler, Ernest; Kenneth Kaushansky; Thomas J. Kipps; Seligsohn, Uri: Williams hematology. McGraw-Hill, Medical Pub. Division, New York 2006, ISBN 0-07-143591-3.
- ↑ Scienceticker: Nase im Darm
- ↑ Deutsches Arzteblatt 2007; 104(50): A-3475 / B-3056 / C-2953
- ↑ van Zwieten PA, Blauw GJ, van Brummelen P: Pharmacological profile of antihypertensive drugs with serotonin receptor and alpha-adrenoceptor activity. In: Drugs. 40 Suppl 4. Jahrgang, 1990, S. 1–8; discussion 28–30, PMID 1982649.
- ↑ Nagatomo T, Rashid M, Abul Muntasir H, Komiyama T: Functions of 5-HT2A receptor and its antagonists in the cardiovascular system. In: Pharmacol. Ther. 104. Jahrgang, Nr. 1, Oktober 2004, S. 59–81, doi:10.1016/j.pharmthera.2004.08.005, PMID 15500909 (elsevier.com).
Siehe auch
Weblinks
- Wiktionary: Serotonin – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
- Serotonin Catabolism
- informativer Artikel zu neuer Studie 2008