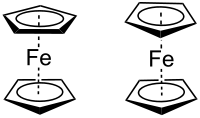
Ferrocen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Ekliptische Konformation | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ferrocen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H10Fe | ||||||||||||||||||
| Kurzbeschreibung |
orangefarbene Nadeln mit campherartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 186,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,49 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
249 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Ferrocen ist eine metallorganische Verbindung mit der Halbstrukturformel [Fe(C5H5)2]. Es handelt sich um einen orangefarbenen Feststoff mit campherartigem Geruch, der in vielen organischen Lösungsmitteln löslich ist. Die Verbindung ist sehr stabil. Luft, Wasser und starke Basen greifen sie nicht an, und sie lässt sich ohne Zersetzung hoch erhitzen. Der Komplex gehört zur Klasse der Metallocene und besteht aus zwei aromatischen Cyclopentadienylliganden, die mit einem zentralen Eisenatom verbunden sind. Aufgrund der parallelen Anordnung der Liganden wird Ferrocen als Sandwichverbindung bezeichnet, ein Begriff, der heute allgemein für die Gruppe dieser Verbindungen verwendet wird.
Ferrocen und seine Derivate finden Anwendung in Bereichen wie der Sensorik, der Katalyse und der Medizin und sie lassen sich zu Polyferrocenen polymerisieren, einer Klasse von Ferrocen enthaltenden, temperaturstabilen Polymeren. Seine hohe thermische Stabilität ermöglicht die Synthese einer großen Vielfalt von metallorganischen Flüssigkristallen. Bei Elektronentransferprozessen in der Elektrochemie können sie reversibel zu isolierbaren 17-Elektronen-Eisen(III)-Komplexionen oxidiert werden, eine nützliche Eigenschaft in elektrochemischen Systemen. Weiterhin werden sie in stereo- und enantioselektiven homogenkatalytischen Reaktionen sowie als Kraftstoffzusätze verwendet.
Die Ferrocen-Synthese und die Untersuchung der Struktur sowie der chemischen Eigenschaften, seiner Analoga und Derivate, spielten eine zentrale Rolle bei der Entwicklung der metallorganischen Chemie. Diese Arbeiten führten zur Verleihung des Nobelpreises für Chemie an Geoffrey Wilkinson und Ernst Otto Fischer.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Entdeckung der Ferrocensynthese erfolgte mehrfach durch Zufall. Das erste Ferrocen entstand bei Versuchen von Union Carbide in den 1940er Jahren, bei denen heißer Dicyclopentadiendampf zur Darstellung von Cyclopentadien mittels Retro-Diels-Alder-Reaktion durch ein Eisenrohr geleitet wurde. Der Dampf reagierte mit dem Eisen und bildete eine Substanz, die das Rohr verstopfte. Später stellte sich heraus, dass es sich bei dieser Substanz um Ferrocen handelte.[4]
Thomas J. Kealy und Peter L. Pauson entdeckten es 1951 zufällig an der Duquesne University wieder, als sie versuchten, Fulvalen durch die Reaktion von Cyclopentadienylmagnesiumbromid mit Eisen(III)-chlorid herzustellen. Bei der Reaktion entstand zwar kein Fulvalen, doch sie erhielten orangefarbene Kristalle, die an der Luft erstaunlich stabil waren und sich leicht sublimieren ließen. Es wird angenommen, dass ein Teil der Grignard-Reagenzien das Eisen(III) zu Eisen(II) reduziert, das dann mit überschüssigem Reagenz zu Ferrocen reagiert.[5]
Samuel A. Miller, John A. Tebboth und John F. Tremaine, Mitglieder einer Forschergruppe bei der British Oxygen Company, gelang bereits 1948 die Darstellung von Ferrocen durch die Reaktion von Cyclopentadiendampf mit frisch reduziertem Eisen bei 300 °C in einer Stickstoffatmosphäre.[6] Die Versuche wurden in der Hoffnung durchgeführt, Ammoniak analog dem Haber-Bosch-Verfahren herstellen zu können. Da die Ammoniaksynthese auf diese Weise nicht gelang, reichten sie ihre Arbeit erst 1951 zur Veröffentlichung ein.[4] Der Artikel erschien jedoch erst 1952.[7]
Der erste Strukturvorschlag von Pauson und Kealy basierte auf zwei Cyclopentadienylgruppen mit jeweils einer kovalenten Einfachbindung zwischen dem Cyclopentadien und dem Eisenatom ([Fe(η1-C5H5)]2). Jedoch widersprach diese Struktur den bestehenden Bindungsmodellen und erklärte nicht die unerwartete Stabilität der Verbindung.[5]
William von Eggers Doering schlug nach einer Diskussion mit Pauson bei einem IUPAC-Kongress als Erster die richtige Struktur vor, und dass die Messung der magnetischen Suszeptibilität dafür einen Beweis liefern könnte.[8] Pauson ignorierte jedoch von Eggers Doerings Hinweis und wartete auf eine Röntgenstrukturanalyse.
An der Lösung des Strukturproblems beteiligten sich in der Folge vor allem Ernst Otto Fischer, Robert B. Woodward und Geoffrey Wilkinson. Die Verbindung war diamagnetisch, und das Infrarotspektrum enthielt nur eine einzelne scharfe Bande, die auf das Vorhandensein von C-H-Bindungen eines einzigen Typs im Molekül hinwies. Das Dipolmoment der Verbindung war nahezu null.[9] Basierend auf diesen Eigenschaften schlugen Geoffrey Wilkinson und Robert B. Woodward, damals beide an der Harvard University, die richtige Struktur vor.[10]
Ernst Otto Fischer hatte versucht, Ferrocen in einem Autoklaven mit Kohlenstoffmonoxid bei etwa 150 °C und 200 bar umzusetzen. Da es unter diesen Bedingungen nicht reagierte, vermutete er, dass das Eisen(II)-Zentrum eine 18-Elektronen-Konfiguration aufweisen muss. Durch Röntgen-Kristallstrukturanalyse konnten Fischer und Wolfgang Pfab, beide damals Technische Universität München, die Strukturvorschläge von Wilkison und Woodward bestätigen.[4] Fischer schlug den Namen Doppelkegelstruktur für diese Art von Verbindungen vor. Der Name setzte sich jedoch nicht durch. Fischer stellte mit Cobaltocen und Nickelocen auch die Sandwichverbindungen der benachbarten Elemente her.[11][12]
Woodward stellte die These auf, dass die Cyclopentadienylringe in Ferrocen einer elektrophilen aromatischen Substitution zugänglich sein sollten. Seine Mitarbeiter Whitning und Rosenblum führten daraufhin die erste Friedel-Crafts-Acylierung mit Acetylchlorid und Aluminium(III)-chlorid an den Cyclopentadienylringen durch und erhielten dabei ein rotes Diacetylderivat des Ferrocens.[13] Aufgrund dieses benzolanalogen Verhaltens schlugen sie den Namen Ferrocene mit der Endung -ene vor, analog zu benzene, dem englischen Namen für Benzol. Dies sollte die Aromatizität der Verbindung betonen.[8] Ernst Otto Fischer und Geoffrey Wilkinson erhielten 1973 den Nobelpreis für Chemie für ihre Arbeiten über metallorganische Verbindungen, die auch die Bindungsverhältnisse im Ferrocen erklärten.

Schon kurz nach der Entdeckung des Ferrocens gelang die Darstellung von Ferrocen-enthaltenen Polymeren, etwa durch Selbstkondensation von Ferrocenylcarbinolen über Methylen- oder Methinbrücken. Die Reaktion von Ferrocen mit Aldehyden wie Benzaldehyd führte ebenfalls zu polymeren Strukturen.[14] Ende der 1950er Jahre erfolgte die Darstellung von Ferrocenophanen. In dieser Substanzklasse sind die Cyclopentadienyl-Liganden des Ferrocens durch eine oder mehrere Brückengruppen verbunden.[15] Mit Ferroceron wurde 1971 in der Sowjetunion das erste ferrocenhaltige Arzneimittel zur Behandlung von Eisenmangelanämie zugelassen.[16] Erste Studien zur Verwendung von Ferrocenylpolyaminen in der Krebsforschung begannen 1978.[17]
Japanischen Wissenschaftlern gelang es 2003, mit Hilfe eines chiral substituierten Ferrocens, das aus einem 1,1',3,3'-Tetraarylferrocen als Drehpunkt und einer Azobenzol-Struktureinheit als Antriebskomponente besteht, eine molekulare Schere zu synthetisieren, die durch Licht gesteuert werden kann. Wird die Verbindung mit ultraviolettem Licht bestrahlt, bildet sich das cis-Isomer des Azobenzols und drückt die „Griffe“ auseinander. Durch Bestrahlung mit sichtbarem Licht entsteht wieder das trans-Isomer der Azobenzol-Struktureinheit.[18]
Darstellung
[Bearbeiten | Quelltext bearbeiten]

Deprotonierung von Cyclopentadien
[Bearbeiten | Quelltext bearbeiten]Ferrocen ist im Labor leicht zugänglich über die Umsetzung von Cyclopentadien mit Eisen(II)-chlorid in einem inerten Lösemittel und einem Überschuss von Kaliumhydroxid, das sowohl als Deprotonierungsreagenz für das Cyclopentadien als auch als Dehydratisierungsmittel dient:[19]
Einige Amine wie Diethylamin eignen sich ebenfalls zur Deprotonierung des Cyclopentadiens.[20]
Metalliertes Cyclopentadien
[Bearbeiten | Quelltext bearbeiten]Neben der originalen Synthese über die Grignard-Verbindung kann Natriumcyclopentadienyl als Reagent eingesetzt werden:
Neben dem Natriumsalz reagieren die Lithium- und Magnesiumsalze des Cyclopentadiens in ähnlicher Weise.[20]
Metall-Cyclopentadien-Reaktion
[Bearbeiten | Quelltext bearbeiten]Eine weitere einfache Darstellung erfolgt durch die Überleitung eines Cyclopentadien-Stickstoffstroms über getrocknetes Eisen(II)-oxalat bei Temperaturen von 320 bis 450 °C. Bei diesen Temperaturen zerfällt das Oxalat und das Cyclopentadien reagiert leicht mit dem entstehenden Eisen.[21]
Die Ferrocensynthese erfolgt ebenfalls durch die direkte Reaktion von metallischem Eisen mit gasförmigem Cyclopentadien bei erhöhter Temperatur unter Freisetzung von Wasserstoff.
Anstelle von Eisen kann Eisenpentacarbonyl als Eisenquelle dienen.[22]
Ligandenaustausch
[Bearbeiten | Quelltext bearbeiten]Ferner lässt sich Ferrocen durch Ligandenaustausch mit anderen Sandwichkomplexen herstellen. So reagiert [Mn(C5H5)2] bereits bei Raumtemperatur vollständig und schnell mit Eisen(II)-chlorid unter Bildung von Ferrocen und Mangan(II)-chlorid. In ähnlicher Weise reagiert [Cr(C5H5)2], wenngleich in geringerer Ausbeute und unter Bildung von Nebenprodukten.[20]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Ferrocen bildet orangefarbene Kristallnadeln mit einem Schmelzpunkt von 173 °C und einem Siedepunkt von 249 °C, ab 100 °C tritt jedoch bereits eine merkliche Sublimation ein.[19] In Wasser ist Ferrocen nicht löslich, in unpolaren Lösungsmitteln wie n-Hexan oder Toluol hingegen gut. Es besitzt große thermische und chemische Stabilität. Ferrocen lässt sich durch Vakuumsublimation gut reinigen, da es für einen Feststoff einen relativ hohen Dampfdruck hat. Im Vergleich zum Benzol weist Ferrocen eine deutlich höhere Lipophilie und Hydrophobie auf.[24][25]
Der Abstand der Cyclopentadienylringe beträgt 332 pm, was dem Van-der-Waals-Kontakt zweier π-Systeme entspricht, etwa dem Abstand der Schichten im Graphit von 330 pm oder im Bis(benzol)chrom mit 322 pm. Der Fe-C-Abstand beträgt 204,5 ± 1 pm, der C-C-Abstand 140,3 ± 2 pm. Es kristallisiert oberhalb von 163,9 Kelvin im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit den Gitterparametern a = 1056,1 pm, b = 759,7 pm c = 595,2 pm und β = 121,02° mit zwei Formeleinheiten pro Elementarzelle.[26] Unterhalb dieser Temperatur gibt es einen Phasenübergang, bei der sich trikline Kristalle mit Raumgruppe P1 (Raumgruppen-Nr. 1) oder Raumgruppe P1 (Raumgruppen-Nr. 2) (Z=16) bilden.[27] Bei einer Temperatur unter 110 Kelvin findet ein weiterer Phasenübergang in orthorhombische Modifikation statt. In der monoklinen Form wird durch Fehlordnung eine gestaffelte Konformation (D5d) individueller Sandwichmoleküle vorgetäuscht. Die trikline Form weicht um 9° von der ekliptischen Anordnung (D5) ab, die orthorhombische Form (D5h) ist exakt ekliptisch gebaut.[28][29]
Molekulare Eigenschaften
[Bearbeiten | Quelltext bearbeiten]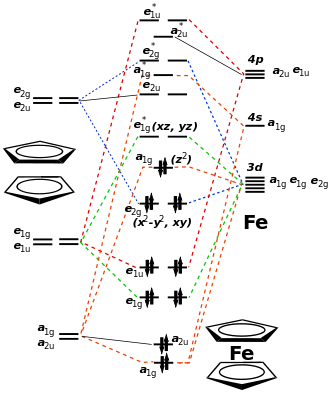
Ferrocen besteht formal aus einem Eisen(II)-Kation und zwei Cyclopentadienylanionen. Dies führt zu einem ungeladenen Komplex. Die Bindungsverhältnisse lassen sich vereinfacht dadurch erklären, dass die Cyclopentadienylanionen als Aromaten ein delokalisiertes π-Elektronensystem aufweisen. Jeder der beiden Liganden kann dem Eisen(II)-Kation sechs π-Elektronen zur Verfügung stellen. Da das Eisen(II)-Kation sechs Elektronen besitzt und zwölf Elektronen von den Liganden erhält, verfügt es im Komplex über 18 Elektronen. Dadurch wird nach der 18-Elektronen-Regel die energetisch günstige Edelgaskonfiguration von Krypton erreicht. Bei Ferrocen handelt es sich um einen low-spin-Komplex.
Die Infrarotspektren von Ferrocen deuten auf aromatische Cyclopentadienylringe und eine D5d- beziehungsweise D5h-Symmetrie des Komplexes hin. Die Infrarotbanden der beiden Konformeren unterscheiden sich geringfügig, und da diese leicht ineinander überführt werden können, kann ein Spektrum eine Mischung aus beiden Konformeren zeigen.[30]
| Infrarotbanden von Ferrocen[30] | |
|---|---|
| Wellenzahl in cm−1 | Zuordnung |
| 3100 | C-H-Streckschwingung |
| 1470 | Asymmetrische C-C-Streckschwingung |
| 1141 | Atmungsschwingung, bei der ein Ring sich ausdehnt und der andere schrumpft |
| 1035 | C-C-H-Biegeschwingung |
| 870 | C-H-Streckschwingung, wobei zwei C-H-Bindungen aufwärts und zwei abwärts schwingen |
| 840 | C-H-Streckschwingung |
| 488 | Ringkippschwingung |
| 471 | Eisen-Cp-Streckschwingung |
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Elektrophile aromatische Substitution
[Bearbeiten | Quelltext bearbeiten]Trotz seiner formalen Ungesättigtheit weist Ferrocen keine typischen Eigenschaften ungesättigter Verbindungen auf. Es geht keine Diels-Alder-Reaktion mit Maleinsäureanhydrid ein und lässt sich nicht hydrieren. Ferrocen zeigt dagegen zahlreiche für aromatische Verbindungen charakteristische Reaktionen. Dies erlaubt die meist einfache Herstellung von Derivaten des Ferrocens. Die Friedel-Crafts-Reaktion von Ferrocen mit Acetylchlorid in Gegenwart von Aluminiumchlorid als Katalysator war die erste Reaktion, die in diesem Bereich untersucht wurde. Ferrocen bildet unter den Bedingungen einer Mannich-Reaktion N,N-Dimethylaminomethylferrocen.
Die π-Rückbindung des d-Orbitals von Eisen verstärkt die Elektronendichte des Cyclopentadienylrings, die viel höher ist als die des Benzols. Infolgedessen ist seine Reaktivität in einer Friedel-Crafts-Reaktion um den Faktor 106 höher als die von Benzol. Gleiches gilt für andere elektrophile Substitutionsreaktionen wie die Vilsmeier-Haack-Reaktion oder die Mannich-Reaktion.[31]
Metallierungen
[Bearbeiten | Quelltext bearbeiten]Die Lithiierung von Ferrocen mit Butyllithium in Gegenwart von Ethern wie Tetrahydrofuran oder tertiären Aminen wie Tetramethylendiamin führt zu 1,1'-Dilithioferrocen, unabhängig von der Stöchiometrie.[31] Die Ether und tertiären Amine bilden Addukte mit den Lithiumionen.
Oft wird es in Lösung belassen und nicht isoliert. Durch die weitere Umsetzung mit Elektrophilen dient es zur Herstellung disubstituierter Ferrocenderviate.
Das Lithioferrocen lässt sich zu vielen weiteren Produkten umsetzen. Die Reaktion mit Kohlenstoffdioxid führt zum Carbonsäurederivat und die Reaktion mit Chlor(diphenyl)phosphan führt zur Bildung des als Liganden verwendeten 1,1′-Bis(diphenylphosphino)ferrocen, abgekürzt als dppf. Das monolithiumsubstituierte Ferrocen lässt sich durch die Reaktion eines Ferrocenüberschusses mit tert-Butyllithium darstellen. Eine Methode unter Verwendung von tert-Butyllithium und mit Kalium-tert-butanolat liefert das Mono-Lithio-Ferrocen in guter Ausbeute.[31]
Redoxreaktionen
[Bearbeiten | Quelltext bearbeiten]In der Cyclovoltammetrie wird Ferrocen wegen seiner reversiblen Oxidation zum Ferrocenium-Ion oft als Referenzsubstanz in nicht wässrigen Lösungen gegen eine Wasserstoffelektrode verwendet.[32][33]
Als typischer Standard gilt eine Lösung von 1 Millimol Ferrocen in Acetonitril mit 0,1 Mol Tetrabutylammoniumperchlorat als Leitsalz.[34] Diese Verwendung geht auf eine um 1960 aufgestellte Hypothese von Stehlow zurück, die besagt, dass Ferrocen gut für den Vergleich von Redoxpotentialen in verschiedenen organischen Lösungsmitteln geeignet ist, weil der elektrostatische Anteil der Solvatationsenthalpie des Ferricenium-Ions sehr klein ist und deshalb die freie Solvatationsenthalpie des Ferrocen-Moleküls der des Ferrocenium-Ions sehr ähnlich ist. Gleiches gilt für das Cobaltocen/Cobaltocenium-System, so dass das Redoxpotential des Cobaltocens in vielen verschiedenen Lösungsmitteln einen Wert von −1,32 V vs. Fc annimmt. Aus diesem Grund wurde Ferrocen neben Bis(benzol)chrom 1984 als IUPAC-Potentialstandard für die Angabe von Potentialen in organischen Lösungsmitteln festgelegt.[35] Die Umrechnung von mit Ferrocen kalibrierten Redoxpotentialen auf die Potentialskala der Standard-Wasserstoffelektrode in wässriger Phase ist schwierig, da in der Literatur viele sehr unterschiedliche Werte für das Redoxpotential existieren.[36] Ein Grund für diese stark variierenden Daten liegt in der Unlöslichkeit von Ferrocen in wässriger Phase. Darüber hinaus ist dies auf die Realisierung der Standard-Wasserstoffelektrode in organischer Phase und die intrinsische Unmöglichkeit einer genauen potentiostatischen Messung von Redoxpotentialen zwischen Halbzellen, die mit unterschiedlichen Elektrolyten gefüllt sind, zurückzuführen. Da der anionische und der kationische Verteilungskoeffizient nicht unabhängig voneinander bestimmt werden können, ist der Spannungsabfall, der an der Grenzfläche auftritt, unbekannt.
Neuere Arbeiten verweisen auf vorteilhafte Eigenschaften des Decamethylferrocens als Referenzsystem in organischer Phase, da dieses ähnlich wie Bisbiphenylchrom eine größere Abschirmung gegen das Lösungsmittel besitzt.[37] Die Abhängigkeit des Redoxpotentials vom Lösungsmittel ist noch geringer einzuschätzen als beim Ferrocen/Ferricenium-System, da aber Decamethylferrocen ebenso unlöslich in Wasser ist wie Ferrocen, liefert dieser Ansatz keine zufriedenstellende Lösung der Probleme beim Vergleich von Redoxpotentialen in wässriger und organischer Phase. Im Gegensatz zu Decamethylferrocen bildet Ferrocen kein stabiles, isolierbares Dikation.
Das durch die Ullmann-Reaktion von Iodoferrocen mit Kupferpulver einfach darzustellende Biferrocen lässt sich leicht zu einem gemischtvalenten Komplex mit einem Fe(II)- und einem Fe(III)-Kation oxidieren.[38]
Die Elektronenübertragung vom Fe(II)-Ion auf das Fe(III)-Ion über die Ligandenbrücke erfolgt durch thermische Aktivierung. Dieser Komplex hat somit eine Ähnlichkeit mit dem gemischtvalenten Berliner Blau.[39]
Ligandensubstitution
[Bearbeiten | Quelltext bearbeiten]Durch die Reaktion von Ferrocen mit Benzol in Gegenwart von Aluminiumpulver und Aluminiumchlorid entsteht ein kationischer Komplex mit einem Cyclopentadienyl- und einem Benzolliganden:[40]
Die Substitution von Benzol durch Thiophen unter analogen Reaktionsbedingungen ergibt den entsprechenden gemischten Cyclopentadien-Eisen-Thiophen-Komplex.
Stereochemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Konformation
[Bearbeiten | Quelltext bearbeiten]Die ekliptische Konformation („auf Deckung“) ist gegenüber der gestaffelten Konformation der Ringe bevorzugt.[41]
Dagegen weist Ferrocen in der Gasphase eine gestaffelte Konformation auf, wobei die Aktivierungsenergie für die Rotation um die Molekülachse sehr niedrig ist. Wenn nur ein Cyclopentadienylring monoderivatisiert wird, wobei ein Wasserstoffatom durch eine andere Gruppe ersetzt wird, entsteht aufgrund der Äquivalenz aller Wasserstoffatome nur ein mögliches Derivat. Dieses kann wie das unsubstituierte Ferrocen in zwei möglichen Konformationen auftreten. Wenn nur ein Cyclopentadienylring derivatisiert wird, wird der Begriff „homoannular“ verwendet, während der Begriff „heteroannular“ verwendet wird, wenn beide Ringe substituiert sind.
Sind beide Cyclopentadienylringe monosubstituiert, treten fünf gestaffelte Rotationsisomere auf, von denen eines symmetrisch ist. Die Gleichgewichtseinstellung zwischen den möglichen Konformationen erfolgt aufgrund der niedrigen Aktivierungsenergie von etwa 8 bis 21 Kilojoule ebenfalls schnell.[42]
Stellungsisomerie
[Bearbeiten | Quelltext bearbeiten]Aufgrund der räumlichen Struktur von Ferrocen kann bei geeigneter Substitution nicht nur Stellungsisomerie, sondern auch optische Isomerie auftreten. Die Zahl der möglichen Stellungsisomere in Ferrocen für einige Substitutionsmuster steigt mit der Zahl der Substituenten schnell an.[42]
| Zahl der möglichen Stellungsisomere von Ferrocen[42] | |||
|---|---|---|---|
| Substituenten Ring 1 oder Ring 2 | Mögliche Stellungsisomere | Racemate | Mesoformen |
| R, R | 3 | 0 | 3 |
| R, R’ | 3 | 2 | 1 |
| R, R, R | 4 | 0 | 4 |
| R, R, R’ | 8 | 3 | 5 |
| R, R’, R’’ | 13 | 13 | 0 |
| Substituenten Ring 1 und Ring 2 | Mögliche Stellungsisomere | Racemate | Mesoformen |
| Ring 1: R, R’ / Ring 2: R, R' | 6 | 4 | 2 |
| Ring 1: R, R’, R’’ / Ring 2: R, R’, R’’ | 13 | 8 | 5 |
Planare Chiralität
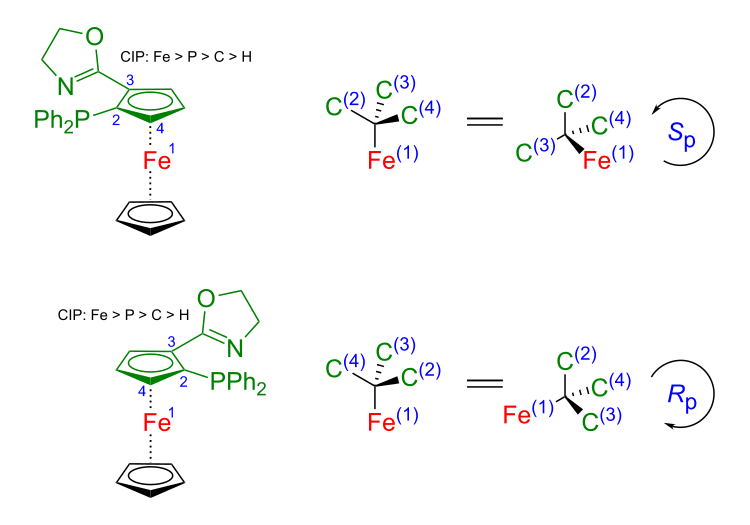
[Bearbeiten | Quelltext bearbeiten]Wird ein Cyclopendienylring disubstituiert, wird die relative Stellung der Substituenten zueinander mit ortho- und meta- bezeichnet. Ferrocene, in denen ein Cyclopentadienylring in 1,2-Stellung mit zwei verschiedenen Substituenten substituiert sind, haben keine Symmetrieebene mehr. Sie weisen aufgrund ihrer räumlichen Struktur bei entsprechender Substitution optische Isomerie auf. Dieses Phänomen wird durch das Konzept der planaren Chiralität beschrieben.[42]
Die Bezeichnung der Stereoisomere folgt den Sequenzregeln der Cahn-Ingold-Prelog-Konvention (CIP-Konvention). Die Regeln für die planare Chiralität leiten sich von den Regeln für die so genannte zentrale Chiralität ab, die auf Stereozentren beruht. Dies geschieht durch die Annahme von Einfachbindungen zwischen den Ringkohlenstoffen und dem Eisen. Dadurch werden die betroffenen Ringkohlenstoffe sowie das zentrale Eisenatom Teil eines meist verzerrten Tetraeders, auf den die Regeln für die zentrale Chiralität angewendet werden. Zu diesem Zweck wird zunächst das Kohlenstoffatom mit der höchsten Priorität im Cyclopentadienylring bestimmt, gefolgt von der Priorität der beiden unmittelbar benachbarten Kohlenstoffatome im Ring des Liganden. Diese drei Kohlenstoffatome bilden mit dem zentralen Eisenatom einen Tetraeder. Dieser Tetraeder wird so gedreht, dass der Substituent mit der niedrigsten Priorität nach hinten zeigt. Im obigen Beispiel hat der Diphenylphosphansubstituent (2) in Ring die höchste Priorität, gefolgt vom Kohlenstoffatom des Oxazolinsubstituenten (3), gefolgt vom Wasserstoff (4); Eisen (1) erhält bezüglich des Tetraeders die höchste Priorität. Zeigen die oben liegenden Tetraederatome gemäß der Cahn-Ingold-Prelog-Priorität im Uhrzeigersinn, wird das Stereoisomer als Rp bezeichnet, zeigt die Sequenz gegen den Uhrzeigersinn, wird es als Sp bezeichnet. Das Subskript p weist auf die planare Chiralität hin.[42]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Zersetzungskatalysator
[Bearbeiten | Quelltext bearbeiten]Ammoniumperchlorat eignet sich als Raketentreibstoff für Feststoffraketen oder als Sprengstoff. Es zersetzt sich bei Initialzündung oder Erhitzung über 200 °C in Chlor, Sauerstoff, Stickstoff und Wasser gemäß:
Ferrocen sowie seine Derivate katalysieren die Zersetzung von Perchlorsäure, die eines der Erstzersetzungsprodukte von Ammoniumperchlorat ist.
Die Geschwindigkeit der thermischen Zersetzung von Ammoniumperchlorat wird schon bei niedrigen Temperaturen erhöht.[43]
Ligand
[Bearbeiten | Quelltext bearbeiten]Planar chirale Ferrocenderivate oder diastereomere Verbindungen wie die Josiphos-Liganden werden in der enantioselektiven Synthese verwendet. Sie wurden technisch bei der Synthese von (S)-Metolachlor zur asymmetrischen Hydrierung eingesetzt.[44] Bei der Synthese des HIV-Integrase-Hemmers Indinavir ist die enantioselektive Hydrierung eines Methylimins unter Verwendung des Josiphos-Liganden ein wichtiger Schritt.[45]
Verbesserung der Diesel- und Benzinverbrennung
[Bearbeiten | Quelltext bearbeiten]Ferrocen wirkt aufgrund seiner katalytischen Eigenschaften bei der Verbrennung von Dieselkraftstoff, Heizöl und Schiffsdiesel emissionsmindernd und reduziert gesundheitsschädliche Rußpartikel.[46] Die Verbrennungstemperatur des Öls wird durch das Additiv nicht erhöht.
Ferrocen kann als Alternative zu (Methylcyclopentadienyl)mangantricarbonyl (MMT) und Tetraethylblei (TEL) als Oktanbooster zur Erhöhung der Oktanzahl von Motorbenzin eingesetzt werden. Es bildet jedoch eisenhaltige, leitfähige Ablagerungen auf Zündkerzenoberflächen.[47]
Polyferrocene
[Bearbeiten | Quelltext bearbeiten]Substituierte Ferrocene dienen als Monomere für die Herstellung von Polyferrocenen. Dies gelingt beispielsweise durch die Umsetzung von Ferrocen mit Benzaldehyd in Gegenwart einer Lewis-Säure. Polymere auf Ferrocenbasis wie Poly(vinylferrocen) eignen sich gut als kathodische Materialien für wiederaufladbare Lithium-Ionen-Akkumulatoren, da sie eine hohe Reproduzierbarkeit, eine gute Lade-Entladekapazität und eine hohe Stabilität aufweisen. Die mittlere Entladespannung einer Poly(vinylferrocen)/Lithium-Zelle beträgt 2,96 Volt, die Kapazität nahm nach 300 Zyklen um 5 % ab.[48]
Medizinische Verwendung
[Bearbeiten | Quelltext bearbeiten]Seit den 1990er-Jahren werden Ferrocen-Derivate als Medikamente untersucht, vor allem als Zytostatika und Antimalariamittel.[49] Ferroquin ist eine Ferrocen enthaltende, mit dem Chloroquin verwandte synthetische Verbindung, die wirksame antimalariatische Eigenschaften gegen chloroquinresistente Stämme von Plasmodium falciparum aufweist.[50]
-
Ferroquin
-
Chloroquin
Wie andere Hämatin-Biokristallisationsinhibitoren bildet es einen Komplex mit Ferriprotoporphyrin IX, der die Bildung von β-Hämatin unterdrückt. Beim intrazellulären pH-Wert ist Ferroquin jedoch lipophiler als Chloroquin und kann nicht aus der Verdauungsvakuole des Erregers herausgepumpt werden. Dadurch wird der Resistenzmechanismus gegen Chloroquin umgangen.[50]
Weitere Ferrocen-modifizierte Analoga von Arzneistoffen wurden zur Therapie verschiedener Krebsarten untersucht. Dazu zählen Ferrocifene, eine Gruppe von Ferrocen-modifizierten Verbindungen, die der Struktur von Tamoxifen ähneln, sowie Ferrocenyl-Retinoide und -Peptide.[51] Molekulare Modellierungsstudien zeigten, dass bestimmte Ferrocifene eine antiöstrogene Bindung mit dem Estrogenrezeptor-α (ER-α) bilden. Diese antiöstrogene Wirkung führt zu einer Hemmung des Wachstums von MCF-7-Zellen.[52] Für keine dieser Verbindungen lagen bis 2022 klinische Studien vor. Die Ferrocen-Analoga weiterer Wirkstoffe, wie etwa die von Salicylsäure und Aspirin, wurden zwar synthetisiert, doch fanden sie keine Verwendung als Arzneimittel.[53]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Bei intraperitonealer Applikation liegt die letale Dosis (LD50) bei der Ratte bei 500 Milligramm pro Kilogramm.[54] Bei oraler Applikation liegt der Wert bei 1320 Milligramm pro Kilogramm.[1] Substituierte Ferrocene besitzen mitunter eine höhere akute Toxizität. Die tödliche orale Dosis von Acetylferrocen bei weiblichen Ratten betrug zum Beispiel weniger als 5 Milligramm pro Kilogramm. Acetylferrocen war beim Kontakt mit der Haut oder den Augen hoch toxisch. Bei der pathologischen Untersuchung wurden Anzeichen einer Entzündung des Lungengewebes festgestellt.[55]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Literatur
[Bearbeiten | Quelltext bearbeiten]- A. Togni, T. Hayashi: Ferrocenes: Homogeneous Catalysis, Organic Synthesis, Materials Science. VCH Verlagsgesellschaft, Weinheim, 1995, ISBN 978-3-527-29048-2.
- Petr Stepnicka (Hrsg.): Ferrocenes: Ligands, Materials and Biomolecules. John Wiley & Sons, Chichester, 2008, ISBN 978-0-470-03585-6.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i Eintrag zu Ferrocen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Sicherheitsdatenblatt von Ferrocen bei Merck Millipore.
- ↑ Eintrag zu Ferrocen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. April 2014.
- ↑ a b c Helmut Werner: At Least 60 Years of Ferrocene: The Discovery and Rediscovery of the Sandwich Complexes. In: Angewandte Chemie International Edition. 51.25, 2012, S. 6052–6058, doi:10.1002/anie.201201598.
- ↑ a b Thomas J. Kealy, Peter L. Pauson: A New Type of Organo-Iron Compound. In: Nature. Band 168, Nr. 4285, 1951, S. 1039–1040, doi:10.1038/1681039b0.
- ↑ Samuel A. Miller, John A. Tebboth, John F. Tremaine: 114. Dicyclopentadienyliron. In: Journal of the Chemical Society. 1952, S. 632–635, doi:10.1039/JR9520000632.
- ↑ J. I. Seeman, S. Cantril: Wrong but seminal. In: Nature Chemistry. 8.3, 2016, S. 193–200, doi:10.1038/nchem.2455.
- ↑ a b P. L. Pauson: Ferrocene—how it all began. In: Journal of Organometallic Chemistry. 637–639, 2001, S. 3–6, doi:10.1016/s0022-328x(01)01126-3.
- ↑ S. Swaminathna, S. Ranganathan: The Chemistry of ferrocene and related Compounds. In: Current Science. 25.1, 1956, S. 6–8, JSTOR:24065460.
- ↑ P. Lazlo, R. Hoffmann: Ferrocen: objektive Geschichte oder eine Rashomon-Erzählung? In: Angewandte Chemie. 112.1, 2000, S. 127–128, doi:10.1002/(sici)1521-3757(20000103)112:1<127::aid-ange127>3.0.co;2-2.
- ↑ E. O. Fischer, R. Jira: Notizen: Di-cyclopentadienyl-kobalt (II). In: Zeitschrift für Naturforschung B. 8.6, 1953, S. 327–328, doi:10.1515/znb-1953-0615.
- ↑ E.O. Fischer, R. Jira: Di-cyclopentadienyl-nickel. In: Zeitschrift für Naturforschung B. 8.5, 1953, S. 217–219, doi:10.1515/znb-1953-0501.
- ↑ R. B. Woodward, M. Rosenblum, M. C. Whiting: A New Aromatic System. In: J. Am. Chem. Soc. Band 74, Nr. 13, 1952, S. 3458–3459, doi:10.1021/ja01133a543 (englisch).
- ↑ Eberhard W. Neuse: Ferrocene-containing Polymers: Polycondensation of Ferrocene with Aldehydes. In: Nature. 204, 1964, S. 179–180.
- ↑ Arthur Lüttringhaus, W. Kullick: Ansa-Ferrocene. In: Angewandte Chemie, 70, 1958, S. 438, doi:10.1002/ange.19580701407.
- ↑ T. A. Beliakova, L. S. Leshchev: Use of ferroceron for the treatment of iron deficiency anemia. In: Terapevticheskii arkhiv. 47.6, 1975, S. 115–119, PMID 1188626.
- ↑ V. J. Fiorina, R. J. Dubois, S. Brynes: Ferrocenyl polyamines as agents for the chemoimmunotherapy of cancer. In: Journal of Medicinal Chemistry. 21.4, 1978, S. 393–395, doi:10.1021/jm00202a016.
- ↑ T. Muraoka, K. Kinbara, Y. Kobayashi, T. Aida: Light-Driven Open−Close Motion of Chiral Molecular Scissors. In: Journal of the American Chemical Society. 125.19, 2003, S. 5612–5613. doi:10.1021/ja034994f.
- ↑ a b William L. Jolly: Bis(cyclopentadienyl)iron (Ferrocene). In: William L. Jolly (Hrsg.): Inorganic Syntheses. Band 11. McGraw-Hill Book Company, Inc., 1968, S. 120–122 (englisch).
- ↑ a b c G. Wilkinson, F. A. Cotton, J. M. Birmingham: On manganese cyclopentadienide and some chemical reactions of neutral bis-cyclopentadienyl metal compounds. In: Journal of Inorganic and Nuclear Chemistry. 2.2, 1956, S. 95–113, doi:10.1016/0022-1902(56)80004-3.
- ↑ R. Riemenschneider, D. Helm: Über Ferrocen und verwandte Verbindungen.. In: Zeitschrift für Naturforschung B. 14.12, 1959, S. 811–814, doi:10.1515/znb-1959-1211.
- ↑ G. Wilkinson, F. A. Cotton: Cyclopentadienyl and Arene Metal Compounds. In: Progress in Inorganic Chemistry. 2007, S. 1–124, doi:10.1002/9780470166024.ch1.
- ↑ C. P. Brock, Y. Fu: Rigid-Body Disorder Models for the High-Temperature Phase of Ferrocene. In: Acta Crystallographica Section B Structural Science. 53.6, 1997, S. 928–938, doi:10.1107/s0108768197005132.
- ↑ Zhong Jin: Asymmetric C–H Functionalization of Ferrocene. In: Debabrata Maiti: Handbook of CH-Functionalization. Wiley‐VCH GmbH, 2022, ISBN 978-3-527-83424-2, S. 1–44, doi:10.1002/9783527834242.
- ↑ Didier Astruc: Why is Ferrocene so Exceptional? In: European Journal of Inorganic Chemistry. Band 2017, Nr. 1, 3. Januar 2017, S. 6–29, doi:10.1002/ejic.201600983.
- ↑ Jack D. Dunitz, Leslie Orgel, Alexander Rich: The Crystal Structure of Ferrocene. In: Acta Crystallographica. Band 9, Nr. 4, 1956, S. 373–375, doi:10.1107/S0365110X56001091.
- ↑ A. Kubo, R. Ikeda, D. Nakamura: Motion of C5H5 Rings in three Crystalline Modifications of Ferrocene as studied by 1H-NMR. In: Chemistry Letters. 10.10, 1981, S. 1497–1500, doi:10.1246/cl.1981.1497.
- ↑ Paul Seiler, Jack D. Dunitz: A new interpretation of the disordered crystal structure of ferrocene. In: Acta Crystallographica Section B. Band 35, Nr. 5, 1979, S. 1068–1074, doi:10.1107/S0567740879005598.
- ↑ Paul Seiler, Jack D. Dunitz: The structure of triclinic ferrocene at 101, 123 and 148 K. In: Acta Crystallographica Section B. Band 35, Nr. 9, 1979, S. 2020–2032, doi:10.1107/S0567740879008384.
- ↑ a b N. Mohammadi, A. Ganesan, C. T. Chantler, F. Wang: Differentiation of ferrocene D5d and D5h conformers using IR spectroscopy. In: Journal of Organometallic Chemistry. 713, 2012, S. 51–59, doi:10.1016/j.jorganchem.2012.04.009.
- ↑ a b c Li-Xin Dai, Xue-Long Hou (Hrsg.): Chiral Ferrocenes in Asymmetric Catalysis. Wiley VCH, Weinheim, 2010, ISBN 978-3-527-32280-0, S. 6–7.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 84. Auflage. (Internet-Version: 2003–2004), CRC Press / Taylor and Francis, Boca Raton FL, Physical constants of organic compounds, S. 3-282 – 3-283 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H.-M. Koepp, H. Wendt, H. Stkehlow: Der Vergleich der Spannungsreihen in verschiedenen Solventien. II. In: Zeitschrift für Elektrochemie, Berichte der Bunsengesellschaft für physikalische Chemie, 64.4, S. 483–491, 1960, doi:10.1002/bbpc.19600640406 (Abstract).
- ↑ Jochen Kieniger: Electrochemical laboratory. In: Jochen Kieninger: Electrochemical Methods for the Micro- and Nanoscale. Theoretical Essentials, Instrumentation and Methods for Applications in MEMS and Nanotechnology. De Gruyter, 2022, doi:10.1515/9783110649758, S. 118.
- ↑ G. Gritzner, J. Kůta: Recommendations on reporting electrode potentials in nonaqueous solvents. In: Electrochimica Acta. 29.6, 1984, S. 869–873, doi:10.1016/0013-4686(84)80027-4.
- ↑ V. V. Pavlishchuk, A. W. Addison: Conversion constants for redox potentials measured versus different reference electrodes in acetonitrile solutions at 25 °C. In: Inorganica Chimica Acta. 298.1, 2000, S. 97–102, doi:10.1016/s0020-1693(99)00407-7.
- ↑ Indra Noviandri, Kylie N. Brown, Douglas S. Fleming, Peter T. Gulyas, Peter A. Lay, Anthony F. Masters, Leonidas Phillips: The Decamethylferrocenium/Decamethylferrocene Redox Couple: A Superior Redox Standard to the Ferrocenium/Ferrocene Redox Couple for Studying Solvent Effects on the Thermodynamics of Electron Transfer. In: The Journal of Physical Chemistry. Band 103, Nr. 32, 1999, S. 6713–6722, doi:10.1021/jp991381+.
- ↑ M. D. Rausch: Ferrocene and Related Organometallic π-Complexes. IV. Some Ullmann Reactions of Haloferrocenes. In: The Journal of Organic Chemistry. 26.6, 1961, S. 1802–1805, doi:10.1021/jo01065a026.
- ↑ D. O. Cowan, C. LeVanda, J. Park, F. Kaufman: Organic solid state. VIII. Mixed-valence ferrocene chemistry. In: Accounts of Chemical Research. 6.1, 1973, S. 1–7, doi:10.1021/ar50061a001.
- ↑ Ionel Haiduc: Organometallic Chemistry. Fundamentals and Applications. De Gruyter, 2022, doi:10.1515/9783110695274, S. 237–242.
- ↑ Norman Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlag, Weinheim 1988, ISBN 3-527-26169-9, S. 408–409.
- ↑ a b c d e Karl Schlögl: Stereochemie von Metallocenen. In: K. Weinges, L. Dulog, K. Schlögl: Stereochemie. Topics in Current Chemistry, Springer Berlin, Heidelberg, 1966, ISBN 978-3-540-03509-1, S. 479–514.
- ↑ Eckart W. Schmidt: Perchlorate Oxidizers. In: Eckart W. Schmidt: Encyclopedia of Oxidizers. De Gruyter, 2022, doi:10.1515/9783110750294, S. 3548.
- ↑ Hans-Ulrich Blaser: Industrielle asymmetrische Hydrierung „Made in Switzerland“. In: Nachrichten aus der Chemie. 58, 2010, S. 864–867.
- ↑ B. M. Trost: Asymmetric catalysis: An enabling science. In: Proceedings of the National Academy of Sciences. 101.15, 2004, S. 5348–5355, doi:10.1073/pnas.0306715101.
- ↑ H. Jungbluth, G. Lohmann: Ferrocen als Additiv für Mineralölprodukte. In: Nachrichten aus Chemie, Technik und Laboratorium. 47.5, 1999, S. 532–536, doi:10.1002/nadc.19990470510.
- ↑ A. Demirbas, M. A. Balubaid, A. M. Basahel, W. Ahmad, M. H. Sheikh: Octane Rating of Gasoline and Octane Booster Additives. In: Petroleum Science and Technology. 33.11, 2015, S. 1190–1197, doi:10.1080/10916466.2015.1050506.
- ↑ B. N. Jha, N. Singh, A. N. Sahay, A. Raghuvanshi: Scope of Ferrocene in Cathodic Materials of Lithium-Ion Batteries (LIBs): A Review. In: Journal of Electronic Materials. 50.11, 2021, S. 6073–6086, doi:10.1007/s11664-021-09176-0.
- ↑ M. Patra, G. Gasser: The medicinal chemistry of ferrocene and its derivatives. In: Nature Reviews Chemistry. 1.9, 2017, doi:10.1038/s41570-017-0066.
- ↑ a b T. A. Abubakar, U. B. Eke, A. Salisu: Bioorganometllic Ferroquine and related Compound as antimalarial chemotherapeutic Agents: A short Review. In: Journal of Chemical Society of Nigeria. 47.3, 2022, doi:10.46602/jcsn.v47i3.758.
- ↑ Shahid-ul-Islam, Athar Adil Hashmi, Salman Ahmad Khan (Hrsg.): Advances in Metallodrugs. John Wiley & Sons, Hoboken, 2020, ISBN 978-1-119-64042-4, S. 131–132.
- ↑ G. Jaouen, A. Vessières, S. Top: Ferrocifen-type anti cancer drugs. In: Chemical Society Reviews. 44.24, 2015, S. 8802–8817, doi:10.1039/c5cs00486a.
- ↑ R. Epton, G. Marr, G. K. Rogers: The ferrocene analogues of salicylic acid and aspirin. In: Journal of Organometallic Chemistry. 110.2, 1976, S. C42–C44, doi:10.1016/s0022-328x(00)89702-8.
- ↑ RTECS:LK0700000 - Ferrocene - The Registry of Toxic Effects of Chemical Substances | CDC/NIOSH. In: cdc.gov. 28. März 2018, abgerufen am 3. Juni 2024 (englisch).
- ↑ L. Hon-Wing u. a.: Toxicological evaluation of substituted dicyclopentadienyliron (ferrocene) compounds. In: Toxicology Letters. 38.1–2, 1987, S. 103–108, doi:10.1016/0378-4274(87)90117-2.
- Feuergefährlicher Stoff
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 40
- Gesundheitsschädlicher Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Einatmen
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Wikipedia:Lesenswert
- Eisenverbindung
- Cyclopentadien
- Metallocen
- Kraftstoffzusatz







![{\displaystyle {\ce {8 KOH + 2 C5H6 + FeCl2 * 4 H2O ->[N_2][] Fe(C5H5)2 + 2 KCl + 6 KOH * H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/567c1c701f62dc8a1b05d49a667c68bed8838acd)




![{\displaystyle {\ce {[Fe(C5H5)2] + 2 LiC4H9 -> [Fe(C5H4Li)2] + 2 C4H10}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6ac321d2a232586cbace7b05871312ff687b50a0)
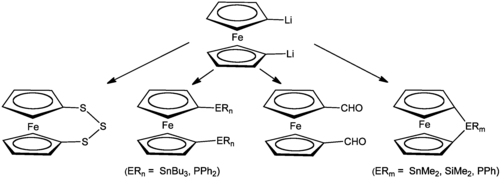
![{\displaystyle {\ce {[Fe(C5H5)2]+ + e- <=> [Fe(C5H5)2];_E0 = 0,400 V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/272212725fbe72dbc296eef628a8103c9aa3fb13)

![{\displaystyle {\ce {[Fe(C5H5)2] + C6H6 ->[Al/AlCl3] [Fe(C5H5)(C6H6)]+ Cl-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cdd1ef8d470e89c66b638f677c156696ceea140)
![{\displaystyle {\ce {[Fe(C5H5)2] + SC4H4 ->[Al/AlCl3] [Fe(C5H5)(SC4H4)]+ Cl-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ecf613140d7a49b2ca3b8fbe398c7137249ead7)