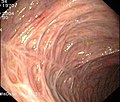
Colitis ulcerosa
| Klassifikation nach ICD-10 | |
|---|---|
| K51.- | Colitis ulcerosa |
| K51.0 | Ulzeröse (chronische) Enterokolitis |
| K51.1 | Ulzeröse (chronische) Ileokolitis |
| K51.2 | Ulzeröse (chronische) Proktitis |
| K51.3 | Ulzeröse (chronische) Rektosigmoiditis |
| K51.4 | Pseudopolyposis des Kolons |
| K51.5 | Proktokolitis der Schleimhaut |
| K51.8 | Sonstige Colitis ulcerosa |
| K51.9 | Colitis ulcerosa, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Die Colitis ulcerosa (auch ulzerative Kolitis und ulzeröse Kolitis) ist eine meist vom Enddarm ausgehende chronisch-entzündliche Darmerkrankung. Sie ist durch einen entzündlichen Befall des Dickdarms gekennzeichnet und verläuft in Schüben. Im Gegensatz zum Morbus Crohn ist von der Entzündung nur der Dickdarm kontinuierlich betroffen und diese ist auf die Darmschleimhaut (Mukosa) und die darunter liegende Bindegewebsschicht (Submukosa) beschränkt.
Häufigkeit
Etwa 160 bis 250 von 100.000 Einwohnern in der westlichen Welt leiden an einer Colitis ulcerosa, wobei es in Deutschland 3 bis 3,9 Neuerkrankungen pro Jahr unter 100.000 Einwohnern gibt.[1] Die Zahl der Erkrankten in der BRD wird auf über 150.000 geschätzt.[2] Die höchste Prävalenz wurde in Norwegen (505 pro 100.000), in Kanada (319 pro 100.000) und in den USA (286 pro 100.000) festgestellt.[3] Frauen und Männer sind gleich häufig betroffen. Das typische Erkrankungsalter liegt zwischen dem 20. und 40. Lebensjahr. Nachdem die Krankheitshäufigkeit (Prävalenz) in Nordamerika und Europa über Jahrzehnte gestiegen ist, beginnt sie dort zu stagnieren. In Asien, Afrika und Südamerika, wo die Erkrankung früher selten war, ist allerdings ein deutlicher Anstieg der Neuerkrankungen zu bemerken.
Klassifikation

Die S3-Leitlinie empfiehlt, eine Einteilung nach dem Befallsmuster vorzunehmen („Montreal-Klassifikation“[4]):[5]
- E1: Proktitis, limitiert auf das Rektum (distal des rektosigmoidalen Übergangs)
- E2: Linksseitencolitis, Befall bis zur linken Flexur
- E3: Ausgedehnte Colitis, Ausdehnung über die linke Flexur hinaus bis zur Pancolitis
Eine Einteilung nach der Ausdehnung ist aus folgenden Gründen sinnvoll: Zäpfchen wirken nur im Rektum (E1), nicht aber in höheren Colonregionen. Mit Einläufen erreicht man das linksseitige Colon (E2). Bei generalisiertem Befall sind lokale Therapien allein nicht ausreichend. Auch entscheidet die Ausdehnung über das Ausmaß der endoskopischen Überwachung.[5]
In manchen Fällen greift die Entzündung auch auf das terminale Ileum über („Backwash-Ileitis“), was eine Unterscheidung der Ileocolitis Crohn erschwert.[6]
Ein weiteres Klassifikationsmerkmal ist das gleichzeitige Vorliegen einer primär sklerosierenden Cholangitis (PSC). Die Kombination von Colitis ulcerosa und PSC bedeutet ein wesentlich höheres Risiko, ein Dickdarmkarzinom zu entwickeln. Das muss bei den Empfehlungen zur endoskopischen Überwachung berücksichtigt werden.[7]
Ätiologie und Pathogenese
Die Ursache der Erkrankung ist unbekannt. Ähnlich wie beim Morbus Crohn nimmt man eine genetisch prädisponierte, krankhaft gesteigerte Immunreaktion gegen die Darmflora an. Es handelt sich in beiden Fällen um eine chronisch entzündliche, in Schüben verlaufende Darmerkrankung.[6][8] Es konnten mehrere Genmutationen identifiziert werden, die mit dem Auftreten von chronisch-entzündlichen Darmerkrankungen in Verbindung stehen. Wie bei Morbus Crohn steht der NF-κB-Transkriptionsfaktor im Verdacht, durchgängig aktiv zu sein. Umweltfaktoren wie Hygienestandard und Ernährung sollen eine ebenso wichtige Rolle spielen. Stress und Belastungen können wesentlich zu einem schwierigen Verlauf beitragen und aktive Schübe der Krankheit auslösen.
In der medizinischen Forschung wird abgebautes Carrageen verwendet, um die Krankheit in Tiermodellen an z. B. Ratten und Hamstern künstlich auszulösen.[9][10]
Colitis ulcerosa wurde über einen langen Zeitraum ähnlich wie Morbus Crohn zu den psychosomatischen Krankheiten gezählt, sie gehört zu den Holy Seven. Mittlerweile ist allerdings klar, dass die Colitis ulcerosa durch die genannten organischen Ursachen hervorgerufen wird, und dass die Psychosomatik allenfalls Begleit- und Folgeerscheinungen beeinflusst.[11]
Symptome/Beschwerden
Klinisch stehen wiederkehrende (rezidivierende) Diarrhoen, Darmblutungen und Koliken im Vordergrund. Der Verlauf der Colitis ulcerosa ist nicht vorhersehbar. Häufig ist der Beginn schleichend. Es gibt aber auch akute Phasen und schwerste Verläufe.
Problematisch im Alltag sind Stuhlinkontinenz und zwanghafte Stuhlgänge, die körperliche Schwächung an sich sowie Begleiterkrankungen und die Nebenwirkung der verabreichten Medikamente. Starke Blähungen können im Schub zur erhöhten Stuhlfrequenz führen. Die schubabhängigen Blähungen liegen teils an einer schubbedingten Zuckerunverträglichkeit (etwa Lactose, Fructose, Sorbit). Krankheitsspezifische Symptome (wie Durchfälle) können stark in den Alltag der betroffenen Personen eingreifen.[12] Häufig entwickeln sich zudem Ängste und Depressionen. Entsprechend ist die Lebensqualität der Betroffenen oft verringert.[13] Auch psychischer Stress kann den Krankheitsverlauf negativ beeinflussen.[14] Hinsichtlich dieser unterschiedlichen Problemlagen ist es bei der Krankheitsbewältigung wichtig, die gesamte Lebenssituation in den Blick zu nehmen.[12]
Manifestationen außerhalb des Verdauungsbereichs (extraintestinal):
- ankylosierende Spondylitis (1–26 %)
- Arthritis peripherer Gelenke mit wanderndem Befall großer Gelenke (11 %)
- Augenhautentzündung Episkleritis (1,5–4 %)
- Erythema nodosum (14–19 %)
- Osteoporose (7–18 %) oder Osteopenie (34–67 %)
- PSC (primär sklerosierende Cholangitis) (2–10 %)
- Pyoderma gangraenosum (1–2 %)
- Sakroiliitis (bis zu 24 %)
- Uveitis (Iritis/Iridocyclitis)
Akuter Schub
Der akute Schub einer Colitis ulcerosa ist durch die typischen klinischen Beschwerden, das heißt blutige Diarrhoe und gegebenenfalls beständigen schmerzhaften Harn- und Stuhldrang (Tenesmus) charakterisiert. Stuhlfrequenzen von etwa 40-mal innerhalb 24 Stunden sind keine Seltenheit.

Fulminanter Schub
Bei einem schweren (fulminanten) Schub treten häufig blutige Durchfälle (Diarrhoe), Fieber über 38,5 °C und ein reduzierter Allgemeinzustand sowie Gewichtsabnahme auf. Zusätzlich kann es zu Herzrasen (Tachykardie) und Blutarmut (Anämie) kommen. Als weitere Komplikation ist das toxische Megakolon zu nennen.[15]
Chronisch aktiver Verlauf
Ein chronisch aktiver Verlauf ist gekennzeichnet durch ein Fortbestehen (Persistenz) der klinischen Symptome trotz einer angemessenen medikamentösen Therapie, die zwar eine Besserung, jedoch keine vollständige und dauerhafte (weniger als zwei Rezidive, also erneute Schübe, pro Jahr) Remission bewirkt.
Häufig entwickelt sich bei chronisch aktiven Verläufen eine Abhängigkeit von Medikamenten. Nach einiger Zeit wirken sie schwächer oder können nicht unter einem bestimmten Wert dosiert werden, ohne dass sofort wieder starke Probleme auftreten. Man spricht dann von einem refraktären (nicht ansprechenden) Verlauf.
Remission
Von einer Remission der Colitis ulcerosa wird gesprochen, wenn keine Diarrhoe (nicht mehr als drei Stühle täglich), kein sichtbares Blut im Stuhl sowie keine durch die Colitis ulcerosa bedingten Beschwerden vorliegen.[5]
Diagnostik/Differentialdiagnosen
- Endoskopische Befunde bei Colitis ulcerosa
-
Floride (blühende = aktive) Colitis ulcerosa
-
Narbenstadium einer Colitis ulcerosa
Endoskopie
Die Diagnose Colitis ulcerosa kann nur durch eine Darmspiegelung (Koloskopie) mit Probeentnahmen (Biopsie) und anschließender feingeweblicher (histologischer) Untersuchung gestellt werden.
Differenzialdiagnostisch sind Erkrankungen mit ähnlichen endoskopischen Befunden abzugrenzen, insbesondere der Morbus Crohn, weiterhin eine infektiös oder medikamentös bedingte Kolitis, eine pseudomembranöse Kolitis, eine ischämische Kolitis oder eine Divertikelkolitis.
Labor
Erhöhtes CRP, erhöhte Blutsenkung und Leukozytose werden als Zeichen der Entzündung vorgefunden, eventuell eine Anämie als Folge der Blutung. In 60 % der Fälle findet man antineutrophile cytoplasmatische Antikörper, dabei perinukleäres Fluoreszenzmuster (p-ANCA).
Pathologie/Morphologie

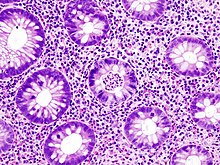
- Bei einem milden Verlauf kommt es zur ödematösen Schwellung der Darmschleimhaut.
- Bei mittleren Verlaufsformen kommt es zu leichten Blutungen und Geschwürsbildungen.
- Bei schweren Verläufen kommt es zu großflächigen Geschwürsbildungen, die zum Verlust des Reliefs und zur Schleimhautabflachung führen. Durch überschießende Regeneration kommt es zur Bildung von Pseudopolypen. Feingeweblich (histologisch) fallen Lymphozyten und Histiozyten auf, während die Zahl der Becherzellen stark vermindert ist. Als typisch, wenn auch nicht beweisend, gelten Kryptenabszesse.
- Im akuten schwersten Verlauf kann es zur toxischen Dickdarmerweiterung kommen. Dabei findet sich eine Überblähung des Bauchraumes und eine Bauchfellentzündung, außerdem besteht die Gefahr einer Perforation, weshalb jegliche invasive Diagnostik kontraindiziert ist.
Karzinom-Risiko
Nach längerer Erkrankungszeit und ausgedehntem Krankheitsverlauf (8–10 Jahre bei Befall des gesamten Kolons, 12–15 Jahre nach linksseitiger Kolitis) besteht ein erhöhtes Risiko für eine bösartige (maligne) Entartung. Neben der Dauer der Erkrankung stellt die Ausdehnung der Colitis ulcerosa einen eindeutigen Risikofaktor für die Entstehung eines Dickdarmkrebses (kolorektalen Karzinoms) dar und wird deshalb auch als sogenannter Vorkrebs (Präkanzerose) betrachtet.
Endoskopische Tumor-Vorsorge
Bei regelmäßigen koloskopischen Kontrollen mit Stufenbiopsien (Gewebeprobenentnahme aus mehreren Abschnitten des Kolons) ist das Kolitis-Karzinom selten (2,1 % nach einer Erkrankungsdauer von zehn Jahren, bei 8,5 % nach 20 Jahren und bei 17,8 % nach 30 Jahren). Es sollte daher eine jährliche Koloskopie mit Stufenbiopsien bei Patienten mit (sub-)totaler Colitis ulcerosa, die mehr als acht Jahre besteht, oder linksseitiger Colitis, die mehr als 15 Jahre besteht, durchgeführt werden.
Therapie
Allgemeine Strategie
Grundsätzlich sollte nach der aktuellen Leitlinie behandelt werden.[5] Die Krankheit verläuft in Schüben mit zwischenzeitlichen Remissionen. Schübe kündigen sich durch vermehrte Durchfälle, Tenesmen und erhöhte Entzündungsparameter an. Je besser die Behandlung eines Schubes gelingt, umso länger sind die durchschnittlichen Remissionszeiten. Ziel der Behandlung eines Schubes ist vor allem, eine Remission ohne Dauerbehandlung mit Glucocorticoiden zu erzielen. Gelingt dieses nicht, so handelt es sich um einen Steroid-abhängigen Verlauf mit zahlreichen Nebenwirkungen.[16] Die Behandlung eines akuten Schubes enthält 5-Aminosalizylsäure(= 5-ASA oder deren Derivate) und Glucocorticoide. Gelingt es damit nicht, eine Remission zu erzielen, so handelt es sich um einen Steroid-refraktären Schub, der einer intensiveren Behandlung bedarf. Zur intensivierten Therapie können vor allem TNF-Inhibitoren, Calcineurin-Inhibitoren und andere Immunsuppressiva eingesetzt werden. In der Remission sollte eine Erhaltungstherapie mit dem Ziel durchgeführt werden, die Zeit bis zum nächsten Schub zu verlängern und die Symptomatik des Patienten zu minimieren. Bei einem fulminanten, therapieresistenten Schub, einer bedrohlichen Komplikation oder anderen Gründen kann eine Proktokolektomie erforderlich sein.
5-ASA
Mesalazin (auch 5-Aminosalicylsäure, 5-ASA) und deren Derivate (Sulfasalazin, Olsalazin, Balsalazid) werden sowohl zur Behandlung des Schubes[17] als auch in der Erhaltungstherapie in der Remission[18] angewendet. Es kann oral als magensaftresistente Tablette oder als magensaftresistente Mikrogranula verabreicht werden. Die magensaftresistente Galenik der oralen Präparate soll verhindern, dass die Medikamente bereits im Magen ihre Wirkung entfalten, was Nebenwirkungen in Form einer Gastritis oder eines Magengeschwürs bewirken kann. Als COX-Hemmer wirkt 5-ASA lokal antientzündlich. Zusätzlich vermindern 5-ASA-Derivate die Häufigkeit von kolorektalen Karzinomen.[19] Mit einer rektalen Applikation vermeidet man den Kontakt mit Magen und Dünndarm, was höhere Wirkstoffkonzentrationen im entzündeten Dickdarmbereich erlaubt. Zäpfchen oder Schaum sind vor allem bei Befall des Rektums geeignet. Mit Einläufen erreicht man auch Sigma und linksseitiges Colon. Bei komplettem Befall ist eine orale Applikation erforderlich. Bei Mesalazin-Unverträglichkeit weicht man in der Regel auf Sulfasalazin (= SAPS) aus. Bei der Erhaltungstherapie erwies sich Sulfasalazin sogar Mesalazin überlegen.[18] Wegen der häufigeren Nebenwirkungen sollte jedoch Mesalazin als erstes eingesetzt werden.[5]
Glucocorticoide
Wenn das 5-ASA nicht ausreicht, wird zunächst Glucocorticoid örtlich (rektal als Einlauf bzw. Schaum oder oral als Tablette mit MMX-Galenik) oder systemisch (oral oder intravenös) für kurze Zeit eingesetzt. Ist die Erkrankung auf den Enddarm und das Colon sigmoideum begrenzt, bringt Budesonid-Schaum gegenüber anderen Glucocorticoidpräparaten den Vorteil, dass es nur örtlich und kaum im übrigen Organismus wirkt. Es wird bei der ersten Leberpassage abgebaut.
TNF-Inhibitoren
Folgende TNF-α-Antikörper wurden in randomisierten Studien bei der Colitis ulcerosa getestet:
- Infliximab
- Adalimumab
- Golimumab
Studien (ACT 1 und ACT 2) haben auch eine Wirksamkeit des TNF-Blockers Infliximab bei Colitis ulcerosa nachgewiesen. Dieses Medikament wird auch klinisch bei Colitis ulcerosa eingesetzt. Die medikamentös nicht heilbare Colitis ulcerosa ist eine Erkrankung, die (bis auf die extraintestinalen Symptome) durch eine totale Dickdarmentfernung (Kolektomie) geheilt werden kann. Als Faustregel kann Infliximab bei Patienten eingesetzt werden, die einer Operation gegenüber eher ablehnend eingestellt sind, und wenn Ciclosporin kontraindiziert ist. Bei Infliximab handelt es sich um ein Immunsuppressivum. Die Behandlung sollte aber, wenn möglich, mit einem weiteren immunsuppressiven Präparat (etwa Azathioprin) kombiniert werden. Die Verabreichung ist wie beim Morbus Crohn im Abstand von zwei und vier Wochen, wenn eine Dauertherapie notwendig ist, alle acht Wochen.
Darüber hinaus ist seit April 2012 als weitere Therapieform der TNF-alpha-Blocker Adalimumab (Handelsname Humira®; Hersteller AbbVie) zugelassen. Dabei handelt es sich um einen humanen monoklonalen Antikörper vom Typ IgG1, der sich ähnlich wie Infliximab hochspezifisch an das Zytokin Tumornekrosefaktor-alpha (TNF-α) bindet und seine Wirkung neutralisiert. Im Gegensatz zu vielen anderen Antikörpern wurde Adalimumab durch Phagen-Display aus einer Bank humaner Immunglobulinsequenzen identifiziert. Adalimumab ist somit ein „vollständig humaner“ Antikörper. 2013 folgte die Zulassung des ebenfalls humanen Golimumab (Handelsname Simponi®; Hersteller Centocor). Beide TNF-alpha-Blocker werden subcutan injiziert und bieten diesen Vorteil gegenüber Infliximab, das nur per Infusion verabreicht werden kann.
Calcineurin-Inhibitoren
Die Calcineurin-Inhibitoren Ciclosporin A und Tacrolimus wurde bei der Colitis ulcerosa allein oder in Kombination z. B. mit TNF-Inhibitoren eingesetzt.
Januskinase-Inhibitoren
Tofacitinib hemmt JAK1 und Jak3. Es kann bei der intensivierten Behandlung des Steroid-refraktärer Schubes eingesetzt werden.[20][21]
Sonstige Immunsuppressiva
Ist eine längerfristige Immunsuppression sinnvoll, sollte zunächst Azathioprin eingesetzt werden. Bei Unverträglichkeit kann auf 6-Mercaptopurin ausgewichen werden. Daneben stehen weitere Reservemedikamente aus der Gruppe der Antimetabolite Methotrexat (MTX) zur Verfügung. Diese kommen bei Patienten in Betracht, die auf Glucocorticoide nicht oder nicht ausreichend ansprechen und bei denen Azathioprin keine Wirkung zeigt, sowie in schwer verlaufenden Fällen oder auch begleitend zu Therapiebeginn mit Azathioprin.
Probiotika
E-Coli-Alfred Nissle-1917-Bakterien (EcN): Diese probiotischen Bakterien sind unter dem Namen Mutaflor in Apotheken erhältlich und haben sich bei der Remissionserhaltung in mehreren Studien als wirksamer Ersatz von 5-ASA-Präparaten wie Mesalazin erwiesen.[20] Dennoch wird Mesalazin häufiger gegenüber EcN in der klinischen Praxis bevorzugt, da sowohl die Datenlage größer ist als es auch einen zusätzlichen karzinompräventiven Effekt entfaltet. In der Induktionstherapie konnte keine Gleichwertigkeit gegenüber Mesalazin gezeigt werden.[20]
Mutaflor wird bei Mesalazinunverträglichkeit von den Krankenkassen übernommen.[22] Das Präparat muss ständig, auch beim Transport, gekühlt werden und ist nur einige Monate haltbar.
Antikoagulantien
Je nach Intensität eines akuten Schubes besteht ein erhöhtes Risiko für thromboembolische Komplikationen. Daher wird bei höhergradigen Schüben grundsätzlich eine Behandlung mit Gerinnungshemmern empfohlen.[5]
Medikamentöse Therapie außerhalb der Leitlinie
Seit Mai 2014 ist Vedolizumab (Handelsname Entyvio; Hersteller Takeda), ein humanisierter monoklonaler Antikörper aus der Gruppe der Integrin-Antagonisten, zur Behandlung von Colitis ulcerosa oder Morbus Crohn zugelassen.[23][24][25]
Es befinden sich zahlreiche weitere Medikamente in der Zulassung und werden daher derzeit (2008) nur im Rahmen von Studien verwendet, viele zunächst für Morbus Crohn und evtl. später für Colitis ulcerosa, etwa Biologika, die verträglicher sein sollen als Infliximab und zum Teil auch einfacher zu verabreichen sind (etwa subkutan und ohne Gewichtsanpassung), außerdem einige schon länger bekannte Wirkstoffe, deren Wirksamkeit für die Colitis erst erkannt wird: Certolizumab, Etanercept, Basiliximab, Daclizumab, Visilizumab, Mycophenolat-Mofetil (MMF), 6-Thioguanin, Heparin, Dehydroepiandrosteron (DHEA). In der Diskussion als mögliches Medikament befindet sich auch Thalidomid.
Antibiotika finden kaum Verwendung. Lediglich Ciprofloxacin und Metronidazol konnten in bestimmten Fällen in Studien Linderung bringen. Schwere Schübe werden in Krankenhäusern oft zusätzlich zur bisherigen Medikation mit einer Kombination aus Antibiotika und hochdosiertem Cortison behandelt.
Chirurgische Therapie
Erste spezielle Operationsverfahren zur Behandlung der Kolitis wurden um 1900[26] durchgeführt.[27]
In fortgeschrittenen (Pancolitis) oder schwereren Fällen bei Komplikationen wie dem toxischen Megakolon kann eine Operation nötig werden. Dies bedeutet in der Regel eine vollständige Entfernung des Dickdarms (Proktokolektomie), gefolgt von einer Operation, die ileoanale Pouch-Operation genannt wird.[5] Die restaurative Proktokolektomie ist mittlerweile eine Standardoperation, Ziel ist die Wiederherstellung der gastrointestinalen Kontinuität und Erhalt der Kontinenzfunktion. Wenn ein Adenokarzinom des Darmes vorliegt, ist die Proktokolektomie ebenfalls indiziert.[2]
Im Zuge des ileoanalen Pouches wird aus dem Dünndarm eine Art künstlicher Enddarm konstruiert, der die Reservoirfunktion des entfernten Mastdarmes übernimmt. Der Dünndarm wird dann an den Darmausgang angeschlossen, so dass die Patienten eine normale Stuhlentleerung haben. In besonders schweren Fällen oder wenn ein künstlicher Darmausgang schon länger vorliegt, wird in einem Zwischenschritt lediglich der Pouch angelegt, um ihn nach der zweiten schweren OP erst einmal zur Ruhe kommen zu lassen. Bei vorhersehbarer Stuhlinkontinenz wird mit einer Art Trichter im Zwei- bis Dreitage-Rhythmus Spülungen des Pouches (in Anbetracht des Haltens der Flüssigkeit) vorgenommen, um damit den Schließmuskel zu trainieren. Dieses Training wird nach dem Krankenhausaufenthalt selbstständig fortgeführt und erfordert einige Disziplin und am Anfang auch Überwindung. In der darauf folgenden (relativ harmlosen) OP werden dann beide Enden (Ileostoma und Pouch-Zugang) miteinander verbunden.
Die Operationen erfolgt in enger Absprache und Zusammenarbeit mit der Gastroenterologie und Viszeralchirurgie, es können erhebliche Nebenwirkungen auftreten, insbesondere das Risiko einer Pouchitis, also einer akutem oder chronischem Schleimhautentzündung des neu geschaffenen Pouches.[2] Hierbei liegt die kumulative Prävalenz bei 15,5 % nach einem Jahr, 36 % nach fünf Jahren und ca. 45 % nach 10 Jahren. Zudem liegt ein erhöhtes Risiko vor, unfruchtbar zu werden, sowie für sexuelle Funktionsstörungen.
Eine teilweise Entfernung des Darmes kann bei speziellen Einzelfällen durchgeführt werden.[2]
Extrakorporales Therapieverfahren
Die Leukozytapherese, also die extrakorporale Entfernung einer Übermenge an Granulozyten und Monozyten, die für die Aufrechterhaltung der Entzündungsreaktion mitverantwortlich sein sollen, ist in Japan ein Standardverfahren zur Behandlung der Colitis ulcerosa. Die Leitlinien für Deutschland empfehlen die Leukozytapherese in Ausnahmefällen. Die hohen Kosten werden von den gesetzlichen Krankenkassen jedoch allenfalls nach einer Einzelfallprüfung und bei Versagen sämtlicher medikamentöser Therapieoptionen übernommen.[28]
Mangelerscheinungen
Zwar lässt sich die Erkrankung über die Ernährung nicht verhindern – mit Ausnahme des Stillens (mindestens 6 Monate) es gibt keine Ernährungsform, die das Risiko für die Entstehung einer CU-Erkrankung reduziert.[5] Im Schub sowie auch in Remission als Wechselwirkung mit Medikamenten kann es aber zu Mangelerscheinungen kommen. Auch wenn die Entzündung bei Colitis ulcerosa immer auf den Dickdarm beschränkt ist, werden bei starken Durchfällen viele Nährstoffe nicht im Dünndarm resorbiert. Mängel können daher im Schub ausgeprägt sein. Allgemein sollten zum Zeitpunkt der Erstdiagnose und im weiteren Krankheitsverlauf Anzeichen einer Mangelernährung untersucht werden.[5]
Bekannt sind ein Eisenmangel, ein 25-OH-Vitamin D-Mangel, ein Folsäuremangel und ein Zink- bzw. Selenmangel. Nach Anlage eines Ileoanalen Pouches wurden auch Vitamin B12-Mängel beschrieben.[5] Wenn ein solcher Mikronährstoffmangel identifiziert wurden, soll entsprechend gezielt supplementiert werden. Dies kann insbesondere in der Remissionsphase oral erfolgen; eine parenterale Substitution ist bei Unverträglichkeit solcher Präparate (z. B. Eisen) oder unzureichender Resorption (Eisen, Vitamin B12) insbesondere bei ausgeprägter entzündlicher Aktivität angezeigt.[5] Eine allgemeine Vitamin- oder Spurenelementsubstitution wird von der Leitlinie aber nicht empfohlen.
Auch vor einer geplanten Operation sollte bei Vorliegen einer schweren Mangelernährung eine Ernährungstherapie von mindestens sieben Tagen erfolgen. Dies liegt daran, dass Patienten mit entsprechender Mangelernährung ein deutlich erhöhtes Risiko an postoperativen Komplikationen aufweisen. Ein schwere Mangelernährung liegt vor, wenn der BMI unter 18,5 kg/m2 liegt, ein Gewichtsverlust von mehr als 10 % in den letzten 6 Monaten auftrat und/oder das Wert an Serumalbumin 30 g/l unterschreitet.
Die Leitlinie empfiehlt keine spezielle Diät oder Ernährungstherapie (z. B. eine sulfitarme Kost) zur Remissionserhaltung. Auf die Krankheitsaktivität in der akuten Phase oder bei chronisch-aktiver Colitis ulcerosa liegen für spezielle ernährungstherapeutische Maßnahmen – Trinknahrung, enterale (künstliche) und parenterale Ernährung – keine oder kaum Evidenzen vor. Allgemein sollte individuell und stufenweise zunächst eine Ernährungsberatung, dann eine zusätzliche Ernährung durch Trinknahrung, dann eine Ernährung über eine Sonde und schließlich eine parenterale Ernährung erfolgen. Eine künstliche Ernährung kann bei Zeichen einer Mangelernährung oder bei hohem Risiko für Ernährungsdefizite unterstützend eingesetzt werden.
Komplementäre Therapien
- Myrrhe: Myrrhe wird in der Naturheilkunde schon länger gegen Entzündungen innerlich und äußerlich angewendet. Neben der reinen (beim Kauen bitteren) Myrrhe stehen auch geschmacksneutrale Präparate zur Verfügung. Die Heilpflanze setzt den Spannungszustand der glatten Darmmuskulatur herab. Dadurch verringert sich die Zahl der Darmkontraktionen und Darmkrämpfe werden gelindert.[29] Außerdem reduziert Myrrhe im Darm entzündungsfördernde Prozesse und besitzt die Fähigkeit, dort die Bildung freier Radikale zu vermindern und somit das antioxidative Schutzsystem zu verstärken.[30] Eine klinische Studie in der remissionserhaltenden Therapie mit Myrrhe, Kamilleblütenextrakt und Kaffeekohle hat gezeigt, dass diese pflanzliche Therapie vergleichbar wirksam ist wie die Standardtherapie mit Mesalazin. Aufgrund dieser Studie empfiehlt die aktuelle S3-Leitlinie „Colitis ulcerosa“ der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS): „Eine Kombination aus Myrrhe, Kamillenblütenextrakt und Kaffeekohle kann komplementär in der remissionserhaltenden Behandlung eingesetzt werden.“[20]
- Weihrauch (Boswellia serrata): Studien deuten darauf hin, dass die im Weihrauch enthaltenen Boswelliasäuren entzündungshemmend wirken und bei entzündlichen Darmerkrankungen wie Colitis ulcerosa Linderung bringen können.[5]
- Flohsamenschalen: Eine Studie zeigte eine der Anwendung von Aminosalizylaten (z. B. Mesalazin) ähnliche Wirkung durch die Einnahme der Samenschalen des Wegerichgewächses Plantago ovata. Gemäß S3-Leitlinie kann P. ovata komplementär in der remissionserhaltenden Behandlung eingesetzt werden.[5]
- Lecithin: Gesunde Darmschleimhaut im Dickdarm enthält Lecithin, und dieses Lecithin spielt eine wichtige Rolle für die Barrierefunktion des Darms, also die Möglichkeit der Abgrenzung gegen Bakterien und Schadstoffe sowie die Möglichkeit, diese ohne Immunreaktion zu tolerieren. In Studien wurde gezeigt, dass die Darmschleimhaut von Colitis-ulcerosa-Betroffenen signifikant weniger Lecithin enthält als die von Gesunden. Da Lecithin jedoch durch Enzyme der Bauchspeicheldrüse für die Verdauung aufgespalten wird, erreicht normal verabreichtes Lecithin den betroffenen Dickdarm nicht. Um intaktes Lecithin oral bis zum Dickdarm transportieren zu können, wird ein Lecithin-Granulat für diesen Therapieansatz mit dem Polymerharz Eudragit S100 magensaftresistent mikroverkapselt, so dass das Lecithin erst im unteren Dünndarm und im Dickdarm freigesetzt wird. Eine 2014 begonnene Zulassungsstudie für ein Medikament wurde Ende 2016 aufgrund mangelnder Wirksamkeit gegenüber einem Placebo jedoch abgebrochen.[31]
- Zwar haben sich Eier des Schweinepeitschenwurms (TSO-Eier) oral eingenommen in einer kleinen monozentrischen Studie als erfolgversprechend und ohne schwerwiegende Nebenwirkungen dargestellt. Da aber eine große RCT zur Remissionsinduktion bei Morbus Crohn negativ ausgefallen ist, wird der Therapieansatz nicht mehr verfolgt.[5]
- Das curcuminhaltige Kurkuma (Curcuma longa) ist zusammen mit Mesalazin oder Sulfasalazin verabreicht für die Remissionserhaltung geeignet. Gemäß S3-Leitlinie liegen Studien mit positiven Ergebnissen in der Remissionsinduktion sowie in der Remissionserhaltung vor.[5]
- Nicotin: Colitis ulcerosa kommt bei Nichtrauchern signifikant häufiger vor als bei Rauchern.[32][33] Zwei RCTs zeigten zusätzlich positive Effekte von Nicotinpflastern, jedoch nicht als remissionserhaltende Therapie oder als alleinige Behandlungsmethode bei aktiver Colitis.[5] Nachteilig ist diese Gabe vor allem bei lebenslangen Nichtrauchern, da sie zu häufigen und teils schweren Nebenwirkungen führt.
Mitarbeit der Patienten
Zum besseren Verständnis der eigenen Situation und der aktuellen Beschwerden kann mit Hilfe eines Fragebogens[34] betroffenen Patienten eine umfassende Übersicht über ihre aktuelle Gesundheitssituation und ihr persönliches Problemprofil gegeben werden. Bei Bedarf erhalten die Betroffenen Vorschläge für passende und aussichtsreiche Unterstützungsangebote. Die Ergebnisse des Fragebogens können im Anschluss an die Auswertung als Ausgangspunkt für ein ärztliches Gespräch genutzt werden. Der Nutzen des Fragebogens und die Wirksamkeit auf die Lebensqualität von Betroffenen wurden in einer randomisierten kontrollierten Studie bestätigt.[35]
Literatur
Leitlinien
- S3-Leitlinie Aktualisierte S3-Leitlinie Colitis ulcerosa (Version 6.1) der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). In: AWMF online (Stand 02/2023)
- Torsten Kucharzik et al.: ECCO Guidelines on the Prevention, Diagnosis, and Management of Infections in Inflammatory Bowel Disease. In: Journal of Crohn's & Colitis. Band 15, Nr. 6, 22. Juni 2021, S. 879–913, doi:10.1093/ecco-jcc/jjab052, PMID 33730753 (englisch).
- David T. Rubin et al.: ACG Clinical Guideline: Ulcerative Colitis in Adults. In: The American Journal of Gastroenterology. Band 114, Nr. 3, März 2019, S. 384–413, doi:10.14309/ajg.0000000000000152, PMID 30840605 (englisch).
Fachartikel
- Daniel Baumgart: Diagnostik und Therapie von Morbus Crohn und Colitis ulcerosa. In: Dtsch Arztebl Int. Nr. 106(8), 2009, S. 123–133 (aerzteblatt.de).
- Silvio Danese, Claudio Fiocchi: Ulcerative colitis. In: The New England Journal of Medicine. Band 365, Nr. 18, 3. November 2011, S. 1713–1725, doi:10.1056/NEJMra1102942, PMID 22047562 (englisch).
- Taku Kobayashi et al.: Ulcerative colitis. In: Nature Reviews. Disease Primers. Band 6, Nr. 1, 10. September 2020, S. 74, doi:10.1038/s41572-020-0205-x, PMID 32913180 (englisch).
- Paula Sousa et al.: Management of inflammatory bowel disease in the elderly: A review. In: Digestive and Liver Disease: Official Journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver. Band 55, Nr. 8, August 2023, S. 1001–1009, doi:10.1016/j.dld.2022.12.024, PMID 36681569 (englisch).
Weblinks
- Ulcerative Colitis, MedicineNet.com (englisch)
- Bildergalerie zur Colitis ulcerosa
Überregionale Verbände
- Deutsche Morbus-Crohn-/Colitis-ulcerosa-Vereinigung (DCCV e. V.)
- Österreichische Morbus Crohn/Colitis ulcerosa Vereinigung (ÖMCCV)
- SMCCV (Schweizerische Morbus Crohn/Colitis ulcerosa Vereinigung)
- European Federation of Crohn’s and Ulcerative Colitis Associations (EFCCA) – Dachverband der europäischen Patientenvereinigungen
- Kompetenznetz chronisch entzündliche Darmerkrankungen e. V.
Einzelnachweise
- ↑ S3-Leitlinie Diagnostik und Therapie der Colitis ulcerosa der Deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten (DGVS). In: AWMF online (Stand 2011)
- ↑ a b c d Torsten Kucharzik et al.: Ulcerative colitis—diagnostic and therapeutic algorithms. In: Deutsches Ärzteblatt. Band 117, Nr. 33/34, 2020, S. 564–74, doi:10.3238/arztebl.2020.0564, PMID 33148393, PMC 8171548 (freier Volltext).
- ↑ Siew C. Ng, Hai Yun Shi, Nima Hamidi, Fox E. Underwood, Whitney Tang: Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. In: The Lancet. Band 390, Nr. 10114, Dezember 2017, S. 2769–2778, doi:10.1016/S0140-6736(17)32448-0.
- ↑ Mark S. Silverberg et al.: Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. In: Canadian Journal of Gastroenterology. 19 Suppl A, September 2005, S. 5A–36A, doi:10.1155/2005/269076, PMID 16151544 (englisch).
- ↑ a b c d e f g h i j k l m n o p Torsten Kucharzik, Axel U. Dignaß et al.: Aktualisierte S3-Leitlinie Colitis ulcerosa. (PDF) AWMF, Februar 2023, abgerufen am 16. Oktober 2023.
- ↑ a b Daniel C. Baumgart: Diagnostik und Therapie von Morbus Crohn und Colitis ulcerosa. In: Deutsches Ärzteblatt. 20. Februar 2009, abgerufen am 20. Januar 2024.
- ↑ Roy M. Soetikno, Otto S. Lin, Paul A. Heidenreich, Harvey S. Young, Michael O. Blackstone: Increased risk of colorectal neoplasia in patients with primary sclerosing cholangitis and ulcerative colitis: a meta-analysis. In: Gastrointestinal Endoscopy. Band 56, Nr. 1, Juli 2002, ISSN 0016-5107, S. 48–54, doi:10.1067/mge.2002.125367, PMID 12085034.
- ↑ R. J. Xavier, D. K. Podolsky: Unravelling the pathogenesis of inflammatory bowel disease. In: Nature. Band 448, Nr. 7152, 26. Juli 2007, S. 427–434, doi:10.1038/nature06005, PMID 17653185 (englisch).
- ↑ K. Dahm, A. Knipper, H. Mitschke: Maligne Entartung der Colitis ulcerosa im Experiment. In: Langenbecks Archiv für Chirurgie. Band 343, Nr. 4, 1. Dezember 1976, ISSN 1435-2451, S. 307–311, doi:10.1007/BF01300577.
- ↑ Revista Medicina. Fundacion Revista Medicina (buenos Aires), 1987 (google.de [abgerufen am 5. Juni 2021]).
- ↑ Hetbert Renz-Polster, Steffen Krautzig: Basislehrbuch Innere Medizin. Elsevier, München 2013, ISBN 978-3-437-41114-4, S. 553f.
- ↑ a b K. Kemp, J. Griffiths, K. Lovell: Understanding the health and social care needs of people living with IBD: a meta-synthesis of the evidence. In: World journal of gastroenterology. 2012; 18 (43), S. 6240–6249, PMID 23180944.
- ↑ L. A. Graff, J. R. Walker, L. Lix, I. Clara, P. Rawsthorne, L. Rogala, N. Miller, L. Jakul, C. McPhail, J. Ediger, C. N. Bernstein: The relationship of inflammatory bowel disease type and activity to psychological functioning and quality of life. In: Clinical gastroenterology and hepatology. 2006; 4 (12), S. 1491–1501, PMID 17162241.
L. A. Graff, J. R. Walker, C. N. Bernstein: Depression and anxiety in inflammatory bowel disease: a review of comorbidity and management. In: Inflammatory bowel diseases. 2009; 15 (7), S. 1105–1118, PMID 19161177. - ↑ M. S. Sajadinejad, K. Asgari, K. Molavi, M. Kalantari, P. Adibi: Psychological issues in inflammatory bowel disease: an overview. In: Gastroenterology research and practice. 2012; doi:10.1155/2012/106502, PMID 22778720.
- ↑ Gerd Herold und Mitarbeiter. Innere Medizin. Köln 2008.
- ↑ Hafiz M Waqas Khan, Faisal Mehmood, Nabeel Khan: Optimal management of steroid-dependent ulcerative colitis. In: Clinical and Experimental Gastroenterology. Band 8, 12. November 2015, ISSN 1178-7023, S. 293–302, doi:10.2147/CEG.S57248, PMID 26648749, PMC 4648600 (freier Volltext).
- ↑ John K. Marshall, Marroon Thabane, A. Hillary Steinhart, Jamie R. Newman, Anju Anand: Rectal 5-aminosalicylic acid for induction of remission in ulcerative colitis. In: Cochrane Database of Systematic Reviews. 20. Januar 2010, doi:10.1002/14651858.CD004115.pub2.
- ↑ a b Yongjun Wang, Claire E. Parker, Brian G. Feagan, John K. MacDonald: Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. In: Cochrane Database of Systematic Reviews. 9. Mai 2016, doi:10.1002/14651858.CD000544.pub4, PMID 27158764, PMC 7045447 (freier Volltext).
- ↑ Fernando S. Velayos, Jonathan P. Terdiman, Judith M. Walsh: Effect of 5-Aminosalicylate Use on Colorectal Cancer and Dysplasia Risk: A Systematic Review and Metaanalysis of Observational Studies. In: The American Journal of Gastroenterology. Band 100, Nr. 6, Juni 2005, ISSN 0002-9270, S. 1345–1353, doi:10.1111/j.1572-0241.2005.41442.x.
- ↑ a b c d Torsten Kucharzik, Axel Dignaß et al.: S3-Leitlinie Colitis ulcerosa. (PDF) In: AWMF. Februar 2023, S. 59ff. bzw. 63ff., abgerufen am 4. Juni 2023.
- ↑ William J. Sandborn, Chinyu Su, Bruce E. Sands, Geert R. D’Haens, Séverine Vermeire: Tofacitinib as Induction and Maintenance Therapy for Ulcerative Colitis. In: New England Journal of Medicine. Band 376, Nr. 18, 4. Mai 2017, ISSN 0028-4793, S. 1723–1736, doi:10.1056/NEJMoa1606910.
- ↑ Durchfall. In: Stiftung Warentest. 1. Mai 2023, abgerufen am 4. Juni 2023.
- ↑ European public assessment report (EPAR) for Entyvio, EPAR der Europäischen Arzneimittel-Agentur (EMA), englisch, abgerufen am 5. November 2014.
- ↑ Zusammenfassung des EPAR für die Öffentlichkeit (PDF; 131 kB) EPAR auf deutsch; abgerufen am 5. November 2014.
- ↑ Entyvio Fachinformation, Rote Liste, Fachinfo-Service, abgerufen am 5. November 2014.
- ↑ M. Bolton: The treatment of colitis by valvular colostomy and irrigation. In: Med. Rec. Band 59, 1901, S. 404 ff.
- ↑ Vgl. auch R. B. Cattell, E. Sachs jr.: Surgical treatment of ulcerative colitis. In: Journal of the American Medical Association. Band 137, 1948, S. 929 ff.
- ↑ Jan Richert: Colitis ulcerosa – Medikamente und Therapien bei der chronisch entzündlichen Darmerkrankung (CED)– mit einem Blick auf Neuentdeckungen und Alternativmedizin. epubli, Berlin 2014, ISBN 978-3-8442-8205-4.
- ↑ C. Vissiennon et al.: Antispasmodic Effects of Myrrh due to Calcium Antagonistic Effects in Inflamed Rat Small Intestinal Preparations. In: Planta Med, 2015 Jan;81(2):116–122, doi:10.1055/s-0034-1383391.
- ↑ A. J. Fatani et al.: Myrrh attenuates oxidative and inflammatory processes in acetic acid-induced ulcerative colitis. In: Experimental and therapeutic medicine 12: 730–738, (2016).
- ↑ 13.10.2016: Die PCG-2/UCA Studie mit Phosphatidylcholin (Lecithin) wurde gestoppt. In: DCCV e. V. Deutsche Morbus Crohn/Colitis ulceroa Vereinigung. DCCV e. V., 13. Oktober 2016, abgerufen am 18. Juni 2020.
- ↑ BM Calkins: A meta-analysis of the role of smoking in inflammatory bowel disease. In: Digestive Diseases and Sciences. 34. Jahrgang, Nr. 12, 1989, S. 1841–1854, doi:10.1007/BF01536701, PMID 2598752.
- ↑ PL Lakatos, T Szamosi, L Lakatos: Smoking in inflammatory bowel diseases: good, bad or ugly? In: World Journal of Gastroenterology. 13. Jahrgang, Nr. 46, 2007, S. 6134–6139, doi:10.3748/wjg.13.6134, PMID 18069751, PMC 4171221 (freier Volltext).
- ↑ Online-Fragebogen für Betroffene mit chronisch entzündlicher Darmerkrankung. Herausgeber: Seniorprofessur für Bevölkerungsmedizin; Universität zu Lübeck. Abgerufen am 10. Januar 2015.
- ↑ A. Hueppe, J. Langbrandtner, H. Raspe: Inviting patients with inflammatory bowel disease to active involvement in their own care: a randomized controlled trial. In: Inflammatory bowel diseases. 2014; 20 (6), S. 1057–1069, PMID 24788217.