„HPV-Impfstoff“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K Gardasil 9 vs. Gardasil |
→Therapeutische HPV-Impfstoffe: Korrekturen, das sind alles verschiedene Impfstoffkandidaten; Lit/Weblinks aktualisiert |
||
| Zeile 144: | Zeile 144: | ||
=== Japan === |
=== Japan === |
||
Die HPV-Impfung war in [[Japan]] ab April 2013 als Routineimpfung empfohlen und ist ab diesem Zeitpunkt kostenfrei.<ref name=":0">{{Literatur |Autor=Yutaka Ueda et al. |Titel=The last strategy for re-dissemination of HPV vaccination in Japan while still under the suspension of the governmental recommendation |Hrsg= |Sammelwerk=Scientific Reports |Band=10 |Nummer=1 |Auflage= |Datum=2020-09-30 |DOI=10.1038/s41598-020-73120-1 |Seiten=16091}}</ref> Die Empfehlung wurde im Juni 2013 ausgesetzt, nachdem Monate vorher wiederholte mutmaßliche schwere Nebenwirkungen von [[Impfgegnerschaft|Impfgegnern]] verbreitet wurden.<ref name=":0" /> So wurde das Auftreten des [[Komplexes regionales Schmerzsyndrom|Komplexen regionalen Schmerzsyndroms]] bei einem 14-järhigen Mädchen kausal der HPV-Impfung angelastet.<ref>Doris Uhl: [http://www.deutsche-apotheker-zeitung.de/pharmazie/news/2013/06/20/japan-setzt-empfehlung-fuer-hpv-impfung-aus/10371.html ''Japan setzt Empfehlung für HPV-Impfung aus.''] [[Deutsche Apothekerzeitung]] vom 20. Juni 2013.</ref> Das [[Paul-Ehrlich-Institut]] sah 2013 nach Auswertung aller gemeldeten Verdachtsfälle und der Literatur kein Risikosignal für das Auftreten dieses Syndroms.<ref>{{Internetquelle |url=https://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Bulletin/2013/4-2013.pdf?__blob=publicationFile&v=6 |titel=Kein Hinweis auf ein erhöhtes Risiko für Autoimmunerkrankungen nach HPV-Impfung |format=PDF; 1,1 MB |werk=Bulletin zur Arzneimittelsicherheit, Ausgabe 3 |hrsg=Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel ([[Paul-Ehrlich-Institut]]) |datum=2013-09 |abruf=2020-03-18}}</ref> Dieser Einschätzung schloss sich die [[Europäische Arzneimittel-Agentur|Europäische Arzneimittelagentur]] nach einem Review im November 2015 an.<ref name=":1">{{Internetquelle |autor= |url=https://www.ema.europa.eu/documents/referral/hpv-vaccines-article-20-procedure-ema-confirms-evidence-does-not-support-they-cause-crps-pots_de.pdf |titel=HPV-Impfstoffe – EMA bestätigt: Nachweise unterstützen nicht die Annahme, dass die Impfstoffe CRPS oder POTS verursachen |werk=EMA |hrsg= |datum=2016-01-12 |abruf=2020-12-20 |format=PDF}}</ref> 2017 plädierten die Mitglieder von 17 japanischen Fachgesellschaften für eine Erneuerung der Impfempfehlung.<ref>Satoshi Iwata, Kenji Okada, Kei Kawana: ''Consensus statement from 17 relevant Japanese academic societies on the promotion of the human papillomavirus vaccine.'' Vaccine 35 (2017), S. 2291–2292, PMID 28325478, [[doi:10.1016/j.vaccine.2017.03.015]], [http://vaccine-kyogikai.umin.jp/pdf/HPV_Vaccine35_2017_2291-2292.pdf vaccine-kyogikai.umin.jp] (PDF; 219 kB)</ref> Durch die Ereignisse sanken die HPV-Impfraten in Japan von 70 % auf zwischenzeitlich 0 %, sie liegen durch Informationskampagnen der Regierung mittlerweile bei 10 %.<ref name=":0" /> Japans Regierung spricht zwar weiterhin öffentlich keine |
Die HPV-Impfung war in [[Japan]] ab April 2013 als Routineimpfung empfohlen und ist ab diesem Zeitpunkt kostenfrei.<ref name=":0">{{Literatur |Autor=Yutaka Ueda et al. |Titel=The last strategy for re-dissemination of HPV vaccination in Japan while still under the suspension of the governmental recommendation |Hrsg= |Sammelwerk=Scientific Reports |Band=10 |Nummer=1 |Auflage= |Datum=2020-09-30 |DOI=10.1038/s41598-020-73120-1 |Seiten=16091}}</ref> Die Empfehlung wurde im Juni 2013 ausgesetzt, nachdem Monate vorher wiederholte mutmaßliche schwere Nebenwirkungen von [[Impfgegnerschaft|Impfgegnern]] verbreitet wurden.<ref name=":0" /> So wurde das Auftreten des [[Komplexes regionales Schmerzsyndrom|Komplexen regionalen Schmerzsyndroms]] bei einem 14-järhigen Mädchen kausal der HPV-Impfung angelastet.<ref>Doris Uhl: [http://www.deutsche-apotheker-zeitung.de/pharmazie/news/2013/06/20/japan-setzt-empfehlung-fuer-hpv-impfung-aus/10371.html ''Japan setzt Empfehlung für HPV-Impfung aus.''] [[Deutsche Apothekerzeitung]] vom 20. Juni 2013.</ref> Das [[Paul-Ehrlich-Institut]] sah 2013 nach Auswertung aller gemeldeten Verdachtsfälle und der Literatur kein Risikosignal für das Auftreten dieses Syndroms.<ref>{{Internetquelle |url=https://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Bulletin/2013/4-2013.pdf?__blob=publicationFile&v=6 |titel=Kein Hinweis auf ein erhöhtes Risiko für Autoimmunerkrankungen nach HPV-Impfung |format=PDF; 1,1 MB |werk=Bulletin zur Arzneimittelsicherheit, Ausgabe 3 |hrsg=Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel ([[Paul-Ehrlich-Institut]]) |datum=2013-09 |abruf=2020-03-18}}</ref> Dieser Einschätzung schloss sich die [[Europäische Arzneimittel-Agentur|Europäische Arzneimittelagentur]] nach einem Review im November 2015 an.<ref name=":1">{{Internetquelle |autor= |url=https://www.ema.europa.eu/documents/referral/hpv-vaccines-article-20-procedure-ema-confirms-evidence-does-not-support-they-cause-crps-pots_de.pdf |titel=HPV-Impfstoffe – EMA bestätigt: Nachweise unterstützen nicht die Annahme, dass die Impfstoffe CRPS oder POTS verursachen |werk=EMA |hrsg= |datum=2016-01-12 |abruf=2020-12-20 |format=PDF}}</ref> 2017 plädierten die Mitglieder von 17 japanischen Fachgesellschaften für eine Erneuerung der Impfempfehlung.<ref>Satoshi Iwata, Kenji Okada, Kei Kawana: ''Consensus statement from 17 relevant Japanese academic societies on the promotion of the human papillomavirus vaccine.'' Vaccine 35 (2017), S. 2291–2292, PMID 28325478, [[doi:10.1016/j.vaccine.2017.03.015]], [http://vaccine-kyogikai.umin.jp/pdf/HPV_Vaccine35_2017_2291-2292.pdf vaccine-kyogikai.umin.jp] (PDF; 219 kB)</ref> Durch die Ereignisse sanken die HPV-Impfraten in Japan von 70 % auf zwischenzeitlich 0 %, sie liegen durch Informationskampagnen der Regierung mittlerweile bei 10 %.<ref name=":0" /> Japans Regierung spricht zwar weiterhin öffentlich keine Impfempfehlung für HPV aus, sie ist trotzdem ein Bestandteil der Routine-Impfungen. |
||
== Kosten == |
== Kosten == |
||
| Zeile 186: | Zeile 186: | ||
== Therapeutische HPV-Impfstoffe == |
== Therapeutische HPV-Impfstoffe == |
||
Zusätzlich zu den beiden präventiven Impfstoffen ''Gardasil 9'' und ''Cervarix'', werden für bereits Infizierte therapeutische HPV-Impfstoffe entwickelt. Sie befinden sich in klinischer Testung und sind damit noch nicht [[Arzneimittelzulassung|zugelassen]]. |
|||
| ⚫ | |||
Beispielsweise enthält ''VGX-3100'' zwei DNA-Plasmide, die intramuskulär via [[Elektroporation]] injiziert werden.<ref>{{Internetquelle |autor=Birgit Schindler |url=https://www.deutsche-apotheker-zeitung.de/daz-az/2016/daz-1-2016/gebaermutterhalskrebs-durch-therapeutische-impfung-heilbar |titel=Gebärmutterhalskrebs durch therapeutische Impfung heilbar? |werk=[[Deutsche Apothekerzeitung]] |datum=2016-01-07 |abruf=2022-01-05}}</ref> Körpereigene Zellen [[Genexpression|exprimieren]] dann nach Aufnahme der Plasmide die Onkoproteine E6 und E7 der HPV-Typen 16 und 18. Das Immunsystem richtet sich damit gegen diese Proteine und bildet zytoxische T-Zellen aus. Ein anderer Impfstoffkandidat ist ein [[Viraler Vektor|Vektorimpfstoff]], ''MVA-E2''. Er enthält das [[Modified-Vaccinia-Ankara-Virus]] (MVA), das direkt in die Gebärmutter von Patientinnen injiziert wird, die von CIN-Zellveränderung betroffen sind.<ref>{{Literatur |Autor=John T. Schiller et al. |Titel=Human Papillomavirus Vaccines |Hrsg=Stanley A. Plotkin et al. |Sammelwerk=Plotkin's Vaccines |Auflage=7 |Verlag=Elsevier |Ort=Philadelphia |Datum=2017 |ISBN=978-0-323-35761-6 |DOI=10.1016/B978-0-323-35761-6.00030-4 |Seiten=454 }}</ref> MVA exprimiert das E2-Protein des Bovinen Papillomvirus Typ 1 (BPV-1).<ref>{{Literatur |Autor=Emily Farmer et al. |Titel=Vaccination Strategies for the Control and Treatment of HPV Infection and HPV-Associated Cancer |Sammelwerk=Recent results in cancer research. Fortschritte der Krebsforschung. Progres dans les recherches sur le cancer |Band=217 |Datum=2021 |DOI=10.1007/978-3-030-57362-1_8 |PMC=8564785 |PMID=33200366 |Seiten=157–195}}</ref> |
|||
| ⚫ | Wissenschaftler des [[Deutsches Krebsforschungszentrum|Deutschen Krebsforschungszentrums]] entwickelten einen therapeutischen Impfstoff, mit dem im Tierversuch an Mäusen der durch HPV verursachte Gebärmutterhalskrebs bekämpft werden konnte. Bei der Hälfte der geimpften Tiere bildeten sich die Tumoren zurück.<ref>[https://www.dkfz.de/de/presse/pressemitteilungen/2019/dkfz-pm-19-03-Impfung-als-Therapie.php ''Impfung als Therapie: Experimenteller Impfstoff gegen Gebärmutterhalskrebs an Mäusen erfolgreich erprobt''.] Deutsches Krebsforschungszentrum, Pressemitteilung, 16. Januar 2019</ref><ref>{{Literatur |Autor=Sebastian Kruse et al. |Titel=Therapeutic vaccination using minimal HPV16 epitopes in a novel MHC-humanized murine HPV tumor model |Sammelwerk=OncoImmunology |Band=8 |Nummer=1 |Datum=2019-01-02 |Seiten=e1524694 |DOI=10.1080/2162402X.2018.1524694 |PMC=6287800 |PMID=30546964}}</ref> |
||
== Literatur == |
== Literatur == |
||
* {{Literatur |Autor=Gregory D. Zimet, Marcia L. Shew, Jessica A. Kahn |Titel=Appropriate use of cervical cancer vaccine |Sammelwerk=[[Annual Review of Medicine]] |Band=59 |Datum=2008 |Seiten=223–236 |DOI=10.1146/annurev.med.59.092806.131644 |PMID=18186704}} |
|||
* Ulrich R. Hengge (Hrsg.): ''HPV-Infection and Cancers of the Skin – Diagnostics and Therapy.'' Uni-Med Science, Bremen 2008, ISBN 978-3-8374-1076-1. |
|||
* {{Literatur |Autor=Emily Farmer et al. |Titel=Vaccination Strategies for the Control and Treatment of HPV Infection and HPV-Associated Cancer |Sammelwerk=Recent results in cancer research. Fortschritte der Krebsforschung. Progres dans les recherches sur le cancer |Band=217 |Datum=2021 |DOI=10.1007/978-3-030-57362-1_8 |PMC=8564785 |PMID=33200366 |Seiten=157–195}} |
|||
* {{Literatur |
|||
|Autor=Gregory D. Zimet, Marcia L. Shew, Jessica A. Kahn |
|||
|Titel=Appropriate use of cervical cancer vaccine |
|||
|Sammelwerk=[[Annual Review of Medicine]] |
|||
|Band=59 |
|||
|Datum=2008 |
|||
|Seiten=223–236 |
|||
|DOI=10.1146/annurev.med.59.092806.131644 |
|||
|PMID=18186704}} |
|||
== Weblinks == |
== Weblinks == |
||
* {{AWMF|http://www.awmf.org/leitlinien/detail/ll/082-002.html|Impfprävention HPV-assoziierter Neoplasien|S3|Paul-Ehrlich-Gesellschaft für Chemotherapie (AG HPV-Management-Forum), der Deutschen STD-Gesellschaft und der Deutschen Dermatologischen Gesellschaft| |
* {{AWMF|http://www.awmf.org/leitlinien/detail/ll/082-002.html|Impfprävention HPV-assoziierter Neoplasien|S3|Paul-Ehrlich-Gesellschaft für Chemotherapie (AG HPV-Management-Forum), der Deutschen STD-Gesellschaft und der Deutschen Dermatologischen Gesellschaft|05/2020}} |
||
* [http://www.rki.de/DE/Content/Infekt/Impfen/ImpfungenAZ/HPV/HPV.html Informationen] des [[Robert Koch-Institut]]s zu HPV-Impfstoffen |
* [http://www.rki.de/DE/Content/Infekt/Impfen/ImpfungenAZ/HPV/HPV.html Informationen] des [[Robert Koch-Institut]]s zu HPV-Impfstoffen |
||
* Veröffentlichungen der [[Europäische Arzneimittel-Agentur|Europäischen Arzneimittelagentur]] zu [http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000703/human_med_000805.jsp&mid=WC0b01ac058001d124 Gardasil] und zu [http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000721/human_med_000694.jsp&mid=WC0b01ac058001d124 Cervarix] |
* Veröffentlichungen der [[Europäische Arzneimittel-Agentur|Europäischen Arzneimittelagentur]] zu [http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000703/human_med_000805.jsp&mid=WC0b01ac058001d124 Gardasil] und zu [http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000721/human_med_000694.jsp&mid=WC0b01ac058001d124 Cervarix] |
||
* [https://www.krebsinformationsdienst.de/vorbeugung/risiken/hpv-impfung.php ''HPV-Impfung: Antworten auf häufige Fragen – Wovor schützt die Impfung?''] [[Deutsches Krebsforschungszentrum#Krebsinformationsdienst|Krebsinformationsdienst]] des [[Deutsches Krebsforschungszentrum|Deutschen Krebsforschungszentrums]] (DKFZ), Heidelberg, |
* [https://www.krebsinformationsdienst.de/vorbeugung/risiken/hpv-impfung.php ''HPV-Impfung: Antworten auf häufige Fragen – Wovor schützt die Impfung?''] [[Deutsches Krebsforschungszentrum#Krebsinformationsdienst|Krebsinformationsdienst]] des [[Deutsches Krebsforschungszentrum|Deutschen Krebsforschungszentrums]] (DKFZ), Heidelberg, 7. Spetember 2020 |
||
* [http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/referrals/Human_papillomavirus_vaccines/human_referral_prac_000053.jsp&mid=WC0b01ac05805c516f&source=homeMedSearch&category=human EMA - Übersicht zugelassener Impfstoffe] |
* [http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/referrals/Human_papillomavirus_vaccines/human_referral_prac_000053.jsp&mid=WC0b01ac05805c516f&source=homeMedSearch&category=human EMA - Übersicht zugelassener Impfstoffe] |
||
Version vom 5. Januar 2022, 12:05 Uhr
HPV-Impfstoffe schützen durch den Aufbau einer Immunität gegen bestimmte Typen der sexuell übertragbaren humanen Papillomaviren (HPV) und dienen damit der Krebsprävention. Die Weltgesundheitsorganisation empfiehlt allen Ländern, die HPV-Impfung in ihre nationalen Immunisierungsprogramme aufzunehmen, der HPV-Impfstoff befindet sich auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation.[1][2] Die Hochrisiko-HPV-Typen 16 und 18 sind weltweit für etwa 70 % aller Fälle von Gebärmutterhalskrebs verantwortlich.[3] Nach Angaben des Robert Koch-Instituts starben im Jahr 2014 in Deutschland 1506 Frauen an Gebärmutterhalskrebs.[4] Die Papillomaviren vom Typ 6 und 11 sind primär verantwortlich für die Entstehung von Genitalwarzen (Feigwarzen).
Derzeit sind drei HPV-Impfstoffe zugelassen: ein Zweifach-Impfstoff, der ausschließlich gegen die HPV-Typen 16 und 18 wirksam ist, ein Vierfach-Impfstoff, der sich gegen die HPV-Typen 6, 11, 16 und 18 richtet, und dessen Nachfolger, ein Neunfach-Impfstoff, welcher vor den HPV-Typen 6, 11, 16, 18, 31, 33, 45, 52, und 58 schützt. Die Wirksamkeit des Vierfach-Impfstoffs hinsichtlich der Vorbeugung gegen durch die entsprechenden HPV-Typen hervorgerufene Vorstufen des Gebärmutterhalskrebses lag in klinischen Studien bei 98 bis 100 % für vorher nicht HPV-infizierte Probanden.
Die Impfstoffe wirken nur vorbeugend (prophylaktisch). Bereits bestehende Infektionen können durch sie nicht behandelt werden. Die Impfung schützt jedoch noch vor den anderen im Impfstoff enthaltenen HPV-Typen.[5] HPV-Impfstoffe sind gut verträglich und sicher. Die häufigsten unerwünschten Wirkungen sind lokale Reaktionen wie Rötung, Schwellung und Schmerzen an der Injektionsstelle. Die Vorsorgeuntersuchung zur frühzeitigen Erkennung des Gebärmutterhalskrebses (Pap-Test) wird weiterhin empfohlen, da nicht alle kanzerogenen HPV-Typen durch die Impfung erfasst werden.
Risiken der HPV-Infektion
Die Hochrisiko-HPV-Typen 16 und 18 werden weltweit für etwa 70 % aller Fälle von Gebärmutterhalskrebs bei der Frau verantwortlich gemacht.[6] 55,3 % aller Gebärmutterhalskrebsvorstufen der Schweregrade CIN 2 und 3 waren in zwei deutschen Studien mit HPV 16 assoziiert, 6,4 % mit HPV 18, HPV 45 konnte in 8,5 % und HPV 31 in 6,4 % der Fälle nachgewiesen werden.[7] Hochrisiko-Virus-Untergruppen sind nicht nur an der Entstehung von Gebärmutterhalskrebs beteiligt; man findet sie auch bei Krebserkrankungen des Penis, der Vulva, des Anus und des Mundes. Die WHO hat 2005 die HPV-Typen 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 und 66 als krebserregend eingestuft.[8]
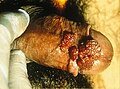
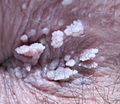
Die sogenannte Niedrigrisiko-HPV-Typen 6 und 11 sind verantwortlich für die Entstehung von über 90 % der Genitalwarzen (Feigwarzen), die die weltweit häufigste virale sexuell übertragene Krankheit sind. Man schätzt, dass etwa 1 % der europäischen und bundesdeutschen Bevölkerung in der Altersgruppe vom 15. bis 49. Lebensjahr von diesen gutartigen Tumoren betroffen ist. Untersuchungen der letzten Jahre zeigen eine ansteigende Häufigkeit. Genitalwarzen führen oft zu Ängsten und psychosozialen Komplikationen sowie zu Partnerproblemen und damit zu einer erheblichen Einschränkung der Lebensqualität.[9]
-
Feigwarzen im rasierten Schambereich an Peniswurzel, ca. 6 bis 10 Monate nach Infektion
-
Stark ausgeprägter Feigwarzenbefall am Penis
-
Stark ausgeprägter Feigwarzenbefall in der Vulva
-
Feigwarzenbefall des Anus
Entwicklung
Ein von Sanofi Pasteur MSD hergestellter Vierfach-Impfstoff wurde im Juni 2006 zunächst in den USA durch die Food and Drug Administration und im September 2006 von der EU-Kommission nach einem zentralen Zulassungsverfahren in den Ländern der Europäischen Union zugelassen. Im November 2006 folgte die Zulassung in der Schweiz durch die Swissmedic.[10] In Europa lautet der Handelsname Gardasil bzw. Silgard. Der Impfstoff enthält gereinigte, rekombinant hergestellte L1-Proteine aus dem Kapsid der vier Papillomavirustypen 6, 11, 16 und 18, die sich spontan zu Virus-like particles (VLP) zusammenlagern.[11] Laut Europäischer Arzneimittelagentur wurden bis Januar 2008 in Europa bereits 1,5 Millionen Patientinnen mit Gardasil geimpft.[12] Es folgten Indikationserweiterungen für die Prävention von Vorstufen des Vaginal- und Vulva-Karzinoms (USA: September 2008,[13] EU: Juli 2008[14]) sowie für die Verhütung von Genitalwarzen (USA: im Oktober 2009 Ausweitung auf Männer und Jungen,[13][15] EU: November 2011) und Prävention von Vorstufen maligner Läsionen im Analbereich und Analkarzinomen (USA: Dezember 2010,[16] EU: Juni 2014[17]).
Die Zulassung für den von GlaxoSmithKline entwickelten bivalenten Impfstoff, der unter dem Handelsnamen Cervarix vertrieben wird, wurde im Mai 2007 in Australien und am 20. September 2007 für die Europäische Union erteilt. Eine Zulassung durch die FDA erfolgte im Oktober 2009.[18] Dieser Impfstoff enthält ebenfalls rekombinante L1-Proteine aus dem Kapsid in VLPs, jedoch nur der Papillomavirustypen 16 und 18.[19]
In einer Phase-III-Studie von MSD mit einem neuen rekombinanten nonavalenten Impfstoff gegen die Virustypen 6, 11, 16, 18, 31, 33, 45, 52 und 58 mit der Bezeichnung V503[20] verhinderte die Impfung 97 % der hochgradigen vaginalen, Vulva- und Zervixkrebsvorstufen, die durch diese Virustypen verursacht werden. Der neue Impfstoff erzeugte eine gleiche oder bessere Immunantwort als Gardasil bei den HPV-Typen 6, 11, 16 und 18.[21] Die Zulassung von V503 in den USA erfolgte im Dezember 2014[22] und in der EU im Juni 2015[23] unter dem Handelsnamen Gardasil 9, welches in Deutschland seit 2016 verfügbar ist.[24]
Eine internationale Arbeitsgruppe berichtete im Juni 2013 über die Entwicklung eines multivalenten Impfstoffes, der in Zukunft nicht nur gegen die Mehrzahl der genitalen Hoch- und Niedrig-Risiko-Virustypen schützen könnte, sondern auch gegen jene Typen, die für die Bildung von Hautwarzen verantwortlich sind. Eine Evaluierung in klinischen Studien steht noch aus.[25][26]
Wirksamkeit
Generell
2018 hat ein Cochrane-Review die HPV-Impfung als wirksam und sicher beurteilt.[27] Dieser Ansicht schlossen sich Wissenschaftler aus Schottland an.[28][29] Die Auswertung von über 100.000 Gesundheitsdaten hat ergeben, dass routinemäßige HPV-Impfungen bei Mädchen im Alter von 12-13 Jahren die Wahrscheinlichkeit für das Auftreten abnormaler Zellen und zervikaler intraepithelialer Neoplasien (CIN; Vorstufen des Gebärmutterhalskrebses) deutlich reduziert hat. Je früher eine HPV-Impfung stattgefunden hatte, desto wirksamer war sie.
Eine Meta-Analyse von über 60 Millionen Patientendaten und einer achtjährigen Nachbeobachtung hat ergeben, dass die HPV-Impfung einen signifikanten Einfluss auf den Rückgang von HPV-Erkrankungen und der Gebärmutterhalskrebsvorstufe CIN2+ hat.[30] So ging CIN2+ 5-9 Jahre nach der HPV-Impfung bei Frauen zwischen 15 und 19 Jahren um 51 %, bei Frauen zwischen 20 und 24 Jahren um 31 % zurück.
In den USA wurde beobachtet, dass nach der Einführung des quadrivalenten Impfstoffes das Auftreten der krebserregenden HPV-Stämme im Vergleich zur Vorimpfperiode signifikant sank: bei 14- bis 19-Jährigen von 11,5 % auf 1,8 % und bei 20- bis 24-Jährigen von 18,5 % auf 5,3 %.[31] In Großbritannien zeigte sich 10 Jahre nach Einführung der HPV-Impfung, dass 16–24-jährige sexuell aktive Frauen nicht mehr mit den Hochrisikostämmen 16 und 18 infiziert waren.[32] In einer großen Beobachtungsstudie in England wurde gezeigt, dass seit Einführung der Impfung im Jahr 2008 ein deutlicher Rückgang sowohl beim Zervixkarzinom als auch bei der Vorstufe CIN3 verzeichnet wurde.[33][34] Falls die Impfung vor ersten sexuellen Kontakten erfolgt ist, war der Effekt am signifikantesten. Die Autoren schätzen zudem, dass in England die Impfung bis Ende Juni 2019 im Mittel 448 Zervixkarzinome und 17.235 CIN3-Läsionen verhindert hat.
In einer schwedischen retrospektiven Registerstudie mit 1,6 Millionen Mädchen und Frauen zeigte sich 2020 bei Frauen, die bis zu ihrem 31. Geburtstag erfasst wurden, eine altersadjustierte Reduktion von 49 % der Inzidenz für Gebärmutterhalskrebs, bei Adjustierung aller Covariaten eine Reduktion von 88 % bei vor dem 17. Geburtstag geimpften Frauen (Incidence rate ratio 0,12 mit 95 % -Konfidenzintervall 0,00 bis 0,34). Bei Frauen, die zwischen 17 und 30 Jahren geimpft wurden, betrug die adjustierte Risikoreduktion nur 53 %, da eine bereits vorhandene Infektion durch eine spätere Impfung nicht behandelt werden kann und bereits ein Risiko für einen zukünftigen Gebärmutterhalskrebs mit sich bringt. Längere Nachuntersuchungszeiträume existieren noch nicht, das Risiko, einen Gebärmutterhalskrebs zu entwickeln, steigt auch nach dem 31. Geburtstag weiter an, jedoch haben Frauen, die vor dem 17. Geburtstag geimpft wurden, diese Altersgruppe noch nicht erreicht. Bisher findet sich in der Sensitivitätsanalyse kein Hinweis auf eine Herdenimmunität, von der statistische Modellierungen ab einer Impfquote von 50 % bei Mädchen und Frauen ausgehen.[35]
Studien zur Wirksamkeit von Gardasil
Die Wirksamkeit des tetravalenten Impfstoffes (Gardasil) wurde in vier placebokontrollierten, randomisierten und doppelblinden Phase II- und Phase III-Studien untersucht. Bei Frauen, die zum Zeitpunkt der Impfung nicht mit den entsprechenden humanen Papillomaviren infiziert waren, konnte durch die Impfung eine Infektion bei nahezu allen Frauen (96 – 100 %) verhindert werden. Bei den geimpften Studienteilnehmerinnen konnte durch die Impfung das Auftreten zervikaler intraepithelialen Neoplasien, einem Surrogatmarker für Gebärmutterhalskrebs, die durch die entsprechenden HPV-Typen verursacht wurden, bei 98–100 % der Probandinnen verhindert werden. Beispielsweise wurde in der sogenannten Future II-Studie das Auftreten von CIN Grad 2 oder schwereren Vorstufen des Gebärmutterhalskrebses registriert. Während in der Gruppe der mit dem Impfstoff behandelten Frauen (insgesamt 5305 Frauen) ein Fall von CIN auftrat, kam es in der Gruppe der Frauen, die mit Placebo behandelt wurden (5260 Frauen), zu 42 Fällen. Darüber hinaus schützte die Impfung 98 – 100 % der Studienteilnehmerinnen vor der Entwicklung von anogenitalen Warzen. Das unabhängige Data Safety Monitoring Board empfahl aus ethischen Gründen eine baldige Impfung der mit Placebo behandelten Probandinnen.[36][37]
Bezieht man Frauen mit zu Studienbeginn bestehenden HPV-Infektionen in die Auswertung mit ein und auch solche, die weniger als die drei erforderlichen Impfdosen erhielten, ist die Wirksamkeit von Gardasil gegenüber durch HPV verursachten Vorstufen des Gebärmutterhalskrebs geringer, aber vorhanden. In der für die Zulassung durchgeführten kombinierten Interimsanalyse der vier relevanten Wirksamkeitsstudien lag die Wirksamkeit gegen durch die HPV-Typen 16 und/oder 18 verursachten CIN 2/3/AIS bei 39 %.[38]
Jungen im Alter von 9 bis 15 Jahren entwickelten nach Impfung eine Immunität. Der quadrivalente Impfstoff wurde in einer Studie mit 4.065 Jungen und Männer im Alter von 16 bis 26 Jahren als effektiv beurteilt.[39] Für homosexuelle Männer läuft eine weltweite klinische Studie zur Vorbeugung gegen Geschlechtskrankheiten, insbesondere Feigwarzen, ferner Studien mit dem HPV-Impfstoff. Ziel ist eine Schutzimpfung zur Vorbeugung gegen Anal- und Peniskrebs, deren Entstehung ebenfalls mit Infektionen mit HPV in Verbindung gebracht wird.
Im Jahre 2011 wurden erste Daten nach Einführung eines flächendeckendes Impfprogramms mit einem quadrivalenten Impfstoff publiziert. Das Programm wurde 2007 in Australien etabliert. Die Impfquote liegt dort bei 80 bis 90 Prozent. Drei Jahre nach Beginn der Impfkampagne waren die behandlungsbedürftigen Krebsvorstufen bei Mädchen unter 18 Jahren um 59 Prozent niedriger als zuvor.[40][41]
Studien zur Wirksamkeit von Cervarix
Der bivalente Impfstoff Cervarix schützt gegen die krebserregenden HPV-Typen 16 und 18. Statistisch signifikante Wirksamkeit konnte für dieses Medikament in einer großen Studie nur für HPV 16 nachgewiesen werden. Klinische Daten liegen für Cervarix bisher über einen Zeitraum von 5,5 Jahren vor.[42] Nach neuen Daten schützt Cervarix auch gegen Infektionen mit HPV-Typen, die nicht im Impfstoff enthalten sind. Diese sogenannte Kreuzprotektion erstreckt sich in unterschiedlichem Maß auf die Virustypen 31, 33, 35, 39, 45, 51, 52, 56, 58 und 59. Dabei haben besonders die Virustypen 31 und 45 (neben HPV 16 und 18) ein hohes onkogenes Potenzial.[43] Auch bei Gardasil ist eine Kreuzprotektion mit den phylogenetisch verwandten HPV-Typen 45, 52 und 58 bekannt.[44][45][46] In einer in PLoS ONE veröffentlichten Studie wurde gezeigt, dass Cervarix auch vor oralen Infektionen schützt.[47] Dies ist vor allem aufgrund der steigenden Tumoren im Kopf-Hals-Bereich, die zunehmend über HP-Viren ausgelöst werden, besonders relevant.
Nach Daten der PATRICIA-Studie (Papilloma Trial against Cancer in young Adults), einer Phase-III-Studie (HPV 008) mit Cervarix, an der in 14 Ländern Nord- und Südamerikas, Europas und der Asien-Pazifik-Region 18.644 Frauen im Alter zwischen 15 und 25 Jahren teilnahmen, wurde eine Verminderung der CIN 2+-Befunde um 70 % (33 gegenüber 110 Fälle), der CIN 3+-Befunde um 87 % (3 gegenüber 23 Fälle) gefunden. Die Rate der Konisationen reduzierte sich um 68,8 Prozent (also auf 31,2 %).[42][43]
Vergleich von Gardasil und Cervarix
Die erste direkte Vergleichsstudie zwischen beiden Präparaten (HPV 010), die 1106 gesunde Frauen zwischen 18 und 45 Jahren aus 40 US-Zentren einschloss, zeigte eine deutlich höhere Immunantwort des bivalenten Impfstoffs Cervarix, die am ehesten durch ein neues Adjuvans (AS04) erklärt werden kann. Ob diese gesteigerte Immunantwort relevant für den Schutz oder dessen Dauer ist, ist unklar.[43]
Im November 2008 forderten 13 Wissenschaftler verschiedener deutscher Forschungseinrichtungen eine Neubewertung der HPV-Impfung mit der Begründung, die Wirksamkeit könne deutlich niedriger sein als angenommen.[48][49] In dieser Neubewertung des Robert Koch-Instituts vom 10. August 2009 wurde die Impfung weiterhin empfohlen. Informationsmedien, die den Eindruck erwecken, dass eine HPV-Impfung zu 100 % gegen Gebärmutterhalskrebs schützt, wurden als nach derzeitigem Wissensstand unseriös eingestuft.[50]
Durchführung
Das Impfschema richtet sich nach dem Alter der zu immunisierenden Person: ab 14 Jahre (Gardasil) bzw. ab 15 Jahre (Cervarix) erfolgt die Grundimmunisierung mittels dreier intramuskulärer Injektionen, die je im Abstand von zwei und sechs Monaten nach der Erstinjektion (Gardasil) bzw. nach einem und sechs Monaten (Cervarix) verabreicht werden. Kinder im Alter von neun bis 13 Jahren (Gardasil) bzw. bis 14 Jahren (Cervarix) werden nach einem Zweidosen-Schema mit nur einer weiteren Injektion sechs Monate nach der Erstinjektion geimpft.[51][52] Ob eine Auffrischimpfung erforderlich wird, ist noch Gegenstand weiterer Untersuchungen. Jedoch ergaben Nachbeobachtungen bisher keine Hinweise auf ein Nachlassen des Impfschutzes, wobei die Aussagefähigkeit der Studien für den Langzeitschutz über 5 Jahre hinaus schlechter war als für den Kurzzeitschutz bis zu 5 Jahren.[53] Daten aus zwei großen Phase-III-Studien mit dem bivalenten HPV-Impfstoff Cervarix weisen darauf hin, dass offenbar auch bereits eine einzelne Impfung ausreichend ist.[54]
Impfempfehlung
Die Impfung ist bis Ende Dezember 2019 weltweit in das Impfprogramm von über 124 Ländern und Territorien aufgenommen worden,[35] so in Australien,[55][56] Kanada,[57][58] Neuseeland[59] und Südkorea[60]. In den USA wurde die Impfung in vielen Bundesstaaten gesetzlich festgeschrieben.[61]
| Land | Datum der Impfempfehlung |
|---|---|
| Belgien | 11. Mai 2007 |
| Dänemark | 4. Oktober 2007 |
| Deutschland | 26. März 2007 |
| Frankreich | 16. März 2007 |
| Griechenland | 7. Februar 2008 |
| Irland | 5. August 2008 |
| Island | 19. Februar 2008 |
| Italien | 28. Februar 2007 |
| Luxemburg | 27. Februar 2007 |
| Niederlande | 31. März 2008 |
| Norwegen | 12. April 2007 |
| Österreich | 20. Dezember 2006 |
| Portugal | 10. Dezember 2007 |
| Schweden | 26. Februar 2008 |
| Schweiz | 18. Juni 2007 |
| Spanien | 10. Oktober 2007 |
| Vereinigtes Königreich | 26. Oktober 2007 |
Deutschland
Die Ständige Impfkommission (STIKO) empfahl die HPV-Impfung für Mädchen ab März 2007.[63]
Nach der Einführung der HPV-Impfung entbrannte in Deutschland eine Diskussion um deren Kosten, Kosteneffizienz, Werbemaßnahmen der Hersteller sowie Risiken der Impfung. Im November 2008 veröffentlichten 13 Gesundheitswissenschaftler auf einer Webseite der Universität Bielefeld ein „Manifest“,[64] in dem sie ein Ende von „irreführenden Informationen“ zur Wirksamkeit der HPV-Impfung und eine erneute Überprüfung der STIKO-Empfehlung forderten. Kritisiert wurde insbesondere, dass bisher keine Daten zum Schutz vor Zervixkarzinom vorliegen und die STIKO über die HPV-Impfempfehlung entschieden habe, bevor die entscheidenden Studiendaten publiziert worden seien.[46][65][66] Der Berufsverband der Frauenärzte (BVF), die Deutsche Gesellschaft für Gynäkologie und Geburtshilfe (DGGG), die Gesellschaft für Virologie (GfV) und die Deutsche Vereinigung zur Bekämpfung der Viruskrankheiten (DVV) sowie der Nobelpreisträger Harald zur Hausen wiesen die Kritik zurück.[67][68] In einer Stellungnahme zur Impfung nahm die STIKO 2009 auf die Kritik Bezug und kam nach Auswertung aller vorliegenden wissenschaftlichen Daten zu dem Schluss, dass die Impfung unverändert für Mädchen von 12 bis 17 Jahren empfehlenswert sei.[50] Daten aus flächendeckenden Programmen mit hoher Impfquote, wie in Australien, bestätigen die Empfehlung der STIKO.
Die STIKO setzte 2014 in ihren Empfehlungen die Altersgrenze für Mädchen herab.[69] Sie empfiehlt seit Sommer 2014 die Impfung gegen die HPV-Typen 16 und 18 für alle Mädchen im Alter von 9 bis 14 Jahren nach einem 2-Dosen-Schema. Danach sollten spätestens bis zum vollendeten 18. Lebensjahr versäumte Impfungen gegen HPV mit insgesamt 3 Impfdosen nachgeholt werden. Die vollständige Impfserie sollte vor dem ersten Geschlechtsverkehr abgeschlossen sein.[70]
Die Deutsche Gesellschaft für Urologie (DGU) und der Berufsverband der Deutschen Urologen (BDU) beurteilen 2018 die Impfung auch für Jungen als empfehlenswert.[71]
Am 5. Juni 2018 verabschiedete die STIKO einen Beschluss, in dem die Empfehlung der HPV-Impfung von Jungen im Alter von 9 bis 14 Jahren ausgesprochen wurde. Für den Fall, dass dieser Zeitraum nicht wahrgenommen wurde, wird eine Nachholimpfung noch bis zum Alter von 17 Jahren empfohlen.[72] Formell trat die Empfehlung mit ihrer Veröffentlichung sowie der wissenschaftlichen Begründung im Epidemiologischen Bulletin 26/2018 am 28. Juni 2018 in Kraft.[73]
Österreich
Der Oberste Sanitätsrat empfiehlt seit 2007 die Impfung gegen onkogene HPV-Typen für alle 9- bis 17-jährigen Mädchen und Frauen möglichst vor dem ersten Sexualkontakt. Die Impfung von Knaben bzw. männlichen Jugendlichen wird im österreichischen Impfplan 2009 als „prinzipiell sinnvoll“ bezeichnet, um eine Unterbrechung der Infektionskette zu erreichen. Bei Verwendung eines Impfstoffs, der auch vor Kondylomen verursachenden Viren schützt, hätten auch die männlichen Jugendlichen einen persönlichen Vorteil.[74]
Schweiz
Das Bundesamt für Gesundheit (BAG) und die Eidgenössische Kommission für Impffragen (EKIF) empfehlen die HPV-Impfung aller Jugendlichen allgemein im Alter von 11 bis 14 Jahren, bei 15- bis 26-Jährigen als Nachhold- oder Ergänzungsimpfung.[75]
Da bei Frauen häufiger HPV-assoziierte Krankheiten vorkommen, wird die Impfung bei jungen Mädchen als Basisimpfung empfohlen. Hierbei erhalten Mädchen bis 14 Jahren ein Zwei-Dosis-Impfschema (Abstand ca. 6 Monate).[76] Eine Nachholimpfung im Drei-Dosen-Schema (0/2/6 Monate) wird für adoleszente Mädchen bis zum 20. Geburtstag empfohlen.
Japan
Die HPV-Impfung war in Japan ab April 2013 als Routineimpfung empfohlen und ist ab diesem Zeitpunkt kostenfrei.[77] Die Empfehlung wurde im Juni 2013 ausgesetzt, nachdem Monate vorher wiederholte mutmaßliche schwere Nebenwirkungen von Impfgegnern verbreitet wurden.[77] So wurde das Auftreten des Komplexen regionalen Schmerzsyndroms bei einem 14-järhigen Mädchen kausal der HPV-Impfung angelastet.[78] Das Paul-Ehrlich-Institut sah 2013 nach Auswertung aller gemeldeten Verdachtsfälle und der Literatur kein Risikosignal für das Auftreten dieses Syndroms.[79] Dieser Einschätzung schloss sich die Europäische Arzneimittelagentur nach einem Review im November 2015 an.[80] 2017 plädierten die Mitglieder von 17 japanischen Fachgesellschaften für eine Erneuerung der Impfempfehlung.[81] Durch die Ereignisse sanken die HPV-Impfraten in Japan von 70 % auf zwischenzeitlich 0 %, sie liegen durch Informationskampagnen der Regierung mittlerweile bei 10 %.[77] Japans Regierung spricht zwar weiterhin öffentlich keine Impfempfehlung für HPV aus, sie ist trotzdem ein Bestandteil der Routine-Impfungen.
Kosten
Mit Ausnahme von Finnland haben bislang alle westeuropäischen Länder eine Finanzierung der HPV-Impfung beschlossen.[82] Internationale Studien zeigen bei der Kosten-Nutzen-Analyse der Impfung unter Annahme einer lebenslangen Dauer des Impfschutzes ein Kosten-Effektivitäts-Verhältnis, welches unter dem Schwellenwert von 50.000 Euro pro zusätzlichem qualitätsadjustiertem Lebensjahr (QALY), einem Lebensjahr mit guter Lebensqualität, liegt. Daher kommen die meisten Studien zum Ergebnis, dass die HPV-Impfung kosteneffektiv ist.[44][83][84] Eine Bewertung kann jedoch derzeit nur über Modellrechnungen erfolgen, deren Ergebnis von den berücksichtigten Faktoren (wie etwa Annahmen zur unbekannten Wirkung gegen Gebärmutterhalskrebs und unbekannten Dauer des Impfschutzes) und den Rahmenbedingungen im jeweiligen Land abhängt. So kam man in den Niederlanden zu dem Ergebnis, dass die Impfung nicht kosteneffektiv ist.[85][86] Die Impfung von Frauen, die 35 Jahre und älter sind, ist in den USA nicht kosteneffektiv.[87] Nobelpreisträger Harald zur Hausen hat selbst „…bei jeder sich bietenden Gelegenheit darauf hingewiesen, dass der Impfstoff zurzeit zu teuer ist. Dies gilt in besonderer Weise für Entwicklungsländer, in denen Gebärmutterhalskrebs zum Teil die häufigste Krebserkrankung von Frauen darstellt.“[88] In Kenia kostet der Impfstoff etwa ein halbes durchschnittliches Jahreseinkommen.[89][90]
Deutschland
Die Kosten für den Impfstoff belaufen sich auf um die 150 Euro pro erforderlicher Einzeldosis.[24] Im Jahr 2008 gaben die Krankenkassen in Deutschland für die beiden Impfstoffe Gardasil und Cervarix 244 Millionen Euro aus, so die Zahlen aus dem Arzneiverordnungs-Report 2009. Die gesetzlichen Krankenkassen übernehmen nach Aufnahme der Impfung in die Richtlinie des Gemeinsamen Bundesausschusses über Schutzimpfungen nach § 20d Abs. 1 SGB V,[91] die Impfkosten für Mädchen zwischen 9 und 17 Jahren. Einige Krankenkassen übernehmen die Kosten für die Impfung von Frauen bis zum 26. Lebensjahr als freiwillige Satzungsleistung.
Seit 2018 wird eine Impfung bei 9- bis 14-jährigen Jungen durch die Ständige Impfkommission (STIKO) empfohlen,[92] die Kosten übernehmen alle gesetzlichen Krankenkassen bis zum 17. Lebensjahr, manche Krankenkassen übernehmen sie als freiwillige Satzungsleistung bis zum 26. Lebensjahr.[93][94]
Österreich
Die HPV-Impfung für Mädchen und Jungen wurde am 12. August 2013 ins Schulimpfprogramm aufgenommen und ist damit seit Februar 2014 kostenfrei für Kinder von 9 bis 12 Jahren. Vergünstigte Preise gelten für Jugendliche bis 15 Jahre.[95]
Bereits zuvor konnte die Impfung in einzelnen Bundesländern im Rahmen von Schul- oder öffentlichen Impfaktionen vergünstigt bezogen werden. So lief in Niederösterreich bereits ab 2007 eine Impfaktion, bei der sich alle Mädchen und Frauen zwischen 9 und 26 Jahren an den niederösterreichischen Landeskliniken zu einem vergünstigten Preis von 90 Euro pro Dosis (statt 208 Euro) impfen lassen konnten. Im Burgenland wurde die Impfung ab September 2008 über eine Schulimpfaktion allen Mädchen der 5. bis 8. Schulstufe vergünstigt angeboten. Der Aktionspreis inkl. Landesförderung lag bei 90 Euro (statt 208 Euro) pro Teilimpfung. Auch Mädchen und Frauen von 15 bis 26 Jahren sowie Knaben von 9 bis 15 Jahren konnten den Impfstoff über eine öffentliche Impfaktion im Burgenland vergünstigt beziehen. Hier lag der Aktionspreis bei 150 Euro (statt 208 Euro) pro Teilimpfung.[96]
Das Ludwig Boltzmann Institut sah 2007 die Impfempfehlung aufgrund hoher Unsicherheit und hoher Kosten und somit unklarer Kosteneffektivität nur als dritte Option an.[97]
Schweiz
Für weibliche und männliche Jugendliche von 11 bis 26 Jahren werden die Kosten der HPV-Impfung durch die obligatorische Krankenversicherung übernommen.[98][99] Voraussetzung ist, dass die Leistung im Rahmen eines kantonalen Impfprogrammes erbracht wird. Die bivalente (HPV-Typ 16/18) und quadrivalente (HPV-Typ 6/11/16/18) HPV-Impfung wird zum Preis von 91,50 Fr. pro Dosis von den Versicherungen dem Kanton vergütet.[100] Die gesamte Rückerstattungspauschale für die Krankenkassen beträgt pro Impfung 159 Franken. Ab Juli 2016 wird diese auch für Knaben und junge Männer in der gleichen Altersgruppe gewährt.[101]
Unerwünschte Wirkungen
Zur Verträglichkeit der HPV-Impfung lagen zum Zeitpunkt der Zulassung Daten aus mehreren klinischen Studien mit über 20.000 Teilnehmerinnen vor. Seit der Zulassung von Gardasil wurden weltweit mehrere Millionen Mädchen und Frauen geimpft. Das Auftreten von unerwünschten Wirkungen, die möglicherweise durch die HPV-Impfung verursacht werden, wird in speziellen Überwachungsprogrammen registriert.
Aufgrund der vorliegenden Studiendaten wird die HPV-Impfung im deutschen Health Technology Assessment, von der US-amerikanischen Zulassungsbehörde für Arzneimittel (FDA), den Centers for Disease Control and Prevention (CDC), der Europäischen Arzneimittel-Agentur (EMA), der Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) und dem Global Advisory Committee der Weltgesundheitsorganisation (WHO) als sicher und gut verträglich eingeschätzt.[11][19][44][102][103][104]
Die in den kontrollierten Studien am häufigsten aufgetretenen unerwünschten Wirkungen waren bei beiden Impfstoffen lokale Reaktionen (Rötung, Schwellung und Schmerzen) an der Einstichstelle. In den Studien zu Gardasil traten lokale Reaktionen bei etwa 83 % der Frauen in der Impfgruppe und bei 73 % der Frauen in der Placebogruppe auf. Als (aktives) Placebo erhielten die Studienteilnehmer in fast allen Fällen eine Mischung aus Wasser und dem Adjuvans amorphes Aluminiumhydroxyphosphatsulfat.[14] Die häufigsten systemischen Reaktionen waren Kopfschmerzen, Müdigkeit, Muskelschmerzen und Übelkeit; sie traten in gleicher Häufigkeit in der Impf- und Placebogruppe auf. Fieber wurde bei 10–15 % der Frauen sowohl in der Impf- als auch in der Placebogruppe gemessen. Schwerere unerwünschte Wirkungen traten ebenfalls gleich häufig in der Impf- und Placebogruppe auf und bestanden in einer Einengung der Atemwege (Bronchospasmus), Gastroenteritis, Erhöhung des Blutdrucks, starken Kopfschmerzen, Schmerzen an der Einstichstelle und verminderter Beweglichkeit im benachbarten Gelenk. In einer Studie, die das Auftreten von chronischen Krankheiten bis zu vier Jahre nach Gabe des HPV-Impfstoffs oder des Placebos untersuchte, zeigte sich, dass bei 3 % der Frauen in der Impfgruppe eine chronische Krankheit aufgetreten war. In der Placebogruppe lag der Anteil neu aufgetretener chronischer Krankheiten bei 5 %. Hinsichtlich aufgetretener Todesfälle zeigte eine Metaanalyse der klinischen Studien, dass Todesfälle gleich häufig in Impf- und Placebogruppe auftraten und zumeist durch Unfälle verursacht waren. Für keinen der Todesfälle wurde die Impfung als Ursache angesehen.[37][105]
Seit der US-Zulassung des HPV-Impfstoffs Gardasil im Juni 2006 sind bei der FDA und bei den Centers for Disease Control and Prevention im Rahmen von Überwachungsprogrammen bis zum September 2009 17.160 Berichte über mögliche unerwünschte Arzneimittelwirkungen bei etwa 26 Millionen verabreichter Dosen Impfstoff eingegangen. Die überwiegende Zahl der unerwünschten Wirkungen (92 %) wurde als nicht schwerwiegend eingestuft und bestand in lokalen Reaktionen, Kopfschmerzen, Übelkeit, Fieber und Synkopen. 8 % der gemeldeten unerwünschten Wirkungen waren schwerwiegend. Als schwerwiegend wurden Fälle definiert, bei denen es zu einer Krankenhausaufnahme, zu einer lebensbedrohlichen Erkrankung, zu einer irreversiblen Behinderung oder zum Tod kam. Beispielsweise wurden im zeitlichen Zusammenhang mit der Impfung aufgetretene Erkrankungen an einem Guillain-Barré-Syndrom, Thrombosen sowie Todesfälle gemeldet. Alle schwerwiegenden Fälle wurden hinsichtlich einer möglichen Verursachung durch Gardasil untersucht; in keinem Fall konnte ein ursächlicher Zusammenhang zwischen der Impfung und der jeweiligen Erkrankung nachgewiesen werden.[102] Das vermutete erhöhte Thromboserisiko konnte durch eine dänische Fall-Kontroll-Studie nicht bestätigt werden.[106] Eine weitere große Kohortenstudie aus Skandinavien konnte zudem zeigen, dass die HPV-Impfung nicht mit einem erhöhten Risiko für Multiple Sklerose (MS) und anderen demyelinisierenden Erkrankungen verbunden ist.[107]
Cervarix weist ein zu Gardasil ähnliches Nebenwirkungsspektrum auf: die nach der Verabreichung am häufigsten beobachteten Nebenwirkungen waren Schmerzen an der Injektionsstelle (78 %) sowie Kopf- und Muskelschmerzen.[51] Für beide Impfstoffe wurden in Einzelfällen eine Schwellung der Lymphknoten (Lymphadenopathie) sowie anaphylaktoide Reaktionen berichtet. Ein kausaler Zusammenhang zwischen einer HPV-Impfung und einer Unfruchtbarkeit durch Ovarialinsuffizienz konnte nicht gezeigt werden.[108] Ein hierfür plausibler biologischer Entstehungsmechanismus ist nicht bekannt.
Im November 2015 gab die Europäische Arzneimittelagentur (EMA) bekannt, dass sie HPV-Impfstoffe in einem Review untersucht habe, bei dem nicht das Nutzen-Risiko-Verhältnis in Frage gestellt, sondern geprüft wurde, ob zwei selten im Zusammenhang mit der Impfung berichtete unerwünschte Wirkungen, das komplexe regionale Schmerzsyndrom (Complex Regional Pain Syndrome, CRPS) und das posturale orthostatische Tachykardiesyndrom (POTS), bei geimpften Frauen häufiger auftreten als bei ungeimpften. Die Auswertung aller verfügbaren wissenschaftlichen Informationen und Meldungen in Bezug auf die beiden Syndrome ergab, dass die im zeitlichen Zusammenhang mit HPV-Impfungen beobachteten Melderaten dieser Erkrankungen der erwarteten Häufigkeit des Auftretens in der untersuchten Altersgruppe (weibliche Jugendliche im Alter von 10 bis 17 Jahren) entspreche und sich somit kein Hinweis auf einen Zusammenhang ergebe.[80] Nach einer im Dezember 2015 publizierten Kritik der dänischen Wissenschaftlerin Louise Brinth an diesem Review[109] reichte der Direktor des Nordic Cochrane Centres, Peter C. Gøtzsche, im Mai 2016 eine formelle Beschwerde zu dem offiziellen Beurteilungsbericht der EMA ein.[110]
2018 hat ein Cochrane-Review die Impfung als wirksam und sicher beurteilt.[111]
Dieses Review wurde von Gøtzsche und seinen Kollegen ebenfalls kritisiert.[112] Er wurde wegen „fortgesetztes schlechtes Benehmen, welches nicht mit den Prinzipien und der Steuerung von Cochrane vereinbar sei“ am 26. September 2018 aus der Cochrane Collaboration ausgeschlossen.[113][114]
Schwangerschaft und Stillzeit
Hinsichtlich der Sicherheit einer Impfung mit HPV-Impfstoffen während der Schwangerschaft existieren nur begrenzte Daten aus klinischen Studien. Diese zeigten kein erhöhtes Risiko für den Embryo oder den Fetus. So hat man beispielsweise bei knapp 1.800 untersuchten, unabsichtlich während der Schwangerschaft geimpften Frauen keine Hinweise auf einen negativen Ausgang beobachtet.[115] Es gibt auch keine Hinweise für unerwünschte Wirkungen der Impfung während der Stillzeit.[116] Obwohl weder Tierexperimente noch die vorhandenen Daten aus klinischen Studien beim Menschen Hinweise auf direkte oder indirekte schädliche Auswirkungen geben, hat die STIKO eine Impfung während der Schwangerschaft 2007 vorsichtshalber nicht „als bedenkenlos“ eingestuft und die Hersteller raten vorsichtshalber von der Anwendung während der Schwangerschaft ab.[117][118]
Gardasil wurde in klinischen Studien bei stillende Müttern gegen Placebo getestet. Die Häufigkeit der Nebenwirkungen bei Mutter und Säugling war in beiden Gruppen vergleichbar. Die Immunogenität des Impfstoffs bei stillenden Müttern war mit der Immunogenität des Impfstoffs bei Frauen, die zum Zeitpunkt der Impfung nicht gestillt haben, vergleichbar. Gardasil kann stillenden Frauen daher verabreicht werden.[14]
Die Auswirkungen auf gestillte Kinder, deren Mütter Cervarix erhalten haben, sind (Stand 2013) in klinischen Studien noch nicht untersucht worden. Cervarix sollte darum während der Stillzeit nur verabreicht werden, wenn die möglichen Vorteile mögliche Risiken überwiegen.[51]
Die Autoren der S3-Leitlinie Impfprävention HPV-assoziierter Neoplasien[119] der Paul-Ehrlich-Gesellschaft für Chemotherapie (AG HPV-Management-Forum), der Deutschen STD-Gesellschaft und der Deutschen Dermatologischen Gesellschaft halten eine Impfung in der Stillzeit generell für vertretbar.[9]
Therapeutische HPV-Impfstoffe
Zusätzlich zu den beiden präventiven Impfstoffen Gardasil 9 und Cervarix, werden für bereits Infizierte therapeutische HPV-Impfstoffe entwickelt. Sie befinden sich in klinischer Testung und sind damit noch nicht zugelassen.
Beispielsweise enthält VGX-3100 zwei DNA-Plasmide, die intramuskulär via Elektroporation injiziert werden.[120] Körpereigene Zellen exprimieren dann nach Aufnahme der Plasmide die Onkoproteine E6 und E7 der HPV-Typen 16 und 18. Das Immunsystem richtet sich damit gegen diese Proteine und bildet zytoxische T-Zellen aus. Ein anderer Impfstoffkandidat ist ein Vektorimpfstoff, MVA-E2. Er enthält das Modified-Vaccinia-Ankara-Virus (MVA), das direkt in die Gebärmutter von Patientinnen injiziert wird, die von CIN-Zellveränderung betroffen sind.[121] MVA exprimiert das E2-Protein des Bovinen Papillomvirus Typ 1 (BPV-1).[122]
Wissenschaftler des Deutschen Krebsforschungszentrums entwickelten einen therapeutischen Impfstoff, mit dem im Tierversuch an Mäusen der durch HPV verursachte Gebärmutterhalskrebs bekämpft werden konnte. Bei der Hälfte der geimpften Tiere bildeten sich die Tumoren zurück.[123][124]
Literatur
- Gregory D. Zimet, Marcia L. Shew, Jessica A. Kahn: Appropriate use of cervical cancer vaccine. In: Annual Review of Medicine. Band 59, 2008, S. 223–236, doi:10.1146/annurev.med.59.092806.131644, PMID 18186704.
- Emily Farmer et al.: Vaccination Strategies for the Control and Treatment of HPV Infection and HPV-Associated Cancer. In: Recent results in cancer research. Fortschritte der Krebsforschung. Progres dans les recherches sur le cancer. Band 217, 2021, S. 157–195, doi:10.1007/978-3-030-57362-1_8, PMID 33200366, PMC 8564785 (freier Volltext).
Weblinks
- S3-Leitlinie Impfprävention HPV-assoziierter Neoplasien der Paul-Ehrlich-Gesellschaft für Chemotherapie (AG HPV-Management-Forum), der Deutschen STD-Gesellschaft und der Deutschen Dermatologischen Gesellschaft. In: AWMF online (Stand 05/2020)
- Informationen des Robert Koch-Instituts zu HPV-Impfstoffen
- Veröffentlichungen der Europäischen Arzneimittelagentur zu Gardasil und zu Cervarix
- HPV-Impfung: Antworten auf häufige Fragen – Wovor schützt die Impfung? Krebsinformationsdienst des Deutschen Krebsforschungszentrums (DKFZ), Heidelberg, 7. Spetember 2020
- EMA - Übersicht zugelassener Impfstoffe
Einzelnachweise
- ↑ WHO Model Lists of Essential Medicines. (PDF) In: WHO. 2019, abgerufen am 4. April 2020 (englisch).
- ↑ Human papillomavirus vaccines: WHO position paper, May 2017. In: WHO (Hrsg.): Weekly epidemiological record. Band 92, Nr. 19, 2017, S. 241–268, PMID 28530369 (who.int [PDF]).
- ↑ Krebsinformationsdienst, Deutsches Krebsforschungszentrum: HPV-Impfung. In: www.krebsinformationsdienst.de.
- ↑ Gebärmutterhalskrebs (Zervixkarzinom) beim Zentrum für Krebsregisterdaten (ZfKD) im Robert Koch-Institut, Stand: 28. Februar 2018
- ↑ Schutzimpfung gegen Humane Papillomviren (HPV): Antworten auf häufig gestellte Fragen (FAQ) zu Erreger und Impfung. Kann auch nach dem ersten Sex noch gegen HPV geimpft werden? In: RKI. 7. Juni 2018, abgerufen am 27. Mai 2021.
- ↑ Maura L. Gillison, Anil K. Chaturvedi, Douglas R. Lowy: HPV prophylactic vaccines and the potential prevention of noncervical cancers in both men and women. In: Cancer 113, 2008, S. 3036–3046, doi:10.1002/cncr.23764, PMID 18980286, online (PDF; 177 kB).
- ↑ Stefanie J. Klug, Meike Hukelmann, Bettina Hollwitz, Nurgül Düzenli, Betti Schopp, Karl-Ulrich Petry, Thomas Iftner: Prevalence of human papillomavirus types in women screened by cytology in Germany. In: J Med Virol 79 (2007), S. 616–25, PMID 17385693.
- ↑ V. Cogliano, R. Baan, K. Straif, Y. Grosse, B. Secretan, F. El Ghissassi: Carcinogenicity of human papillomaviruses. In: Lancet Oncol, 6, 2005, S. 204, PMID 15830458.
- ↑ a b S3-Leitlinie Impfprävention HPV-assoziierter Neoplasien der Paul-Ehrlich-Gesellschaft für Chemotherapie (AG HPV-Management-Forum), der Deutschen STD-Gesellschaft und der Deutschen Dermatologischen Gesellschaft. In: AWMF online (Stand 06/2008)
- ↑ Über die Zulassung von Gardasil siehe: Zulassung eines neuen Impfstoffes: Gardasil. In: Swissmedic Journal, 6. Jahrgang, Nr. 1, 2007, ISSN 0026-9212, S. 12–13; swissmedic.ch (PDF; 522 kB).
- ↑ a b Gardasil – European Public Assessment Report. Europäische Arzneimittel-Agentur; abgerufen am 9. Februar 2016.
- ↑ Pressemitteilung zur Sicherheit von Gardasil. (PDF; 28 kB) Europäische Arzneimittelagentur, 24. Januar 2008
- ↑ a b Approved Products – Gardasil. In: fda.gov. Center for Biologics Evaluation and Research
- ↑ a b c Fachinformationen Gardasil (PDF; 384 kB)
- ↑ FDA Approves New Indication for Gardasil to Prevent Genital Warts in Men and Boys. ( vom 10. Mai 2015 im Internet Archive) FDA, Pressemitteilung, 16. Oktober 2009.
- ↑ FDA: Gardasil approved to prevent anal cancer ( vom 7. August 2015 im Internet Archive) FDA, Pressemitteilung, 22. Dezember 2010
- ↑ Gardasil Procedural steps taken and scientific information after the authorisation (PDF; 339 kB) ema.europa.eu
- ↑ FDA-Zulassung von Cervarix.
- ↑ a b Cervarix – European Public Assessment Report. Europäische Arzneimittelagentur; abgerufen am 14. Februar 2009.
- ↑ Broad Spectrum HPV (Human Papillomavirus) Vaccine Study in 16-to 26-Year-Old Women (V503-001) auf ClinicalTrials.gov
- ↑ Warner K Huh, Elmar A Joura, Anna R Giuliano, Ole-Erik Iversen, Rosires Pereira de Andrade, Kevin A Ault, Deborah Bartholomew, Ramon M Cestero, Edison N Fedrizzi, Angelica L Hirschberg, Marie-Hélène Mayrand, Angela Maria Ruiz-Sternberg, Jack T Stapleton, Dorothy J Wiley, Alex Ferenczy, Robert Kurman, Brigitte M Ronnett, Mark H Stoler, Jack Cuzick, Suzanne M Garland, Susanne K Kjaer, Oliver M Bautista, Richard Haupt, Erin Moeller, Michael Ritter, Christine C Roberts, Christine Shields, Alain Luxembourg: Final efficacy, immunogenicity, and safety analyses of a nine-valent human papillomavirus vaccine in women aged 16–26 years: a randomised, double-blind Trial. Lancet 390 (2017), S. 2143–2159, PMID 28886907, doi:10.1016/S0140-6736(17)31821-4
- ↑ FDA approves Gardasil 9 for prevention of certain cancers caused by five additional types of HPV FDA News Release.
- ↑ Gardasil 9. In: ema.europa.eu. European Medicines Agency
- ↑ a b HPV-Impfung – Gebärmutterhalskrebs vorbeugen. In: www.krebsgesellschaft.de.
- ↑ Christina Schellenbacher, Kihyuck Kwak, Dieter Fink, Saeed Shafti-Keramat, Bettina Huber, Christoph Jindra, Helena Faust, Joakim Dillner, Richard B.S. Roden, Reinhard Kirnbauer: Efficacy of RG1-VLP Vaccination against Infections with Genital and Cutaneous Human Papillomaviruses. In: Journal of Investigative Dermatology, 2013; 133: 2706–2713, PMID 23752042, doi:10.1038/jid.2013.253
- ↑ Neue HPV-Vakzine könnte breiteren Schutz bieten. Mitteilung der Medizinischen Universität Wien vom 26. Februar 2014.
- ↑ M. Arbyn et al.: Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors. In: Cochrane Database of Systematic Reviews, 2018, Issue 5. Art. No.: CD009069. doi:10.1002/14651858.CD009069.pub3 PMC 4176676 (freier Volltext).
- ↑ Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Die HPV-Impfung wirkt. 11. April 2019, abgerufen am 27. Mai 2019.
- ↑ Tim Palmer et al.: Prevalence of cervical disease at age 20 after immunisation with bivalent HPV vaccine at age 12-13 in Scotland: retrospective population study. In: BMJ. Band 365, 3. April 2019, S. l1161, doi:10.1136/bmj.l1161, PMID 30944092.
- ↑ Mélanie Drolet et al.: Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes: updated systematic review and meta-analysis. In: Lancet (London, England). Band 394, Nr. 10197, 10. August 2019, S. 497–509, doi:10.1016/S0140-6736(19)30298-3, PMID 31255301.
- ↑ Nancy M. McClung et al.: Declines in Vaccine-Type Human Papillomavirus Prevalence in Females Across Racial/Ethnic Groups: Data From a National Survey. In: Journal of Adolescent Health. Band 65, Nr. 6, 1. Dezember 2019, S. 715–722, doi:10.1016/j.jadohealth.2019.07.003.
- ↑ HPV prevalence in sexually active young females in England. Public Health England, 22. Januar 2020, abgerufen am 28. Januar 2020 (englisch).
- ↑ England: Weniger Zervixkarzinome bei jüngeren Frauen dank HPV-Impfung. In: Deutsches Ärzteblatt. 4. November 2021, abgerufen am 5. November 2021.
- ↑ Milena Falcaro et al.: The effects of the national HPV vaccination programme in England, UK, on cervical cancer and grade 3 cervical intraepithelial neoplasia incidence: a register-based observational study. In: The Lancet. 3. November 2021, doi:10.1016/S0140-6736(21)02178-4.
- ↑ a b Jiayao Lei, Alexander Ploner, K. Miriam Elfström, Jiangrong Wang u. a.: HPV Vaccination and the Risk of Invasive Cervical Cancer New England Journal of Medicine 2020, Band 383, Ausgabe 14 vom 1. Oktober 2020, Seiten 1340–1348, doi:10.1056/NEJMoa1917338
- ↑ Diane M. Harper, Martin S. Hirsch, Barbara H. McGovern: Human papillomavirus vaccines. In: D. S. Basow (Hrsg.): UpToDate. UpToDate, Waltham, MA, 2008.
- ↑ a b L. Rambout, L. Hopkins, B. Hutton, D. Fergusson: Prophylactic vaccination against human papillomavirus infection and disease in women: a systematic review of randomized controlled trials. In: CMAJ. 2007 Aug 28;177(5):469–79. PMID 17671238
- ↑ European Public assessment report – Scientific discussion (PDF; 524 kB) 5. Oktober 2006 (englisch).
- ↑ Anna R. Giuliano et al.: Efficacy of Quadrivalent HPV Vaccine against HPV Infection and Disease in Males. In: New England Journal of Medicine. Band 364, Nr. 5, 3. Februar 2011, S. 401–411, doi:10.1056/NEJMoa0909537, PMID 21288094, PMC 3495065 (freier Volltext).
- ↑ Rüdiger Meyer: Früher Rückgang der Zervixläsionen durch HPV-Impfung. Dt. Ärzteblatt 108 (2011), S. A-1458, aerzteblatt.de (PDF)
- ↑ Julia ML Brotherton, Masha Fridman, Cathryn L May, Genevieve Chappell, A Marion Saville, Dorota M Gertig: Early effect of the HPV vaccination programme on cervical abnormalities in Victoria, Australia: an ecological study. In: Lancet, 377, 2011, S. 2085–2092, doi:10.1016/S0140-6736(11)60551-5
- ↑ a b Paavonen J et al.: Efficacy of a prophylactic adjuvanted bivalent L1 virus-like-particle vaccine against infection with human papillomavirus types 16 and 18 in young women: an interim analysis of a phase III double-blind, randomised controlled trial. In: The Lancet. 369. Jahrgang, Nr. 9580, Juni 2007, S. 2161–70, doi:10.1016/S0140-6736(07)60946-5, PMID 17602732.
- ↑ a b c Vera Zylka-Menhorn: HPV-Impfung: Die Studienwelt wurde erweitert. Dtsch Arztebl 106 (2009), A-1185.
- ↑ a b c O Damm, M Nocon, S Roll, C Vauth, SN Willich, W Greiner: Impfung gegen humane Papillomaviren (HPV) zur Prävention HPV 16/18 induzierter Zervixkarzinome und derer Vorstufen. Schriftenreihe Health Technology Assessment, 2009, Band 83, 1. Auflage dimdi.de (PDF; 689 kB) abgerufen am 11. März 2009
- ↑ JF Smith, M Brownlow, M Brown et al.: Antibodies from women immunized with Gardasil cross-neutralize HPV 45 pseudovirions. Hum Vaccin 3 (2007), 109–115
- ↑ a b H M Hepburn, A M Kaufmann: Nobelpreis für die Impfung gegen Zervixkrebs. Aktuelle Daten- und Leitlinienlage. In: Internist, 50, 2009, S. 617–626, doi:10.1007/s00108-009-2388-9
- ↑ Rolando Herrero, Wim Quint, Allan Hildesheim, Paula Gonzalez, Linda Struijk, Hormuzd A. Katki, Carolina Porras, Mark Schiffman, Ana Cecilia Rodriguez, Diane Solomon, Silvia Jimenez, John T. Schiller, Douglas R. Lowy, Leen-Jan van Doorn, Sholom Wacholder, Aim e R. Kreimer, Torbj rn Ramqvist: Reduced Prevalence of Oral Human Papillomavirus (HPV) 4 Years after Bivalent HPV Vaccination in a Randomized Clinical Trial in Costa Rica. In: PLoS ONE. 8, 2013, S. e68329, doi:10.1371/journal.pone.0068329.
- ↑ Zweifel an der Wirksamkeit. In: Frankfurter Rundschau, 28. November 2008
- ↑ Bielefelder Manifest ( vom 28. März 2016 im Internet Archive) (PDF) von Gesundheitswissenschaftlern zur HPV-Impfung.
- ↑ a b Empfehlung der STIKO zur HPV-Impfung (PDF; 170 kB) In: Epidemiologisches Bulletin, 32/2009, 10. August 2009
- ↑ a b c Produktinformationstexte Cervarix (PDF; 467 kB) Europäische Arzneimittelagentur, Stand Februar 2014.
- ↑ Zwei-Dosen-Schema für HPV-Impfstoffe. In: apotheke-adhoc.de. 7. April 2014, abgerufen am 10. Juni 2018.
- ↑ Yvonne Deleré et al.: Effektivität und Dauer des Impfschutzes gegen humane Papillomviren: Systematische Literaturübersicht und Metaanalyse. In: Dtsch Arztebl Int, 111, 2014, S. 584–591, doi:10.3238/arztebl.2014.0584
- ↑ A R Kreimer et al.: Efficacy of fewer than three doses of an HPV-16/18 AS04-adjuvanted vaccine: combined analysis of data from the Costa Rica Vaccine and PATRICIA trials. In: The Lancet, online veröffentlicht am 10. Juni 2015 doi:10.1016/S1470-2045(15)70199-3
- ↑ Human Papillomavirus (HPV) ( vom 23. Februar 2016 im Internet Archive), Immunise Australia Program
- ↑ Government funds Gardasil. Australian Government Department of Health
- ↑ Human Papillomavirus (HPV) Prevention and HPV Vaccine: Questions and Answers. Public Health Agency of Canada
- ↑ Update On Human Papillomavirus (HPV) Vaccines. Public Health Agency of Canada
- ↑ Informationen zur HPV-Impfung in Neuseeland ( vom 30. Januar 2009 im Internet Archive) Ministry of Health
- ↑ Young-Tak Kim: Current status of cervical cancer and HPV infection in Korea. In: J Gynecol Oncol, 20, 2009, S. 1–7, PMID 19471667, doi:10.3802/jgo.2009.20.1.1
- ↑ HPV Vaccine: State Legislation. National Conference of State Legislatures.
- ↑ Jan Leidel: Stellungnahme an den Landtag Nordrhein-Westfalen. (PDF; 2,9 MB) 23. Februar 2009
- ↑ Impfung gegen humane Papillomaviren (HPV) für Mädchen von 12 bis 17 Jahren – Empfehlung und Begründung. In: RKI (Hrsg.): Epidemiologisches Bulletin. Nr. 12, 23. März 2007, S. 97–106 (rki.de [PDF]).
- ↑ Wissenschaftler/innen fordern Neubewertung der HPV-Impfung und ein Ende der irreführenden Informationen. (PDF) 25. November 2008, archiviert vom (nicht mehr online verfügbar) am 1. April 2014; abgerufen am 25. April 2017.
- ↑ Volker Stollorz: Impfen und Schimpfen. In: Die Zeit, Nr. 21/2009.
- ↑ Ansgar Gerhardus et al.: Gebärmutterhalskrebs: Wie wirksam ist die HPV-Impfung? In: Dtsch Arztebl, 106, 2009, S. A-330 aerzteblatt.de
- ↑ Joachim Müller-Jung: Vier Fachverbände verteidigen Krebsimpfung. In: FAZ, 8. Dezember 2008; abgerufen am 30. Juni 2009.
- ↑ Sonja Kastilian: Ein ärgerliches Manifest. In: FAZ, 8. Dezember 2008; abgerufen am 30. Juni 2009.
- ↑ HPV-Impfung: STIKO setzt Altersgrenze herab. In: univadis.de. 26. August 2014, archiviert vom (nicht mehr online verfügbar) am 12. Juni 2018; abgerufen am 12. Juni 2018.
- ↑ Empfehlung der STIKO zur HPV-Impfung. (PDF; 241 kB) In: Epidemiologisches Bulletin, 34/2014, 25. August 2014.
- ↑ Urologen empfehlen: Die HPV-Impfung für Jungen. In: urologenportal.de. DGU, BDU, 23. Juni 2016, abgerufen am 10. Juni 2018.
- ↑ Schutzimpfung gegen Humane Papillomviren (HPV): Häufig gestellte Fragen und Antworten: Sollen sich auch Jungen gegen HPV impfen lassen? Robert Koch Institut, 7. Juni 2018, abgerufen am 10. Juni 2018.
- ↑ Wissenschaftliche Begründung für die Empfehlung der HPV-Impfung für Jungen im Alter von 9 bis 14 Jahren. (PDF; 806 kB) In: Epidemiologisches Bulletin, 26/2018, 28. Juni 2018.
- ↑ Impfplan 2009 Österreich – Evidenz-basierte Empfehlungen des Obersten Sanitätsrates ( vom 5. November 2013 im Internet Archive) (PDF; 452 kB), 14. Oktober 2008.
- ↑ Humane Papillomaviren (HPV). In: Bundesamt für Gesundheit. Abgerufen am 17. April 2021.
- ↑ Schweizerischer Impfplan. In: Bundesamt für Gesundheit BAG. 15. April 2021, abgerufen am 17. April 2021.
- ↑ a b c Yutaka Ueda et al.: The last strategy for re-dissemination of HPV vaccination in Japan while still under the suspension of the governmental recommendation. In: Scientific Reports. Band 10, Nr. 1, 30. September 2020, S. 16091, doi:10.1038/s41598-020-73120-1.
- ↑ Doris Uhl: Japan setzt Empfehlung für HPV-Impfung aus. Deutsche Apothekerzeitung vom 20. Juni 2013.
- ↑ Kein Hinweis auf ein erhöhtes Risiko für Autoimmunerkrankungen nach HPV-Impfung. (PDF; 1,1 MB) In: Bulletin zur Arzneimittelsicherheit, Ausgabe 3. Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel (Paul-Ehrlich-Institut), September 2013, abgerufen am 18. März 2020.
- ↑ a b HPV-Impfstoffe – EMA bestätigt: Nachweise unterstützen nicht die Annahme, dass die Impfstoffe CRPS oder POTS verursachen. (PDF) In: EMA. 12. Januar 2016, abgerufen am 20. Dezember 2020.
- ↑ Satoshi Iwata, Kenji Okada, Kei Kawana: Consensus statement from 17 relevant Japanese academic societies on the promotion of the human papillomavirus vaccine. Vaccine 35 (2017), S. 2291–2292, PMID 28325478, doi:10.1016/j.vaccine.2017.03.015, vaccine-kyogikai.umin.jp (PDF; 219 kB)
- ↑ Sepp Leodolter: Psychische und körperliche Belastung durch Krebsvorstufen und Konisation: Kombinierte Vorsorgestrategie könnte auch Großteil der Gebärmutterhalskrebs-Vorstufen verhindern. Österreichische Initiative gegen Gebärmutterhalskrebs, 3. Dezember 2008
- ↑ F Marra, K Cloutier, B Oteng, C Marra, G Ogilvie: Effectiveness and cost effectiveness of human papillomavirus vaccine: a systematic review. In: Pharmacoeconomics, 27, 2009, S. 127–147, PMID 19254046, doi:10.2165/00019053-200927020-00004
- ↑ M. Jit et al.: Economic evaluation of human papillomavirus vaccination in the United Kingdom. BMJ 337 (2008), 769, doi:10.1136/bmj.a769
- ↑ Inge M. C. M. de Kok, Marjolein van Ballegooijen, J. Dik F. Habbema: Cost-Effectiveness Analysis of Human Papillomavirus Vaccination in the Netherlands. Journal of the National Cancer Institute, doi:10.1093/jnci/djp183
- ↑ Roxanne Nelson: HPV Vaccination Is Not Cost-Effective in the Netherlands. Medscape Medical News
- ↑ Jane J. Kim: Cost-Effectiveness of Human Papillomavirus Vaccination and Cervical Cancer Screening in Women Older Than 30 Years in the United States. In: Annals of Internal Medicine. 151. Jahrgang, Nr. 8, 19. Oktober 2009, S. 538–545 (annals.org [abgerufen am 20. Oktober 2009]).
- ↑ Verhütung der nötigen Zervix-Ca-Vorstufen durch die Impfung ist eindeutig belegt. Interview mit Harald zur Hausen. In: Ärzte Zeitung, 3. Dezember 2008.
- ↑ Medical News Today, 5. September 2007 ( vom 3. Januar 2009 im Internet Archive) abgerufen 22. Februar 2016
- ↑ The Economic Impact of AIDS in Kenya (S.11) (PDF; 230 kB), The POLICY Project, 1999.
- ↑ Richtlinie des Gemeinsamen Bundesausschusses über Schutzimpfungen nach § 20d Abs. 1 SGB V, zuletzt geändert am 5. Dezember 2013 (PDF; 380 kB).
- ↑ Vorabinformation: STIKO empfiehlt HPV-Impfung für Jungen. In: Empfehlungen der STIKO. RKI, abgerufen am 11. Juni 2018.
- ↑ Kassen zahlen HPV-Impfung auch für Jungen, auf spiegel.de
- ↑ Übersicht über Krankenkassen, die die Kosten einer HPV-Impfung übernehmen.
- ↑ HPV-Impfung gratis, Mitteilung des Bundesministeriums für Gesundheit.
- ↑ Österreichische Initiative gegen Gebärmutterhalskrebs.
- ↑ Ingrid Zechmeister, Birgitte Freiesleben de Blasio, Philipp Radlberger, Claudia Wild, Erich Kvas, Geoff Garnett, Aileen Rae Neilson: Ökonomische Evaluation der Impfung gegen humane Papillomaviren (HPV-Impfung) in Österreich. (PDF; 961 kB) HTA-Projektbericht 2007; 9.
- ↑ Humane Papillomaviren (HPV). Impfung gegen Gebärmutterhalskrebs. In: admin.ch. Bundesrat, archiviert vom (nicht mehr online verfügbar) am 23. Juli 2010; abgerufen am 23. Juli 2010.
- ↑ Impfung gegen humane Papillomaviren (HPV): Kostenübernahme durch die obligatorische Krankenpflegeversicherung. In: Bundesamt für Gesundheit (Hrsg.): Bulletin. Nr. 8, 18. Februar 2008 (Impfung gegen humane Papillomaviren (HPV): Kostenübernahme durch die obligatorische Krankenpflegeversicherung ( vom 26. April 2009 im Internet Archive) [PDF]). Impfung gegen humane Papillomaviren (HPV): Kostenübernahme durch die obligatorische Krankenpflegeversicherung ( vom 23. September 2015 im Internet Archive)
- ↑ P. Pesenti: HPV-Impfprogramme in den Kantonen. ( vom 4. Dezember 2013 im Internet Archive; PDF; 50 kB) Medienorientierung, 15. September 2008.
- ↑ Kostenübernahme von Impfungen gegen HPV. Bundesamts für Gesundheit, 15. Dezember 2015, Mitteilung.
- ↑ a b This page has been moved HPV – Vaccines – Vaccine Safety – CDC. In: cdc.gov.
- ↑ FIGO Statement on HPV Vaccination Safety. (PDF; 85 kB) Fédération Internationale de Gynécologie et d’Obstétrique, 2. August 2013.
- ↑ Global Advisory Committee on Vaccine Safety Statement on the continued safety of HPV vaccination. (PDF; 173 kB) Global Advisory Committees der Weltgesundheitsorganisation (WHO), 12. März 2014.
- ↑ Francisco A. R. Garcia, Debbie Saslow: Prophylactic human papillomavirus vaccination: a breakthrough in primary cervical cancer prevention. In: Obstetrics and Gynecology Clinics of North America. Band 34, Nr. 4, Dezember 2007, S. 761–781, ix, doi:10.1016/j.ogc.2007.09.007, PMID 18061868.
- ↑ Nikolai Madrid Scheller, Björn Pasternak, Henrik Svanström, Anders Hviid: Quadrivalent human papillomavirus vaccine and the risk of venous thromboembolism. In: JAMA. Band 312, Nr. 2, Juli 2014, S. 187–188, doi:10.1001/jama.2014.2198, PMID 25005658.
- ↑ Nikolai Madrid Scheller, Henrik Svanström, Björn Pasternak, Lisen Arnheim-Dahlström, Karin Sundström, Katharina Fink, Anders Hviid: Quadrivalent HPV Vaccination and Risk of Multiple Sclerosis and Other Demyelinating Diseases of the Central Nervous System In: JAMA, 313, 2015, S. 54–61, doi:10.1001/jama.2014.16946.
- ↑ David Hawkes: Evidence evolves over time and should be based on data not opinion. In: BMJ Evidence-Based Medicine. Band 25, Nr. 6, 1. Dezember 2020, S. 191–192, doi:10.1136/bmjebm-2019-111222, PMID 31548208.
- ↑ Louise Brinth: Responsum to Assessment Report on HPV-vaccines released by EMA November 26th 2015. (PDF; 1,3 MB)
- ↑ Complaint to the European Medicines Agency (EMA) over maladministration at the EMA. (PDF) Nordic Cochrane Center, 26. Mai 2016.
- ↑ M Arbyn, L Xu, C Simoens, PPL Martin-Hirsch: Prophylactic vaccination against human papillomaviruses to prevent cervical cancer and its precursors. Cochrane Database of Systematic Reviews 2018, Issue 5. Art. No.: CD009069. doi:10.1002/14651858.CD009069.pub3.
- ↑ L Jørgensen, PC Gøtzsche, T. Jefferson: The Cochrane HPV vaccine review was incomplete and ignored important evidence of bias. BMJ Evidence-Based Medicine 2018; 23, S. 165–168, doi:10.1136/bmjebm-2018-111012
- ↑ Statement from Cochrane’s Governing Board
- ↑ Statement from Cochrane’s Governing Board – 26th September 2018
- ↑ HPV-Impfung in Schwangerschaft ohne negative Folgen. Deutsches Ärzteblatt, 31. März 2017, abgerufen am 9. September 2019.
- ↑ Ulrich Heininger: Impfratgeber. Impfempfehlungen für Kinder, Jugendliche und Erwachsene. 5. Auflage. Uni-Med Verlag, Bremen 2009, ISBN 978-3-8374-1101-0, S. 99–102.
- ↑ Empfehlung der STIKO zur HPV-Impfung vom 23. März 2007. (PDF; 120 kB) In: Epidemiologisches Bulletin, 12/2007.
- ↑ HPV-Impfung - Antworten auf häufige Fragen. DKFZ, 22. Juli 2019, abgerufen am 9. September 2019.
- ↑ awmf.org/leitlinien/...
- ↑ Birgit Schindler: Gebärmutterhalskrebs durch therapeutische Impfung heilbar? In: Deutsche Apothekerzeitung. 7. Januar 2016, abgerufen am 5. Januar 2022.
- ↑ John T. Schiller et al.: Human Papillomavirus Vaccines. In: Stanley A. Plotkin et al. (Hrsg.): Plotkin's Vaccines. 7. Auflage. Elsevier, Philadelphia 2017, ISBN 978-0-323-35761-6, S. 454, doi:10.1016/B978-0-323-35761-6.00030-4.
- ↑ Emily Farmer et al.: Vaccination Strategies for the Control and Treatment of HPV Infection and HPV-Associated Cancer. In: Recent results in cancer research. Fortschritte der Krebsforschung. Progres dans les recherches sur le cancer. Band 217, 2021, S. 157–195, doi:10.1007/978-3-030-57362-1_8, PMID 33200366, PMC 8564785 (freier Volltext).
- ↑ Impfung als Therapie: Experimenteller Impfstoff gegen Gebärmutterhalskrebs an Mäusen erfolgreich erprobt. Deutsches Krebsforschungszentrum, Pressemitteilung, 16. Januar 2019
- ↑ Sebastian Kruse et al.: Therapeutic vaccination using minimal HPV16 epitopes in a novel MHC-humanized murine HPV tumor model. In: OncoImmunology. Band 8, Nr. 1, 2. Januar 2019, S. e1524694, doi:10.1080/2162402X.2018.1524694, PMID 30546964, PMC 6287800 (freier Volltext).