Lithium-Ionen-Akkumulator
Ein Lithium-Ionen-Akkumulator (auch Lithiumionenakku, Lithiumionen-Akku, Lithiumionen-Sekundärbatterie oder kurz Lithium-Akkumulator; fachsprachlich [] ausgesprochen, auch [] (mit s-Laut))[1] ist der Oberbegriff für Akkumulatoren auf der Basis von Lithium-Verbindungen in allen drei Phasen der elektrochemischen Zelle. Die reaktiven Materialien sowohl in der negativen als auch in der positiven Elektrode sowie der Elektrolyt enthalten Lithiumionen.
Lithiumionenakkumulatoren weisen im Vergleich zu anderen Akkumulatortypen eine hohe spezifische Energie auf, erfordern jedoch in den meisten Anwendungen elektronische Schutzschaltungen, da sie sowohl auf Tiefentladung als auch Überladung empfindlich reagieren.




Allgemeines
Die Lithiumionenakkus zeichnen sich durch hohe spezifische Energie aus. Sie sind thermisch stabil und unterliegen einem nur sehr geringen Memory-Effekt.[2] Je nach Aufbau bzw. den eingesetzten Elektrodenmaterialien werden Lithiumionen-Akkus weiter untergliedert: Lithium-Polymer-Akkumulator, Lithium-Cobaltdioxid-Akkumulator (LiCoO2), Lithium-Titanat-Akkumulator, Lithium-Luft-Akkumulator, Lithium-Mangandioxid-Akkumulator, Lithium-Eisenphosphat-Akkumulator (LiFePO4) und Zinn-Schwefel-Lithium-Ionen-Akkumulator.[3] Kenndaten wie Zellenspannung, Temperaturempfindlichkeit oder der maximal erlaubte Lade- oder Entladestrom variieren bauartbedingt stark und sind wesentlich vom eingesetzten Elektrodenmaterial und Elektrolyten abhängig. Die Angabe des Subtyps (z. B. „Lithium-Eisenphosphat-Akkumulator“) ist aus diesem Grund informativer als die Angabe des Oberbegriffs „Lithiumionen-Akkumulator“.
Je nach Typ werden für die Herstellung eines Lithium-Akkumulators mit einer Speicherfähigkeit von einer Kilowattstunde (kWh) an Energie etwa 80 g bis 130 g chemisch reines Lithium benötigt.
Geschichte
Bereits in den 1970er Jahren wurden an der TU München das grundlegende Funktionsprinzip der reversiblen Alkalimetallionen-Interkalation in Kohlenstoff-Anoden[4][5] sowie oxidische Kathoden[6][7] und deren Anwendung in Lithium-Batterien[8][9] erforscht und veröffentlicht, auch wenn damals die praktische Anwendbarkeit als Elektroden für Lithium-Batterien nicht erkannt wurde.
Der Lithium-Cobaltdioxid-Akkumulator, auch LiCoO2-Akku, auch Lithiumcobaltdioxid-Akkumulator, war das erste verfügbare elektrodenchemische System für einen Lithiumionenakkumulator. Die Brauchbarkeit als Elektrodenmaterial wurde 1980 von einer Forschergruppe um John B. Goodenough an der University of Oxford entdeckt.[10] Die positive Elektrode besteht aus der namensgebenden Substanz Lithium-Cobalt(III)-oxid.
Im November 1989 wurde in Deutschland ein Patent[11] für einen Lithiumionen-Akkumulator angemeldet sowie im Folgenden ein Versuchsmuster angefertigt und erfolgreich getestet. Die deutsche Industrie zeigte damals allerdings kein Interesse an der Weiterentwicklung.
Der erste kommerziell erhältliche Lithiumionen-Akku wurde als Lithium-Cobaltdioxid-Akkumulator von Sony im Jahr 1991 auf den Markt gebracht und in der Hi8-Videokamera CCD TR 1 eingesetzt. Die Batterie besitzt mit zwei seriell verschalteten Zellen eine Spannung von 7,2 V und eine Kapazität von etwa 1200 mAh. Bis heute (2016) werden Akkumulatoren dieser Bauform mit Kapazitäten bis 6900 mAh angeboten und in einer Vielzahl von Geräten eingesetzt.[12]
Anwendungsbereiche

Lithiumionen-Akkus versorgten anfangs hauptsächlich tragbare Geräte mit hohem Energiebedarf, für die herkömmliche Nickel-Cadmium- beziehungsweise Nickel-Metallhydrid-Akkus zu schwer oder zu groß waren, beispielsweise Mobiltelefone, Tablets, Digitalkameras, Camcorder, Notebooks, Handheld-Konsolen, Softairwaffen oder Taschenlampen. Mittlerweile sind sie in fast allen Bereichen anzutreffen. Sie dienen bei der Elektromobilität als Energiespeicher für Pedelecs, Elektroautos, moderne Elektrorollstühle und Hybridfahrzeuge. Auch im RC-Modellbau haben sie sich früh etabliert. Durch ihr geringes Gewicht bilden sie, in Verbindung mit bürstenlosen Gleichstrommotoren und den entsprechenden Reglern, eine im Flugmodellbau verwendete Antriebseinheit. Seit 2003 kommen Lithiumionen-Akkus bei Elektrowerkzeugen wie zum Beispiel Akkuschraubern und bei Gartengeräten zum Einsatz. In der Boeing 787 kommen Lithium-Kobaltoxid-Akkus (LiCoO2) zum Einsatz, die jedoch nach mehreren Bränden nachträglich eine Stahlummantelung erhielten. Andere moderne Flugzeuge verwenden den Typ mit Eisenphosphat.[13]
Große Lithiumionenbatterie-Systeme werden auch in Batterie-Speicherkraftwerken eingesetzt. Ende 2011 ging die zu diesem Zeitpunkt mit 36 MWh größte Lithium-Ionen-Batterie – ein Batterie-Speicherkraftwerk in China von BYD in Betrieb.[14] Ein weiteres Beispiel für die Speicherung von Windenergie ist die 8-MW-Anlage beim Tehachapi-Pass, die eine Energie von 32 MWh speichern kann.[15] Bezogen auf die gespeicherte Energie ist das die größte Batterie in Nordamerika.[16] Die größte Lithium-Ionen-Batterie, die in einen Container passt, kann eine Energie von 1,5 MWh speichern.[17][18] Der seinerzeit europaweit größte kommerzielle Batteriepark wurde von der WEMAG in Schwerin gebaut. Er ist seit September 2014 in Betrieb und besteht aus 25.600 Lithium-Manganoxid-Zellen die eine Gesamtleistung von 5 Megawatt bereitstellen können.[19] Im Jahr 2015 ging eine Lithium-Ionen-Speicheranlage der Energiequelle GmbH in Feldheim mit 10 MW ans Netz.[20]
Prinzip

Im geladenen Lithiumionen-Akkumulator wird die elektrische Potentialdifferenz der Elektroden in einem elektrochemischen Prozess mit Stoffänderung der Elektroden zur Stromerzeugung genutzt. Im Akkumulator können Lithiumionen (Li+) durch den Elektrolyten zwischen den beiden Elektroden frei wandern, wovon sich der Name des Akkus ableitet. Im Gegensatz zu den Lithiumionen sind die Übergangsmetall- und Graphit-Strukturen der Elektroden ortsfest und durch einen Separator vor einem direkten Kontakt geschützt. Die Mobilität der Lithiumionen ist zum Ausgleich des externen Stromflusses beim Laden und Entladen nötig, damit die Elektroden selbst (weitgehend) elektrisch neutral bleiben.
Die negative Elektrode ist eine Graphit-Intercalationsverbindung mit der allgemeinen Zusammensetzung LixCn, wobei Lithium als Kation vorliegt. Beim Entladen gibt die Interkalationsverbindung Elektronen ab, welche über den externen Stromkreis zur positiven Elektrode fließen. Gleichzeitig wandern gleich viele Li+-Ionen aus der Intercalationsverbindung durch den Elektrolyten zur positiven Elektrode. An der positiven Elektrode nehmen nicht die Lithiumionen die Elektronen des externen Stromkreises auf, sondern die dort vorhandenen Strukturen der Übergangsmetallverbindungen. Je nach Akkumulatortyp können das Cobalt-, Nickel-, Mangan- oder Eisen-Ionen sein, die ihre Ladung ändern. Das Lithium liegt im entladenen Zustand des Akkumulators in der positiven Elektrode weiterhin in Ionenform vor.
Innerhalb beider Elektroden können sich Elektronen als Elektronengas frei bewegen und zu den externen Leitern wandern bzw. aus den Leitern in die Elektrode eintreten.
Aufbau
An Materialien werden unter anderem verwendet:
Negative Elektrode (beim Entladen: Anode; beim Laden: Kathode)
- Graphit und verwandte Kohlenstoffe, bei denen eine Interkalation von Lithium stattfindet, sind immer noch die wichtigsten Materialien.
- nanokristallines, amorphes Silicium (Legierungsbildung mit Lithium)
- Li4Ti5O12 (Lithium-Titanat-Akku)
- SnO2 (Zinndioxid)
Elektrolyt
- Salze, wie LiPF6 (Lithiumhexafluorophosphat), LiBF4 (selten) in wasserfreien aprotischen Lösungsmitteln (z. B. Ethylencarbonat, Propylencarbonat, Dimethylcarbonat, Diethylcarbonat oder 1,2-Dimethoxyethan etc.) oder LiBOB (selten)[21]
- Polymer aus Polyvinylidenfluorid (PVDF) oder Polyvinylidenfluorid-Hexafluorpropen (PVDF-HFP)
- Li3PO4N (Lithiumphosphatnitrid)
Positive Elektrode (beim Entladen: Kathode; beim Laden: Anode)
- LiCoO2 (Lithium-Cobalt(III)-oxid) und verwandte Schichtverbindungen haben eine herausragende Bedeutung. Beispielsweise wurden sie im Jahr 2008 in etwa 90 % aller verkauften Lithium-Ionen-Akkumulatoren eingesetzt.[22]
- Lithium-Nickel-Mangan-Kobalt-Oxide wie z.B. LiNi0,33Co0,33Mn0,33O2, die Mischoxide aus dem genannten LiCoO2, aus LiNiO2 und LiMnO2 sind. Eine manganfreie Variante ist das Oxid LiNi1−xCoxO2. Sie zählen heute zu den wichtigsten Speichermaterialien.
- LiNi0,85Co0,1Al0,05O2
- LiMn2O4 (Spinell)
- LiFePO4 (Lithium-Eisenphosphat)
Reaktionsgleichungen
Negative Elektrode (Entladen):
Positive Elektrode (Entladen):
Redox-Gleichung:
Elementares Lithium kommt in keiner der Reaktionen vor.
Recycling
Um zukünftige Engpässe bei Kobalt, Nickel und Lithium zu vermeiden, ist ein Recycling von Lithium-Ionen-Akkus notwendig. Die Wertstoffe Kobalt, Nickel, Kupfer und Aluminium sind dabei für die Prozessökonomie und Prozessökologie besonders attraktiv, Lithium muss jedoch mittelfristig zusätzlich recycelt werden, um langfristig Engpässe zu vermeiden[23]
Um Lithium-Ionen-Akkumulatoren und primäre Lithium-Ionen-Batterien zu recyclen, werden verschiedene Grundoperationen zu komplexen Prozessketten kombiniert[23]
- Deaktivieren/Entladen (speziell für Traktionsbatterien)
- Demontage der Batteriesysteme (speziell für Traktionsbatterien)
- Mechanische Prozesse (Schreddern, Sortieren, Sieben, uvw.[23])
- Hydrometallurgische Prozesse
- Pyrometallurgische Prozesse
Dabei muss das spezielle Gefahrpotential von Lithium-Ionen-Batterien immer beachtet werden. Elektrische, chemische, Brand- Gefahren und deren Wechselwirkungen müssen im Recycling von Lithium-Ionen-Batterien beachtet und prozesstechnisch vermieden werden.[23]
Eigenschaften

Da Lithiumionenakkumulator der Oberbegriff für eine Vielzahl an möglichen Kombinationen von Materialien für Anode, Kathode und Separator darstellt, ist es schwierig, allgemeingültige Aussagen zu treffen. Je nach Materialkombination unterscheiden sich die Eigenschaften teilweise deutlich. Hinzu kommt die fortwährende Verbesserung durch die Batteriehersteller, die in den letzten Jahren insbesondere auf den bekannten Problemfeldern wie Haltbarkeit und Sicherheit erhebliche Verbesserungen erzielen konnten, während die spezifische Energie nur in vergleichsweise geringem Umfang erhöht wurde.[24]
- Kein Memory-Effekt
- Bei Lithium-Eisenphosphat-Zellen wurde eine Anomalie im Verlauf der Entladespannungskurve entdeckt, die von ihren Entdeckern als „Memory-Effekt“ bezeichnet wird. Dieser Effekt ist jedoch nicht mit dem allgemein bekannten Memory-Effekt bei NiCd- und NiMH-Akkumulatoren vergleichbar und hat für den Anwender keine direkten negativen Auswirkungen.[25]
- Selbstentladung
- siehe Hinweise zum Umgang mit Li-Ionen-Akkus, Unterpunkt Lagerung/Selbstentladung.
- Lebensdauer
- Lithiumionen-Akkus verschlechtern sich sowohl durch Benutzung, wobei eine vollständige Ladung und Entladung als Zyklus bezeichnet wird, als auch ohne Benutzung einfach mit der Zeit (kalendarische Lebensdauer). Insbesondere die Mehrheit der in Endverbrauchergeräten verbauten Lithiumionen-Akkus der ersten Generationen hatten nur eine kurze Lebensdauer. Teilweise konnten die Nutzer schon nach einem Jahr erhebliche Kapazitätsverluste feststellen; nach zwei bis drei Jahren war so mancher Lithiumionen-Akku bereits unbrauchbar geworden. Dabei stellte sich heraus, dass der schleichende Kapazitätsverlust weniger von der Zahl der Lade-Entlade-Zyklen, sondern vor allem von den Lagerbedingungen abhing: Je höher die Temperatur und je voller der Akku, desto eher kam es zum Ausfall. Als Grund hierfür werden in der Regel parasitäre unumkehrbare chemische Reaktionen genannt.[26]
- Bei aktuellen Lithiumionen-Akkus liegt die kalendarische Lebensdauer deutlich höher, so dass inzwischen meist die Zyklenhaltbarkeit entscheidet, wie lange der Akku verwendet werden kann.
- Die Zyklenlebensdauer ist abhängig von Art und Qualität des Akkus, von der Temperatur, und von der Art der Nutzung des Akkus, insbesondere (Ent-)Ladehub, Ladeschlussspannung und Stärke der Lade- sowie Entladeströme. Bei hohen Temperaturen verringert sich die Zyklenhaltbarkeit drastisch, weshalb der Akku am besten bei Raumtemperatur verwendet werden sollte. Niedrige Temperaturen während des Betriebs, nicht jedoch während der Lagerung, sind ebenfalls schädlich. Durch flaches Laden und Entladen wird die Haltbarkeit stark überproportional verbessert, das heißt, dass ein Lithiumionen-Akku, von dem statt 100 % nur 50 % der maximalen Kapazität entladen und dann wieder geladen werden, die mehr als doppelte Zyklenzahl durchhält. Der Grund hierfür ist, dass bei vollständig entladenem und vollständig geladenem Akku hohe Belastungen für die Elektroden entstehen. Optimalerweise werden bei solchen seicht zyklisierten Akkus sowohl die Ladeschlussspannung reduziert als auch die Entladeschlussspannung erhöht. Ebenso erhöhen starke Lade- und Entladeströme die mechanischen und thermischen Belastungen und wirken sich so negativ auf die Zyklenzahl aus.[27]
- Zunehmend werden jedoch auch im Endverbraucherbereich bessere Lithiumionen-Akkus mit längerer Haltbarkeit verkauft. Apple gibt für die in die MacBooks eingebauten Akkus beispielsweise an, dass nach fünf Jahren und 1000 Zyklen immer noch 80 % der Anfangskapazität zur Verfügung stehen.[28] Bei Beachtung der von den schlechten Akkus der ersten Generationen (meist LiCoO2-Akkus) gelernten Anwendungsregeln (Betrieb und Lagerung bei möglichst tiefer Temperatur; Lagerung nur im teilgeladenen Zustand; generell weder ganz geladen noch ganz entladen) dürfte die mit den genannten moderneren Akkus tatsächlich erzielbare Zyklenzahl noch deutlich höher ausfallen.
- Es gibt bereits Zellen für Spezialanwendungen, die auch nach mehreren Jahren im Einsatz und mehreren 10.000 Lade-Entlade-Zyklen nur einen sehr geringen Teil ihrer Kapazität und Leistung verlieren.[29][30]
- Coulomb-Wirkungsgrad
- Der Coulomb-Wirkungsgrad bzw. die Coulomb-Effizienz beträgt typischerweise annähernd 100 %,[30] das heißt, fast die gesamte in den Akkumulator geflossene Ladung kann diesem auch wieder entnommen werden. Nur während der ersten Zyklen ist die Coulomb-Effizienz geringer, da ein Teil der Lithiumionen mit der Elektrolytlösung an der Anode und Kathode irreversibel unter Ausbildung von Deckschichten reagiert.[31]
- Speichervermögen in Abhängigkeit vom Entladestrom
- Das Speichervermögen in Abhängigkeit vom Entladestrom kann durch die Peukert-Gleichung näherungsweise beschrieben werden. Je höher der Entladestrom, desto weniger elektrische Energie kann dem Akku entnommen werden. Für Lithiumionen-Akkus liegt die Peukert-Zahl bei ca. 1,05.
- Energie-Effizienz
- Es kommt – wie bei jedem Akkumulator – zu Energieverlusten durch den Innenwiderstand sowohl beim Laden als auch beim Entladen. Typische Gesamtwirkungsgrade früher Lithium-Cobaltdioxid-Akkumulatoren (vor 2006) betrugen um die 90 %.[30] Werden im Verhältnis zur maximalen Strombelastbarkeit des Akkumulators kleine Lade- und Entladeströme verwendet, können auch über 98 % erreicht werden.
| Material | Spannung |
|---|---|
| LiCoO2 | 3,6 V |
| LiMnO2 | 3,7–3,8 V |
| LiFePO4 | 3,3 V |
| Li2FePO4F | 3,6 V |
- Spannung
- Ein konventioneller LiCoO2-Akku liefert eine Nennspannung von 3,6 Volt, die damit rund dreimal so hoch wie die eines Nickel-Metallhydrid-Akkumulators (NiMH-Akku) ist. Die Ladeschlussspannung liegt bei bis zu 4,3 Volt. Die Entladeschlussspannung beträgt 2,5 Volt; eine Tiefentladung führt zu irreversibler Schädigung und Kapazitätsverlust. Die Zellenspannung hängt jedoch vom verwendeten Katodenmaterial ab und ist daher von Akkutyp zu Akkutyp leicht unterschiedlich.[32]
- Leistungsdichte
- Die Leistungsdichte liegt typischerweise bei 300–1500 W/kg.[33]
- Spezifische Energie und Energiedichte
- Die spezifische Energie ist mehr als doppelt so hoch wie beispielsweise die des Nickel-Cadmium-Akkumulators und liegt bei 95–190 Wh/kg, die Energiedichte bei 250–500 Wh/l, je nach verwendeten Materialien. Anwendungen, die eine besonders lange Lebensdauer benötigen, beispielsweise der Einsatz in Elektroautos, laden und entladen den Lithiumionen-Akku oft nur teilweise (z. B. von 30 bis 80 % statt von 0 bis 100 %), was die Zahl der möglichen Lade-Entlade-Zyklen überproportional erhöht, aber die nutzbare Energiedichte entsprechend absenkt.[32]
Hinweise zum Umgang mit Li-Ionen-Akkus

Wegen der Vielzahl an möglichen Materialien für negative und positive Elektrode sowie Separator ist es schwierig, allgemeingültige Aussagen für Lithiumionenakkus zu treffen. Die verschiedenen Arten werden von den Herstellern für die verschiedensten Einsatzmöglichkeiten optimiert und unterscheiden sich im Umgang teilweise sehr stark.
- Ladung
- Die Ladeschlussspannung beträgt typischerweise 4,0–4,2 V, teils auch 4,35 V,[34] was etwas höhere Kapazitäten ermöglicht, aber auf Kosten einer reduzierten Zykluszahl. Da Lithiumionen-Akkus keinen Memory-Effekt kennen und auch nicht formiert werden müssen, werden sie immer auf die gleiche Art geladen: Zuerst mit einem konstanten Strom, der bei den meisten handelsüblichen Zellen 0,6 bis 1 C nicht übersteigen darf. Schnellladefähige Zellen vertragen je nach Typ aber auch 2 C, 4 C oder gar 8 C.[35] Die Abkürzung C steht hier für den auf die Kapazität bezogenen relativen Ladestrom (d. h. A/Ah)[36] und ist nicht mit der Einheit Coulomb (d. h. As) zu verwechseln; ein Ladestrom von 0,75 C bedeutet, dass ein Akku mit einer Kapazität von 1 Ah mit 0,75 A geladen wird. Generell ist es möglich, Li-Ion-Akkus mit einem geringeren Ladestrom als dem Nennstrom zu laden; meist erhöht sich dadurch auch die erreichbare Zyklenzahl etwas.
- Erreicht der Akkumulator die Ladeschlussspannung von z. B. 4,2 V, wird diese Spannung gehalten. Der Ladestrom sinkt dann mit der Zeit immer weiter ab, je voller der Akkumulator wird. Sobald der Strom einen bestimmten Wert (z. B. C/10 oder gar nur 3 Prozent des anfänglichen Stroms) unterschreitet oder er über einen längeren Zeitraum nicht mehr sinkt, wird die Ladung beendet.[32] Die Ladeschlussspannung von produktabhängig 4,1 V bis 4,3 V darf allenfalls mit einer geringen Toleranz (z. B. 50 mV) überschritten werden. Die Verwendung einer etwas niedrigeren Ladeschlussspannung ist hingegen unkritisch. Einer gewissen Verringerung der Kapazität steht meist eine deutliche Erhöhung der Zahl der nutzbaren Lade-Entlade-Zyklen gegenüber.
- Entladung
- Die Spannung des Lithiumionen-Akkus sinkt während der Entladung zunächst recht schnell von der erreichten Ladeschlussspannung auf die Nennspannung (ca. 3,6 bis 3,7 V) ab, sinkt dann aber während eines langen Zeitraums kaum weiter ab. Erst kurz vor der vollständigen Entladung beginnt die Zellenspannung wieder stark zu sinken.[37] Die Entladeschlussspannung beträgt je nach Zellentyp um die 2,5 V; diese darf nicht unterschritten werden, sonst wird die Zelle durch irreversible chemische Vorgänge zerstört. Viele Elektronikgeräte schalten aber schon bei deutlich höheren Spannungen, z. B. 3,0 V, ab.
- Es ist empfehlenswert, Li-Ionen-Akkus „flach“ zu (ent-)laden, da sich deren Lebensdauer so verlängert. Wenn ein Li-Ionen-Akku immer von 100 % Ladezustand auf 0 % entladen wird, bevor er wieder geladen wird, erreicht er nur die minimale Zyklenzahl. Besser ist es, je nach Typ, z. B. 70 % Entladetiefe anzuwenden. Dies bedeutet, dass der Akku noch 30 % Restkapazität enthält, wenn er wieder geladen wird. Einige Hersteller geben die Zyklenlebensdauer in Abhängigkeit vom Entladungsgrad an.[38]
- Generell gilt, dass hohe Entladeströme sowohl die Nennkapazität eines Akkus senken, da dank des höheren Spannungsabfalls am Innenwiderstand die Entladeschlussspannung früher erreicht wird, als auch die Zyklenzahl aufgrund der höheren mechanischen und thermischen Belastung reduzieren. In früheren Veröffentlichungen wird noch auf einen optimalen Entladestrom von 0,2 C (das heißt einem Entladestrom in Höhe von einem Fünftel des Nominalwerts der Nennkapazität in Ah) hingewiesen. Bei einem Akku mit einer Kapazität von 5 Ah wären dies 1 A.[39]
- Lagerung/Selbstentladung
- Der Akku altert schneller, je höher seine Zellenspannung ist, daher ist es zu vermeiden, einen Li-Ion-Akku ständig 100 Prozent geladen zu halten. Der Ladezustand sollte 55–75 % betragen, kühle Lagerung ist vorteilhaft. Ältere Quellen nennen eine Selbstentladung bei 5 ° Celsius von etwa 1–2 % pro Monat, bei 20 ° Celsius etwa 30 % pro Monat.[40] Aktuelle Angaben geben eine Selbstentladung von 3 %/Monat auch bei Zimmertemperatur an.[38] Hersteller empfehlen eine Lagerung bei 15 °C bei einem Ladestand von 60 % – ein Kompromiss zwischen beschleunigter Alterung und Selbstentladung. Ein Akku sollte etwa alle sechs Monate auf 55–75 % nachgeladen werden. Lithium-Ionen-Akkumulatoren dürfen sich auch bei Lagerung nicht unter 2,5 V pro Zelle entladen. Eventuell flüssige oder gelförmige Elektrolyte in der Zelle dürfen nicht gefrieren, was einer Mindesttemperatur um −25 °C entspricht.
- Beförderung/Transport
- Für die Beförderung von Lithium-Akkumulatoren/-Batterien gelten auf Grund der hohen Brandgefahr bei Kurzschluss oder Wasser-Einfluss besondere Sicherheitsvorschriften:
- die „Empfehlungen für die Beförderung gefährlicher Güter – Handbuch über Prüfungen und Kriterien“[41] (UN 38.3 – Transport-Test für Lithiumbatterien Lithium-Akkumulatoren/-Batterien),
- das Gesetz über die Beförderung gefährlicher Güter (GGBefG),
- die „Gefahrgutverordnung Straße, Eisenbahn und Binnenschifffahrt“ (GGVSEB),
- das „Europäische Übereinkommen über die internationale Beförderung gefährlicher Güter auf der Straße“ (ADR). Die Übergangsvorschrift gem. 1.6.1.20 ADR findet Anwendung.
- Viele Fluggesellschaften und Flughäfen haben Beförderungsbestimmungen für Lithium-Ionen-Akkus, wobei kleinere Akkus (ca. < 100 Wh) meist unproblematisch sind.
- Für den DHL-Versand von Artikeln, die Lithium-Ionen-Akkumulatoren oder Batterien enthalten, gilt eine Regelung für die Beförderung von gefährlichen Stoffen und Gegenständen.[42]
- Der Versand der Pakete erfolgt mit einer deutlich sichtbaren Kennzeichnung (Begleitdokumentation als Aufkleber) gemäß Kapitel 3.3 der Sondervorschrift 188 des Europäischen Übereinkommens über die internationale Beförderung gefährlicher Güter auf der Straße (ADR).
- Der Aufkleber enthält Hinweise über/darüber
- das Vorhandensein von Lithium-Ionen-Zellen bzw. Batterien,
- dass die Sendung besonders sorgsam zu behandeln ist,
- dass bei Beschädigung Entzündungsgefahr besteht,
- dass bei Beschädigung der Verpackung das Paket vor dem weiteren Transport neu zu verpacken, sowie die Kurzschlusssicherung der Zellen zu überprüfen und neu vorzunehmen ist.
- (Integrierte) Elektronik
- Li-Ion-Akkus reagieren sehr empfindlich auf falsche Behandlung, weshalb dieser Akkutyp zuerst nicht eingesetzt wurde, obwohl er bereits seit den 1980er-Jahren bekannt war.[43] Integrierte Schaltkreise sind sehr preisgünstig geworden; daher können Li-Ion-Akkus heute in Verbindung mit einer Elektronik (BMS = Batteriemanagementsystem) betrieben werden, was die Sicherheit im Umgang mit diesem Akkutyp erheblich erhöht hat. Bei Akku-Packs kleiner und mittlerer Baugröße ist diese Elektronik meist integriert; sie dient zum Schutz gegen Tiefentladung, Überladung und thermische Überlastung. Eine selbstrückstellende Sicherung verhindert Überstrom beziehungsweise Kurzschluss. Die verwendete Prozessorsteuerung ist auf die Eigenschaften des jeweiligen Akkutyps abgestimmt. Akku-Packs, in denen zur Spannungserhöhung mehrere Zellen in Reihe geschaltet werden, verfügen oft auch über eine Elektronik, die durch sog. „Cell-Balancing“ den Ladezustand aller Zellen in einem Pack aneinander angleicht.[44][45] Insbesondere muss die Ladung beendet bzw. zumindest der Ladestrom reduziert werden, wenn die erste Zelle die Maximalspannung überschreitet, und die Entladung, wenn die erste Zelle die Minimalspannung unterschreitet.
- Überladung
- Bei einem Überladungsversuch wird bei einem Akku mit integrierter Überwachungselektronik die Zelle von den äußeren Kontakten getrennt, bis die zu hohe Spannung nicht mehr anliegt. Danach kann er meist ohne Probleme wieder verwendet werden. Nicht alle auf dem Markt erhältlichen Akkus enthalten eine solche Überwachungselektronik. Bei Überladung verschiedener Li-Ion-Akkus kann sich metallisches Lithium an der Anode ablagern und/oder es wird Sauerstoff aus der Kathode freigesetzt. Letzterer gast bestenfalls durch ein Sicherheitsventil aus, oder reagiert mit Elektrolyt oder Anode. Dadurch heizt sich der Akkumulator auf und kann sogar in Brand geraten.[32] Andere Lithium-Ionen-Akkus, wie der LiFePO4-Akku sind thermisch stabil, werden aber bei Überladung ebenfalls irreversibel geschädigt.
- Tiefentladung
- Bei einer Tiefentladung von Zellen schaltet eine eventuell vorhandene interne Sicherung oder ein BMS den Akku, meist nur temporär, ab. Es liegt dann an den externen Kontakten des Akkupacks überhaupt keine Spannung mehr an, das heißt, er kann nicht noch weiter entladen werden. Manche Ladegeräte weigern sich, einen derartig defekt anmutenden Akkumulator wieder zu laden, da in diesem Fall an den externen Kontakten keine Spannung messbar ist. Der Akku wird jedoch von seiner Schutzelektronik meist wieder an die Kontakte geschaltet, sobald eine äußere Spannung anliegt. In solchen Fällen kann es helfen, ein anderes Ladegerät zu verwenden.
- Generell gilt: Tiefentladung führt meist zu irreversibler Schädigung und Kapazitätsverlust. Wenn eine Zelle auf unter 1,5 V entladen wurde, sollte sie nicht mehr verwendet werden, denn mit hoher Wahrscheinlichkeit haben sich Brücken ausgebildet, die zu einem Kurzschluss führen. Die Zelle wird instabil und erhitzt sich stark. Es kann Brandgefahr bestehen.
- Ladegeräte
- Herkömmliche Li-Ionen-Akkus dürfen nur mit einer speziellen Ladeschaltung geladen werden. Die Elektronik steuert den ladungsabhängigen Ladestrom und überwacht insbesondere die exakt einzuhaltende Ladeschlussspannung. Auch bei vorhandener interner Schutzschaltung sollte nur mit passenden Geräten geladen werden. Schnell-Ladegeräte sollten immer unter Aufsicht und möglichst nicht in der Nähe brennbarer Materialien benutzt werden.
- Betriebs- und Umgebungstemperatur
- Da bei Kälte die chemischen Prozesse (auch die Zersetzung des Akkumulators bei der Alterung) langsamer ablaufen und die Viskosität der in Li-Zellen verwendeten Elektrolyte stark zunimmt, erhöht sich auch beim Lithium-Ionen-Akku bei Kälte der Innenwiderstand, womit die abgebbare Leistung sinkt. Zudem können evtl. die verwendeten Elektrolyte bei Temperaturen um −25 °C einfrieren. Manche Hersteller geben den Arbeitsbereich mit 0–40 °C an. Optimal sind für viele Zellen aber 18–25 °C. Unter 10 °C kann bei manchen Arten durch den erhöhten Innenwiderstand die Leistung so stark nachlassen, dass sie nicht lange für den Betrieb eines Camcorders oder einer Digitalkamera ausreicht. Es gibt aber Li-Ionen-Akkus mit speziellen Elektrolyten, die bis −54 °C eingesetzt werden können. Durch Laden bei niedrigen Temperaturen tritt meist eine sehr starke Alterung auf, die mit irreversiblem Kapazitätsverlust einhergeht.[46] Aus diesem Grund wird für die meisten Batterien 0 °C als untere zulässige Temperatur während des Ladevorgangs angegeben. Bei zu hohen Betriebstemperaturen bildet sich bei vielen Systemen durch Zersetzung des Elektrolyts eine Schicht auf der Anode, die den Zellinnenwiderstand stark erhöht. Die Temperatur während des Entladevorgangs wird von den meisten Herstellern deshalb auf 60 °C limitiert. Lithium-Ionen Batterien erwärmen sich während des Entladevorgangs, besonders bei hohen Strömen. Die maximale Temperatur hängt dabei in vielen Fällen linear von der Entladerate ab.[47][48]
Gefahren beim Umgang mit Lithium-Ionen-Akkus
Bei verschiedenen Lithium-Ionen-Akkus mit flüssigen oder polymeren Elektrolyten kann es ohne spezielle Schutzmaßnahmen zum thermischen Durchgehen kommen. Mit der steigenden Verwendung vor allem preiswerter Akkus mehren sich Meldungen von Überhitzungen. Dies führt zu kostspieligen Rückrufaktionen der Hersteller.[49] Im Automobilbau kommt es durch besonders hohe Sicherheitsanforderungen auf Grund der hohen installierten Energiemengen teilweise zu Verzögerungen beim Einsatz. So verschob Opel die Auslieferung des Ampera, als drei Wochen nach einem Crashtest eines baugleichen Chevrolet Volt die versuchsweise nicht ausgebaute, voll geladene Batterie überhitzte und zum Fahrzeugbrand führte.[50] Daraufhin wurde das Sicherheitskonzept der Traktionsbatterie überarbeitet.[51] In arbeitswissenschaftlichen Untersuchungen wurde festgestellt, dass der Umgang mit leistungsstarken Energiespeichern auf Lithium-Basis, d. h. deren Fertigung, Einbau, Lagerung, Entsorgung sowie bestimmte Betriebszustände nur geringe Auswirkungen auf den Arbeitsschutz hat. Die Gefahren durch höhere Spannungen und zusätzliche Gefahrstoffe (z. B. Lithium) können durch Anpassung und konsequente Umsetzung bestehender Sicherheitsanforderungen minimiert werden.[52]
Folgende Risiken sind bekannt:
- Mechanische Belastung
- Mechanische Beschädigungen können zu inneren Kurzschlüssen führen. Die hohen fließenden Ströme führen zur Erhitzung des Akkumulators. Gehäuse aus Kunststoff können schmelzen und entflammen. Unter Umständen ist ein mechanischer Defekt nicht unmittelbar zu erkennen. Auch längere Zeit nach dem mechanischen Defekt kann es noch zum inneren Kurzschluss kommen. Ebenso kann durch äußere Beschädigung Luft und insbesondere Luftfeuchtigkeit in die Zelle eindringen und chemische Reaktionen hervorrufen.
- Chemische Reaktionen
- Lithium ist ein hochreaktives Metall.[53] Zwar liegt es in Lithiumbatterien nur als chemische Verbindung vor, allerdings sind die Komponenten eines Li-Ionen-Akkus oft leicht brennbar. Ausgleichsreaktionen beim Überladen, zum Beispiel die Zersetzung von Wasser zu Knallgas wie bei anderen Akkus, sind nicht möglich. Li-Ionen-Akkus sind hermetisch gekapselt. Dennoch sollten sie nicht in Wasser getaucht werden, insbesondere in voll geladenem Zustand. Brennende Akkus dürfen daher nicht mit Wasser, sondern sollten zum Beispiel mit Sand gelöscht werden. In den meisten Fällen besteht im Falle eines Brandes lediglich die Möglichkeit, auftretende Folgebrände zu löschen und den Akkumulator kontrolliert abbrennen zu lassen. Die Elektrolytlösung ist meist brennbar. Ausgelaufene Elektrolytlösung eines Li-Ionen-Akkus kann fern vom Akku mit Wasser abgewaschen werden.
Neuere Erkenntnisse im Umgang mit diesen Batterien zeigen, dass die positiven Auswirkungen des (Lösch-)Wassers die negativen Aspekte deutlich auf- und überwiegen. Die für die amerikanischen Feuerwehren zuständige Behörde NFPA sowie auch die einschlägige Feuerwehrliteratur in Europa weist in neueren Ausgaben zur Behandlung von verunfallten Elektrofahrzeugen die Verwendung einer großen Menge Wassers als primäre Strategie aus. Es wird allerdings explizit darauf hingewiesen, dass Löschversuche im Allgemeinen nicht direkt zum Erfolg führen. Wenn die Zelle sich bzw. ihre Elektrodenmaterialien thermisch zersetzt, so entsteht der zur weiteren exothermen Reaktion nötige Sauerstoff im Inneren der Zelle. Die exotherme Zersetzung lässt sich daher nicht stoppen (Thermal runaway). Durch den Einsatz von großen Mengen Wasser werden jedoch benachbarte Zellen soweit abgekühlt, dass diese sich in der Folge nicht ebenso zersetzen. Außerdem werden große Anteile der freiwerdenden gefährlichen Stoffe durch das Wasser gebunden und/oder auf ein unkritisches Lösungsniveau verdünnt.
- Thermische Belastung, Brandgefahr
- Bei thermischer Belastung kann es bei verschiedenen Lithium-Ionen-Akkus (→Lithium-Polymer-Akkumulator) zum Schmelzen des Separators und damit zu einem inneren Kurzschluss mit schlagartiger Energiefreisetzung (Erhitzung, Entflammung) kommen. Eine weitere Gefahr geht von exothermen Zersetzungsreaktionen der Zellchemikalien bei Überlastung, insbesondere beim Laden aus. Neuartige keramische, temperaturbeständigere Separatoren gewähren eine erhöhte Sicherheit. Ebenso können alternative Zellchemikalien eingesetzt werden, die thermisch stabiler sind oder deren Zersetzung nicht exotherm abläuft (LiFePO4, Nano-Li2TiO3).
In der Zelle selbst gibt es verschiedene Schutzvorrichtungen, die den Umgang mit den Zellen sehr sicher machen. Zum Beispiel werden sogenannte „Shut-Down-Separatoren“ eingesetzt, die den Effekt des Aufschmelzens gezielt ausnutzen und sich von einem porösen Kunststoff zu einer für den weiteren Ionenaustausch undurchlässigen Folie wandeln. Weitere, unmittelbar in die Zelle integrierte Schutzmaßnahmen betreffen die elektrische Verbindung zwischen dem Elektrodenmaterial und dem äußeren Zellanschluss. Die Verbindung kann so ausgeführt werden, dass sie wie eine Schmelzsicherung wirkt und zusätzlich beim Öffnen etwaiger Berstöffnungen abgerissen wird. Diese zellinternen Schutzmechanismen sind jedoch in der Regel irreversibel ausgeführt. Neben den zellinternen Schutzvorrichtungen gibt es innerhalb moderner Batterien meist weitere elektronische Schutzschaltungen. Deren Funktionen reichen von komplexen Batteriemanagementsystemen (BMS) mit Temperatursensoren, Ladeelektronik, Batteriezustandsüberwachung und externen Kommunikationsanschlüssen (smart batteries) bis zu einfachen, zumeist reversibel wirkenden Sicherheitsschaltungen, die lediglich die Überladung oder Überlastung der Batterie verhindern sollen.
- Li-Ionen-Akkus dürfen, wie andere Akkumulatoren auch, nicht kurzgeschlossen werden. Durch Kurzschluss (auch mit Metallschmuck oder Werkzeugen) können durch die hohen Ausgleichströme Feuer oder Verbrennungen verursacht werden.
Entwicklungen
Im April 2006 schrieb eine Gruppe von Wissenschaftlern des Massachusetts Institute of Technology, einen Prozess entwickelt zu haben, der für die Herstellung von nanometergroßen Drähten mittels Viren verwendet werden kann. Damit können ultradünne Lithium-Ionen-Akkus mit höherer Energiedichte hergestellt werden.[54]
Im Juni 2006 stellten Forscher aus Frankreich Akku-Elektroden in Nanometer-Größe her, die ein Mehrfaches der Energiedichte im Vergleich zu gewöhnlichen Elektroden besaßen.[55]
Im September 2006 berichteten Forscher der Universität Waterloo in Kanada in der Zeitschrift Nature von einem neuen Kathodenmaterial, bei dem die Hydroxid-Gruppe der Eisenphosphat-Kathode durch Fluorid ersetzt wurde. Dies hat einen doppelten Vorteil: Erstens ergibt sich während eines Ladungszyklus eine geringere Volumenänderung in der Kathode, was eine längere Lebensdauer erwarten lässt. Zweitens erlaubt es den Ersatz des Lithiums durch Natrium beziehungsweise einer Natrium-Lithium-Mischung, weswegen er auch als Alkali-Ionen-Akku bezeichnet wird.[56]
Im Dezember 2007 berichteten Forscher der Stanford University von einem neuen Anodenmaterial für Lithium-Ionen-Akkus mit dem zehnfachen der bisher erreichten Energiedichte. Sie verwendeten dazu Silizium-Nanodrähte auf rostfreiem Stahl.[57] Es wird die Tatsache genutzt, dass Silizium als Trägermaterial größere Mengen Lithium einlagern kann als Graphit; die geringe Größe der Drähte löst das Problem des Aufbrechens der Anode. Allerdings ist die Anode nur ein Teil des Akkumulators; bei unveränderter Kathode, Separator und Elektrolyt ist entsprechend nur eine deutlich geringere Gesamtsteigerung der Energiedichte zu erwarten.[58] Einen ähnlichen Ansatz mit nanoporösem Silicium[59] verfolgt das Team von Jaephil Cho von der Hanyang University in Ansan, Südkorea.
Am 12. März 2009 wurde eine Weiterentwicklung der Lithium-Ionen-Akkus durch die beiden MIT-Forscher Byoungwoo Kang und Gerbrand Ceder veröffentlicht, die sowohl die Lade- als auch die Entladezeit auf 10 Sekunden statt 6 Minuten für einen kleinen Test-Akku reduziert.[60]
Etwa im Juni 2011 berichteten Forscher der japanischen Firma Sumitomo Electric Industries, dass für den Fall, dass der Ableiter der Kathode, welcher üblicherweise aus Aluminiumfolie besteht, durch den Werkstoff Aluminium-Celmet ersetzt werden würde, dies eine Erhöhung der Akkumulator-Energiedichte um einen Faktor von 1,5 bis 3 ermöglicht.[61]
Ausführungsformen
Lithium-Polymer-Akkumulator
Wie beim Lithium-Ionen-Akku mit Lithium-Cobaltdioxid (LiCoO2) als Elektrodenmaterial besteht die negative Elektrode aus Graphit, die positive aus Lithium-Metalloxid. Jedoch enthalten Lithium-Polymer-Akkus keinen flüssigen Elektrolyten, sondern einen auf Polymerbasis, der als feste bis gelartige Folie vorliegt. Daher ist der Lithium-Polymer-Akkumulator als spezielle Bauform zu betrachten, nicht als eigenständige Zellchemie. Die äußere Form der Lithium-Polymer-Akkus unterliegt praktisch keinen Beschränkungen.
Lithiumtitanat-Akkumulator
Der Lithiumtitanat-Akkumulator ist eine Unterkategorie des Lithium-Ionen-Akkumulators, bei der die herkömmliche Graphitelektrode (negativer Pol) durch eine gesinterte Elektrode aus Lithiumtitanspinell (Li4Ti5O12) ersetzt wird. Die wesentlich stärkere chemische Bindung des Lithiums im Titanat verhindert die Bildung einer Oberflächenschicht, die eine der Hauptgründe für die schnelle Alterung vieler herkömmlicher Li-Ion-Akkus ist. Dadurch wird die Zahl der möglichen Ladezyklen erhöht. Da das Titanat nicht mehr mit Oxiden aus der Kathode reagieren kann, wird auch das thermische Durchgehen des Akkumulators verhindert, selbst bei mechanischen Schäden. Außerdem kann der Akkumulator aufgrund der Lithiumtitanat-Anode im Gegensatz zu herkömmlichen Lithium-Ionen-Akkus auch bei tiefen Temperaturen in einem Temperaturbereich von −40 bis +55 °C betrieben werden.
Lithium-Mangan-Akkumulator
Beim Lithium-Mangan-Akkumulator wird Lithium-Manganoxid als Aktivmaterial in der Kathode eingesetzt. Die Anode besteht entweder aus herkömmlichem Graphit (Hochenergiezellen) oder aus einer amorphen Kohlenstoffstruktur (amorphous carbon, in Hochleistungszellen). Durch die größere Anodenoberfläche ergibt sich eine verbesserte Hochstromfestigkeit. Die Zellen werden derzeit (2012) sowohl in Pedelecs und E-Bikes verschiedener Hersteller (u. a. vom Schweizer Pedelec-Hersteller Flyer[62][63]), als auch in Hybridelektrokraftfahrzeugen (Bsp.: Nissan Fuga Hybrid, Infinity Mh) und Elektroautos (Bsp.: Nissan Leaf) eingesetzt. Großformatige Zellen für Traktionsbatterien fertigt beispielsweise AESC für Nissan.
Lithium-Eisenphosphat-Akkumulator
Der Lithium-Eisenphosphat-Akkumulator (LiFePO4-Akkumulator) ist eine Version des Lithium-Ionen-Akkumulators, bei dem die herkömmliche Lithium-Cobaltoxid-Kathode durch eine Lithium-Eisenphosphat-Kathode ersetzt wurde. Dieser Akku zeichnet sich durch hohe Lade- und Entladeströme, eine sehr gute Temperaturstabilität und eine lange Lebensdauer aus. Die Nominalspannung beträgt 3,2 V beziehungsweise 3,3 V, die Energiedichte beträgt 100–120 Wh/kg, die Leistungsdichte etwa 1,8 kW/kg.
Weiterentwicklungen zur Verbesserung der technischen Eigenschaften sind Dotierungen mit Yttrium- (LiFeYPO4) und Schwefelatomen.
Lithium-Luft-Akkumulator
Der Lithium-Luft-Akkumulator ist eine in Forschung und Entwicklung befindliche Ausführung eines wiederaufladbaren Lithium-Ionen-Akkumulators mit einer Zellspannung von 2,91 V, bei der die positive, aus porösem Kohlenstoff ausgeführte Elektrode Sauerstoff für die elektrochemische Reaktion benötigt. Dieser Akkumulator weist theoretisch eine sehr hohe spezifische Energiedichte auf, stößt aber auf technische Schwierigkeiten bei der Umsetzung, weshalb mit Stand 2010 keine Akkumulatoren dieses Typs am Markt verfügbar sind.[64], [65]
Lithium-Luft-Akkumulatoren können auch mit festen Elektrolyten ausgeführt werden und zählen dann zu der Gruppe der Festkörperakkumulatoren.
Dual-Carbon-Akkumulator
Bei dem Dual-Carbon-Akkumulator bestehen als Besonderheit beide Elektroden, sowohl die Kathode als auch die Anode, aus porösem Graphit.
Spezielle Bauweisen
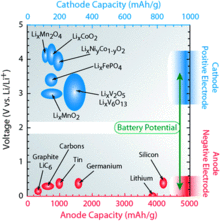
Es stehen zahlreiche Materialkombinationen zur Speicherung von Lithium-Ionen zur Verfügung. Die chemischen Speichermaterialien verändern die Eigenschaften des Akkumulators entscheidend, so dass diese zur Einstellung auf spezielle Anforderungen genutzt werden können. Die Abbildung zeigt zahlreiche Kathoden- und Anodenmaterialien in einer Gegenüberstellung und weist den Potentialunterschied der Materialien aus.
Durch die zusätzliche Verwendung unterschiedlicher, spezieller Separatoren (z. B. Keramikseparatoren),[66] Elektrolyte (z. B. Ionische Flüssigkeiten) und Verpackungsmaterialien können weitere Eigenschaften des Akkumulators eingestellt werden, so dass diese auch extremen Anforderungen gerecht werden können.
Als besondere Anforderungen an Lithium-Ionen-Akkumulatoren gelten:
- Hoch- und Niedrigtemperaturfestigkeit
- Strahlungstoleranz (z. B. Gammastrahlung in der Luft- und Raumfahrt)
- Hoch- und Niederdruckfestigkeit (bis Grobvakuum)
- Spezielle Formfaktoren für Folienkörper oder Anschlusspole
- Stoßfestigkeit
- Amagnetismus
- Maximierung von Energiedichte oder Leistungsdichte
- Schnellladefähigkeit
- Eigensicherheit
- Biegeflexibilität

Obwohl diese Möglichkeiten bestehen, stützt sich die industrielle Massenfertigung auf die Verwendung von etablierten Speichermaterialien, wie z. B. Lithium-Cobalt(III)-oxid und Graphit. Nur wenige Spezialhersteller, wie z. B. das deutsche Unternehmen Custom Cells Itzehoe GmbH und das amerikanische Unternehmen Yardney Technical Products Inc., bieten Sonderlösungen an. Nebenstehende Abbildung zeigt einen vom Fraunhofer-Institut für Siliziumtechnologie (ISIT) entwickelten Akkumulator, der in seiner Energiedichte, Druckresistenz und ungewöhnlichen Formgebung (sechseckig) für den Einsatz in einem Autonomen Unterwasserfahrzeug (AUV)) optimiert wurde.[67][68]
Literatur
- Lucien F. Trueb, Paul Rüetschi: Batterien und Akkumulatoren. Mobile Energiequellen für heute und morgen. Springer, Berlin 1998, ISBN 3-540-62997-1.
- Thomas B. Reddy (Hrsg.): Linden's Handbook of Batteries. 4. Auflage. McGraw-Hill, New York 2011, ISBN 978-0-07-162421-3.
- Claus Daniel, Jürgen O. Besenhard: Handbook of Battery Materials. Wiley-VCH, Weinheim 2011, ISBN 3-527-32695-2.
- Masaki Yoshio (Hrsg.): Lithium-Ion Batteries. Science and Technologies. Springer, New York 2009, ISBN 978-0-387-34444-7.
Weblinks
- BMZ: Nicht alle Ladegeräte sind gleichwertig – Höhere Akkuleistung durch richtiges Laden (28. Nov. 2012)
- Umfangreiche Informationen über Lithium-Ionen-Akkus in Notebooks
- Skript über diverse Typen von Lithium-Batterien (PDF-Datei; 3,2 MB)
- Berechnung von Verbrauch und Ladezeit
- Simulation von Lithium-Ionen-Akkus bei der Entwicklung von Elektro- und Hybridfahrzeugen
- Varta Automotive (Hrsg.): Die Entwicklung der Batterie. Kapitel 7: Lithium-Ionen-Batteriesystem. Abgerufen am 4. Jan. 2009.
- Thomas Kretschmann: news-240291.html Kapazität von Li-Ionen-Akkus verzehnfacht. In: Tom’s Hardware DE. 21. December 2007
- Matthias Gräbner: Drahtiges Silizium. In: Telepolis. 22. Dezember 2007
- List of manufacturer of batteries and ultracapacitors for plug-ins (EV, PHEV). In: AortaCity. 10. August 2008 (Liste von Herstellern von Lithium-Ionen-Batterien für Elektrofahrzeuge)
- ZSW Ulm
- Univ.-Prof. Dr.-Ing. Michael Weyrich: Lithium-Ionen-Batterien für Elektroautos von morgen – Zellenkonzepte und ihre Herausforderungen an die Fertigungstechnologien, Lerhrstuhlwiki an der Universität Siegen
- IATA Lithium Battery Guidance (Vorschriften der IATA für den Transport per Flugzeug von Lithiumbatterien)
- Untersuchung des Brandverhaltens von Lithium-Ionen- und Lithium-Metall-Batterien in verschiedenen Anwendungen und Ableitung einsatztaktischer Empfehlungen (Forschungsbericht der Forschungsstelle für Brandschutztechnik, Karlsruher Institut für Technologie – KIT) (PDF)
Einzelnachweise
- ↑ Duden.de: Lithium, das
- ↑ Memory-Effekt bei Lithium-Ionen-Akkus, Heise.de Zugriff: 3. März 2014
- ↑ Markus Pflegerl: Zinn-Schwefel-Lithiumionen-Akku: Stärker, langlebiger und sicherer. In: wattgehtab.com. 15. März 2010.
- ↑ J. O. Besenhard, H. P. Fritz: Cathodic reduction of graphite in organic solutions of alkali and NR4+ salts. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 53, Nr. 2, 25. Juni 1974, S. 329–333, doi:10.1016/S0022-0728(74)80146-4.
- ↑ J. O. Besenhard: The Electrochemical Preparation and Properties of Ionic Alkali Metal and NR4 Graphite Intercalation Compounds in Organic Electrolytes. In: Carbon. Band 14, Nr. 2, 1976, S. 111–115, doi:10.1016/0008-6223(76)90119-6.
- ↑ R. Schöllhorn, R. Kuhlmann, J. O. Besenhard: Topotactic redox reactions and ion exchange of layered MoO3 bronzes. In: Materials Research Bulletin. Band 11, Nr. 1, Januar 1976, S. 83–90, doi:10.1016/0025-5408(76)90218-X.
- ↑ J. O. Besenhard, R. Schöllhorn: The discharge reaction mechanism of the MoO3 electrode in organic electrolytes. In: Journal of Power Sources. Band 1, Nr. 3, 1976, S. 267–276, doi:10.1016/0378-7753(76)81004-X.
- ↑ J. O. Besenhard, G. Eichinger: High energy density lithium cells: Part I. Electrolytes and anodes. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 68, Nr. 1, 25. Februar 1976, S. 1–18, doi:10.1016/S0022-0728(76)80298-7.
- ↑ G. Eichinger, J. O. Besenhard: High energy density lithium cells: Part II. Cathodes and complete cells. In: Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. Band 72, Nr. 1, 25. August 1976, S. 1–31, doi:10.1016/S0022-0728(76)80072-1.
- ↑ K. Mizushima, P.C. Jones, P.J. Wiseman, J.B. Goodenough: LixCoO2 (0 < x < l): A New Cathode Material For Batteries Of High Energy Density. In: Materials Research Bulletin. 15. Jahrgang, 1980, S. 783–789.
- ↑ Patent DD290979: Galvanisches Element. Angemeldet am 10. November 1989, Erfinder: Peter Busch.
- ↑ WebShop: Akku für Sony CCD Tr1, eingefügt 4. März 2012
- ↑ mue: Memory-Effekt bei Lithiumionen-Akkus, in heise.de, Datum: 15. April 2013, Abgerufen: 19. April 2013
- ↑ Heindl Server GmbH: 36 MWh Lithiumspeicher fertig gestellt. solarserver.de, 2. Januar 2012, abgerufen am 28. Juni 2014.
- ↑ Herman K. Trabish: Southern California Edison’s 8MW Li-Ion Battery for Wind Power Storage. Greentech Media, Inc., 21. Februar 2012, abgerufen am 14. März 2014 (englisch).
- ↑ LG Chem Ltd : LG Chem to Power North America’s Largest Battery Energy Storage System. 4-Traders, 4. Juni 2013, abgerufen am 14. März 2014 (englisch).
- ↑ Ken Graber: Electrovaya Delivers 1.5 MWh Lithium Ion Battery-Based Energy Storage System to Arizona Public Service Company. (PDF) Electrovaya Inc., abgerufen am 14. März 2014.
- ↑ Ken Graber: Electrovaya Delivers 1.5 MWh Lithium Ion Battery-Based Energy Storage System to Arizona Public Service Company. Electrovaya Inc., abgerufen am 14. März 2014.
- ↑ dpa: Europas größter Batteriepark wächst: Transformatoren angeliefert. t-online.de, 11. März 2014, abgerufen am 14. März 2014.
- ↑ Größter Batteriespeicher Europas in Betrieb genommen. 7. September 2015, archiviert vom am 24. Januar 2016; abgerufen am 14. Oktober 2016.
- ↑ M. Wohlfahrt-Mehrens, C. Vogler, J. Garche: Aging mechanisms of lithium cathode materials. In: Journal of Power Sources. 127, Nr. 1–2, 2004, S. 58–64, doi:10.1016/j.jpowsour.2003.09.034.
- ↑ Sébastien Patoux, Lucas Sannier, Hélène Lignier, Yvan Reynier, Carole Bourbon, Séverine Jouanneau, Frédéric Le Cras, Sébastien Martinet,: High voltage nickel manganese spinel oxides for Li-ion batteries. In: Electrochimica Acta. Band 53, Nr. 12, Mai 2008, S. 4137–4145, doi:10.1016/j.electacta.2007.12.054.
- ↑ a b c d Christian Hanisch, Jan Diekmann, Alexander Stieger, Wolfgang Haselrieder, Arno Kwade: Handbook of Clean Energy Systems – Recycling of Lithium-Ion Batteries. 5 Energy Storage Auflage. John Wiley & Sons, Ltd, 2015, ISBN 978-1-118-99197-8, Kap. 27, S. 2865–2888, doi:10.1002/9781118991978.hces221.
- ↑ Isidor Buchmann: Ist Lithium-Ion die ideale Batterie? Plattform für die Förderung und Verbreitung von Elektrofahrzeugen, abgerufen am 17. Dezember 2011.
- ↑ Tsuyoshi Sasaki, Yoshio Ukyo, Petr Novák: Memory effect in a lithium-ion battery. In: nature materials. 14. April 2013, doi:10.1038/NMAT3623.
- ↑ Isidor Buchmann: Will Lithium-Ion batteries power the new millennium? September 2008.
- ↑ Richard L. Hartmann II: An aging model for lithium-ion cells, S. 75–79 (PDF-Datei; 3,4 MB).
- ↑ Neue Macbook-Pro-Modelle mit 13 und 15 Zoll. In: golem.de. 8. Juni 2009.
- ↑ Untersuchungen von Polarisationseffekte an Lithium-Ionen-Batterien In: Promotion Dr. Marcel Wilka 19. Dezember 2013.
- ↑ a b c Life-Cycle Testing of Mars Surveyor Program Lander Lithium Ion Battery Achieved Over 10,000 Low-Earth-Orbit Cycles. In: NASA.gov. 16. Oktober 2006.
- ↑ PDF bei www.et-inf.fho-emden.de
- ↑ a b c d Charging lithium-ion batteries. In: BORDER RADIO CLUB Newsletter. März 2006.
- ↑ E-One Moli Energy: Ankündigung einer neuen Zelle ( vom 11. März 2007 im Internet Archive)
- ↑ LiIon: viele Zellen haben Ladeschlussspannung von 4,35 V! ALC Update geplant?, elv.de, 2013.
- ↑ Produktbeschreibung SCiB von Toshiba
- ↑ Akkus: Kurzlebig ab Werk, TecChannel.de, Seite 4 von 15
- ↑ Lithium-Ionen-Akku. In: qsl.net.
- ↑ a b Winston Battery: WB-LYP100AHA Datenblatt LiFePO4-Zelle 3,2 V 100 Ah, eingefügt 11. Februar 2012
- ↑ Bernhard Haluschak: Akkus: Kurzlebig ab Werk. In: Tecchannel. 23. September 2005.
- ↑ M.Frehner, 2007: Alles über Akkus Abschnitt: Selbstentladung, eingefügt 15. Februar 2012
- ↑ Empfehlungen für die Beförderung gefährlicher Güter. (PDF; 4,9 MB) Abgerufen am 23. September 2016.
- ↑ DHL Vertriebs GmbH & Co OHG Marktkommunikation: Regelung für die Beförderung von gefährlichen Stoffen und Gegenständen (PDF; 132 kB)
- ↑ Isidor Buchmann: Wann wurde die Batterie erfunden? In: Batterien-Montage-Zentrum GmbH.
- ↑ Battery Management Systems (BMS). In: Electropaedia.
- ↑ Multi-Cell Li-ion Battery Pack OCP/Analog Front End bei intersil
- ↑ Thomas Waldmann, Marcel Wilka, Michael Kasper, Meike Fleischhammer, Margret Wohlfahrt-Mehrens: Temperature dependent ageing mechanisms in Lithium-ion batteries – A Post-Mortem study. In: Journal of Power Sources. 262, 2014, S. 129–135, doi:10.1016/j.jpowsour.2014.03.112.
- ↑ Thomas Waldmann, Margret Wohlfahrt-Mehrens: In-Operando Measurement of Temperature Gradients in Cylindrical Lithium-Ion Cells during High-Current Discharge In: ECS Electrochemistry Letters 4, 2015, S. A1-A3, doi:10.1149/2.0031501eel.
- ↑ Thomas Waldmann, Gunther Bisle, Björn-Ingo Hogg, Stefan Stumpp, Michael A. Danzer, Michael Kasper, Peter Axmann, and Margret Wohlfahrt-Mehrens: Influence of Cell Design on Temperatures and Temperature Gradients in Lithium-Ion Cells: An In Operando Study In: Journal of The Electrochemical Society 162, 2015, S. A921-A927, doi:10.1149/2.0561506jes.
- ↑ Gigaset ruft Telefon-Akkus wegen Überhitzung zurück
- ↑ Opel verkauft vorerst keinen Ampera
- ↑ Spiegel online 6. Januar 2012: Opel-Mutterkonzern kriegt Flammengefahr in den Griff, eingefügt 13. Februar 2012
- ↑ Bundesanstalt für Arbeitsschutz und Arbeitsmedizin 2012: Elektromobilität – Abschätzung arbeitswissenschaftlich relevanter Veränderungen,eingefügt 28. März 2012
- ↑ YouTube: Lithium and Water
- ↑ Ki Tae Nam u. a.: Virus-Enabled Synthesis and Assembly of Nanowires for Lithium Ion Battery Electrodes. In: Science. Band 312, Nr. 5775, 2006, S. 885–888, doi:10.1126/science.1122716.
- ↑ Kevin Bullis: Higher-Capacity Lithium-Ion Batteries. In: Technology Review. 22. Juni 2006.
- ↑ B. L. Ellis u. a.: A multifunctional 3.5 V iron-based phosphate cathode for rechargeable batteries. In: Nature Materials. Band 6, Nr. 10, 2007, S. 749–753, doi:10.1038/nmat2007.
- ↑ New Nanowire Battery Holds 10 Times The Charge Of Existing Ones. In: ScienceDaily. 20. Dezember 2007 (Meldung auf Sciencedaily.com).
- ↑ Interview with Dr. Cui, Inventor of Silicon Nanowire Lithium-ion Battery Breakthrough. In: GM-Volt. 21. Dezember 2007 (Interview auf der Website gm-volt.com).
- ↑ Peter Fairley: Realizing Lithium-Battery Potential. In: Technology Review. 3. Dezember 2008.
- ↑ Rainer Kayser: Der Super-Akku. In: pro-physik.de. 12. März 2009.
- ↑ Gernot Goppelt: „Aluminium-Celmet“ soll die Kapazität von Lithium-Ionen-Batterien verdreifachen Heise-Internetportal, Rubrik „Auto“, Sektion „News“, 30. Juni 2011
- ↑ Flyer: Produktübersicht, aufgerufen 10. Mai 2012
- ↑ Flyer (NL): Abschnitt: Actieradius (Hinweis auf Verwendung der Lithium-Mangan-Technologie), aufgerufen 10. Mai 2012
- ↑ G. Girishkumar, B. McCloskey, A. C. Luntz, S. Swanson, W. Wilcke: Lithium−Air Battery: Promise and Challenges. In: The Journal of Physical Chemistry Letters. Band 1, Nr. 14, 15. Juli 2010, S. 2193–2203, doi:10.1021/jz1005384.
- ↑ Singlet Oxygen Formation during the Charging Process of an Aprotic Lithium–Oxygen Battery J. Wandt, P. Jakes, J. Granwehr, H.A. Gasteiger, R.-A. Eichel, Angew. Chem. Int. Ed. 2016, 128, 7006–7009. {{doi: 10.1002/anie.201602142}}
- ↑ Mehr Reichweite für Elektroautos, Schott AG
- ↑ tietEK: technology concept for inspectation and exploration of the deep sea, Fraunhofer IOSB
- ↑ Altana und CCI kooperieren bei der Entwicklung von Energiespeichersystemen, chemanager-online.com, 23. Januar 2014.