„Glykolyse“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K typo |
Ausbau, Ausbau, Ausbau (Pflanzenteil nach Plaxton) |
||
| Zeile 3: | Zeile 3: | ||
Die Glykolyse wird nach ihren Entdeckern [[Gustav Embden]], [[Otto Meyerhof]] und [[Jakub Karol Parnas]] auch als ''Embden-Meyerhof-Parnas-Weg'' oder ''EMP-Weg'' bezeichnet. Veraltet ist die Bezeichnung ''FDP-Weg'', der auf ein Zwischenprodukt, <small>D</small>-[[Fructose-1,6-bisphosphat]] (veraltet: Fructosediphosphat), zurückgeht. Sie ist der einzige metabolische Weg, den fast alle [[Organismus|Organismen]] gemeinsam haben, was auf eine sehr frühe Entstehung hinweist. |
Die Glykolyse wird nach ihren Entdeckern [[Gustav Embden]], [[Otto Meyerhof]] und [[Jakub Karol Parnas]] auch als ''Embden-Meyerhof-Parnas-Weg'' oder ''EMP-Weg'' bezeichnet. Veraltet ist die Bezeichnung ''FDP-Weg'', der auf ein Zwischenprodukt, <small>D</small>-[[Fructose-1,6-bisphosphat]] (veraltet: Fructosediphosphat), zurückgeht. Sie ist der einzige metabolische Weg, den fast alle [[Organismus|Organismen]] gemeinsam haben, was auf eine sehr frühe Entstehung hinweist. |
||
Einige [[Bakterien]] und [[Archaeen]] verwenden andere Stoffwechselwege für den Abbau von Glucose, beispielsweise den [[Entner-Doudoroff-Weg]] ( |
Einige [[Bakterien]] und [[Archaeen]] verwenden andere Stoffwechselwege für den Abbau von Glucose, beispielsweise den [[Entner-Doudoroff-Weg]] (ED-Weg). |
||
== Geschichte == |
== Geschichte == |
||
[[Datei:Eduardbuchner.jpg|thumb|hochkant|[[Eduard Buchner]] erhielt 1907 den [[Nobelpreis für Chemie]] für seine Entdeckung der zellfreien Vergärung.]] |
[[Datei:Eduardbuchner.jpg|thumb|hochkant|[[Eduard Buchner]] erhielt 1907 den [[Nobelpreis für Chemie]] für seine Entdeckung der zellfreien Vergärung.]] |
||
Untersuchungen über den Abbau von Zucker gehen ins 19. Jahrhundert zurück. |
Untersuchungen über den Abbau von Zucker gehen weit ins 19. Jahrhundert zurück. 1837 wurde durch die Forscher [[Charles Cagniard-Latour]], [[Theodor Schwann]] und [[Friedrich Traugott Kützing]] unabhängig voneinander nachgewiesen, dass der heutezutage als [[Alkoholische Gärung|alkoholische Gärung]] bekannte Abbau von Glucose zu [[Ethanol]] durch Lebewesen, Hefen, verursacht wird.<ref>Racker, E. (1974): ''History of the Pasteur effect and its pathobiology''. In: ''Mol Cell Biochem.'' 5(1–2); 17–23; PMID 4279327; {{DOI|10.1007/BF01874168}}</ref> Dieser anaerobe Abbau von Zuckern in lebenden Hefezellen bestätigte [[Louis Pasteur]] in den Jahren 1857 bis 1876. Insbesondere konnte er beobachten, dass der Verbrauch an Glucose bei diesem Vorgang unter anaeroben Bedinungen höher ist als wenn den Hefen Sauerstoff zur Verfügung steht. Diese Beobachtung wird „[[Pasteur-Effekt]]“ bezeichnet. |
||
1897 entdeckte [[Eduard Buchner]], dass die alkoholische Vergärung in einem zellfreien Hefeextrakt möglich ist. Damit zeigte er, dass der Stoffwechselweg auch dann stattfinden kann, wenn die Zellen nicht mehr intakt sind (''[[in vitro]]''). Diese Gäraktivität bezeichnete er als „[[Zymase]]“, ohne zu wissen, dass mehrere Enzyme am anaeroben Abbau von Glucose involviert sind. |
|||
| ⚫ | Die Identifikation und Aufklärung der einzelnen Schritte in der Glykolyse wurde Anfang des 20. Jahrhunderts vorangetrieben. [[Arthur Harden]] und [[William John Young]] hatten 1905 herausgefunden, dass die ''in vitro'' stattfindende Gärreaktion von Hefeextrakten durch die Zugabe von anorganischem Phosphat (P<sub>i</sub>) wiederhergestellt werden kann.<ref>Harden, A. und Young, WJ. (1906): ''The Alcoholic Ferment of Yeast-Juice''. In: ''Proc. R. Soc. Lond. B'' 77; 405–420; [http://rspb.royalsocietypublishing.org/content/77/519/405.full.pdf+html PDF] (freier Volltextzugriff, engl.)</ref> Außerdem gelang es ihnen, dabei Fructose-1,6-bisphosphat zu isolieren. Sie konnten damit nachweisen, dass es ein Zwischenprodukt der Glykolyse ist. Zudem trennten sie zellfreien Hefeextrakt mittels [[Dialyse (Chemie)|Dialyse]] in zwei Fraktionen auf.<ref>Donald Voet, Judith G. Voet, Alfred Maelicke (Hsrg.), Werner Müller-Esterl (Hrsg.): ''Biochemie''. Wiley-VCH 1992. ISBN 3-527-28242-4; S. 421f.</ref> Die Forscher bezeichneten die nicht dialysierbare Fraktion als „Zymase“. Sie war auch wärmeempfindlich. Die dialysierbare Fraktion war dagegen wärmestabil und wurde „Cozymase“ genannt. Nur beide zusammen konnten eine Gärreaktion ''in vitro'' hervorrufen. Es stellt sich heraus, dass die Zymase ein Enzymgemisch war, während die Cozymase die für diese Enzyme nötigen Coenzyme enthielt. |
||
| ⚫ | Die Identifikation und Aufklärung der einzelnen Schritte in der Glykolyse wurde Anfang des 20. Jahrhunderts vorangetrieben. [[Arthur Harden]] und [[William John Young]] hatten 1905 herausgefunden, dass die ''in vitro'' stattfindende Gärreaktion von Hefeextrakten durch die Zugabe von anorganischem Phosphat (P<sub>i</sub>) wiederhergestellt werden kann.<ref>Harden, A. und Young, WJ. (1906): ''The Alcoholic Ferment of Yeast-Juice''. In: ''Proc. R. Soc. Lond. B'' 77; 405–420; [http://rspb.royalsocietypublishing.org/content/77/519/405.full.pdf+html PDF] (freier Volltextzugriff, engl.)</ref> Außerdem gelang es ihnen, dabei Fructose-1,6-bisphosphat zu isolieren. Sie konnten damit nachweisen, dass es ein Zwischenprodukt der Glykolyse ist. Zudem trennten sie zellfreien Hefeextrakt mittels [[Dialyse (Chemie)|Dialyse]] in zwei Fraktionen auf.<ref>Donald Voet, Judith G. Voet, Alfred Maelicke (Hsrg.), Werner Müller-Esterl (Hrsg.): ''Biochemie''. Wiley-VCH 1992. ISBN 3-527-28242-4; S. 421f.</ref> Die Forscher bezeichneten die nicht dialysierbare Fraktion als „Zymase“. Sie war auch wärmeempfindlich. Die dialysierbare Fraktion war dagegen wärmestabil und wurde „Cozymase“ genannt. Nur beide zusammen konnten eine Gärreaktion ''in vitro'' hervorrufen. Es stellt sich heraus, dass die Zymase ein Enzymgemisch war, während die Cozymase die für diese Enzyme nötigen Coenzyme enthielt. 1918 konnte [[Otto Meyerhof]] nachweisen, dass in der [[Milchsäuregärung]] des Muskels die gleichen Coenzmye benötigt werden wie bei der alkoholischen Gärung.<ref name="Meyerhof">Kresge N., Simoni, RD. und Hill, RL. (2005): ''Otto Fritz Meyerhof and the elucidation of the glycolytic pathway''. In: ''J Biol Chem''. 280(4):e3; PMID 15665335; [http://www.jbc.org/content/280/4/e3.full.pdf+html PDF] (freier Volltextzugriff, engl.)</ref> |
||
| ⚫ | |||
Wegen der Kurzlebigkeit vieler Intermediate gestaltete sich die Aufklärung des Stoffwechselweges als schwierig. [[Gustav Embden]] schlug 1932 eine erste biochemische Reaktionsfolge für die Glykoylse vor. Zwei Jahre später konnte [[Kurt Lohmann]] im Labor Meyerhofs den Nachweis erbringen, dass der universelle Energieträger [[Adenosintriphosphat]] (ATP) bei der Glykolyse erzeugt wird. Meyerhofs Forschergruppe hatte Anteil daran, dass etwa ein Drittel der in der Glykolyse beteiligten Enzyme entdeckt wurden. |
|||
Schließlich waren Ende der 1930er-Jahre durch die Arbeiten von [[Otto Warburg]] und [[Hans Karl August Simon von Euler-Chelpin|Hans von Euler-Chelpin]] die Reaktionsschritte in Hefe aufgeklärt; Embden, Meyerhof und [[Jakub Karol Parnas]] arbeiteten dagegen mit Muskelzellen. Außerdem hatten auch [[Carl Ferdinand Cori|Carl]] und [[Gerty Cori]], [[Carl Neuberg]] und [[Robert Robison]] einen großen Anteil an der Aufklärung der Glykolyse. |
|||
| ⚫ | |||
== Bedeutung für die Zelle == |
== Bedeutung für die Zelle == |
||
| Zeile 19: | Zeile 25: | ||
In der Glykolyse wird Energie gewonnen und in Form von zwei Molekülen ATP bereitgestellt, unabhängig davon, ob [[Sauerstoff]] für die [[Atmungskette]] vorliegt oder nicht. Die Glykolyse erzeugt ungefähr 15 Mal weniger ATP auf ein Molekül <small>D</small>-Glucose als der vollständige oxidative Abbau zu Kohlenstoffdioxid und Wasser im [[Citratzyklus]] und in der [[Atmungskette]]. Daher wird unter aeroben Bedingungen auch weniger Glucose verstoffwechselt, was bereits 1861 von [[Louis Pasteur]] bei Hefen beobachtet wurde ([[Pasteur-Effekt]]). |
In der Glykolyse wird Energie gewonnen und in Form von zwei Molekülen ATP bereitgestellt, unabhängig davon, ob [[Sauerstoff]] für die [[Atmungskette]] vorliegt oder nicht. Die Glykolyse erzeugt ungefähr 15 Mal weniger ATP auf ein Molekül <small>D</small>-Glucose als der vollständige oxidative Abbau zu Kohlenstoffdioxid und Wasser im [[Citratzyklus]] und in der [[Atmungskette]]. Daher wird unter aeroben Bedingungen auch weniger Glucose verstoffwechselt, was bereits 1861 von [[Louis Pasteur]] bei Hefen beobachtet wurde ([[Pasteur-Effekt]]). |
||
Da die Glykolyse auch unter [[anoxisch]]en Bedingungen abläuft, eröffnet dies einige vorteilhafte Möglichkeiten im Stoffwechsel. Beispielsweise können [[Mikroorganismen]] in einem anoxischen Milieu auf diese Weise Energie gewinnen. Bei [[Wirbeltiere]]n wird im Falle starker Muskelbeanspruchung manchmal mehr Sauerstoff verbraucht als in die Zellen transportiert wird. Daher muss die Zelle ihre Energie kurzfristig ausschließlich aus der Glykolyse beziehen. Dies ist häufig bei größeren Tieren wie [[Alligatoren]], [[Krokodile]]n, [[Elefanten]], [[Nashörner]]n, [[Wale]]n und [[Robben]] der Fall, bei denen Sauerstoff für den oxidativen Abbau von Glucose nicht schnell genug bereitgestellt werden kann.<ref name="Lehninger">Albert L. Lehninger, David L. Nelson und Michael M. Cox:'' Lehninger Biochemie''. 3., vollst. überarb. u. erw. Auflage. Springer, Berlin 2009, ISBN 978-3-540-41813-9; S. 584ff.</ref> Auch beim Menschen wird Glucose in schnell [[Muskelkontraktion|kontraktierenden Muskelzellen]] im Zuge der Glykolyse und der |
Da die Glykolyse auch unter [[anoxisch]]en Bedingungen abläuft, eröffnet dies einige vorteilhafte Möglichkeiten im Stoffwechsel. Beispielsweise können [[Mikroorganismen]] in einem anoxischen Milieu auf diese Weise Energie gewinnen. Bei [[Wirbeltiere]]n wird im Falle starker Muskelbeanspruchung manchmal mehr Sauerstoff verbraucht als in die Zellen transportiert wird. Daher muss die Zelle ihre Energie kurzfristig ausschließlich aus der Glykolyse beziehen. Dies ist häufig bei größeren Tieren wie [[Alligatoren]], [[Krokodile]]n, [[Elefanten]], [[Nashörner]]n, [[Wale]]n und [[Robben]] der Fall, bei denen Sauerstoff für den oxidativen Abbau von Glucose nicht schnell genug bereitgestellt werden kann.<ref name="Lehninger">Albert L. Lehninger, David L. Nelson und Michael M. Cox:'' Lehninger Biochemie''. 3., vollst. überarb. u. erw. Auflage. Springer, Berlin 2009, ISBN 978-3-540-41813-9; S. 584ff.</ref> Auch beim Menschen wird Glucose in schnell [[Muskelkontraktion|kontraktierenden Muskelzellen]] im Zuge der Glykolyse und der Milchsäuregärung zu [[Lactat]] umgesetzt. Ein großer Vorteil der Glykolyse ist die Tatsache, dass ATP dabei 100 mal schneller bereitgestellt werden kann als über die oxidative Phosphorylierung in der Atmungskette.<ref>Donald Voet, Judith G. Voet, Alfred Maelicke (Hsrg.), Werner Müller-Esterl (Hrsg.): ''Biochemie''. Wiley-VCH, 1992, ISBN 3-527-28242-4; S. 444</ref> |
||
[[Pflanzen]] gewinnen ihre Energie entweder aus der [[Photosynthese]] oder aus der Atmungskette. Es gibt jedoch auch Situationen, in denen temporär Licht bzw. Sauerstoff nicht zur Verfügung steht, beispielsweise bei der [[Imbibition]] während der [[Keimung|Samenkeimung]] oder bei einer zeitweiligen Überflutung der [[Wurzel (Pflanze)|Wurzeln]] mit Wasser. Unter diesen Bedingungen wird der lokale Stoffwechsel durch die Glykolyse aufrechterhalten.<ref>Hans W. Heldt, Birgit Piechulla: ''Pflanzenbiochemie''. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 334</ref> |
[[Pflanzen]] gewinnen ihre Energie entweder aus der [[Photosynthese]] oder aus der Atmungskette. Es gibt jedoch auch Situationen, in denen temporär Licht bzw. Sauerstoff nicht zur Verfügung steht, beispielsweise bei der [[Imbibition]] während der [[Keimung|Samenkeimung]] oder bei einer zeitweiligen Überflutung der [[Wurzel (Pflanze)|Wurzeln]] mit Wasser. Unter diesen Bedingungen wird der lokale Stoffwechsel durch die Glykolyse aufrechterhalten.<ref>Hans W. Heldt, Birgit Piechulla: ''Pflanzenbiochemie''. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 334</ref> |
||
| Zeile 82: | Zeile 88: | ||
| [[Datei:Beta-D-Fructose-6-phosphat2.svg|130px]] || ATP ADP<br />[[Datei:R-Pfeil rechts 1-3.svg]]<br />[[Phosphofructokinase|Phospho-<br />fructo-<br />kinase]] || [[Datei:Beta-D-Fructose-1,6-bisphosphat2.svg|130px]] |
| [[Datei:Beta-D-Fructose-6-phosphat2.svg|130px]] || ATP ADP<br />[[Datei:R-Pfeil rechts 1-3.svg]]<br />[[Phosphofructokinase|Phospho-<br />fructo-<br />kinase]] || [[Datei:Beta-D-Fructose-1,6-bisphosphat2.svg|130px]] |
||
|- |
|- |
||
| β-<small>D</small>- |
| β-<small>D</small>-Fructose-6-phosphat || || β-<small>D</small>-[[Fructose-1,6-bisphosphat]] |
||
|} |
|} |
||
| Zeile 93: | Zeile 99: | ||
| [[Datei:Beta-D-Fructose-1,6-bisphosphat2.svg|130px]] || [[Aldolase]]<br />[[Datei:GG-Pfeil 1.svg]]<br /> || [[Datei:Dihydroxyacetonphosphat2.svg|70px]] || [[Triosephosphatisomerase|Triose-<br />phosphat-<br />Isomerase]]<br />[[Datei:GG-Pfeil 1.svg]]<br /> || [[Datei:D-Glycerinaldehyd-3-phosphat2.svg|100px]] |
| [[Datei:Beta-D-Fructose-1,6-bisphosphat2.svg|130px]] || [[Aldolase]]<br />[[Datei:GG-Pfeil 1.svg]]<br /> || [[Datei:Dihydroxyacetonphosphat2.svg|70px]] || [[Triosephosphatisomerase|Triose-<br />phosphat-<br />Isomerase]]<br />[[Datei:GG-Pfeil 1.svg]]<br /> || [[Datei:D-Glycerinaldehyd-3-phosphat2.svg|100px]] |
||
|- |
|- |
||
| α-<small>D</small>- |
| α-<small>D</small>-Fructose-1,6-bisphosphat || || [[Dihydroxyacetonphosphat|Dihydroxy-<br />aceton-<br />phosphat]] || || <small>D</small>-[[Glycerinaldehyd-3-phosphat|Glycerin-<br />aldehyd-<br />3-phosphat]] |
||
|} |
|} |
||
| Zeile 104: | Zeile 110: | ||
| [[Datei:D-Glycerinaldehyd-3-phosphat2.svg|100px]] || NAD<sup>+</sup> NADH<br /> + P<sub>i</sub> + H<sup>+</sup><br />[[Datei:GG-Pfeil 1-4.svg]]<br />[[Glycerinaldehyd-3-phosphat-Dehydrogenase|Glycerinaldehyd-<br />3-phosphat-<br />Dehydrogenase]] || [[Datei:D-1,3-Bisphosphoglycerat2.svg|130px]] |
| [[Datei:D-Glycerinaldehyd-3-phosphat2.svg|100px]] || NAD<sup>+</sup> NADH<br /> + P<sub>i</sub> + H<sup>+</sup><br />[[Datei:GG-Pfeil 1-4.svg]]<br />[[Glycerinaldehyd-3-phosphat-Dehydrogenase|Glycerinaldehyd-<br />3-phosphat-<br />Dehydrogenase]] || [[Datei:D-1,3-Bisphosphoglycerat2.svg|130px]] |
||
|- |
|- |
||
| <small>D</small>- |
| <small>D</small>-Glycerinaldehyd-3-phosphat || || <small>D</small>-[[1,3-Bisphosphoglycerat]] |
||
|} |
|} |
||
| Zeile 114: | Zeile 120: | ||
| [[Datei:D-1,3-Bisphosphoglycerat2.svg|130px]] || [[Phosphoglyceratkinase|Phospho-<br />glycerat-<br />kinase]]<br />ADP ATP<br />[[Datei:GG-Pfeil 1-4.svg]] || [[Datei:D-3-Phosphoglycerat2.svg|100px]] |
| [[Datei:D-1,3-Bisphosphoglycerat2.svg|130px]] || [[Phosphoglyceratkinase|Phospho-<br />glycerat-<br />kinase]]<br />ADP ATP<br />[[Datei:GG-Pfeil 1-4.svg]] || [[Datei:D-3-Phosphoglycerat2.svg|100px]] |
||
|- |
|- |
||
| <small>D</small>- |
| <small>D</small>-1,3-Bisphosphoglycerat || || <small>D</small>-[[3-Phosphoglycerat]] |
||
|} |
|} |
||
| Zeile 124: | Zeile 130: | ||
| [[Datei:D-3-Phosphoglycerat2.svg|100px]] || [[Phosphoglyceratmutase|Phospho-<br />glycerat-<br />Mutase]]<br />[[Datei:GG-Pfeil 1.svg]] || [[Datei:D-2-Phosphoglycerat2.svg|130px]] || −H<sub>2</sub>O<br />[[Enolase]]<br />[[Datei:GG-Pfeil 1.svg]]<br /> || [[Datei:Phosphoenolpyruvat Fischer2.svg|130px]] || ADP ATP<br />[[Datei:R-Pfeil rechts 1-3.svg]]<br />[[Pyruvatkinase]] || [[Datei:Pyruvat Fischer.svg|80px]] |
| [[Datei:D-3-Phosphoglycerat2.svg|100px]] || [[Phosphoglyceratmutase|Phospho-<br />glycerat-<br />Mutase]]<br />[[Datei:GG-Pfeil 1.svg]] || [[Datei:D-2-Phosphoglycerat2.svg|130px]] || −H<sub>2</sub>O<br />[[Enolase]]<br />[[Datei:GG-Pfeil 1.svg]]<br /> || [[Datei:Phosphoenolpyruvat Fischer2.svg|130px]] || ADP ATP<br />[[Datei:R-Pfeil rechts 1-3.svg]]<br />[[Pyruvatkinase]] || [[Datei:Pyruvat Fischer.svg|80px]] |
||
|- |
|- |
||
| <small>D</small>- |
| <small>D</small>-3-Phosphoglycerat || || <small>D</small>-[[2-Phosphoglycerat]] || || [[Phosphoenolpyruvat]] || || [[Pyruvat]] |
||
|} |
|} |
||
| Zeile 250: | Zeile 256: | ||
=== Phosphofructokinase-1 === |
=== Phosphofructokinase-1 === |
||
Der wichtigste Kontrollpunkt der Glykolyse ist die Phosphorylierung von Frc-6-P zu Frc1,6-bP durch die Phosphofructokinase-1 (PFK-1). Er stellt den ersten wirklichen glykolysespezifischen Schritt |
Der wichtigste Kontrollpunkt der Glykolyse ist die Phosphorylierung von Frc-6-P zu Frc1,6-bP durch die Phosphofructokinase-1 (PFK-1). Er stellt den ersten wirklichen glykolysespezifischen Schritt dar und ist unter physiologischen Bedingungen irreversibel.<ref name="Garr542">Reginald Garrett und Charles M. Grisham: ''Biochemistry''. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 542f.</ref> Das Enzym weist zwei Bindungsstellen für ATP auf. Neben einer hochaffinen Substratbindestelle verfügt die PFK-1 auch über eine regulatorische Seite. So kann ATP sowohl als Substrat dienen, als auch die PFK-1 allosterisch hemmen. Unter ausreichend hohen ATP-Konzentrationen wird der K<sub>M</sub>-Wert des Enzyms erhöht. Dies senkt die Aktivität der PFK-1, so dass die Glykolyse gedrosselt wird. Dennoch schwanken die ATP-Level einer Zelle nur geringfügig, so dass ATP alleine nicht ausreichend wäre für eine genaue Regulation. Daher hängt die Aktivität der PFK-1 auch von der Menge an [[Adenosinmonophosphat|AMP]] ab und spiegelt die energetische Versorgung der Zelle wider. Falls diese ausreichend hoch ist, wird das Enzym gehemmt, andernfalls wird die Aktivität der PFK-1 erhöht, um mehr ATP zu generieren. |
||
Auch [[Citrat]] inhibiert die PFK-1 allosterisch. Citrat ist ein Schlüsselmetabolit des [[Citratzyklus]], dessen primärer Zweck die Erzeugung von Energie unter aeroben Bedingungen ist. Alternativ können aus dem Citratzyklus verschiedene Vorläufermoleküle entnommen werden. Falls viel Citrat vorliegt, ist der Citratzyklus gesättigt. Daher inhibiert Citrat die PFK-1 im Sinne einer Endprodukthemmung, so dass die Glykolyse den Citratzyklus weniger stark speist. |
Auch [[Citrat]] inhibiert die PFK-1 allosterisch. Citrat ist ein Schlüsselmetabolit des [[Citratzyklus]], dessen primärer Zweck die Erzeugung von Energie unter aeroben Bedingungen ist. Alternativ können aus dem Citratzyklus verschiedene Vorläufermoleküle entnommen werden. Falls viel Citrat vorliegt, ist der Citratzyklus gesättigt. Daher inhibiert Citrat die PFK-1 im Sinne einer Endprodukthemmung, so dass die Glykolyse den Citratzyklus weniger stark speist. |
||
| Zeile 295: | Zeile 301: | ||
Nach Spaltung von [[Lactose|Milchzucker]] werden <small>D</small>-Glucose und <small>D</small>-[[Galactose]] freigesetzt. Um Galactose in sein C4-Epimer Glucose zu überführen, wird der Zucker zunächst durch eine [[Galactokinase]] (GK, EC 2.7.1.6) unter Verbrauch von ATP zu Galactose-1-phosphat umgesetzt. Eine [[Galactose-1-phosphat-Uridyltransferase]] (GALT) katalysiert nun einen Austausch von [[Uridindiphosphat|UDP]]-gebundener Glucose mit Galactose. Hierbei entstehen [[Glucose-1-phosphat]] und UDP-Galactose. Während Glucose-1-phosphat durch eine [[Phosphoglucomutase]] (PGM) zu Glucose-6-phosphat isomerisiert wird, epimerisiert eine [[UDP-Glucose-4-Epimerase]] (UGE) UDP-Galactose zu UDP-Glucose. |
Nach Spaltung von [[Lactose|Milchzucker]] werden <small>D</small>-Glucose und <small>D</small>-[[Galactose]] freigesetzt. Um Galactose in sein C4-Epimer Glucose zu überführen, wird der Zucker zunächst durch eine [[Galactokinase]] (GK, EC 2.7.1.6) unter Verbrauch von ATP zu Galactose-1-phosphat umgesetzt. Eine [[Galactose-1-phosphat-Uridyltransferase]] (GALT) katalysiert nun einen Austausch von [[Uridindiphosphat|UDP]]-gebundener Glucose mit Galactose. Hierbei entstehen [[Glucose-1-phosphat]] und UDP-Galactose. Während Glucose-1-phosphat durch eine [[Phosphoglucomutase]] (PGM) zu Glucose-6-phosphat isomerisiert wird, epimerisiert eine [[UDP-Glucose-4-Epimerase]] (UGE) UDP-Galactose zu UDP-Glucose. |
||
== Besonderheiten bei grünen Pflanzen == |
|||
Bei grünen Pflanzen gibt es einige Variationen in der Glykolyse verglichen mit der bei Tieren.<ref name="Plaxton">Plaxton, WC. (1996): ''The organization and regulation of plant glycolysis''. In: ''Annu Rev Plant Physiol Plant Mol Biol.'' 47; 185–214; PMID 15012287; {{DOI|10.1146/annurev.arplant.47.1.185}}</ref> Es ist bekannt, dass dort die Glykolyse nicht nur im Cytoplasma, sondern auch in den Plastiden der Zelle unabhängig voneinander betrieben wird. Nicht in allen Pflanzen läuft sie jedoch in den Plastiden vollständig ab, da häufig Enzyme der Amortisierungsphase fehlen, beispielsweise Enolase oder Phosphoglyceratmutase. Durch hochspezifische Translokatoren können Intermediate von einem zum anderen [[Zellkompartiment]] transportiert werden. |
|||
Grüne Pflanzen nutzen die Glykolyse in den Plastiden, um in der Dunkelheit oder in nicht-photosynthetischem Gewebe Stärke zu Pyruvat unter ATP- und NADH-Gewinn abzubauen und Vorläufermoleküle bereitzustellen, beispielsweise für die Fettsäuresynthese. Im Cytosol vieler unizellulärer [[Grünalge]]n fehlen die cytosolischen Enzyme für die Glykolyse, so dass diese in den Chloroplasten vollständig abläuft. |
|||
Für das parallele Betreiben der Glykolyse im Cytoplasma und in den Plastiden werden Isoenyzme im [[Genom]] der Pflanze kodiert. So gibt es beispielsweise sowohl eine Pyrvatkinase, die sich im Cytoplasma befindet, als auch eine plasitdäre. Die plastidären [[Isoenzym]]e werden ebenfalls im Cytoplasma translatiert und in die [[Organell]]en transportiert. Es ist jedoch unklar, ob diese Isoenzyme durch [[Genduplikation]] entstanden sind. Möglich wäre auch ein [[Gentransfer]] aus dem Genom eines prokaryotischen Symbionten ([[Endosymbiontentheorie]]). |
|||
Eine weitere Besonderheit ist das Verwenden von Pyrophosphat (PP<sub>i</sub>) statt ATPs als Phosphatdonor, was auch in einigen Bakterien vorkommt. Normalerweise wird Pyrophosphat durch eine Pyrophosphatase (PPiase, EC 3.6.1.1) hydrolyisiert. Dadurch werden biochemische Reaktionen unter phyiologischen Bedingungen irreversibel gemacht, man spricht umgangsprachig auch von einem thermodynamischen „Zug“. Im Cytosol der Pflanzen kommt eine PPiase nicht vor, so dass dort eine Pyrophosphatkonzentration von bis zu 0,3 mM entstehen kann. Die 1979 entdeckte Pyrophosphat-abhängige PFK (PFP, EC 2.7.1.90) nutzt für die Phosphorylierung von Fructose-6-phosphat zu Fructose-1,6-bisphosphat Pyrophosphat. Diese Reaktion ist außerdem reversibel und könnte auch für den umgekehrten Weg, der Gluconeogenese, verwendet werden. PFP wird wie PFK-1 durch Fructose-2,6-bisphosphat reguliert. |
|||
Pflanzen nutzen PEP in unterschiedlicher Weise. Neben der klassischen Pyruvatkinase nutzt auch eine PEP-Carboxykinase (PEPC) das Substrat, was beim [[C4-Pflanze|C<sub>4</sub>-Stoffwechsel]] bzw. [[Crassulaceen-Säurestoffwechsel]] wichtig ist. Dabei entsteht [[Oxalacetat]], ein Intermediat des Citratzyklus. Oxalacetat kann aber auch durch eine cytosolische Malatdehydrogenase (MDH) zu <small>L</small>-[[Malat]] und dieses durch eine mitochondrielles NAD<sup>+</sup>-abhängiges [[Malatenzym]] (ME) zu Pyruvat decarboxyliert werden. Dies ist eine Umgehungsreaktion der Pyruvatkinase, bei der kein ATP erzeugt wird bei einem Phosphatmangel nützlich ist. In den Wurzeln der [[Erbse]] wurde diese Umgehung nachgewiesen. |
|||
Aus durch PEPC und MDH erzeugtem Malat kann ein plastidäres [[NADP-abhängiges Malatenzym]] Pyruvat erzeugen, was für die Fettsäuresynthese benötigt wird. Auch dadurch kann die Reaktion der Pyruvatkinase umgangen werden, was unter Phosphatmangel vorteilhaft ist. Unter solchen Bedingungen kann auch eine PEP-Phosphatase (PEPase, EC 3.1.3.60) wertvolles Phosphat freisetzen. Hierbei wird PEP in die Vakuole transportiert und dort von einer PEPase zu Pyruvat hydrolyisiert. Dieses und Phosphat werden dann ins Cytoplasma zurückgebracht. Wenn kein Phosphatmangel vorliegt, wird die PEPase durch eine ausreichend hohe P<sub>i</sub>-Konzentration inhibiert. |
|||
Schließlich gibt es auch eine cytosolische, phosphatunabhängige GADPH (EC 1.2.1.9), die Glycerinaldehyd direkt zu 3-Phosphoglycerat oxidiert. Dabei entsteht nur NADPH, aber kein ATP. |
|||
=== Regulation === |
|||
Bei der Regulation der an der Glykolyse beteiligten Enzyme gibt einige wichtige Unterschiede zu denen bei Tieren.<ref name="Plaxton" /> So ist PEP ein besonderer allosterischer Effektor, das im Gegensatz zu Tieren die PFK inhibieren kann. Fructose-1,6-bisphosphat dagegen kann nicht die Pyruvatkinase aktivieren. Während Fructose-2,6-bisphosphat in Tieren die PFK aktiviert, geschieht nichts dergleichen in Pflanzen. |
|||
Damit wird die Glykolyse in grünen Pflanzen in erster Linie durch die Aktivitäten der Pyruvatkinase und PEP-Carboxykinase reguliert, in zweiter Linie durch die PFK-1 bzw. PFP. Bei Tieren ist es prinzipiell umgekehrt. |
|||
<ref name="Plaxton" /> |
|||
== Glykolyse bei Archaeen == |
== Glykolyse bei Archaeen == |
||
| Zeile 320: | Zeile 348: | ||
* Nelson, David L., Cox, Michael M., Lehninger, Albert L. [Begr.]: ''Lehninger Biochemie''. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2009; ISBN 978-3-540-68637-8; S. 607–730 |
* Nelson, David L., Cox, Michael M., Lehninger, Albert L. [Begr.]: ''Lehninger Biochemie''. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2009; ISBN 978-3-540-68637-8; S. 607–730 |
||
* Ronimus, RS. und Morgan, HW. (2003): ''Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism''. In: ''Archaea'' 1(3); 199–221; PMID 15803666; [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2685568/pdf/Archaea-01-199.pdf PDF] (freier Volltextzugriff, engl.) |
* Ronimus, RS. und Morgan, HW. (2003): ''Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism''. In: ''Archaea'' 1(3); 199–221; PMID 15803666; [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2685568/pdf/Archaea-01-199.pdf PDF] (freier Volltextzugriff, engl.) |
||
* Plaxton, WC. (1996): ''The organization and regulation of plant glycolysis''. In: ''Annu Rev Plant Physiol Plant Mol Biol.'' 47; 185–214; PMID 15012287; {{DOI|10.1146/annurev.arplant.47.1.185}} |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
Version vom 1. April 2010, 17:54 Uhr
Die Glykolyse (aus dem Griechischen glykys = süß und lysis = auflösen) ist der schrittweise Abbau von Einfachzuckern wie der D-Glucose (Traubenzucker), von der sich auch ihr Name ableitet. Sie ist ein zentraler Prozess zur Energiegewinnung in den Zellen (Katabolismus) der meisten Lebewesen. Der Abbau erfolgt in zehn Einzelschritten, dabei entstehen aus einem Glucosemolekül zwei Moleküle Pyruvat. Neben Adenosintriphosphat (ATP) werden auch zwei Moleküle an NADH erzeugt.
Die Glykolyse wird nach ihren Entdeckern Gustav Embden, Otto Meyerhof und Jakub Karol Parnas auch als Embden-Meyerhof-Parnas-Weg oder EMP-Weg bezeichnet. Veraltet ist die Bezeichnung FDP-Weg, der auf ein Zwischenprodukt, D-Fructose-1,6-bisphosphat (veraltet: Fructosediphosphat), zurückgeht. Sie ist der einzige metabolische Weg, den fast alle Organismen gemeinsam haben, was auf eine sehr frühe Entstehung hinweist.
Einige Bakterien und Archaeen verwenden andere Stoffwechselwege für den Abbau von Glucose, beispielsweise den Entner-Doudoroff-Weg (ED-Weg).
Geschichte

Untersuchungen über den Abbau von Zucker gehen weit ins 19. Jahrhundert zurück. 1837 wurde durch die Forscher Charles Cagniard-Latour, Theodor Schwann und Friedrich Traugott Kützing unabhängig voneinander nachgewiesen, dass der heutezutage als alkoholische Gärung bekannte Abbau von Glucose zu Ethanol durch Lebewesen, Hefen, verursacht wird.[1] Dieser anaerobe Abbau von Zuckern in lebenden Hefezellen bestätigte Louis Pasteur in den Jahren 1857 bis 1876. Insbesondere konnte er beobachten, dass der Verbrauch an Glucose bei diesem Vorgang unter anaeroben Bedinungen höher ist als wenn den Hefen Sauerstoff zur Verfügung steht. Diese Beobachtung wird „Pasteur-Effekt“ bezeichnet.
1897 entdeckte Eduard Buchner, dass die alkoholische Vergärung in einem zellfreien Hefeextrakt möglich ist. Damit zeigte er, dass der Stoffwechselweg auch dann stattfinden kann, wenn die Zellen nicht mehr intakt sind (in vitro). Diese Gäraktivität bezeichnete er als „Zymase“, ohne zu wissen, dass mehrere Enzyme am anaeroben Abbau von Glucose involviert sind.
Die Identifikation und Aufklärung der einzelnen Schritte in der Glykolyse wurde Anfang des 20. Jahrhunderts vorangetrieben. Arthur Harden und William John Young hatten 1905 herausgefunden, dass die in vitro stattfindende Gärreaktion von Hefeextrakten durch die Zugabe von anorganischem Phosphat (Pi) wiederhergestellt werden kann.[2] Außerdem gelang es ihnen, dabei Fructose-1,6-bisphosphat zu isolieren. Sie konnten damit nachweisen, dass es ein Zwischenprodukt der Glykolyse ist. Zudem trennten sie zellfreien Hefeextrakt mittels Dialyse in zwei Fraktionen auf.[3] Die Forscher bezeichneten die nicht dialysierbare Fraktion als „Zymase“. Sie war auch wärmeempfindlich. Die dialysierbare Fraktion war dagegen wärmestabil und wurde „Cozymase“ genannt. Nur beide zusammen konnten eine Gärreaktion in vitro hervorrufen. Es stellt sich heraus, dass die Zymase ein Enzymgemisch war, während die Cozymase die für diese Enzyme nötigen Coenzyme enthielt. 1918 konnte Otto Meyerhof nachweisen, dass in der Milchsäuregärung des Muskels die gleichen Coenzmye benötigt werden wie bei der alkoholischen Gärung.[4]
Wegen der Kurzlebigkeit vieler Intermediate gestaltete sich die Aufklärung des Stoffwechselweges als schwierig. Gustav Embden schlug 1932 eine erste biochemische Reaktionsfolge für die Glykoylse vor. Zwei Jahre später konnte Kurt Lohmann im Labor Meyerhofs den Nachweis erbringen, dass der universelle Energieträger Adenosintriphosphat (ATP) bei der Glykolyse erzeugt wird. Meyerhofs Forschergruppe hatte Anteil daran, dass etwa ein Drittel der in der Glykolyse beteiligten Enzyme entdeckt wurden.
Schließlich waren Ende der 1930er-Jahre durch die Arbeiten von Otto Warburg und Hans von Euler-Chelpin die Reaktionsschritte in Hefe aufgeklärt; Embden, Meyerhof und Jakub Karol Parnas arbeiteten dagegen mit Muskelzellen. Außerdem hatten auch Carl und Gerty Cori, Carl Neuberg und Robert Robison einen großen Anteil an der Aufklärung der Glykolyse.
Alle Schritte und Enzyme in der Glykolyse waren somit in den 1940er-Jahren identifiziert, die genaue Untersuchung der beteiligten Enzyme und die Regulation folgten anschließend.
Bedeutung für die Zelle
Die Glykolyse ist der wichtigste Abbauweg der Kohlenhydrate im Stoffwechsel. Diese daran beteiligten Reaktionen werden durch Enzyme katalysiert, die in fast allen Lebewesen vorkommen. Damit ist die Glykolyse universell und nimmt im Stoffwechsel eine zentrale Rolle ein.
Energieerzeugung unter anaeroben Bedingungen
In der Glykolyse wird Energie gewonnen und in Form von zwei Molekülen ATP bereitgestellt, unabhängig davon, ob Sauerstoff für die Atmungskette vorliegt oder nicht. Die Glykolyse erzeugt ungefähr 15 Mal weniger ATP auf ein Molekül D-Glucose als der vollständige oxidative Abbau zu Kohlenstoffdioxid und Wasser im Citratzyklus und in der Atmungskette. Daher wird unter aeroben Bedingungen auch weniger Glucose verstoffwechselt, was bereits 1861 von Louis Pasteur bei Hefen beobachtet wurde (Pasteur-Effekt).
Da die Glykolyse auch unter anoxischen Bedingungen abläuft, eröffnet dies einige vorteilhafte Möglichkeiten im Stoffwechsel. Beispielsweise können Mikroorganismen in einem anoxischen Milieu auf diese Weise Energie gewinnen. Bei Wirbeltieren wird im Falle starker Muskelbeanspruchung manchmal mehr Sauerstoff verbraucht als in die Zellen transportiert wird. Daher muss die Zelle ihre Energie kurzfristig ausschließlich aus der Glykolyse beziehen. Dies ist häufig bei größeren Tieren wie Alligatoren, Krokodilen, Elefanten, Nashörnern, Walen und Robben der Fall, bei denen Sauerstoff für den oxidativen Abbau von Glucose nicht schnell genug bereitgestellt werden kann.[5] Auch beim Menschen wird Glucose in schnell kontraktierenden Muskelzellen im Zuge der Glykolyse und der Milchsäuregärung zu Lactat umgesetzt. Ein großer Vorteil der Glykolyse ist die Tatsache, dass ATP dabei 100 mal schneller bereitgestellt werden kann als über die oxidative Phosphorylierung in der Atmungskette.[6]
Pflanzen gewinnen ihre Energie entweder aus der Photosynthese oder aus der Atmungskette. Es gibt jedoch auch Situationen, in denen temporär Licht bzw. Sauerstoff nicht zur Verfügung steht, beispielsweise bei der Imbibition während der Samenkeimung oder bei einer zeitweiligen Überflutung der Wurzeln mit Wasser. Unter diesen Bedingungen wird der lokale Stoffwechsel durch die Glykolyse aufrechterhalten.[7]
Glucose als einziger Brennstoff

Manche spezialisierte Zellen beziehen ihre Energie ausschließlich aus der Glykolyse. So sind beispielsweise Zellen im Gehirn und dem Nierenmark auf Glucose als Brennstoff angewiesen. Erythrozyten, denen die Mitochondrien und damit die Atmungskette fehlen, und Spermien gewinnen ebenfalls ihre Energie aus der Glykolyse.[8] Insbesondere schnell proliferierende Tumorzellen nutzen die Glykolyse als Energiequelle. Otto Heinrich Warburg hatte bereits 1930 gezeigt, dass Tumorzellen eine sehr viel höhere Glykolyserate besitzen als gesunde Zellen. In der Positronen-Emissions-Tomographie wird dies genutzt, um Tumorgewebe bildlich darzustellen.
Bausteine für Zellmaterial
Die Glykolyse bereitet Glucose nicht nur für den oxidativen Abbau vor, sondern liefert auch Vorläufer für die Biosynthese anderer Verbindungen. So ist Pyruvat Ausgangsstoff für die Fettsäuresynthese und für manche Aminosäuren (L-Alanin, L-Valin und L-Leucin). Aus Dihydroxyacetonphosphat wird reduktiv Glycerin-3-phosphat gebildet, welches bei der Synthese von Lipiden eine Rolle spielt. Phosphoenolpyruvat ist Ausgangsstoff für die Biosynthese der aromatischen Aminosäuren L-Phenylalanin, L-Tryptophan und L-Tyrosin, während L-Serin aus 3-Phosphoglycerat gebildet wird.[9][10]
Bereitstellung von NADH
In der Glykolyse werden neben ATP auch Reduktionsäquivalente in Form von NADH erzeugt. Diese werden entweder in der Atmungskette für einen weiteren ATP-Gewinn reoxidiert, oder als Reduktionsmittel für Synthese anderer Moleküle verwendet – zumindest zum Zwecke der NAD+-Regeneration in Gärungen.
Ort der Glykolyse
Die Glykolyse findet im Cytoplasma einer Zelle statt. In multizellulären Organismen wie beim Menschen wird die Glykolyse in allen (differenzierten) Zelltypen durchgeführt. Es gibt Hinweise darauf, dass Pflanzen die Glykolyse auch zusätzlich in den Plastiden betreiben.[11]
Reaktionsschritte der Glykolyse

Glc-6-P = Glucose-6-phosphat
Frc-6-P = Fructose-6-phosphat
Frc-1,6-bP = Fructose-1,6-bisphosphat
DHAP = Dihydroxyacetonphosphat
GAP = Glycerinaldehyd-3-phosphat
1,3-bPG = 1,3-Bisphosphoglycerat
3-PG = 3-Phosphoglycerat
2-PG = 2-Phosphoglycerat
PEP = Phosphoenolpyruvat
Pyr = Pyruvat
Der Abbau von Glucose bis zu Pyruvat läuft sowohl unter Sauerstoffmangelbedingungen (anaerob) als auch bei ausreichendem Sauerstoffangebot (aerob) gleichartig ab. Im Gegensatz zur Atmungskette wird kein Sauerstoff (O2) verbraucht.
Die Glykolyse lässt sich in zwei Phasen unterteilen. Die erste Phase ist eine Vorbereitungsphase, bei der zunächst Energie in Form von ATP investiert wird. Sie besteht aus der Spaltung der Hexose D-Glucose in zwei Triosephosphate: Dihydroxyacetonphosphat (DHAP) und Glycerinaldehyd-3-phosphat (GAP) (vgl. Abbildung). Hierbei wird DHAP in GAP für die zweite Phase isomerisiert. Dadurch wird der Zucker für den eigentlichen Abbau vorbereitet.
In der zweiten Phase werden zwei Moleküle GAP über mehrere Zwischenschritte in zwei Moleküle Pyruvat umgesetzt. Dabei werden zwei Moleküle NADH sowie vier Moleküle ATP gebildet. Diese Phase liefert somit Energie und Reduktionsäquivalente in Form von NADH.
Die Gesamtbilanz der Glykolyse kann damit wie folgt formuliert werden:
Vorbereitungsphase
Der erste Schritt der Glykolyse ist die Phosphorylierung von D-Glucose (Glc) zu Glucose-6-phosphat (G6P). In Abhängigkeit vom Zelltyp wird diese Reaktion durch das Enzym Hexokinase oder Glucokinase katalysiert, bei der ein Molekül ATP investiert wird. Dies hat zwei Vorteile: Zum einen ist die Zellmembran zwar durchlässig für Glucose, nicht aber für das durch die Phosphorylierung entstehende Glucose-6-phosphat. Dadurch reichert es sich in der Zelle an. Außerdem steht die intrazelluläre Glucosekonzentration im Gleichgewicht zu der extrazellulären. Durch Phosphorylierung der Glucose erniedrigt sich die Glucosekonzentration in der Zelle, so dass mehr Glucose außerhalb der Zelle vorliegt. Infolgedessen strömt weitere Glucose in die Zelle ein, die Aufnahme von Glucose ist also begünstigt.
In Bakterien wird die Phosphorylierung im ersten Schritt der Glykolyse nicht durch Hexo- bzw. Glucokinasen, sondern durch das Phosphoenolpyruvat (PEP)-abhängige Zucker-Phosphotransferasesystem katalysiert.[12]
Glucose-6-phosphat wird dann von der Glucose-6-phosphat-Isomerase in das isomere Fructose-6-phosphat (F6P) umgebaut. Das Enzym bevorzugt die Bindung des alpha-Anomers der G6P, als Reaktionsprodukt entsteht α-D-Fructose-6-phosphat. Unter Standardbedingungen liegt zwar das Gleichgewicht der Isomerisierungsreaktion auf Seite des G6P. Aber da F6P schnell weiterreagiert, wird dieses dem Gleichgewicht entzogen und die Isomerisierungsreaktion läuft zu Gunsten des F6P ab.
 |
ATP ADP Hexokinase oder Glucokinase |
 |
Glucose- 6-phosphat- Isomerase  |

|
| α-D-Glucose | α-D-Glucose-6-phosphat | α-D-Fructose-6-phosphat |
Fructose-6-phosphat wird danach unter Einwirkung des ersten Schlüsselenzyms der Glykolyse, Phosphofructokinase 1, mit einem Molekül ATP zu Fructose-1,6-bisphosphat (F1,6bP) phosphoryliert, wobei ADP entsteht. Das Enzym bevorzugt das beta-Anomer der F6P, in der Vorreaktin ist dagegen das alpha-Anomer entstanden. Dies stellt jedoch kein Problem dar, da die beiden Anomere im Gleichgewicht stehen. In anaeroben Bakterien, manchen Pflanzen, primitiven Eukaryoten und manchen Archaeen wird dieser Schritt von einer Pyrophosphat-abhängigen Phosphofructokinase (EC 2.7.1.90) katalysiert, bei der Pyrophosphat (PPi) anstatt ATP verwendet wird.[13]
 |
ATP ADP Phospho- fructo- kinase |

|
| β-D-Fructose-6-phosphat | β-D-Fructose-1,6-bisphosphat |
Die damit erneute Investition von Energie ist aus zwei Gründen günstig und notwendig: Zum einen macht dieser Schritt – neben der Glucokinase sowie der Pyruvatkinase – die Glykolyse unter physiologischen Bedingungen unumkehrbar. Zum anderen ermöglicht die Spaltung der Hexose die Bildung von zwei phosphorylierten Triosen für den weiteren Abbau, Dihydroxyacetonphosphat (DHAP) und Glycerinaldehyd-3-phosphat (GAP). Die Kohlenstoffatome C1-C3 der F1,6bP finden sich in DHAP, während die C-Atome in GAP aus der C4-C6 Einheit der F1,6bP stammen.
Die Spaltungsreaktion ist unter Standardbedingungen sehr ungünstig (ΔG0’ = +24 kJ/mol) und würde nicht ablaufen. Durch die schnelle Metabolisierung beider Reaktionsprodukte läuft sie aber unter physiologischen Bedingungen im annähernden Gleichgewicht ab. Dihydroxyacetonphosphat wird noch von der Triosephosphatisomerase (TIM) in D-Glycerinaldehyd-3-phosphat umgewandelt. Diese stereospezifische Isomerisierung in Richtung GAP wird dadurch begünstigt, dass GAP in der Glykolyse weiter abgebaut wird und damit die Konzentration in der Zelle niedrig gehalten wird. Ohne weitere Metabolisierung würde das Gleichgewicht zwischen DHAP und GAP stark auf Seiten des Ketons liegen (22:1).[14]
 |
Aldolase |
 |
Triose- phosphat- Isomerase  |

|
| α-D-Fructose-1,6-bisphosphat | Dihydroxy- aceton- phosphat |
D-Glycerin- aldehyd- 3-phosphat |
Amortisierungsphase
Jedes der beiden resultierenden Glycerinaldehyd-3-phosphat-Moleküle wird zu Beginn der Amortisierungsphase der Glykolyse durch eine Glycerinaldehyd-3-phosphat-Dehydrogenase (GAPDH) oxidiert. Bei der Reaktion wird NAD+ zu NADH reduziert. Die Oxidation der Aldehydgruppe (GAP) zur Carboxygruppe ist energetisch sehr günstig. Sie wird ausgenutzt, um anorganisches Phosphat mit der Carboxygrupe zu verknüpfen. Es entsteht dadurch das gemischte Säureanhydrid 1,3-Bisphosphoglycerat (1,3-BPG). Das Gleichgewicht dieser Reaktion ist zwar auf Seiten des Eduktes GAP gegenüber 1,3-BPG (10:1).[14] Durch die schnelle Umsetzung des Produktes wird aber das Gleichgewicht zu Gunsten von 1,3-BPG verschoben, außerdem begünstigt ein hoher Spiegel an NAD+ gegenüber NADH die Umsetzung in eine Richtung.
Ein in Erythrozyten vorhandener alternativer Nebenweg, vom 1,3-Bisphosphoglycerat zum 3-Phosphoglycerat, stellt der über das Intermediat 2,3-Bisphosphoglycerat verlaufende Rapoport-Luebering-Zyklus dar, dessen zentrales Enzym die Bisphosphoglyceratmutase ist.
 |
NAD+ NADH + Pi + H+  Glycerinaldehyd- 3-phosphat- Dehydrogenase |

|
| D-Glycerinaldehyd-3-phosphat | D-1,3-Bisphosphoglycerat |
Im nächsten Schritt erzeugt die Phosphoglyceratkinase je ein Molekül ATP bei der Umwandlung von 1,3-Bisphosphoglycerat zu 3-Phosphoglycerat durch Übertragung eines Phosphatrests auf ADP. Die bei der vorangegangenen Oxidation frei gewordene Energie wird also konserviert, indem ATP aufgebaut wird. Die hier stattfindende Bildung von ATP aus ADP ist ein Beispiel der Substratphosphorylierung. Falls die Zelle bereits viel ATP (und damit wenig ADP) hat, hält die Reaktion an dieser Stelle an, bis wieder genügend ADP zur Verfügung steht. Diese Feedbackregulation ist wichtig, da ATP relativ schnell zerfällt, wenn es nicht genutzt wird. Überproduktion von ATP wird somit verhindert.
Die Energiebilanz der Glykolyse ist an diesem Schritt ausgeglichen: zwei Moleküle ATP wurden verbraucht und zwei wieder gewonnen
 |
Phospho- glycerat- kinase ADP ATP  |

|
| D-1,3-Bisphosphoglycerat | D-3-Phosphoglycerat |

Eine Kofaktor-unabhängige Phosphoglyceratmutase (PGM) katalysiert dann die Umwandlung von 3-Phosphoglycerat zu 2-Phosphoglycerat. Bei dem Vorgang wird die Phosphatgruppe zwischenzeitlich auf einen Aminosäurerest des Enzyms übertragen. In Erythrozyten wird diese Reaktion von einer Cofaktor-abhängigen PGM katalysiert, bei der 2,3-Bisphosphogylcerat als Zwischenprodukt gebildet wird.
2-Phosphoglycerat wird dann mit Hilfe der Enolase zu Phosphoenolpyruvat (PEP) dehydratisiert. Daher nennt man das Enzym auch 2-Phosphoglycerat-Dehydratase. PEP ist eine phosphorylierte Verbindung mit einem sehr hohen Gruppenübertragungspotential. Dies wird im letzten Schritt der Glykolyse genutzt, um ein weiteres Molekül ATP zu gewinnen. Hierbei katalysiert eine Pyruvatkinase (PK) unter ATP-Gewinn die Umsetzung von PEP zu Pyruvat (= Anion der Brenztraubensäure). Dabei entsteht jedoch nicht Pyruvat direkt, sondern das im Gleichgewicht stehende Enolpyruvat.[15] Bei pH 7 liegt das Gleichgewicht auf Seiten der Ketonform. Auch dieser Schritt ist ADP-reguliert, es ist die dritte, irreversible Reaktion im Verlauf der Glykolyse.
 |
Phospho- glycerat- Mutase  |
 |
−H2O Enolase  |
 |
ADP ATP Pyruvatkinase |
|
| D-3-Phosphoglycerat | D-2-Phosphoglycerat | Phosphoenolpyruvat | Pyruvat |
Bei Phosphatmangel können Pflanzen PEP ohne ATP-Gewinn zu Pyruvat hydrolysieren, was in den in den Vakuolen stattfindet. Das beteiligte Enzym ist eine PEP-Phosphatase (EC 3.1.3.60), die anorganisches Phosphat freisetzt und damit dem Phosphatmangel entgegensteuert.[16]
Regeneration des Cofaktors NADH
In der Glykolyse werden pro Durchgang zwei Moleküle NAD+ zu NADH reduziert. Meistens ist die zelluläre Konzentration an NAD+ sehr niedrig, so dass es ohne eine Reoxidation schnell verbraucht wäre. Infolgedessen muss NAD+ wieder regeneriert werden, da sonst die Glykolyse zum Erliegen kommt. Wie das geschieht hängt davon ab, ob anoxische oder oxische Bedingungen vorliegen. Zudem beeinflusst dies den weiteren Abbauweg des Pyruvates.
Oxische Bedingungen
Unter oxischen Bedingungen wird Pyruvat im Pyruvatdehydrogenase-Komplex zu Acetyl-CoA oxidativ decarboxyliert. Hierbei entstehen ein Molekül Kohlenstoffdioxid und ein Molekül NADH. Acetyl-CoA tritt anschließend im Citratzyklus ein, in der es vollständig zu zwei Molekülen Kohlenstoffdioxid oxidiert wird. Bei diesen Oxidationsschritten entstehen weitere Reduktionsäquivalente. Diese und die aus der Glykolyse stammenden werden schließlich im Zuge der Atmungskette unter Verbrauch von Sauerstoff reoxidiert und stehen somit wieder der Glykolyse und dem Citratzyklus zur Verfügung. Gleichzeitig werden bei diesen Schritten weitere Moleküle ATP gebildet. Während Prokaryoten etwa 38 Moleküle ATP insgesamt erzeugen können, hängt die Bilanz bei Eukaryoten vom Weg ab, auf dem im Cytosol gebildetes NADH die Mitochondrienmembran passiert (Malat-Aspartat-Shuttle bzw. Glycerin-3-phosphat-Shuttle).
In Eukaryoten findet der Citratzyklus in der Matrix des Mitochondriums, die Glykolyse hingegen im Cytosol statt. NAD+ bzw. NADH kann nicht frei durch die innere Membran des Mitochondriums diffundieren, außerdem fehlen spezielle Translokatoren. Der Austausch der Reduktionsäquivalente findet daher entweder durch den Malat-Aspartat-Shuttle oder den Glycerin-3-phosphat-Shuttle statt.
In der Literatur werden manchmal die Glykolyse und der Folgeabbau von Pyruvat zu Kohlenstoffdioxid durch die Prozesse des Citratzyklus und der Atmungskette fälschlicherweise als aerobe Glykolyse zusammengefasst. Die Glykolyse endet jedoch mit der Entstehung von Pyruvat und findet sowohl unter oxischen als auch anoxischen Bedingungen statt.
Anoxische Bedingungen
→ siehe auch Hauptartikel alkoholische Gärung, Milchsäuregärung

Steht Sauerstoff nicht oder nur begrenzt zur Verfügung, kann Pyruvat reduktiv weiter umgesetzt werden, beispielsweise in der Milchsäuregärung oder in der alkoholischen Gärung. In der Milchsäuregärung wird Pyruvat zu L-Lactat reduziert, in der alkoholischen Gärung wird es zu Ethanol decarboxyliert und reduziert. In beiden Fällen wird NADH zu NAD+ oxidiert und liegt für weitere Runden der Glykolyse bereit. In diesen Gärungsschritten wird aber im Gegensatz zum aeroben Abbauweg kein ATP gebildet.
In der alkoholischen Gärung bilden Hefen in zwei Reaktionen aus Pyruvat Ethanol, welches durch zwei Enzyme, die Pyruvatdecarboxylase (EC 4.1.1.1) und die Alkoholdehydrogenase, katalysiert wird. Dabei wird das durch die Glykolyse angefallene NADH zu NAD+ reoxidiert. Andere Bakterien wie beispielsweise Milchsäurebakterien oder auch Muskelzellen im Menschen betreiben die Milchsäuregärung (vgl. auch Abbildung rechts). Hierbei wird Pyruvat durch eine Lactatdehydrogenase mittels NADH + H+ zu Lactat und NAD+ reduziert, so dass die Glykolyse wieder ablaufen kann. Diese Reaktion ist sowohl unter Standardbedinungen als auch unter physiologischen Bedingungen stark exergonisch (ΔG0′ = –25 kJ/mol bzw. ΔG = –14,8 kJ/mol)[17]
Die (homofermentative) Milchsäuregärung wird teilweise als anaerobe Glykolyse bezeichnet. Dies ist jedoch irreführend, da die Glykolyse mit dem Entstehen von Pyruvat endet und unter sowohl oxischen als auch anoxischen Bedingungen stattfindet.
Energetische Aspekte der Glykolyse
Gleichgewichtslage
| Schritt | Reaktion in der Glykolyse | ΔG0’ [kJ/mol][18][17] | ΔG [kJ/mol][17] |
|---|---|---|---|
| 1 | Glucose + ATP → Glucose-6-P + ADP | −16,7 | −33,9 |
| 2 | Glucose-6-P ⇌ Fructose-6-P | +1,7 | −2,9 |
| 3 | Fructose-6-P + ATP → Fructose-1,6-P + ADP | −14,2 | −18,8 |
| 4 | Fructose-1,6-P ⇌ DHAP + G-3-P | +23,9 | −0,2 |
| 5 | DHAP ⇌ GAP | +7,6 | +2,4 |
| 6 | GAP + Pi + NAD+ ⇌ 1,3-Bis-P-glycerat + NADH + H+ | +6,3 | −1,3 |
| 7 | 1,3-Bis-P-glycerat + ADP ⇌ 3-P-glycerat + ATP | −18,9 | +0,1 |
| 8 | 3-Phosphoglycerat ⇌ 2-Phosphoglycerat | +4,4 | +0,8 |
| 9 | 2-P-glycerat ⇌ PEP + H2O | +7,5[18] bzw. +1,8[17] | +1,1 |
| 10 | PEP + ADP → Pyruvat + ATP | −31,7 | −23,0 |
Die meisten Reaktionen der Glykolyse sind unter Standardbedingungen bei pH = 7 energetisch ungünstig. Bei vielen Reaktionen ist die Änderung der freien Enthalpie G0’ positiv, so dass jene Reaktionen endergon sind und nicht ablaufen würden (vgl. Tabelle ΔG0’-Werte). Die Glykolyse würde bereits im vierten Schritt enden.
Definitionsgemäß entspricht die Stoffmengenkonzentration der Reaktanten unter solchen Bedingungen jeweils 1 mol·l−1. Dies kann aber nicht als Grundlage einer Berechnung dienen, da lebende Zellen solch hohe Konzentrationen nicht erzeugen bzw. aufrechterhalten können. Misst man die Stoffmengenkonzentrationen unter tatsächlichen und damit physiologischen Bedingungen, kann die Änderung der freien Enthalpie G neu berechnet werden (vgl. Tabelle ΔG-Werte). Den Werten liegt eine Messung der Stoffmengenkonzentrationen in Erythrozyten zu Grunde und zeigt, dass gewisse Intermediate in sehr niedrigen Konzentrationen vorliegen.[19] Dadurch ändert sich die Gleichgewichtslage der korresponiderenden Reaktionen derart, so dass unter physiologischen Bedingungen die gesamte Glykolyse bis auf drei Reaktionen reversibel verläuft (ΔG ungefähr 0 kJ·mol−1).
Bei jenen Reaktionen bleibt die Stoffmengenkonzentration deswegen so niedrig, weil die erzeugten Produkte schnell umgesetzt und abschließend durch irreverbibe Reaktionen dem Gleichgewicht entzogen werden. Diese drei irreversible Reaktionen werden von den Schlüsselenzymen Glucokinase bzw. Hexokinase, Phosphofructokinase 1 sowie Pyruvatkinase katalysiert. Durch die schnelle, irreversible Umsetzung eines der Schlüsselenzyme werden die Stoffmengenkonzentrationen der vorher erzeugten Produkte ausreichend abgesenkt – die Glykoylse kann in eine Richtung ablaufen.
Durch das Vorhandensein dieser Kontrollpunkte ergeben sich zwei Konsequenzen. Erstens kann die Glykoylse an jenen Stellen effektiv reguliert werden, so dass sie abhängig vom Energiestatus der Zelle schnell an- bzw. abgeschaltet werden kann. Zweitens ermöglicht die vorliegende Gleichgewichtslage auch die Umkehrreaktion der Glykolyse, die Gluconeogenese. Bis auf drei Enzyme werden hierbei alle Enzyme der Glykolyse verwendet.
Effizienz
Unter Standardbedingungen wird bei der Umsetzung von D-Glucose zu zwei Molekülen Lactat 183,6 kJ/mol Energie frei (ΔG0’ = −183,6 kJ/mol):
Für den Aufbau von zwei Molekülen ATP aus jeweils zwei Molekülen ADP sowie anorganischem Phosphat (Pi) werden 61,0 kJ/mol benötigt:
Da die Glykolyse diese zwei Reaktionen durch Substratkettenphosphorylierung koppelt, wird somit eine Energie von 122,6 kJ·mol/mol frei:
ΔG0’ = (−183,6 + 61) kJ·mol−1 = −122,6 kJ·mol−1
Unter Standardbedindungen werden beim anaeroben Abbau von Glucose zu Lactat damit 33 % der verfügbaren Energie genutzt, um zwei Moleküle ATP aufzubauen. Da unter physiologischen Bedingungen etwa 50 kJ·mol−1 für den Aufbau von ATP benötigt werden, ist die Energieausbeute auch etwas höher, etwa 50 %.[20]
Regulation

Die Glykolyse dient der Bereitstellung von Energie, insbesondere wenn das entstehende Pyruvat unter aeroben Bedingungen weiter abgebaut wird. Liegt dagegen ein energetisch günstiger Zustand vor, wird Glucose gespeichert und im Zuge des Anabolismus unter Energieverbrauch in andere Metabolite umgewandelt.
Die Regulation der Glykolyse ist daher von entscheidender Bedeutung. Sie sollte beispielsweise nicht parallel zu dessen Umkehrreaktion, der Gluconeogenese, ablaufen. In so einem Falle spricht man von einem „Leerlaufprozess“, der sinnlos ATP verbraucht und damit unproduktiv ist. Biochemisch werden irreversible Reaktionen kontrolliert. Unter physiologischen Bedingungen gibt es drei Reaktionen in der Glykolyse, die irreversibel sind. Sie werden von der Hexo- bzw. Glucokinase, von der Phosphofructokinase-1 und der Pyruvatkinase katalysiert und sind damit Ziel einer Regulation.
Hexo- und Glucokinase
Die Hexokinase ist das erste Enzym in der Glykolyse, dessen Aktivität reguliert wird. Es phosphoryliert unter ATP-Verbrauch Glucose zu Glucose-6-phosphat (G6P), kann aber auch andere Hexosen als Substrat verwenden. G6P ist das Endprodukt der Hexokinasreaktion und inhibiert als solches das Enzym allosterisch.[21]
Das in der Leber vorkommende Isoenzym der Hexokinase, die Glucokinase, wird nicht durch das Produkt G6P inhibiert. Im Gegensatz zur Hexokinase zeigt es auch einen höheren KM-Wert. Daher löst die Glucokinase erst bei sehr hohen Glucosekonzentrationen die Hexokinase ab. Unter diesen Bedingungen wird G6P durch nachfolgende Schritte aber als Glykogen gespeichert und nicht in der Glykolyse abgebaut, denn G6P wird auch für andere Stoffwechselwege abgezweigt. Die Leber fungiert daher als Homöostat der Blutzuckerspiegels, da sie diesen durch den Auf- bzw. Abbau von Glucose aufrechterhält.[22]
Ein leberspezifisches, regulatorisches Protein kann reversibel an die Glucokinase binden und sie dadurch hemmen. Das Binden dieses Regulators an die Glucokinase findet im Zellkern statt, so dass die gehemmte Glucokinase dort inaktiv verbleibt und nicht durch andere cytosolische Effektoren beeinflusst werden kann. Diese Bindung wird dann verstärkt, falls das Enzym allosterisch durch Fructose-6-phosphat modifiziert wurde. Dagegen bewirkt Glucose ein Ablösen dieses Leberproteins. Bei einem hohen Blutzuckerspiegel dominiert Glucose, so dass die Dissoziation des Regulators ermöglicht und Glucose zu Glucose-6-phosphat phosphoryliert wird. Sinkt der Blutzuckerspiegel aber zu sehr ab (unter 5 mmol·l−1), erfolgt die Hemmung der Glucokinase – vermittelt durch Fructose-6-phosphat. Glucose wird nicht mehr phosphoryliert und kann die Leber wieder verlassen, um anderen Organen zur Verfügung zu stehen.[22]
Schließlich wird die Glucokinase auf Ebene der Transkription reguliert.[21] Hierbei beeinflusst das Hormon Insulin die Menge an Glucokinase in der Leber. Eine Stoffwechselstörung liegt bei Patienten mit Diabetes mellitus vor, da sie Insulin nicht ausreichend herstellen können. Bei ihnen ist die Menge an Glucokinase zu niedrig, sie tolerieren nicht einen hohen Blutzuckerspiegel und weisen nur wenig Glucokinase in der Leber auf.
Phosphofructokinase-1
Der wichtigste Kontrollpunkt der Glykolyse ist die Phosphorylierung von Frc-6-P zu Frc1,6-bP durch die Phosphofructokinase-1 (PFK-1). Er stellt den ersten wirklichen glykolysespezifischen Schritt dar und ist unter physiologischen Bedingungen irreversibel.[23] Das Enzym weist zwei Bindungsstellen für ATP auf. Neben einer hochaffinen Substratbindestelle verfügt die PFK-1 auch über eine regulatorische Seite. So kann ATP sowohl als Substrat dienen, als auch die PFK-1 allosterisch hemmen. Unter ausreichend hohen ATP-Konzentrationen wird der KM-Wert des Enzyms erhöht. Dies senkt die Aktivität der PFK-1, so dass die Glykolyse gedrosselt wird. Dennoch schwanken die ATP-Level einer Zelle nur geringfügig, so dass ATP alleine nicht ausreichend wäre für eine genaue Regulation. Daher hängt die Aktivität der PFK-1 auch von der Menge an AMP ab und spiegelt die energetische Versorgung der Zelle wider. Falls diese ausreichend hoch ist, wird das Enzym gehemmt, andernfalls wird die Aktivität der PFK-1 erhöht, um mehr ATP zu generieren.
Auch Citrat inhibiert die PFK-1 allosterisch. Citrat ist ein Schlüsselmetabolit des Citratzyklus, dessen primärer Zweck die Erzeugung von Energie unter aeroben Bedingungen ist. Alternativ können aus dem Citratzyklus verschiedene Vorläufermoleküle entnommen werden. Falls viel Citrat vorliegt, ist der Citratzyklus gesättigt. Daher inhibiert Citrat die PFK-1 im Sinne einer Endprodukthemmung, so dass die Glykolyse den Citratzyklus weniger stark speist.

Die Aktivität der Phosphofructokinase-1 wird auch durch den pH-Wert beeinflusst. Ein niedriger pH-Wert hemmt das Enzym und drosselt die Glykolyse. Dies passiert beispielsweise bei starker Muskelbeanspruchung, bei der viel Lactat entsteht. Dieses senkt den pH-Wert in den Zellen.[24]
Schließlich wird PFK-1 in mikromolaren Konzentrationen durch β-D-Fructose-2,6-bisphosphat (F-2,6-bP) allosterisch aktiviert.[24] Durch F-2,6-bP wird damit die Glykolyse gefördert, während sie die Fructose-1,6-bisphosphatase inhibiert. Dies ist das Enzym, das an dieser Stelle die Rückreaktion in der Gluconeogenese katalysiert. Unter physiologischen Bedingungen verbleibt das Enzym ohne F-2,6-bP in einem praktisch inaktiven Zustand.[22] Nach Binden von F-2,6-bP an PFK-1 wird auch die Affinität der beiden Inhibitoren ATP und Citrat reduziert.
In Bakterien kommt Fructose-2,6-bisphosphat als Aktivator der PFK-1 nicht vor.[24]
Pyruvatkinase
Der letzte Schritt in der Glykolyse ist irreversibel und wird von der Pyruvatkinase (PK) katalysiert. Diese wird zwar auch reguliert, aber im Gegensatz zu den anderen beiden Enzymen in vergleichsweise untergeordneter Weise. Fructose-1,6-bisphosphat und AMP stimulieren die PK, während ATP, Acetyl-CoA und L-Alanin diese allosterisch hemmen. Das in der Leber und Darm vorherrschende Isoenzym (L-Form) kann im Gegensatz zu der im Muskel vorkommende M-Form zusätzlich durch die Proteinkinase A phosphoryliert werden. Die Aktivität der Proteinkinase A wird hormonell durch Glukagon vermittelt. In phosphorylierter Form wird dieses Isoenzym dann vergleichsweise stärker durch ATP und Alanin inhibiert als die unmodifizierte PK.[25] Dies soll ein Abbau von Glucose in der Leber verlangsamen, damit dieses eher für andere Organe zur Verfügung steht. Die Dephosphorylierung wird durch eine Phosphatase katalysiert.
Hemmstoffe
Iodacetat hemmt die Glycerinaldehyd-3-phosphat-Dehydrogenase, die Glycerinaldehyd-3-phosphat mit einem anorganischen Phosphat und unter Beteiligung von NAD+ zu 1,3-Bisphosphoglycerat oxidiert. Es modifiziert dabei eine SH-Gruppe des Enzyms, deshalb kann durch Zugabe von Mercaptanen diese Hemmung wieder aufgehoben werden.
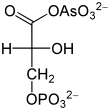
Arsenat, HAsO42−, ähnelt anorganischem Phosphat HPO42− und wird auch als Substrat durch die Glycerinaldehyd-3-phosphat-Dehydrogenase erkannt. Dadurch entsteht aus Glycerinaldehyd-3-phosphat somit 1-Arseno-3-phosphoglycerat (vgl. Abbildung). Im Gegensatz zu 1,3-Bisphosphoglycerat ist diese Arsenatverbindung wie jedes andere Acylarsenat sehr instabil, es zerfällt zu 3-Phosphoglycerat. Infolgedessen kann die Energie der Oxidation nicht mehr durch Substratkettenphosphorylierung nutzbar gemacht werden. Es entfällt ein Schritt der ATP-Bildung in der Glykolyse, diese liefert netto kein ATP mehr.
Eintritt anderer Metabolite in die Glykolyse
Neben D-Glucose können auch andere Metabolite in der Glykolyse eintreten, sofern sie sich in einer der darin vorkommenden Zwischenprodukte umwandeln lassen können. Pentosen und Tetrosen werden dabei in der Regel durch den Pentosephosphatweg zu Glycerinaldehyd-3-phosphat bzw. Fructose-6-phosphat umgewandelt und können dann weiter prozessiert werden.
Glycerin
Glycerin entsteht beim Abbau von Triglyceriden und kann als Vorstufe der Glykolyse bzw. Gluconeogenese dienen. Eine cytosolische Glycerinkinase (EC 2.7.1.30) phosphoryliert Glycerin unter ATP-Verbrach zu Glycerin-3-phosphat, welches dann zu Dihydroxyacetonphosphat oxidiert wird. Entweder wird dies von einer cytosolischen Glycerin-3-phosphat-Dehydrogenase (cGDH, EC 1.1.1.8) oder einem membranständigen Isoenzym im Mitochondrium (mGDH, EC 1.1.5.3) katalyisert. Bei ersterer wird NADH erzeugt, bei letzterer wird Ubichinon reduziert.
Fructose

Fructose (1), Fru-1-P (2), DHAP (3), Glycerinaldehyd (4), GAP (5)
Fructokinase (FK), Aldolase B (ALD-B), Triosephosphatisomerase (TPI), Triosekinase (TK)
Bei der Spaltung des Disaccharids Saccharose werden Glucose und Fructose freigesetzt. Fructose wird in der Leber zu Fructose-1-phosphat phosphoryliert, was eine Fructokinase (Ketohexokinase, FK) unter ATP-Verbrauch katalysiert. Anschließend spaltet die Aldolase B (Fructose-1-phosphat-Aldolase, ALD-B, EC 4.1.2.13) Fructose-1-phosphat in Dihydroxyacetonphosphat (DHAP) und Glycerinaldehyd. DHAP bzw. Glycerinaldehy werden beide in Glycerinaldehyd-3-phosphat umgewandelt. Dies katalyiseren eine weiter oben beschriebene Triosephosphatisomerase (TPI) bzw. eine Triosekinase (TK) unter ATP-Verbrauch.
Mannose
D-Mannose ist Bestandteil verschiedener Glykoproteine und Polysaccharide. Um in die Glykolyse eintreten zu können, wird Mannose zunächst durch eine Hexokinase zu Mannose-6-phosphat unter ATP-Verbrauch phosphoryliert. Dieses wird schließlich zu Fructose-6-phosphat isomerisiert, was eine Mannosephosphatisomerase (auch Phosphomannoseisomerase, EC 5.3.1.8) katalysiert.
Sorbit
Sorbit kann im Polyolweg zu Glucose bzw. Fructose oxidiert werden.
Galactose
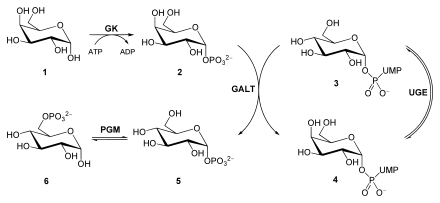
Gal (1), Gal-1-P (2), UDP-Glucose (3), UDP-Galactose (4), Glu-1-P (5), Glu-6-P (6).
Galactokinase (GK), Galactose-1-phosphat-Uridyltransferase (GALT), UDP-Glucose-4-Epimerase (UGE), Phosphoglucomutase (PGM)
Nach Spaltung von Milchzucker werden D-Glucose und D-Galactose freigesetzt. Um Galactose in sein C4-Epimer Glucose zu überführen, wird der Zucker zunächst durch eine Galactokinase (GK, EC 2.7.1.6) unter Verbrauch von ATP zu Galactose-1-phosphat umgesetzt. Eine Galactose-1-phosphat-Uridyltransferase (GALT) katalysiert nun einen Austausch von UDP-gebundener Glucose mit Galactose. Hierbei entstehen Glucose-1-phosphat und UDP-Galactose. Während Glucose-1-phosphat durch eine Phosphoglucomutase (PGM) zu Glucose-6-phosphat isomerisiert wird, epimerisiert eine UDP-Glucose-4-Epimerase (UGE) UDP-Galactose zu UDP-Glucose.
Besonderheiten bei grünen Pflanzen
Bei grünen Pflanzen gibt es einige Variationen in der Glykolyse verglichen mit der bei Tieren.[26] Es ist bekannt, dass dort die Glykolyse nicht nur im Cytoplasma, sondern auch in den Plastiden der Zelle unabhängig voneinander betrieben wird. Nicht in allen Pflanzen läuft sie jedoch in den Plastiden vollständig ab, da häufig Enzyme der Amortisierungsphase fehlen, beispielsweise Enolase oder Phosphoglyceratmutase. Durch hochspezifische Translokatoren können Intermediate von einem zum anderen Zellkompartiment transportiert werden.
Grüne Pflanzen nutzen die Glykolyse in den Plastiden, um in der Dunkelheit oder in nicht-photosynthetischem Gewebe Stärke zu Pyruvat unter ATP- und NADH-Gewinn abzubauen und Vorläufermoleküle bereitzustellen, beispielsweise für die Fettsäuresynthese. Im Cytosol vieler unizellulärer Grünalgen fehlen die cytosolischen Enzyme für die Glykolyse, so dass diese in den Chloroplasten vollständig abläuft.
Für das parallele Betreiben der Glykolyse im Cytoplasma und in den Plastiden werden Isoenyzme im Genom der Pflanze kodiert. So gibt es beispielsweise sowohl eine Pyrvatkinase, die sich im Cytoplasma befindet, als auch eine plasitdäre. Die plastidären Isoenzyme werden ebenfalls im Cytoplasma translatiert und in die Organellen transportiert. Es ist jedoch unklar, ob diese Isoenzyme durch Genduplikation entstanden sind. Möglich wäre auch ein Gentransfer aus dem Genom eines prokaryotischen Symbionten (Endosymbiontentheorie).
Eine weitere Besonderheit ist das Verwenden von Pyrophosphat (PPi) statt ATPs als Phosphatdonor, was auch in einigen Bakterien vorkommt. Normalerweise wird Pyrophosphat durch eine Pyrophosphatase (PPiase, EC 3.6.1.1) hydrolyisiert. Dadurch werden biochemische Reaktionen unter phyiologischen Bedingungen irreversibel gemacht, man spricht umgangsprachig auch von einem thermodynamischen „Zug“. Im Cytosol der Pflanzen kommt eine PPiase nicht vor, so dass dort eine Pyrophosphatkonzentration von bis zu 0,3 mM entstehen kann. Die 1979 entdeckte Pyrophosphat-abhängige PFK (PFP, EC 2.7.1.90) nutzt für die Phosphorylierung von Fructose-6-phosphat zu Fructose-1,6-bisphosphat Pyrophosphat. Diese Reaktion ist außerdem reversibel und könnte auch für den umgekehrten Weg, der Gluconeogenese, verwendet werden. PFP wird wie PFK-1 durch Fructose-2,6-bisphosphat reguliert.
Pflanzen nutzen PEP in unterschiedlicher Weise. Neben der klassischen Pyruvatkinase nutzt auch eine PEP-Carboxykinase (PEPC) das Substrat, was beim C4-Stoffwechsel bzw. Crassulaceen-Säurestoffwechsel wichtig ist. Dabei entsteht Oxalacetat, ein Intermediat des Citratzyklus. Oxalacetat kann aber auch durch eine cytosolische Malatdehydrogenase (MDH) zu L-Malat und dieses durch eine mitochondrielles NAD+-abhängiges Malatenzym (ME) zu Pyruvat decarboxyliert werden. Dies ist eine Umgehungsreaktion der Pyruvatkinase, bei der kein ATP erzeugt wird bei einem Phosphatmangel nützlich ist. In den Wurzeln der Erbse wurde diese Umgehung nachgewiesen.
Aus durch PEPC und MDH erzeugtem Malat kann ein plastidäres NADP-abhängiges Malatenzym Pyruvat erzeugen, was für die Fettsäuresynthese benötigt wird. Auch dadurch kann die Reaktion der Pyruvatkinase umgangen werden, was unter Phosphatmangel vorteilhaft ist. Unter solchen Bedingungen kann auch eine PEP-Phosphatase (PEPase, EC 3.1.3.60) wertvolles Phosphat freisetzen. Hierbei wird PEP in die Vakuole transportiert und dort von einer PEPase zu Pyruvat hydrolyisiert. Dieses und Phosphat werden dann ins Cytoplasma zurückgebracht. Wenn kein Phosphatmangel vorliegt, wird die PEPase durch eine ausreichend hohe Pi-Konzentration inhibiert.
Schließlich gibt es auch eine cytosolische, phosphatunabhängige GADPH (EC 1.2.1.9), die Glycerinaldehyd direkt zu 3-Phosphoglycerat oxidiert. Dabei entsteht nur NADPH, aber kein ATP.
Regulation
Bei der Regulation der an der Glykolyse beteiligten Enzyme gibt einige wichtige Unterschiede zu denen bei Tieren.[26] So ist PEP ein besonderer allosterischer Effektor, das im Gegensatz zu Tieren die PFK inhibieren kann. Fructose-1,6-bisphosphat dagegen kann nicht die Pyruvatkinase aktivieren. Während Fructose-2,6-bisphosphat in Tieren die PFK aktiviert, geschieht nichts dergleichen in Pflanzen.
Damit wird die Glykolyse in grünen Pflanzen in erster Linie durch die Aktivitäten der Pyruvatkinase und PEP-Carboxykinase reguliert, in zweiter Linie durch die PFK-1 bzw. PFP. Bei Tieren ist es prinzipiell umgekehrt.
Glykolyse bei Archaeen
Auch Archaeen sind imstande, Glucose zu Pyruvat abzubauen. Man hat herausgefunden, dass Archaeen einen Stoffwechselweg verwenden, der dem EMP-Weg weitgehend entspricht.[27] So gleichen die vorkommenden Metabolite denen, die auch bei Eukaryoten und Bakterien auftauchen. Jedoch werden hierfür Enzyme verwendet, die keine Ähnlichkeiten mit denen von Bakterien/Eukaryoten aufweisen. In Archaeen findet man ADP- anstatt ATP-abhängige Kinasen, beispielsweise die Glucokinase (EC 2.7.1.147) oder die Phosphofructokinase (EC 2.7.1.146). Im Gegensatz zu Bakterien verfügen sie nicht über ein PEP-abhängiges Zuckertransportsystem.
Ein wichtiger Unterschied besteht bei der Oxidation von Glycerinaldehyd-3-phosphat. Dieses wird entweder von einer NAD(P)+-abhängigen (GAPN) oder einer Ferredoxin-abhängigen Dehydrogenase (GAPOR) direkt zu 3-Phosophoglycerat oxidiert, ohne aber dabei anorganisches Phosphat einzubauen.[13] Daher wird bei diesem Schritt kein ATP durch Substratkettenphosphorylierung gebildet, so dass bei den meisten Archaeen durch die Glykolyse formal kein ATP gewonnen wird. Der am besten untersuchte Glykolysestoffwechselweg bei Archaeen ist der von Pyrococcus furiosus. Dort beträgt die Nettoreaktion:
Ein weiterer wichtiger Unterschied ist die fehlende allosterische Regulation der Schlüsselenzyme mit den Effektoren, die für Bakterien bzw. Eukaryoten weiter oben beschrieben wurde. In Thermoproteus tenax gibt es Hinweise darauf, dass die GAPN durch AMP, Glucose-1-phophat, Fructose-6-phosphat, Fructose-1-phosphat, ADP und Ribose-5-phosphat allosterisch aktiviert wird, während NAD(P)H, NADP+ und ATP das Enzym hemmen. Möglicherweise findet auch eine Regulation auf Ebene der Transkription statt, wie bei der in T. tenax vorkommende GAPDH.[28]
Evolution
Die Glykolyse ist in den meisten Bakterien und Eukaryoten vertreten, in etwas abgewandelter Form auch bei Archaeen und hyperthermophilen Bakterien. Dies lässt darauf schließen, dass die Glykolyse sich sehr früh im Laufe der Evolution etabliert hatte und bereits in den ersten Organismen vertreten war. Durch phylogenetische Vergleiche mit thermophilen und hyperthermophilen Mikroorganismen vermutet man, dass der EMP-Weg nach dem ED-Weg entstanden ist. Außerdem lag wahrscheinlich die ursprüngliche Bedeutung des EMP-Weges nicht im Abbau von Kohlenhydraten, sondern er lief umgekehrt als Gluconeogenese zum Aufbau von Glucose ab.[29][30] Die Gluconeogenese ist bei den Organismen aller drei Reiche weiter verbreitet als die Glykolyse.
Die Enzyme des unteren Zweiges der Glykolyse (Amortisierungsphase) katalysieren größtenteils Reaktionen, die reversibel ablaufen und am höchsten konserviert sind.[13] Außerdem kommen sie auch in dem phylogenetisch älteren ED-Weg vor. Wahrscheinlich waren sie – auch für andere Stoffwechselwege – schon vor der Auftrennung der drei Reiche der Lebewesen vorhanden und zählen daher zu den ältesten Enzymen. Durch ihre essentielle Bedeutung war ein Austausch oder Verlust nicht gegeben. Die Glycerinaldehyd-3-phosphat-Dehydrogenase ist am höchsten konserviert, nur 3 % der katalytischen Domäne haben sich in 100 Millionen Jahren verändert.
Der obere Zweig der Glykolyse (Vorbereitungsphase) hat sich vermutlich später etabliert. Während die darin involvierten Enzyme in Bakterien und Eukaryoten hohe Homologien aufweisen, sind die in Archaeen vorkommenden Enzyme dagegen einzigartig. Es wird noch diskutiert, ob ursprüngliche Enzyme für den ersten Teil der Glykolyse bei Archaeen verloren gingen und erst später durch horizontalen Gentransfer wieder eingeführt wurden. Dies könnte erklären, warum sie sich so von den Enzymen anderer Organismen unterscheiden.
Literatur
- Geoffrey Zubay: Biochemie. Mcgraw-Hill Professional; 4. Auflage 1999; ISBN 3-89028-701-8; S. 293ff.
- Donald Voet und Judith G. Voet: Biochemie. Wiley-VCH 1994; ISBN 3-527-29249-7; S. 420ff.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage. Spektrum Akademischer Verlag, Heidelberg 2007; ISBN 978-3-8274-1800-5; S. 486ff.
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 442ff.
- Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 535–562
- Nelson, David L., Cox, Michael M., Lehninger, Albert L. [Begr.]: Lehninger Biochemie. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2009; ISBN 978-3-540-68637-8; S. 607–730
- Ronimus, RS. und Morgan, HW. (2003): Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism. In: Archaea 1(3); 199–221; PMID 15803666; PDF (freier Volltextzugriff, engl.)
- Plaxton, WC. (1996): The organization and regulation of plant glycolysis. In: Annu Rev Plant Physiol Plant Mol Biol. 47; 185–214; PMID 15012287; doi:10.1146/annurev.arplant.47.1.185
Einzelnachweise
- ↑ Racker, E. (1974): History of the Pasteur effect and its pathobiology. In: Mol Cell Biochem. 5(1–2); 17–23; PMID 4279327; doi:10.1007/BF01874168
- ↑ Harden, A. und Young, WJ. (1906): The Alcoholic Ferment of Yeast-Juice. In: Proc. R. Soc. Lond. B 77; 405–420; PDF (freier Volltextzugriff, engl.)
- ↑ Donald Voet, Judith G. Voet, Alfred Maelicke (Hsrg.), Werner Müller-Esterl (Hrsg.): Biochemie. Wiley-VCH 1992. ISBN 3-527-28242-4; S. 421f.
- ↑ Kresge N., Simoni, RD. und Hill, RL. (2005): Otto Fritz Meyerhof and the elucidation of the glycolytic pathway. In: J Biol Chem. 280(4):e3; PMID 15665335; PDF (freier Volltextzugriff, engl.)
- ↑ Albert L. Lehninger, David L. Nelson und Michael M. Cox: Lehninger Biochemie. 3., vollst. überarb. u. erw. Auflage. Springer, Berlin 2009, ISBN 978-3-540-41813-9; S. 584ff.
- ↑ Donald Voet, Judith G. Voet, Alfred Maelicke (Hsrg.), Werner Müller-Esterl (Hrsg.): Biochemie. Wiley-VCH, 1992, ISBN 3-527-28242-4; S. 444
- ↑ Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 334
- ↑ Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). 4. Auflage. Cengage Learning Services, 2009, ISBN 978-0-495-11464-2, S. 535
- ↑ Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 334.
- ↑ Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage. Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5, S. 764
- ↑ Caroline Bowsher, Martin W. Steer und Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5; S. 145
- ↑ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 448
- ↑ a b c Ronimus, RS und Morgan, HW. (2003): Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism. In: Archaea. 1(3); 199–221; PMID 15803666; PDF (freier Volltextzugriff, engl.)
- ↑ a b Caroline Bowsher, Martin W. Steer und Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5; S. 148
- ↑ David Nelson, Michael Cox: Lehninger Biochemie. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2008; ISBN 978-3-540-68637-8; S. 713
- ↑ Caroline Bowsher, Martin W. Steer und Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5; S. 150
- ↑ a b c d Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). 4. Auflage 2009, Cengage Learning Services, ISBN 978-0-495-11464-2, S. 538.
- ↑ a b David L. Nelson und Michael M. Cox: Lehninger Principles of Biochemistry. Palgrave Macmillan; 5. Auflage 2008; ISBN 978-0-7167-7108-1; S. 553
- ↑ Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 554
- ↑ Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). 4. Auflage 2009, Cengage Learning Services, ISBN 978-0-495-11464-2, S. 537
- ↑ a b Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 539f.
- ↑ a b c David Nelson, Michael Cox: Lehninger Biochemie. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2008; ISBN 978-3-540-68637-8; S. 773ff.
- ↑ Reginald Garrett und Charles M. Grisham: Biochemistry. (International Student Edition). Cengage Learning Services; 4. Auflage 2009; ISBN 978-0-495-11464-2; S. 542f.
- ↑ a b c H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 468
- ↑ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 470
- ↑ a b c Plaxton, WC. (1996): The organization and regulation of plant glycolysis. In: Annu Rev Plant Physiol Plant Mol Biol. 47; 185–214; PMID 15012287; doi:10.1146/annurev.arplant.47.1.185
- ↑ Siebers, B. und Schönheit, P. (2005): Unusual pathways and enzymes of central carbohydrate metabolism in Archaea. In: Curr Opin Microbiol. 8(6); 695–705; PMID 16256419; doi:10.1016/j.mib.2005.10.014
- ↑ Verhees, CH. et al. (2003): The unique features of glycolytic pathways in Archaea. In: Biochem J. 375(Pt 2); 231–246; PMID 12921536; PDF (freier Volltextzugriff, engl.)
- ↑ A. H. Romano, T. Conway: Evolution of carbohydrate metabolic pathways. In: Res. Microbiol. Bd. 147 (6–7), 1996, S. 448–455, PMID 9084754; doi:10.1016/0923-2508(96)83998-2
- ↑ Ronimus, RS. und Morgan, HW. (2003): Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism. In: Archaea 1(3); 199–221; PMID 15803666; PDF (freier Volltextzugriff, engl.)
Weblinks
- Die Glycolyse auf der Homepage von Ulrich Helmich
- Audio-Beitrag zum Thema Glykolyse
- Jennifer McDowall/Interpro: Protein Of The Month: Enzymes of Glycolysis. (engl.)










