Nickel
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Nickel, Ni, 28 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Übergangsmetalle | ||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 10, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | glänzend, metallisch, silbrig | ||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer |
7440-02-0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,015 %[2] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar[3] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 58,6934(4)[4] u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 135 (149) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 124 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Ar] 3d8 4s2 [Ar] 3d9 4s1[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 737,1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 1753 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 3395 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 5300 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch[3] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | kubisch flächenzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 8,908 g/cm3 (20 °C)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mohshärte | 4,0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | ferromagnetisch | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 1728[6] K (1455[6] °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 3003 K[7] (2730 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 6,59 · 10−6 m3·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 379 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 17,7[6] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Schallgeschwindigkeit | 4970 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Spezifische Wärmekapazität | 444[8] J·kg−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Austrittsarbeit | 5,15 eV[9] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrische Leitfähigkeit | 13,9 · 106 S·m−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 91 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch[3] | |||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | 2, seltener −1, 0, 1, 3, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | −0,257 V (Ni2+ + 2 e− → Ni) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 1,91 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,5 mg·m−3 (gemessen als einatembarer Staub)[11] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||
Nickel ist ein chemisches Element mit dem Elementsymbol Ni und der Ordnungszahl 28. Es zählt zu den Übergangsmetallen, im Periodensystem steht es nach der älteren Zählweise in der 8. Nebengruppe oder Eisen-Platin-Gruppe, nach der neueren in der Gruppe 10 oder Nickelgruppe.
Geschichte

Nickel wurde erstmals 1751 von Axel Frederic Cronstedt rein dargestellt. Er nannte das Metall 1754 Nickel, abgeleitet von Kupfernickel (schwedisch kopparnickel), dem aus dem Erzgebirge stammenden Wort für Rotnickelkies. So nannten Bergleute das Erz, das aussah wie Kupfererz, aus dem sich aber kein Kupfer gewinnen ließ, als sei es von Berggeistern („Nickeln“) verhext. Eine ähnlich koboldhafte Etymologie findet sich bei Cobalt.
Die erste Münze aus reinem Nickel wurde 1881 geprägt.
Vorkommen

Gediegen, das heißt in elementarer Form vorkommendes Nickel konnte bisher nur an 24 Fundorten[12] nachgewiesen werden (Stand: 2010) und gehört damit zu den seltenen, aber von der International Mineralogical Association (IMA) anerkannten Mineralen (System-Nr. nach Strunz 1.AA.05 bzw. veraltet 1/A.08-10). Sein Massenanteil an der Erdhülle beträgt etwa 0,01 %. Aufgrund geophysikalischer und geochemischer Indizien geht man davon aus, dass sich der größte Teil des Nickels auf der Erde und anderen terrestrischen Planeten im Kern befindet, wo es eine Legierung mit Eisen und einigen leichten Elementen bildet. Im Erdkern beträgt sein Massenanteil nach neuesten Modellen etwa 5,2 %.[13]

Traditionell wurde der größte Teil der Nickelproduktion aus sulfidischen Erzen wie Pentlandit (ca. 34 % Nickel), Nickelmagnetkies (Verwachsungsaggregat aus Pyrrhotin und Pentlandit)[14] sowie einigen weiteren Nickelmineralen wie Millerit (ca. 64–65 % Nickel) und Nickelin (ca. 44 % Nickel) gewonnen. Darüber hinaus werden auch lateritische Nickelerze, vor allem aus Garnierit, einem Gemenge aus Népouit (ca. 46 % Nickel) und Willemseit (ca. 29 % Nickel), als Rohstoffe zur Nickelproduktion abgebaut. Insgesamt sind bisher rund 200 Nickelminerale bekannt,[15] und einige haben noch weit höhere Nickelgehalte als die bereits genannten, kommen jedoch im Gegensatz zu diesen viel seltener vor.
Die Gewinnung verschiebt sich aufgrund der Ausbeutung der klassischen sulfidischen Lagerstätten zunehmend zu lateritischen Nickelerzen.[16] Diese müssen jedoch aufwendig per Hochdruck-Säurelaugung (englisch high pressure acid leaching) gewonnen werden.[17]
Um das Nickel wirtschaftlich abbauen zu können, muss der Nickelgehalt des Erzes mindestens 0,5 % betragen. Die wichtigsten Vorkommen finden sich in Kanada (Sudbury-Becken), Neukaledonien, Russland (Norilsk und Halbinsel Kola), Australien (Queensland) und Kuba (Moa Bay und Nicaro). Ein häufiger Begleiter des Nickels ist Cobalt.
| Land | Tausend Tonnen pro Jahr | Prozent der Weltproduktion |
|---|---|---|
| Russland | 300,7 | 23,4 |
| Australien | 218,0 | 17,0 |
| Kanada | 162,8 | 12,7 |
| Neukaledonien | 111,9 | 8,7 |
| Indonesien | 103,5 | 8 |
| 5 Länder total | 896,9 | 69,8 |
| Welt | 1 284,2 | 100,0 |
Gewinnung und Darstellung
Darstellung des Kupfer-Nickel-Feinsteins
Der überwiegende Teil des Nickels wird aus nickel- und kupferhaltigen Eisenerzen wie Nickelmagnetkies gewonnen. Um die Gewinnung wirtschaftlich zu machen, muss das Nickel zunächst durch Flotation auf etwa fünf Prozent Nickelgehalt angereichert werden. Danach wird das Erz ähnlich wie bei der Kupferherstellung geröstet. Dabei wird das Erz zunächst vorgeröstet, um einen Teil des Eisensulfids in Eisenoxid umzuwandeln. Anschließend werden Silikate und Koks dazugegeben, um das Eisenoxid als Eisensilikat zu verschlacken. Gleichzeitig bildet sich der Kupfer-Nickel-Rohstein aus Nickel-, Kupfer und Eisensulfid. Da dieser spezifisch schwerer als die Eisensilicat-Schlacke ist, können die beiden Phasen getrennt abgestochen werden.
Anschließend wird der Rohstein in einen Konverter gefüllt und Siliciumdioxid dazugegeben. Es wird Sauerstoff eingeblasen. Dadurch wird das restliche Eisensulfid zu Eisenoxid geröstet und danach verschlackt. Es entsteht der Kupfer-Nickel-Feinstein, der zu etwa 80 % aus Kupfer und Nickel und zu etwa 20 % aus Schwefel besteht.
Gewinnung von Rohnickel
Zur Gewinnung des Rohnickels muss das Nickel vom Kupfer abgetrennt werden. Dazu verschmilzt man den Feinstein mit Natriumsulfid Na2S. Dabei bildet sich nur zwischen Kupfer- und Natriumsulfid ein leicht schmelzendes Doppelsulfid. Es bilden sich zwei einfach zu trennende Phasen aus Kupfer-Natrium-Doppelsulfid (flüssig) und Nickelsulfid. Nach der Abtrennung wird das Nickelsulfid zu Nickeloxid geröstet und danach mit Koks zu Nickel reduziert.
Gewinnung von Rein- und Reinstnickel


Um Reinnickel zu gewinnen, wird das Rohnickel elektrolytisch raffiniert. Dazu wird in einer Elektrolysezelle das Rohnickel als Anode, ein Nickelfeinblech als Kathode geschaltet. Als Elektrolyt dient eine Nickelsalzlösung. Während der Elektrolyse gehen an der Anode Nickel und alle unedleren Bestandteile in Lösung. Alle edleren Bestandteile bleiben fest und fallen als Anodenschlamm unter die Elektrode. Dieser dient als wichtige Quelle für die Herstellung von Edelmetallen, wie Gold oder Platin. An der Kathode werden Nickelionen aus der Lösung zu Nickel reduziert, alle unedleren Bestandteile bleiben in Lösung. Die Reinheit von Elektrolytnickel beträgt rund 99,9 %.
Für die Gewinnung von Reinstnickel mit einer Reinheit von 99,99 % gibt es als Spezialverfahren das Mond-Verfahren, benannt nach Ludwig Mond, der 1890 Nickeltetracarbonyl entdeckte. Dieses Verfahren beruht auf der Bildung und Zersetzung des Nickeltetracarbonyls. Dazu wird feinverteiltes Rohnickelpulver bei 80 °C in einen Kohlenmonoxidstrom gebracht. Dabei bildet sich gasförmiges Nickeltetracarbonyl. Dieses wird von Flugstaub befreit und in eine 180 °C heiße Zersetzungskammer geleitet. Darin befinden sich kleine Nickelkugeln. An diesen zersetzt sich das Nickeltetracarbonyl wieder zu Nickel und Kohlenmonoxid. Es entsteht dadurch sehr reines Nickel.
Eigenschaften
Physikalische Eigenschaften
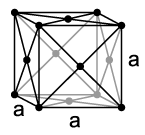

Nickel ist ein silbrig-weißes Metall, das mit einer Dichte von 8,91 g/cm3 zu den Schwermetallen zählt. Es ist mittelhart (Mohs-Härte 3,8), schmiedbar, duktil und lässt sich ausgezeichnet polieren. Nickel ist wie Eisen und Cobalt ferromagnetisch, wobei die Curie-Temperatur 354 °C beträgt.[19] Das Metall kristallisiert in einer kubisch-flächenzentrierten Kristallstruktur (Kupfer-Typ) in der Raumgruppe Fm3m (Raumgruppen-Nr. 225) mit dem Gitterparameter a = 352,4 pm sowie vier Formeleinheiten pro Elementarzelle.[20] Diese Struktur behält es auch bei hohen Drücken bis mindestens 70 GPa bei. Eine weitere, metastabile Modifikation mit kubisch-raumzentrierter Kugelpackung konnte in dünnen Schichten auf Eisen oder Galliumarsenid gewonnen werden. Sie besitzt mit 183 °C eine deutlich geringere Curie-Temperatur.[19][21]
Die Zugfestigkeit von weichgeglühtem Nickel liegt bei 400–450 MPa bei einer Bruchdehnung zwischen 30–45 %. Die Härtewerte liegen um die 80 HB. Kalt verfestigtes Nickel, dessen Bruchdehnung unter 2 % beträgt, erreicht Festigkeiten bis 750 MPa bei Härtewerten um 180 HB. Reinnickelhalbzeuge mit 99 % Ni-Gehalt können kalt hochverfestigt werden.
Das Isotop 62Ni hat die höchste Bindungsenergie je Nukleon aller Isotope aller Elemente.[22]
Chemische Eigenschaften
Nickel ist bei Raumtemperatur gegen Luft, Wasser, Salzsäure und Laugen sehr beständig. Verdünnte Säuren greifen Nickel nur sehr langsam an. Gegenüber konzentrierten, oxidierenden Säuren (Salpetersäure) tritt analog zum rostfreien Stahl Passivierung ein. Löslich ist Nickel in verdünnter Salpetersäure (ca. 10- bis 15-prozentig). Auch eine halbkonzentrierte Salpetersäure (ca. 30-prozentig) bewirkt noch merkliche Passivierung. Der häufigste Oxidationszustand ist +II, seltener werden −I, 0, +I, +III und +IV beobachtet. Im Nickeltetracarbonyl hat Nickel die Oxidationszahl 0. Nickel(II)-Salze lösen sich in Wasser unter Bildung von Aquakomplexen mit grünlicher Farbe.
Fein verteiltes Nickel reagiert mit Kohlenmonoxid bei 50 bis 80 °C zu Nickeltetracarbonyl, Ni(CO)4, einer farblosen, sehr giftigen Flüssigkeit. Diese dient als Zwischenprodukt zur Herstellung von reinstem Nickel nach dem Mond-Verfahren. Bei 180 bis 200 °C zerfällt Nickeltetracarbonyl wieder in Nickel und Kohlenmonoxid.
Physiologie
Der umstrittenen Essenzialität von Nickel steht die Existenz mehrerer Enzyme gegenüber, die im Normalfall Nickel enthalten, darauf aber nicht angewiesen sind, da dessen Rolle als Kation von anderen zweiwertigen Kationen übernommen werden kann. Im Menschen handelt es sich dabei um drei Proteine, von denen bekannt ist, dass sie Nickel binden:[23]
- alpha-Fetoprotein bindet Nickel, ist aber nicht darauf angewiesen, da kein Enzym
- Aciredukton-Dioxygenase, ein Enzym des Methionin-Salvage-Stoffwechselwegs, das üblicherweise Nickel oder ein anderes zweiwertiges Kation bindet[24]
- Polyribonukleotid-5′-hydroxylkinase Clp1, die als Cofaktor Magnesium, Mangan oder Nickel benötigt[25]
Für Pflanzen und verschiedene Mikroorganismen ist die Essenzialität von Nickel durch Isolierung mehrerer Enzyme (z. B. Urease, Co-F430), die Nickel im aktiven Zentrum enthalten, sowie durch Nachweis von Mangelerscheinungen in nickelarmer Umgebung, die sich durch Zusatz von Ni(II)-Salzen beheben lassen, gesichert.
In der Elektrophysiologie werden Nickel-Ionen dazu verwendet, spannungsaktivierte Calciumkanäle zu blockieren.
Gesundheitliche Probleme
Nickel ist mit der Nickeldermatitis der häufigste Auslöser für Kontaktallergien: in Deutschland sind schätzungsweise 1,9 bis 4,5 Millionen Menschen gegen Nickel sensibilisiert.[26] Deswegen werden Metalle und Legierungen, die mit der Haut in Kontakt kommen, zunehmend seltener vernickelt. Etwa 10 % aller Kinder sind gegenüber Nickel sensibilisiert. Bei erneutem Kontakt mit dem Allergen können diese mit einer Kontaktallergie reagieren.[27]
Das Einatmen anorganischer Nickelverbindungen ist mit einem erhöhten Krebsrisiko für Plattenepithelkarzinome der Lunge und der oberen Luftwege verbunden. Derartige bösartige Neubildungen werden in Deutschland bei berufsbedingter Exposition als Berufskrankheiten anerkannt (BK 4109).[28] Außerdem ist ein erhöhter Nickelgehalt in der Atemluft und im Trinkwasser ein Risikofaktor für eine Sensibilisierung gegen Nickel bei Kindern.[29][30]
Wirtschaftliche Bedeutung
Nickel wird als Metall in geringen Mengen benötigt, der größte Teil der Produktion geht in die Produktion von nichtrostenden Stählen und Nickellegierungen. Die Reserven an nach heutigen Gesichtspunkten abbauwürdigen Nickelvorkommen liegen zwischen 70 und 170 Millionen Tonnen. Gegenwärtig werden weltweit jährlich weit mehr als eine Million Tonnen (2006: 1,340 Mio. Tonnen[31]) gefördert. Der Preis für Nickel unterliegt wegen Finanzmarktspekulationen zeitweise sehr hohen Preisschwankungen.[32]
Verwendung als Metall
Reines Nickelmetall wird in feinverteilter Form als Katalysator bei der Hydrierung ungesättigter Fettsäuren verwendet. Auf Grund seiner chemischen Beständigkeit wird Nickel für Apparate im chemischen Labor und der chemischen Industrie verwendet (z. B. Nickeltiegel für Aufschlüsse). Aus Nickelmetall werden Nickellegierungen mit genau bekanntem Verhältnis (z. B. für Münzen) hergestellt.
Nickel dient als Überzugsmetall zum Korrosionsschutz („Vernickeln“) von Metallgegenständen: Wegen seiner vor Oxidation schützenden Eigenschaften werden Metalle (insbesondere Eisen) mittels galvanischer Technik für bestimmte technische Zwecke mit einer Nickelschicht überzogen.
Ebenfalls genutzt wurde das Metall früher zur Herstellung der Fassungen von Nickelbrillen.
Als Betastrahler wird das Nickelisotop 63Ni in Elektroneneinfangdetektoren in Gaschromatografen eingesetzt.
Verwendung als Legierung
Nickel ist ein bedeutendes Legierungsmetall, das hauptsächlich zur Stahlveredelung verwendet wird. Der größte Teil des Nickels geht dorthin. Es macht Stahl korrosionsbeständig und erhöht seine Härte, Zähigkeit und Duktilität. Mit Nickel hochlegierte Stähle werden bei besonders korrosiven Umgebungen eingesetzt. Der Edelstahl V2A (der Name entstammt der "Versuchscharge 2 austenitisch" im Krupp-Stahlwerk, entspricht X12CrNi18-8) enthält 8 % Nickel neben 18 % Chrom, V4A (Markennamen Cromargan oder Nirosta) 11 % neben 18 % Chrom und 2 % Molybdän.
Etwa 20 % des Nickels werden (in Deutschland) zur Herstellung von weiteren Nickellegierungen verwendet:
- Konstantan, eine Legierung aus 55 % Kupfer und 45 % Nickel, die über einen großen Temperaturbereich einen annähernd konstanten spezifischen elektrischen Widerstand besitzt. Sie wird vor allem für genaue Widerstände verwendet.
- Nickelbasis-Superlegierungen sind Legierungen speziell für den Einsatz bei hohen Temperaturen und unter korrosiven Medien. Sie finden zum Beispiel in Flugzeugturbinen und Gasturbinen von Kraftwerken Anwendung.
- Raney-Nickel, eine Nickel-Aluminium-Legierung, die ein wichtiger Katalysator für die Hydrierung organischer Verbindungen ist.
- Neusilber, eine Kupfer-Nickel-Zink-Legierung mit 10–26 % Nickelanteil, die besonders korrosionsbeständig ist und hauptsächlich für Bestecke und elektrotechnische Geräte verwendet wird.
- Monel, ebenfalls eine Kupfer-Nickel-Legierung mit etwa 65 % Nickel, 33 % Kupfer und 2 % Eisen, die sich durch besondere chemische Beständigkeit, unter anderem gegen Fluor auszeichnet. Sie wird deshalb für Fluor-Druckgasflaschen verwendet.
- Austenitisches Gusseisen mit Kugelgraphit, ein sphärolithisches Sondergusseisen mit bis zu 20 % Nickel, für den Einsatz in korrosiver Umgebung und bei hohen Temperaturen.
Nachweis


Die Nachweisreaktion für die in Wasser meist mit grüner Farbe löslichen Nickel(II)-salze wird in der quantitativen Analytik gravimetrisch sowie qualitativ im Kationentrenngang mit Dimethylglyoxim-Lösung (Tschugajews Reagens) durchgeführt. Nickelsalze werden zuvor gegebenenfalls durch Ammoniumsulfid als grauschwarzes Nickel(II)-sulfid ausgefällt und in Salpetersäure gelöst. Der spezifische Nachweis ist dann durch Reaktion mit Dimethylglyoxim in ammoniakalischer Lösung möglich. Dabei fällt das himbeerrote Bis(dimethylglyoximato)nickel(II) als Komplex aus:[33]
.
Da Nickel aus ammoniakalischer Lösung mit Dimethylglyoxim quantitativ ausfällt, ist dieser Nachweis auch für die quantitative gravimetrische Nickelanalyse verwendbar. Aus ammoniakalischer Lösung kann auch mittels Elektrogravimetrie an einer Platinnetzelektrode eine quantitative Bestimmung erfolgen. Ähnlich anderen Schwermetallen wird Nickel heute meist durch Atomspektroskopie oder Massenspektrometrie auch im Ultraspurenbereich quantitativ bestimmt. Äußerst empfindlich ist die inverse Voltammetrie mit adsorptiver Anreicherung des Ni-Dimethyglyoxim-Komplexes an hängenden Quecksilbertropfen oder Quecksilberfilmelektroden.
Verbindungen
Nickel kommt in Verbindungen hauptsächlich in der Oxidationsstufe +II vor. Die Stufen 0, +I, +III und +IV sind selten und meist instabil. Nickel bildet eine Vielzahl meist farbiger Komplexe.
Anorganische Nickelverbindungen

- Nickel(II)-chlorid NiCl2 ist ein gelber, stark hygroskopischer Feststoff, der als Farbstoff für Keramik und zur Herstellung von Nickelkatalysatoren dient. Neben der wasserfreien Form gibt es noch wasserhaltige Nickel(II)-chloride, z. B. das grüne Nickel(II)-chlorid-Hexahydrat, das aus wässrigen Nickelchloridlösungen auskristallisiert.
- Nickel(II)-hydroxid Ni(OH)2 und Nickel(III)-oxidhydroxid NiO(OH) dienen zur Speicherung elektrischer Energie in Nickel-Cadmium- und anderen Nickelakkumulatoren.
- Nickel(II)-oxid NiO und Nickel(III)-oxid Ni2O3 sind grüne beziehungsweise schwarze Feststoffe und werden zur Herstellung von Keramik, Gläsern und Elektroden verwendet. Außerdem werden sie als Katalysatoren für die Hydrierung organischer Verbindungen genutzt.
- Nickel(II)-nitrat Ni(NO3)2
- Nickel(II)-sulfat NiSO4 und Ammoniumnickel(II)-sulfat ((NH4)2Ni(SO4)2·6H2O) werden bei der Galvanisierung (Vernickelung) verwendet.
- Nickel(II)-carbonat NiCO3 wird als Pigment für keramische Erzeugnisse und zum Herstellen von Nickeloxid benutzt.
- Nickel(II)-sulfid NiS fällt aus ammoniakalischen, nicht jedoch aus sauren, nickelhaltigen Lösungen mit Ammoniumsulfid aus. Dadurch kann Nickel mit der Ammoniumsulfid-Gruppe im Kationentrennungsgang abgetrennt werden.
- Nickel(II)-cyanid Ni(CN)2 wird in der Metallurgie und Galvanoplastik verwendet.
- Nickel(II)-borat Ni(BO2)2 wird als Katalysator verwendet.
- Nickelantimonid NiSb wird z.B. in Feldplatten verwendet.
Organische Nickelverbindungen
Nickeltetracarbonyl Ni(CO)4 ist eine farblose, sehr giftige Flüssigkeit. Sie ist ein wichtiges Zwischenprodukt im Mond-Verfahren. Nickeltetracarbonyl war die erste entdeckte Metallcarbonyl-Verbindung.
Nickelkomplexe

Nickel und dabei v. a. Nickel(II)-Ionen bildet viele, meist farbige Komplexe. Die Koordinationszahlen 6, 5 oder 4 sind am häufigsten. Bei schwachen, einzähnigen Liganden, beispielsweise Wasser, liegen sie meist als oktaedrische und paramagnetische High-spin-Komplexe mit Koordinationszahl 6 vor. Starke Liganden wie Cyanid bilden quadratisch-planare, diamagnetische Low-spin-Komplexe. Ebenfalls einen quadratisch-planaren Komplex bildet Dimethylglyoxim, da der Komplex zusätzlich durch Wasserstoffbrücken stabilisiert ist. Letzterer Bis(dimethylglyoximato)nickel(II)-Komplex ist für den nasschemischen Nickelnachweis von Bedeutung. Anionische Nickelkomplexe enden auf "-niccolat".
Beispiele für Amminkomplexe sind der blaue Tetraamminnickel(II)- und violette Hexaamminnickel(II)-komplex. Beide Verbindungen erhält man durch Zugabe von Ammoniak zu Nickel(II)-salzlösungen:
Durch Zugabe von Kaliumcyanid zu Nickel(II)-salzlösungen entsteht zunächst Nickel(II)-cyanid, das sich im Überschuss von Kaliumcyanid zu gelbem Kaliumtetracyanoniccolat(II) auflöst:
Eine entsprechende Verbindung entsteht mit Kaliumthiocyanat. Eine sehr empfindliche Verbindung ist das Kaliumhexafluoroniccolat(IV) (K2[NiF6]). Mit einem starken Reduktionsmittel lässt sich aus Kaliumtetracyanoniccolat(II) der zweikernige Komplex K4[Ni2(CN)6] mit einwertigem Nickel herstellen. Daneben existiert eine Vielzahl von Komplexen mit organischen Liganden wie beispielsweise Ethylendiamin oder Anionen von Carbonsäuren.[34]
Einzelnachweise
- ↑ Scerri, Eric R.: The periodic table: its story and its significance. Oxford University Press, 2007, ISBN 0-19-530573-6, S. 239–240 (google.com).
- ↑ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Nickel) entnommen.
- ↑ CIAAW, Standard Atomic Weights Revised 2013.
- ↑ N. N. Greenwood und A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 1469.
- ↑ a b c Derek G. E. Kerfoot: Nickel in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2005, doi:10.1002/14356007.a17_157
- ↑ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- ↑ Ruhr-Universität Bochum, Institut für Werkstoffe: Nickel.
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik, Band 6: Festkörper. 2. Auflage, Walter de Gruyter, 2005, ISBN 978-3-11-017485-4, S. 361.
- ↑ Eintrag zu CAS-Nr. 7440-02-0 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte
- ↑ Mindat - Localities for Nickel (englisch).
- ↑ McDonough, W. F. (2014): Compositional Model for the Earth's Core. In: The Mantle and Core, hrsg. von R. W. Carlson, Treatise on Geochemistry Bd. 3, Elsevier, S. 559-577.
- ↑ Martin Okrusch, Siegfried Matthes: Mineralogie: Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7. Auflage. Springer Verlag, Berlin, Heidelberg, New York 2005, ISBN 3-540-23812-3, S. 37, 242.
- ↑ Webmineral – Mineral Species containing Nickel (Ni) (englisch).
- ↑ Gavin M. Mudd, 2009, Nickel Sulfide Versus Laterite: The Hard Sustainability Challenge Remains. Proc. “48 th Annual Conference of Metallurgists”, Canadian Metallurgical Society, Sudbury, Ontario, Kanada, August 2009.
- ↑ Xue-yi GUO, Wen-tang SHI, Dong LI, Qing-hua TIAN: Leaching behavior of metals from limonitic laterite ore by high pressure acid leaching. In: Transactions of Nonferrous Metals Society of China. Band 21, Nr. 1, Januar 2011, S. 191, doi:10.1016/S1003-6326(11)60698-5.
- ↑ L'état du monde 2005, annuaire économique géopolique mondial.
- ↑ a b Ying Zhu, Ping Yu, Xiaofeng Jin, Ding-sheng Wang: Curie temperature of body-centered-tetragonal Ni. In: Journal of Magnetism and Magnetic Materials. 2007, 310, 2, S. e301-e303, doi:10.1016/j.jmmm.2006.10.240.
- ↑ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, B30, S. 193-204, doi:10.1107/S0567740874002469.
- ↑ N. B. Brookes, A. Clarke, P. D. Johnson: Electronic and magnetic structure of bcc nickel. In: Phys. Rev. B. 1992, 46, S. 237–241, doi:10.1103/PhysRevB.46.237.
- ↑ M. P. Fewell: The atomic nuclide with the highest mean binding energy. In: American Journal of Physics. 63. Jahrgang, Nr. 7, 1995, S. 653–658, doi:10.1119/1.17828 (englisch, harvard.edu).
- ↑ Suchergebnis UniProt Nickel/Mensch.
- ↑ UniProt Q9BV57
- ↑ UniProt Q92989
- ↑ A. Schnuch, W. Uter, J. Geier, O. Gefeller: Epidemiology of contact allergy. An estimation of morbidity employing the clinical epidemiology and drug-utilization research (CE-DUR) approach. In: Contact Dermatitis 47(1), 2002, S. 32–39; PMID 12225411.
- ↑ BfR: Kontaktallergene in Spielzeug: Gesundheitliche Bewertung von Nickel und Duftstoffen (PDF; 178 kB), Aktualisierte Stellungnahme Nr. 010/2012 des BfR vom 11. April 2012.
- ↑ Jürgen Strutz, Olaf Arndt, Wolfgang Mann: "Praxis der HNO-heilkunde, Kopf- und Halschirurgie", Thieme, 2001, ISBN 3-13-116971-0, S. 386.
- ↑ Prevalence of nickel sensitization and urinary nickel content of children are increased by nickel in ambient air; PMID 21168833.
- ↑ Allergenes Potenzial: Nickel im Trinkwasser.
- ↑ Handelsblatt: Nickelpreis bricht Rekorde. 10. April 2007.
- ↑ Rohstoff-Welt.de » Analysen » LME-Nickel markiert neues Jahrestief, Volatilität kräftig gestiegen.
- ↑ *E. Schweda: Jander/Blasius: Anorganische Chemie II - Quantitative Analyse & Präparate. 16. Auflage. Hirzel, 2012, ISBN 978-3-7776-2133-3, S. 87.
- ↑ Wolfgang Glöckner: Die Komplexverbindungen, Aulis Verlag Köln 1962, S. 103–107.
Literatur
- Eberhard Auer, Siegfried Müller, Rainer Slotta: 250 Jahre Nickel. Vom "nickel" zum "EURO". Verlag Deutsches Bergbau-Museum, Reihe Veröffentlichungen aus dem Deutschen Bergbau-Museum Bochum Bd. 95, Bochum 2001, ISBN 3-921533-81-3.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1709–1721.
- Harry H. Binder: Lexikon der chemischen Elemente - das Periodensystem in Fakten, Zahlen und Daten. Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3.
Weblinks
- Stoff mit Verdacht auf krebserzeugende Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Gruppe-10-Element
- Übergangsmetall
- Schwermetall
- Periode-4-Element
- Chemisches Element
- Nickel
- Coenzym
- Mineral
- Kubisches Kristallsystem
- Elemente (Mineralklasse)
- Magnetwerkstoff




![{\displaystyle \mathrm {NiSO_{4}+4\ NH_{3}\longrightarrow [Ni(NH_{3})_{4}]SO_{4}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/11ab0362c35dc06c53272f072c9612d3fe47a142)
![{\displaystyle \mathrm {Ni(CN)_{2}+2\ KCN\longrightarrow K_{2}[Ni(CN)_{4}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7ca698fde39c48bead3fac7549399f51aec5f144)