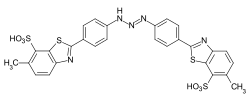
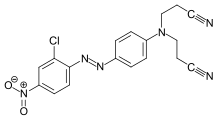
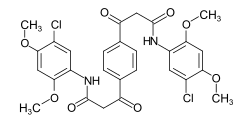
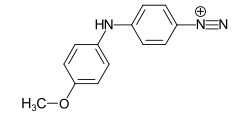
Farbstoffe

Farbstoffe sind Farbmittel, die im Gegensatz zu Pigmenten in Anwendungsmedien wie Wasser oder anderen Lösungsmitteln löslich sind.[1] Sie lassen sich nach verschiedenen Kriterien klassifizieren, beispielsweise nach ihrer Herkunft (Naturfarbstoffe / synthetische Farbstoffe), ihrer Verwendung (Substrat), ihrer chemischen Struktur (Chromophor) oder ihrem anwendungstechnischen Einsatzgebiet.
Manche Farbstoffe lassen sich durch Zugabe von Fällungsmitteln bzw. Beizmitteln in unlösliche Pigmente (Lackpigment) umwandeln, siehe Verlackung.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Über die Verwendung von Farbstoffen im Altertum gibt es wenige Kenntnisse, da sie relativ leicht durch die Einwirkung von Licht, Luft und Mikroorganismen zersetzt werden.[2] Mittels moderner analytischer Methoden (beispielsweise bei der HPLC) lassen sich jedoch kleinste Spuren von Farbstoffen nachweisen. Es gelang den blauen, wasserlöslichen Farbstoff Indigotin auf über 3000 Jahre alten ägyptischen Textilien nachzuweisen.[3] Die Kultivierung der Indigopflanze (Indigofera tinctoria) ist bereits 2500 v. Chr. in Ägypten nachweisbar und aus der Antike sind Aufzeichnungen zum Färbeprozess mit Indigo überliefert (Papyrus Leidensis, Papyrus Holmiensis).[2] In Europa wurde dieser Farbstoff aus dem Färberwaid gewonnen. Dieser Zugang wurde im 17. Jahrhundert durch Einfuhr großer Mengen Indigo aus Ostindien unrentabel.[3]

Die Verwendung des echten Purpurs, gewonnen aus der an der Küste des östlichen Mittelmeeres vorkommenden Purpurschnecke, ist ebenfalls bereits in der Antike nachweisbar. Für Rotfärbungen wurde das sehr teure Purpur zum Teil durch den im Färberkrapp (Rubia tinctorum) enthaltenen Farbstoff Alizarin ersetzt,[3] ein Farbmittel, das schon vor Christi Geburt bekannt war. Weitere seit alters her verwendete Farbstoffe natürlichen Ursprungs waren Henna, Kermes, Kurkuma und Safran.[2]
Mit der „Entdeckung“ Amerikas wurden natürliche Farbstoffe aus Hölzern (Blauholz, Rotholz, Gelbholz) in der Textil- und Lederfärberei, ferner für Haar- und Papierfärbung bedeutsam.[4] Ebenso wurde die Verwendung von echtem Karmin, gewonnen aus Cochenilleschildläusen (Dactylopius coccus Costa), in Europa populär.
Die Grundlage für die Entwicklung synthetischer organischer Farbstoffe wurde in der ersten Hälfte des 19. Jahrhunderts gelegt. Friedlieb Ferdinand Runge isolierte und charakterisierte 1834 aus Steinkohlenteer, der bei der Verkokung von Steinkohle als Nebenprodukt anfällt, unter anderem Anilin und Phenol.[5] Der erste synthetische Farbstoff wurde 1832 durch Zufall vom deutschen Chemiker Karl von Reichenbach entdeckt und Pittakall genannt.[6] Der Chemiker August Wilhelm von Hofmann beschäftigte sich ab 1843 mit der Chemie des Steinkohlenteers und entwickelte zahlreiche neue Umsetzungen und Verfahren. Hofmanns Schüler William Henry Perkin fand 1856 bei Oxidationsversuchen von Anilin das Mauvein. Dies war der erste synthetischen Farbstoff, der kommerziell hergestellt wurde.[7] In den Folgejahren nahm die Chemie der Teerfarben, insbesondere durch die Arbeiten von Hofmann und seiner Schüler Perkin, Johann Peter Grieß, Carl Alexander von Martius (Gründer der Agfa) und Georg Merck (Gründer der Firma Merck & Co. in New York),[8] eine stürmische Entwicklung:
- 1856: Erste Synthese des Triphenylmethan-Farbstoffs Fuchsin durch den polnischen Chemiker Jakub Natanson
- 1858: Entwicklung und Patentierung einer Herstellung von Fuchsin durch den französischen Chemiker François-Emmanuel Verguin. Nahezu zeitgleich entwickelte August Wilhelm Hofmann eine alternative Fuchsin-Synthese.
- 1861: Erfindung vom Kristallviolett durch Charles Lauth – ein Farbstoff aus der Gruppe der kationischen Farbstoffe, der sich für Druckfarben, Tinten und Durchschreibepapier eignet.[9]
- 1862: Entwicklung der Diazotierungsreaktion als wichtiger Zwischenschritt zur Synthese von Azofarbstoffen durch Johann Peter Grieß. Die Azofarbstoffe entwickelten sich zur wichtigsten und größten Gruppe der synthetischen Farbstoffe.[10]
- 1863: Erfindung von Bismarckbraun durch Martius – erster kommerziell hergestellter Azofarbstoff.
- 1869: Erste Synthese eines natürlichen Farbstoffs – Alizarin – durch den BASF-Chemiker Heinrich Caro in Zusammenarbeit mit Carl Graebe und Carl Liebermann.[11]
- 1871: Entwicklung der Synthese des pH-Indikators Phenolphthalein aus Phthalsäureanhydrid und Resorcin durch Adolf von Baeyer.[9]
- 1877: Synthese von Malachitgrün durch Otto Fischer.
- 1878: Erste Vollsynthese von Indigo durch Adolf von Baeyer. Ein alternatives Herstellungsverfahren wurde 1890 durch Karl Heumann entwickelt, das nach weiteren Verbesserungen zur industrielle Herstellung des Farbstoffs ab 1897 führte.[11] Die kostengünstige industrielle Indigo-Produktion, die durch weitere Verfahrensoptimierungen – insbesondere durch den Chemiker Johannes Pfleger – erzielt wurde, führte in wenigen Jahren zu einer drastischen Verringerung des Marktanteils des natürlich gewonnenen Indigos.[12]
Wichtig für diese Entwicklung war die erfolgreiche großtechnische Herstellung und Vermarktung der neuen synthetischen Farbstoffe. So sicherte sich Perkin seine Erfindung durch ein Patent und gründete eine chemische Fabrik, in der bereits ab 1857 das Mauvein als Farbstoff zur Färbung von Seide und Baumwolle produziert wurde. In Deutschland wurden 1863 die spätere Hoechst AG (am 2. Januar 1863 als Theerfarbenfabrik Meister, Lucius & Co.)[13] und Bayer AG (am 1. August 1863 als Friedr. Bayer et comp.)[14] und zwei Jahre danach die BASF (am 6. April 1865 als Badische Anilin- und Sodafabrik)[15] gegründet.
Eine Weiterentwicklung der Farbstoffchemie im 20. Jahrhundert war die Einführung lichtechter Küpenfarbstoffe auf Anthrachinon-Basis. Der erste Vertreter war 1901 der bei der BASF entwickelte Farbstoff Indanthren-Blau, aus dem sich das umfangreiche Indanthren-Sortiment entwickelte.[11] In den zwanziger Jahren wurde durch die Erfindung der Dispersionsfarbstoffe das Färben hydrophober Kunstfasern, wie Acetatseide oder später Polyesterfasern ermöglicht. Mit der Entwicklung der Phthalocyanine, insbesondere dem Kupferphthalocyanin, wurde ab 1935 durch die ICI ein neuer metallhaltiger Chromophor hergestellt, der zunächst als Pigment verwendet wurde. Durch die Einführung von löslichmachender Sulfonsäuregruppen konnte dieser Chromophor auch als Farbstoff verwendet werden. 1951 wurden die ersten Reaktivfarbstoffe für die Färbung von Wolle eingeführt und ab 1956 Reaktivfarbstoffe für die Baumwollfärberei. In den folgenden Jahrzehnten lag der Schwerpunkt der Textilfarbstoffentwicklung in der Verbesserung der anwendungstechnischen Eigenschaften. Beispielsweise durch die Entwicklung von bifunktionellen Reaktivfarbstoffen oder Reaktivfarbstoffen mit neuen Reaktivgruppen.[16]:S. 113–114
Neben den textilen Anwendungen rückten im Laufe der Zeit die funktionellen Farbstoffe verstärkt in den Fokus. Dieser Begriff wurde 1993 für Farbstoffe geprägt, deren spezifische Anwendung nicht auf ihren ästhetischen Farbeigenschaften beruhen.[17] Funktionelle Farbstoffe werden unter anderem in der Medizin, der Pharmazie, der Fotovoltaik, bei der Datenspeicherung oder in der Druckindustrie eingesetzt.[18]
Chemisch-physikalische Grundlagen
[Bearbeiten | Quelltext bearbeiten]Für den Menschen ist das Lichtspektrum im Wellenlängenbereich zwischen 380 und 790 nm sichtbar. Trifft weißes Licht auf einen Körper, wird das Lichtspektrum teilweise reflektiert und teilweise absorbiert. Werden beispielsweise kurzwellige Anteile der Lichtfarbe (Violett bis Blau, 420–480 nm) absorbiert, so enthält die remittierte Strahlung vorwiegend langwellige Anteile (bis 780 nm) und der Farbeindruck, die sogenannte Körperfarbe, ist Gelb bis Rot.

Farbstoffe absorbieren und reflektieren ebenfalls einen Teil des sichtbaren weißen Lichts und es wird die Mischung aus den Komplementärfarben des absorbierten Lichts vom Auge wahrgenommen.


Die Farbstoff-Eigenschaft einer chemischen Verbindung ergibt sich aus ihrer chemischen Struktur. Während Moleküle mit σ-Bindungen elektromagnetische Energie im Röntgen- und UV-Bereich absorbieren, werden Moleküle mit Elektronen in π-Bindungen (ungesättigte Bindungen) bereits durch elektromagnetische Strahlung mit geringerer Energie angeregt. Bei mehreren konjugierten ungesättigten Bindungen im Molekül sind die π-Elektronen delokalisiert und mit steigendem Grad der Konjugation verringert sich der energetische Abstand zwischen Grundzustand und angeregtem Energiezustand des Moleküls. Das Absorptionsmaximum verschiebt sich in Richtung längerer Wellenlängen und in den sichtbaren Bereich des Spektrums.[19] (→Bathochromer Effekt)
Derartige Molekülstrukturen werden nach der Farbstofftheorie von Otto Nikolaus Witt als Chromophore bezeichnet. Funktionelle Gruppen im Molekül, die als Elektronendonatoren oder als Elektronenakzeptoren wirken, beeinflussen die Mesomerie im Molekül, indem sie Elektronendichte der chromophoren Gruppe erhöhen oder verringern. Sie werden auch als Auxochrome oder Antiauxochrome bezeichnet.
Auxochrome Gruppen sind beispielsweise die Hydroxy-, Ether-, Amino- und Amido-Gruppe, antiauxochrome Gruppen die Carbonyl-, Nitro-, Carboxyl- und Sulfo-Gruppe.
Klassifizierung von Farbstoffen
[Bearbeiten | Quelltext bearbeiten]Die gängigste Einteilung der verschiedenen Farbstoffe erfolgt nach ihrer chemischen Struktur oder nach ihrem färbetechnischen Anwendungsverfahren.
Klassifizierung nach chemischen Strukturen
[Bearbeiten | Quelltext bearbeiten]Anthrachinonfarbstoffe
[Bearbeiten | Quelltext bearbeiten]
Die Grundstruktur dieser Farbstoffgruppe ist das Anthrachinon. Durch Variation der Substituenten lassen sich nahezu alle Farbtöne von Gelb über Rot und Blau bis Grün erzielen, wobei insbesondere die roten und blauen Anthrachinonfarbstoffe von Bedeutung sind. Durch Reduktion lässt sich das chinoide System in das entsprechende wasserlösliche Hydrochinon überführen, so dass sich die Anthrachinonfarbstoffe als Küpenfarbstoffe verwenden lassen. Mit geeigneten Substituenten sind Anthrachinonfarbstoffe als Dispersionsfarbstoffe zum Färben von Kunstfasern einsetzbar. Wasserlösliche Anthrachinonfarbstoffe mit Sulfonsäure-Gruppen finden Verwendung als Säure- oder Reaktivfarbstoffe.
-
C.I. Disperse Blue 87
-
C.I. Reactive Blue 19
Azofarbstoffe
[Bearbeiten | Quelltext bearbeiten]
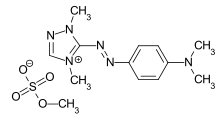
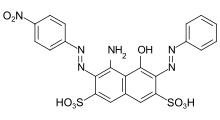
Die Azofarbstoffe enthalten als Grundstruktur eine mit Aryl- oder Alkenylresten substituierte Azogruppe. Azofarbstoffe mit mehreren Azogruppen werden als Bisazo- (auch Disazo-), Trisazo-, Tetrakisazo-, Polyazo-Farbstoffe bezeichnet. Arylsubstituenten sind in aller Regel Benzol- oder Naphthalin-Derivate, aber auch heterocyclische Aromaten, wie Pyrazole oder Pyridone. Als Alkenylsubstituenten werden enolisierbare aliphatische Gruppen, beispielsweise substituierte Anilide der Acetessigsäure, verwendet.
Die Farbstoffsynthese erfolgt durch Diazotierung aromatischer Amine und anschließender Azokupplung des Diazoniumsalzes auf elektronenreiche Aromaten oder β-Dicarbonyl-Verbindungen. Die Azofarbstoffe sind die mit Abstand wichtigste und umfangreichste Farbstoffgruppe und in fast allen anwendungstechnischen Farbstoffkategorien (→Klassifizierung nach anwendungstechnischen Verfahren) vertreten. Es sind keine natürlich vorkommenden Azofarbstoffe bekannt. Bis auf Türkis oder einem brillanten Grün lassen sich mit Azofarbstoffen nahezu alle Farbtöne erzielen. Die Azogruppe ist empfindlich gegen Reduktionsmittel – sie wird gespalten und der Farbstoff dadurch entfärbt.
Einige Beispiele verschiedener Azofarbstoff-Typen (Mono- und Bisazofarbstoffe / Benzol-, Naphthalin-Reste / Pyridon-, Acetoacetanilid-Kupplungskomponente / Metallkomplex-Farbstoff):
-
C.I. Reactive Black 5
-
C.I. Disperse Yellow 241
-
C.I. Solvent Yellow 19
Dioxazinfarbstoffe
[Bearbeiten | Quelltext bearbeiten]
Dioxazinfarbstoffe – auch als Triphendioxazinfarbstoffe bezeichnet – enthalten Triphendioxazin als Grundstruktur. Die farbstarken, brillanten Farbstoffe haben gute Echtheitseigenschaften und vereinigen somit die Vorteile der Azofarbstoffe und der Anthrachinonfarbstoffe. Kommerziell erhältlich sind Dioxazinfarbstoffe als Direkt- und Reaktivfarbstoffe.[16]:S. 112
-
C.I. Direct Blue 106
-
C.I. Reactive Blue 204
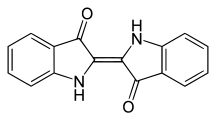
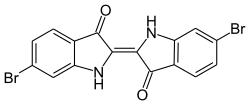
Indigoide Farbstoffe
[Bearbeiten | Quelltext bearbeiten]Die indigoiden Farbstoffe gehören zu den Carbonylfarbstoffen und werden als Küpenfarbstoffe eingesetzt. Der wichtigste Vertreter ist Indigo, der als natürlicher Farbstoff bereits in der Antike aus Pflanzen gewonnen wurde und der nach wie vor in großen Mengen industriell hergestellt und insbesondere für die Färbung von Blue Jeans verwendet wird.
Ebenfalls ein Naturfarbstoff ist der antike Purpur (C.I. Natural Violet 1 / Dibromindigo).
-
C.I. Vat Blue 1 (Indigo)
-
C.I. Natural Violet 1
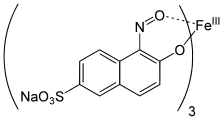
Metallkomplexfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Metallkomplexfarbstoffe sind Koordinationsverbindungen eines Metallions mit einem oder mehreren Farbstoff-Liganden, die Elektronendonorgruppen aufweisen. Es überwiegen die Kupfer- und Chrom-Verbindungen, in geringerem Umfang werden aber auch Cobalt-, Nickel- und Eisen-Komplexe als Farbstoffe verwendet. Bei den Liganden handelt es sich häufig um Azofarbstoffe, Azomethinfarbstoffe, Formazane oder Phthalocyanine. Die Metallkomplexfarbstoffe zeichnen sich durch sehr gute Echtheitseigenschaften aus.
Formazanfarbstoffe
[Bearbeiten | Quelltext bearbeiten]
Die Formazanfarbstoffe sind strukturell mit den Azofarbstoffen verwandt. Die Grundstruktur ist das 1,3,5‑Triphenylformazan. Mit Übergangsmetallen, wie Kupfer, Nickel oder Kobalt bilden sie Chelatkomplexe. Abhängig von den weiteren Substituenten sind die nicht komplexierten Formazane orange bis tiefrot, die Metallkomplexformazane violett, blau bis grün. Die Synthese erfolgt durch Kupplung von Diazoniumsalzen auf Hydrazone.
Kommerziell bedeutend sind blaue vierzähnige Kupferchelatkomplexe verschiedener Formazane, die insbesondere als Reaktivfarbstoffe für Baumwolle eingesetzt werden:
-
C.I. Reactive Blue 160
-
C.I. Reactive Blue 235
Phthalocyaninfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Die Phthalocyaninfarbstoffe sind Kupfer- oder Nickel-Metallkomplexe mit der Grundstruktur des Phthalocyanins. Sie sind strukturell verwandt mit den Porphyrinen, mit denen sie das Aza[18]annulen-Element gemeinsam haben. Durch Einführung von wasserlöslichen Substituenten – hauptsächlich über eine Sulfochlorierung – sind türkisfarbene bis brillantgrüne Farbstoffe zugänglich. Die Phthalocyaninfarbstoffe zeichnen sich durch eine ausgezeichnete Lichtechtheit aus.
-
Phthalocyanin (Aza[18]annulen)
-
C.I. Reactive Blue 7
Methinfarbstoffe
[Bearbeiten | Quelltext bearbeiten]
Die Methin- oder Polymethinfarbstoffe haben als chromophores System konjugierte Doppelbindungen, mit zwei Endgruppen, die als Elektronenakzeptor A und Elektronendonor D fungieren. Die Endgruppen, die in den meisten Fällen Stickstoff- oder Sauerstoffatome enthalten, können Teil eines Heterocyclus sein und die Doppelbindungen Teil eines aromatischen Systems. Sind eine oder mehrere Methingruppen durch Stickstoffatome ersetzt, spricht man von aza-analogen Methinfarbstoffen. Dadurch ergeben sich verschiedenen Unterklassen:
- Cyaninfarbstoffe, bei denen die konjugierten Doppelbindungen durch eine tertiäre Aminogruppe und eine quartäre Ammoniumgruppe flankiert sind.[20] Sind zwei Methingruppen durch Stickstoffatome ersetzt und ist eine terminale Gruppe Teil eines Heterocyclus, während die zweite terminale Gruppe offenkettig ist, erhält man die wichtigen Diazahemicyaninfarbstoffe. Beispiel: C.I. Basic Red 22.
- Styrylfarbstoffe: durch das Einfügen eines Phenylrings in das Polyengerüst, haben diese ein Styrol-Strukturelement. Beispiel: C.I. Disperse Yellow 31.
- Triarylmethinfarbstoffe, in der älteren Literatur auch als Triarylmethanfarbstoffe bezeichnet, da sie sich vom Triphenylmethan ableiten, bei dem mindestens zwei der aromatischen Ringe elektronenliefernde Substituenten aufweisen. Beispiel: C.I. Basic Green 4 (Malachitgrün).[21]
-
C.I. Basic Red 22
-
C.I. Disperse Yellow 31
-
C.I. Basic Green 4 (Malachitgrün)
Nitro- und Nitrosofarbstoffe
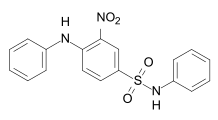
[Bearbeiten | Quelltext bearbeiten]Bei den Nitrofarbstoffen befindet sich eine Nitrogruppe an einem aromatischen Ring in ortho-Position zu einem Elektronendonator – entweder einer Hydroxy- (–OH) oder einer Aminogruppe (–NH2). Der älteste Vertreter dieser Farbstoffklasse ist die Pikrinsäure (2,4,6-Trinitrophenol). Die Hydroxynitrofarbstoffe haben jedoch keine kommerzielle Bedeutung mehr. Es handelt sich um eine relativ kleine aber alte Farbstoffklasse, deren Vertreter sich durch eine hohe Lichtechtheit und ihre einfache Herstellung auszeichnen. Die Nitrofarbstoffe haben einen gelben bis braunen Farbton. Da es relativ kleine Moleküle sind, ist ein wichtiges Einsatzgebiet als Dispersionsfarbstoffe die Färbung von Polyesterfasern. Sie werden auch als Säure- und Pigmentfarbstoff verwendet.
Die seltenen Nitrosofarbstoffe sind aromatische Verbindungen mit einer Nitrosogruppe. Nitrosofarbstoffe mit einer Hydroxygruppe in ortho-Position zur Nitrosogruppe werden ausschließlich als Metallkomplexe eingesetzt. Ein typischer Vertreter ist Naphtol Grün B (C.I. Acid Green 1).[22]:S. 161 ff.
-
Pikrinsäure
-
C.I. Acid Orange 3
-
C.I. Disperse Yellow 42
-
C.I. Acid Green 1
Schwefelfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Schwefelfarbstoffe (Sulfinfarbstoffe) sind wasserunlösliche, makromolekulare Farbstoffe, die Disulfid- oder Oligosulfidbindungen zwischen aromatischen Resten aufweisen. Sie werden durch Schmelzen von Benzol-, Naphthalin- oder Anthrazenderivaten mit Schwefel oder Natriumpolysulfiden gewonnen und sind von uneinheitlicher Konstitution. Sie eignen sich insbesondere zum Färben von Baumwolle und werden dabei wie die Küpenfarbstoffe mit Natronlauge und Dithioniten oder Natriumsulfid in die wasserlösliche Form reduziert (Leukoverbindung) und nach Aufziehen auf die Faser durch Oxidation auf dieser unlöslich fixiert. Aus toxikologischen und ökologischen Gründen verzichtet man inzwischen weitestgehend auf die Oxidation mit Dichromat und verwendet verstärkt Sulfid-arme Schwefelfarbstoffe und Sulfid-freie Reduktionsmittel. Aufgrund der niedrigen Herstellkosten spielen die Schwefelfarbstoffe nach wie vor mengenmäßig eine bedeutende Rolle. Schwefelfarbstoffe sind besonders wasch- und lichtecht, die Farbtöne sind meist gedeckt.[23]
Klassifizierung nach anwendungstechnischen Verfahren
[Bearbeiten | Quelltext bearbeiten]Während die Farbnuance eines Farbstoffs im Wesentlichen durch den Chromophor bestimmt wird, lassen sich durch Einbau von geeigneten chemischen Gruppen die Eigenschaften der Farbstoffe so variieren, dass unterschiedliche Substrat-Typen gefärbt werden können. Daraus ergibt sich eine Klassifizierung der unterschiedlichen Farbstoffe nach dem färbetechnischen Verfahren. Dieser Einteilung folgt auch der Colour Index, ein wichtiges Standardwerk auf dem Gebiet der Farbstoffchemie. Aus dem Colour-Index (C.I.) erkennt der Färber, um welche Farbstoffklasse, welche Farbe und welche Substanz es sich handelt. Im C.I. sind mehr als 10.000 Farbstoffe enthalten – mehr als 50 % davon sind Azofarbstoffe.[24]
Beizenfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Der Name leitet sich vom Färbeverfahren ab, bei dem geeignete Säurefarbstoffe auf das gebeizte Färbegut – vorwiegend Wolle und Seide – aufgebracht werden. Um mit Beizenfarbstoffen zu färben, werden die zu färbenden Fasern zunächst mit Chrom(III)-, Eisen(III)- oder Aluminiumsalzen behandelt, gebeizt. Beim anschließenden Behandeln mit Wasserdampf bilden sich auf der Faser Metallhydroxide. Diese Hydroxide reagieren beim Einfärben mit dem (meist speziellen) Säurefarbstoff zu einem Metallkomplexfarbstoff. Der Vorgang an der Faser entspricht einer Verlackung.[25]
Werden Chromsalze verwendet, spricht man von Chromierungsfarbstoffen. Abhängig von dem Beizenfarbstofftyp kann das Chromsalz – in aller Regel Chromate oder Dichromate – vor, während oder nach dem Färben zugeführt werden. Entsprechend unterscheidet man Vor-, Nach- und Einbad-Chromierverfahren. Die Chromierungsfarbstoffe zeichnen sich insbesondere durch eine sehr gute Nassechheit aus. Nachteilig und ökologisch kritisch ist jedoch die Schwermetallbelastung der Fasern und der Färbereiabwässer.[26]
Die Beizenfarbstoffe werden nach dem Colour Index als C.I. Mordant Dyes bezeichnet.
Beispiele:
-
C.I. Mordant Black 9
-
C.I. Mordant Yellow 8
-
C.I. Mordant Black 7
-
C.I. Mordant Red 60
-
C.I. Mordant Blue 9
Historisch wurden neben Chrom-, Eisen- und Aluminiumsalzen auch Beizen auf Basis von Ammoniumvanadat, Gerbsäure, Tonerde, Antimon, Barium, Blei, Cobalt, Kupfer, Mangan, Nickel, Zinn sowie Türkischrotöl eingesetzt. Zur Fixierung wurden verschiedene Antimonsalze wie beispielsweise Brechweinstein oder Antimon(III)-chlorid, sowie Natriumsilicate und Natriumphosphat, aber auch Kuhkot verwendet.[27]
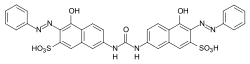
Direktfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Direktfarbstoffe (oder Substantive Farbstoffe) ziehen aufgrund ihrer hohen Substantivität direkt aus wässriger Lösung auf die Faser auf. Sie sind besonders für die Anwendung auf Cellulose geeignet. Diese Farbstoffe werden durch physikalische Wechselwirkungen (Van-der-Waals-Bindungen) an die Faser gebunden. Die meisten Vertreter kommen aus der Gruppe der Azofarbstoffe, vorzugsweise handelt es sich um Polyazofarbstoffe.
Die Direktfarbstoffe werden nach dem Colour Index als C.I. Direct Dyes bezeichnet.
Beispiele:
-
C.I. Direct Blue 8
-
C.I. Direct Orange 26
-
C.I. Direct Yellow 9
Dispersionsfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Die nahezu wasserunlöslichen Dispersionsfarbstoffe werden vorzugsweise zum Färben von hydrophoben Polyester- und Acetatfasern eingesetzt. Sie werden zusammen mit Dispergiermitteln sehr fein zermahlen, dadurch können beim Färbeprozess die molekular gelösten Farbstoffanteile in die Faser diffundieren, bilden dort eine feste Lösung, so dass wasch- und lichtechte Färbungen resultieren.
Die überwiegende Anzahl der Dispersionsfarbstoffen gehören zu den Azofarbstoffen. Dispersionsfarbstoffe sind besonders durch die mechanisch hochwertigen Polyesterfasern eine sehr wichtige Farbstoffgruppe. Die gesamte gehandelte Menge hatte im Jahr 1999 für Westeuropa einen Verkaufswert von 98 Millionen Euro.
Die Dispersionsfarbstoffe werden nach dem Colour Index als C.I. Disperse Dyes bezeichnet.
Beispiele:
-
C.I. Disperse Orange 44
-
C.I. Disperse Blue 797
-
C.I. Disperse Red 177
Entwicklungs- oder Kupplungsfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Bei den Entwicklungsfarbstoffen wird ein praktisch wasserunlöslicher Farbstoff direkt auf der Faser durch Reaktion einer wasserlöslichen Kupplungskomponente (C.I. Azoic Coupling Component) mit einer wasserlöslichen Diazokomponente (C.I. Azoic Diazo Component) gebildet. Mit dieser Farbstoffklasse werden hauptsächlich Cellulosefasern gefärbt, wobei sich die Färbungen durch eine sehr gute Nassechtheit auszeichnen. Die wichtigste Kupplungskomponente bei den Entwicklungsfarbstoffen ist die C.I. Coupling Component 2 (Naphthol AS).
-
C.I. Azoic Coupling Component 2 (Naphthol AS)
-
C.I. Azoic Coupling Component 35 (Naphthol AS-LG)
-
C.I. Azoic Diazo Component 3 (Echtscharlachsalz GG)
-
C.I. Azoic Diazo Component 35 (Variaminblausalz B)
Kationische Farbstoffe
[Bearbeiten | Quelltext bearbeiten]Kationische Farbstoffe sind positiv geladene Verbindungen, die im Wesentlichen mit Polyacrylnitril-Fasern (PAN) und anionisch modifiziertem Polyester brillante und lichtechte Färbungen ergeben. Sie gehen mit negativ geladenen Gruppen der Faser ionische Bindungen ein. Für kationische Farbstoffe können verschiedene Chromophore verwendet werden, wobei die positive Ladung bei den Methinfarbstoffen im Gegensatz zu anderen chromophoren Systemen delokalisiert ist.
Auch wenn die kationischen Farbstoffe nach dem Colour Index mit C.I. Basic Dyes benannt werden, ist die Bezeichnung basische Farbstoffe für diese Farbstoffgruppe in der neueren Literatur nicht mehr gebräuchlich.[22]:S. 102
-
C.I. Basic Orange 22
-
C.I. Basic Blue 3
-
C.I. Basic Blue 54
-
C.I. Basic Red 18
Küpenfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Zu den Küpenfarbstoffen zählen wasserunlösliche Pigmente, die durch Reduktion (Verküpung) in alkalischer Lösung zum Färben in ihre lösliche Dihydro- oder Leukoform gebracht werden. Das Anion zeigt eine ausreichende Affinität zur Baumwoll- oder Viskosefaser, so dass der Küpenfarbstoff aufziehen kann. Hier wird er durch anschließende Oxidation wieder in den unlöslichen Zustand überführt.[28] Dies kann entweder durch Luftsauerstoff oder Behandlung durch Oxidationsmittel erfolgen. Der Farbstoff wird quasi molekular an der Faser fixiert, dieses „Ausfällen in der Faser“ bewirkt die hohe Wasch- und Lichtechtheit.[29] Die wasserunlöslichen Schwefelfarbstoffe verhalten sich ebenfalls wie die Küpenfarbstoffe.
Der wichtigste Küpenfarbstoff ist Indigo. Ebenfalls von Bedeutung sind die Indanthren-Farbstoffe.
Die Küpenfarbstoffe werden nach dem Colour Index als C.I. Vat Dyes bezeichnet.
Beispiele:
-
C.I. Vat Green 11
-
C.I. Vat Orange 7
-
C.I. Vat Red 23
Lebensmittelfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Die Lebensmittelfarbstoffe werden als Lebensmittelzusatzstoffe verwendet, um verarbeitungsbedingte Farbveränderungen ausgleichen bzw. die Farberwartungen der Verbraucher zu befriedigen. Es werden sowohl Farbstoffen natürlichen Ursprungs, als auch synthetisch hergestellte Farbstoffe eingesetzt. Die Verwendung von Farbstoffen als Lebensmittelfarbstoffe ist gesetzlich streng geregelt – in der EU durch die Verordnung (EG) Nr. 1333/2008 vom 16. Dezember 2008 über Lebensmittelzusatzstoffe.[30] Es dürfen nur zugelassene, mit einer E-Nummer versehene Lebensmittelzusatzstoffe in Verkehr gebracht werden. Diese Zusatzstoffe müssen auf dem Produkt kenntlich gemacht werden.[31]
Die Lebensmittelfarbstoffe werden nach dem Colour Index als C.I. Food Dyes bezeichnet.
Lösungsmittelfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Die Lösungsmittelfarbstoffe, Bezeichnung laut Colour Index Solvent Dyes, sind wasserunlösliche Farbstoffe, die in verschiedenen organischen Lösungsmitteln wie Alkoholen, Estern oder Kohlenwasserstoffen löslich sind. In der Regel enthalten die Strukturen der Lösungsmittelfarbstoffe keine Sulfonsäure- oder Carboxygruppen. Ausgenommen sind kationische Farbstoffe, mit einer intramolekularen Sulfonat- oder Carboxylatgruppe als Gegenanion. Vertreter der Lösungsmittelfarbstoffe findet man in verschiedenen chemischen Farbstoffklassen, von den Azofarbstoffen, über Anthrachinonfarbstoffen, Metallkomplexfarbstoffen bis zu den Phthalocyaninen. Lösungsmittelfarbstoffe finden Anwendung als Bestandteil von Lacken (Beispiel: Farbstoffe für Zaponlacke), zum Einfärben von Mineralölprodukten (Sudanfarbstoffe), Wachs, Tinten und verschiedenen transparenten Kunststoffen.
Die Lösungsmittelfarbstoffe werden nach dem Colour Index als C.I. Solvent Dyes bezeichnet.
Beispiele:
-
C.I. Solvent Yellow 32
-
C.I. Solvent Red 8
Reaktivfarbstoffe
[Bearbeiten | Quelltext bearbeiten]Reaktivfarbstoffe bilden beim Färbeprozess mit den funktionellen Gruppen der Faser eine kovalente Bindung, wodurch sich nassechte Färbungen ergeben. Sie sind die größte Farbstoffgruppe zum Färben von Cellulose, können aber auch zum Färben von Wolle und Polyamid in tiefen Nuancen eingesetzt werden.[32]
Chemisch gesehen bestehen die Reaktivfarbstoffe aus zwei Teilen – einem Chromophor und einer oder mehrerer Reaktivgruppen, auch als Reaktivanker bezeichnet. Von Bedeutung sind zwei verschiedene Reaktivankersysteme:
- Heterocyclische Verbindungen, beispielsweise Halogen-substituierte Triazin- oder Pyrimidin-Derivate. Beim Färbeprozess reagieren diese mit den Hydroxygruppen der Fasern unter Abspaltung von Halogenwasserstoff und Bildung einer stabilen kovalenten Etherbindung:

- Die sogenannte Vinylsulfon-Gruppe, die während des Färbeprozesses mit den nukleophilen Gruppen der Faser im Sinne einer Michael-Addition reagiert. Auch in diesem Fall entsteht eine stabile Etherbindung. Bei vielen Vinylsulfonfarbstoffen liegt die Vinylsulfongruppe in geschützter Form als Schwefelsäurehalbester vor. Erst unter den alkalischen Färbebedingungen wird die Vinylsulfongruppe durch Eliminierung von Schwefelsäure gebildet.

Die beiden Reaktivanker-Typen können auch parallel in einem Reaktivfarbstoff vorliegen.
Als Chromophor sind mit Abstand die Azofarbstoffe am häufigsten bei den Reaktivfarbstoffen vertreten. Jedoch spielen auch andere chromophore Systeme, wie Anthrachinon-, Formazan- und Phthalocyaninfarbstoffe eine wichtige Rolle.
Die Reaktivfarbstoffe werden nach dem Colour Index als C.I. Reactive Dyes bezeichnet.
Beispiele:
-
C.I. Reactive Orange 107
-
C.I. Reactive Blue 2
-
C.I. Reactive Blue 21
-
C.I. Reactive Red 227
-
C.I. Reactive Orange 1
Säurefarbstoffe
[Bearbeiten | Quelltext bearbeiten]Säurefarbstoffe besitzen hydrophile, anionische Substituenten – in aller Regel sind dies Sulfosäuregruppen. Die meisten Vertreter dieser Farbstoffklasse gehören zu den Azofarbstoffen, jedoch gibt es auch Säurefarbstoffe mit anderen Chromophoren. Sie werden hauptsächlich zum Färben von Wolle, Seide und Polyamid verwendet, wobei der Färbeprozess im pH-Bereich 2–6 erfolgt. Bei Verwendung kleiner Farbstoffmoleküle erhält man gleichmäßige Färbungen, bei denen die Farbstoffmoleküle hauptsächlich salzartige Bindungen mit den Ammoniumgruppen der Faser bilden. Das Auswaschverhalten (Nassechtheit) ist bei diesen Produkten eher mäßig. Mit zunehmender Molekülgröße nimmt die Bindung des Farbstoffs durch Adsorptionskräfte zwischen dem hydrophoben Teil des Farbstoffmoleküls und der Faser zu. Dadurch verbessert sich die Nassechtheit, jedoch in vielen Fällen auf Kosten der Gleichmäßigkeit (Egalität) der Färbung.
Die Säurefarbstoffe werden nach dem Colour Index als C.I. Acid Dyes bezeichnet.
Beispiele:
-
C.I. Acid Black 1
-
C.I. Acid Yellow 36
-
C.I. Acid Blue 117
-
C.I. Acid Orange 19
-
C.I. Acid Blue 3 (Patentblau V)
Funktionelle Farbstoffe
[Bearbeiten | Quelltext bearbeiten]Während konventionelle Farbstoffe etwa zur optischen Veränderung von Textilien, Leder und Papier eingesetzt werden, dienen funktionelle Farbstoffe in der Regel keinem ästhetischen Zweck. Typische Einsatzgebiete sind Indikatorfarbstoffe oder spannungsabhängige Farbstoffe[33]
Spezielle Farbstoffe können
- Licht bei einer bestimmten Wellenlänge absorbieren und das absorbierte Licht in Wärme umwandeln (etwa in der chemischen und biochemischen Analytik),[33]
- das Licht bei einer anderen Wellenlänge wieder emittieren (als phosphoreszierende Biomarker oder Tinten, Fluoreszenz bei Farbstofflasern, Chemilumineszenz zum Brechen oder Neuknüpfung von chemischen Bindungen in der Biochemie),[33]
- die Polarisationsrichtung des Lichts verändern (wie bei der Frequenzverdoppelung oder als optische Schalter),
- elektrische Phänomene bewirken (in der Anwendung bei Laserdruckern),
- fotochemische Prozesse ermöglichen.
Ökonomisch ist der Einsatz von funktionellen Farbstoffen für die Herstellung von CDs, DVDs besonders wichtig. Die Farbstoffmoleküle sind im Polycarbonat einer CD oder DVD enthalten. Durch den Laserstrahl des Brenners nehmen Farbstoffmoleküle Lichtenergie auf und setzen diese in Wärme um. Durch die Wärmeaufnahme schmilzt der Kunststoff, das Polycarbonat, an dieser Stelle. Die Oberfläche hat sich leicht verändert, die veränderte Oberflächenstruktur wird beim Leseprozess wahrgenommen.[34]
Industrielle Farbstoffproduktion
[Bearbeiten | Quelltext bearbeiten]Die industrielle Farbstoffproduktion umfasst neben den chemischen Umsetzungen verschiedene physikalische Arbeitsgänge, beispielsweise das Aussalzen, die Filtration, die Reversosmose (RO), die Trocknung und die Mahlung.
Vor oder nach der Trocknung werden die Handelsfarbstoffe durch Zugabe farbloser, indifferenter Stellmittel wie Natriumsulfat, Natriumchlorid oder Dextrin auf eine bestimmte Farbstärke standardisiert, um die Schwankungen verschiedener Fabrikationspartien auszugleichen. Durch gezielten Zusatz anderer Farbstoffe (Nuancierfarbstoffe) kann die Farbtonkonstanz des Handelsprodukts gewährleistet werden. Die Lagerstabilität der Produkte lässt sich in manchen Fallen durch Zusatz von Puffersubstanzen wie Mono- und Dinatriumphosphat erhöhen.[35]
Insbesondere bei schlecht wasserlöslichen Farbstoffen hat das Mahlen großen Einfluss auf den Färbungsprozess (Farbton, Farbstärke). In den 1960er und 1970er Jahren wurden neben den Farbstoffpulvern zunehmend konzentrierte wässrigen Farbstofflösungen vermarktet. Durch die Einführung der Flüssigmarken, wie der Entwicklung von Farbstofgranulaten wurde die automatische Farbstoffdosierung in den Färbereien erleichtert und die Staubbelastung verringert.
Vor 1980 war die industrielle Farbstoffproduktion sehr stark in Westeuropa, Nordamerika und Japan vertreten. Gestiegenen Umweltschutzkosten und der zunehmende Importdruck aus Asien durch viele nicht-traditionelle Farbstoffhersteller, insbesondere aus China, Indien, Korea und Thailand, führten zu erheblichen Umstrukturierungen bei den traditionellen Farbstoffherstellern. Es kam zu einer Konzentration des Farbstoffgeschäfts durch Übernahmen und Joint Ventures, infolge derer viele Produktionsanlagen geschlossen wurden.[36]
Große traditionelle Farbstoffhersteller sind Huntsman (ehemals Ciba), DyStar (hervorgegangen aus den Farbstoffbereichen der Hoechst AG, Bayer AG und BASF) und Archroma (hervorgegangen aus Clariant).[36] Diese traditionellen Farbstoffhersteller produzieren mittlerweile weitestgehend in Asien.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Liste der Farbstoffe, nach Farbe sortiert
- Färberei in der Antike
Literatur
[Bearbeiten | Quelltext bearbeiten]- Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Klaus Hunger (Hrsg.): Industrial Dyes: Chemistry, Properties, Applications. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-662-01950-7 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jürgen Fabian, Horst Hartmann: Light Absorption of Organic Colorants. Theoretical Treatment and Empirical Rules. Springer, Berlin 1980, ISBN 3-642-67589-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Martin Klessinger: Konstitution und Lichtabsorption organischer Farbstoffe. In: Chemie in unserer Zeit. Band 12, 1978, S. 1–11.
- Guido Ebner, Dieter Schelz: Textilfärberei und Farbstoffe. Springer-Verlag, Berlin 1989, ISBN 3-642-70172-8 (eingeschränkte Vorschau in der Google-Buchsuche – Reprint 2011).
- Wilfried Kratzert, Rasmus Peichert: Farbstoffe. Quelle & Meyer, Heidelberg 1981, ISBN 3-494-01021-8.
- Helmut Schweppe: Handbuch der Naturfarbstoffe. Vorkommen – Verwendung – Nachweis. ecomed, Landsberg/Lech 1993, ISBN 3-609-65130-X.
- Lutz Roth, Kurt Kormann, Helmut Schweppe: Färbepflanzen – Pflanzenfarben. Botanik – Färbemethoden – Analytik – Türkische Teppiche und ihre Motive. ecomed, Landsberg/Lech 1992, ISBN 3-609-65490-2.
- Sabine Struckmeier: Naturfarbstoffe: Farben mit Geschichte. In: Chemie in unserer Zeit. Band 37, Nr. 6, 2003, S. 402–409, doi:10.1002/ciuz.200300275.
- Herbert Vogler: Gefärbt wird schon seit Jahrtausenden – ein Überblick über die Färberei der Antike. In: Textilveredlung. Band 21, Nr. 6, 1986, S. 229–235.
- Herbert Vogler: 150 Jahre Farbstoffindustrie. Teil I. In: Textilveredlung. Band 42, Nr. 11/12, 2007, S. 11–14 (tib.eu).
- Herbert Vogler: 150 Jahre Farbstoffindustrie. Teil II. In: Textilveredlung. Band 43, Nr. 1/2, 2008, S. 10–14 (tib.eu).
- Anthony Travis: The Rainbow Makers: The Origin of the Synthetic Dyestuff Industry in Western Europe. Lehigh Univ. Press, Bethlehem / London / Toronto 1993, ISBN 0-934223-18-1.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Lexikon der Färbepflanzen auf digitalefolien.de, abgerufen am 7. Januar 2017.
- J. Scherkenbeck: Farbstoffe ( vom 8. Januar 2017 im Internet Archive) (PDF; 2,16 MB)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ DIN 55943. In: Deutsches Institut für Normung e. V. (Hrsg.): Farbmittel 1. 7. Auflage. DIN-Taschenbuch 49. Berlin, Wien, Zürich 2012, ISBN 978-3-410-23202-5, S. 509.
- ↑ a b c Wolfgang Glöckner, Walter Jansen, Rudolf G. Weißenhorn (Hrsg.): Handbuch der experimentellen Chemie Sekundarbereich II. Band 10, Aulis Verlag Deubner & Co. KG, Köln 2008, ISBN 978-3-7614-2388-2, S. 304–309.
- ↑ a b c Christian-Herbert Fischer: Historische Farbstoffe. In: Spektrum der Wissenschaft. Nr. 10, 1997, S. 104 ff.
- ↑ Ullmanns Enzyklopädie der Technischen Chemie. 4. Auflage. Band 11, Stichwort: Farbstoffe, natürliche. S. 103.
- ↑ Karl Aloys Schenzinger: Anilin. Zeitgeschichte-Verlag Berlin, 1937, OCLC 6866470.
- ↑ George B. Kauffman: Pittacal - The first synthetic dyestuff. In: Journal of Chemical Education. 54, 1977, S. 753, doi:10.1021/ed054p753.
- ↑ Karl Hübner: Historie: 150 Jahre Mauvein. In: Chemie in unserer Zeit. Band 40, Nr. 4, 2006, S. 274–275, doi:10.1002/ciuz.200690054.
- ↑ Hans Joachim Störig: Kleine Weltgeschichte der Wissenschaft 2. 4. Auflage. Fischer Taschenbuch, 1982, ISBN 3-596-26399-9, S. 136–137.
- ↑ a b Hermann Raaf: Organische Chemie im Probierglas. 13. Auflage, Kosmos Verlag, Stuttgart 1975, ISBN 3-440-04266-9, S. 186.
- ↑ Joachim Rudolf: Knauers Buch der modernen Chemie. Th. Knauer Nachf., München/Zürich 1975, ISBN 3-426-00381-3, S. 257–263.
- ↑ a b c 1865–1901: Das Zeitalter der Farben. basf.com, abgerufen am 9. November 2018.
- ↑ Renate Kaiser-Alexnat: Indigo – Der König der Farbstoffe. In: Südostasien Magazin. Ausgabe 3, 2008 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ernst Bäumler: Die Rotfabriker. R. Piper GmbH & Co. KG, München 1988, ISBN 3-492-10669-2.
- ↑ Unternehmensgeschichte Bayer AG, abgerufen am 8. November 2018
- ↑ Werner Abelshauser (Hrsg.): Die BASF: Eine Unternehmensgeschichte. 2. Auflage. C.H. Beck, München 2003, ISBN 3-406-49526-5 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Klaus Hunger (Hrsg.): Industrial Dyes: Chemistry, Properties, Applications. WILEY-VCH Verlag, Weinheim 2003, ISBN 978-3-662-01950-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ John Griffiths: Funktionelle Farbstoffe. Ein neuer Trend in der Farbstoffchemie. In: Chemie in unserer Zeit. Band 27, Nr. 1. Wiley-VCH Verlag, Weinheim 1993, S. 21–31, doi:10.1002/ciuz.19930270104.
- ↑ Funktionellen Farbstoffe – Von den Wurzeln der Farbstoffchemie bis hin zu HighchemProdukten. chemanager-online.com, abgerufen am 13. November 2018.
- ↑ K.Peter C. Vollhardt: Organische Chemie. VCH, Weinheim, 1. Auflage 1988, S. 618, ISBN 3-527-26912-6.
- ↑ Eintrag zu Cyanin-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. Februar 2019.
- ↑ Eintrag zu Triarylmethan-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Januar 2019.
- ↑ a b Heinrich Zollinger: Color Chemistry: Syntheses, Properties, and Applications of Organic Dyes and Pigments. 3. Auflage. WILEY-VCH Verlag, Weinheim 2003, ISBN 3-906390-23-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Schwefel-Farbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Januar 2019.
- ↑ Kirk-Othmer, Jacqueline I. Kroschwitz: Encyclopedia of Chemical Technology. 5. Ausgabe, Vol. 9, 2005, ISBN 978-0-471-48494-3, S. 349.
- ↑ Paul Rys, Heinrich Zollinger: Leitfaden der Farbstoffchemie. 2. Auflage, Verlag Chemie, Weinheim 1976, ISBN 3-527-25650-4, S. 181, 182.
- ↑ Eintrag zu Chromierungsfarbstoffe. In: Römpp Online. Georg Thieme Verlag, abgerufen am 23. Januar 2019.
- ↑ Jacob Herzfeld: Die Bleichmittel, Beizen und Farbstoffe. Eigenschaften, Prüfung und praktische Anwendung auf Baumwolle, Wolle, Seide, Halbwolle, Halbseide, Jute, Leinen, etc. 2. Auflage. Unikum Verlag, 1900, S. 55–96 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Bertram Philipp, Peter StevensGrundzüge der Industriellen Chemie. VCH Verlagsgesellschaft mbH, 1987, ISBN 3-527-25991-0, S. 321.
- ↑ Wittko Francke, Wolfgang Walter: Lehrbuch der Organischen Chemie. S. Hirzel Verlag, Stuttgart 2004, ISBN 3-7776-1221-9, S. 684 f.
- ↑ Verordnung (EG) Nr. 1333/2008 vom 16. Dezember 2008 über Lebensmittelzusatzstoffe (PDF), abgerufen am 5. August 2019.
- ↑ Zulassung und Verwendung von Lebensmittelzusatzstoffen. Bundesministerium für Ernährung und Landwirtschaft, abgerufen am 5. August 2019.
- ↑ H. Zollinger: Chemismus der Reaktivfarbstoffe. In: Angew. Chem. 73, Nr. 4, 1961, S. 125–136, doi:10.1002/ange.19610730402.
- ↑ a b c John Griffiths: Funktionelle Farbstoffe. Ein neuer Trend in der Farbstoffchemie. In: Chemie in unserer Zeit. 27, Nr. 1, 1993, S. 21–31, doi:10.1002/ciuz.19930270104.
- ↑ Klaus Roth: Die Chemie der schillernden Scheiben: CD, DVD & Co. In: Chemie in unserer Zeit. 41, Nr. 4, 2007, S. 334–345, doi:10.1002/ciuz.200700428.
- ↑ Hermann Rath: Lehrbuch der Textilchemie. einschl. der textilchemischen Technologie. 2. Auflage. Springer-Verlag, Berlin, Heidelberg 1963, ISBN 978-3-662-00065-6, S. 455 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Karl Winnacker, Leopold Küchler: Chemische Technik, Prozesse und Produkte. Band 7, Industrieprodukte, 5. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, 2004, ISBN 3-527-30772-9, S. 397 ff.












![Phthalocyanin (Aza[18]annulen)](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3f/Phtalocyanine_Aza%2818%29annulene.svg/201px-Phtalocyanine_Aza%2818%29annulene.svg.png)