„Methan“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K Bot: Korrektur der Wiki-Syntax nach phabricator:T101841 |
→Reisanbau und Rinderzucht: Beleg |
||
| Zeile 321: | Zeile 321: | ||
Etwa 70 % der mikrobiellen Methanemission der Erde ist auf menschliche Aktivitäten zurückzuführen. Die Methanemissionen in der [[Landwirtschaft]] und bei der [[Tierhaltung]] gehen zu 39 % auf die [[Rinderproduktion|Rinderhaltung]] und zu 17 % auf den [[Reis#Nassreisanbau|Nassreisanbau]] zurück. Die [[Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen|FAO]] schrieb 2006 dem Viehwirtschaftssektor ein knappes Fünftel der vom Menschen verursachten Treibhausgasemissionen zu, etwas mehr als dem Transportsektor.<ref name="fao" /> |
Etwa 70 % der mikrobiellen Methanemission der Erde ist auf menschliche Aktivitäten zurückzuführen. Die Methanemissionen in der [[Landwirtschaft]] und bei der [[Tierhaltung]] gehen zu 39 % auf die [[Rinderproduktion|Rinderhaltung]] und zu 17 % auf den [[Reis#Nassreisanbau|Nassreisanbau]] zurück. Die [[Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen|FAO]] schrieb 2006 dem Viehwirtschaftssektor ein knappes Fünftel der vom Menschen verursachten Treibhausgasemissionen zu, etwas mehr als dem Transportsektor.<ref name="fao" /> |
||
Die [[Archaeen|archaeellen]] [[Methanbildner]] sind für die ständige Neubildung von Methan verantwortlich. Ein [[Hausrind]] z. B. stößt täglich etwa 150–250 l Methan aus, weil im Rindermagen Methanogene an der Zersetzung von [[Cellulose]] beteiligt sind. Die Senkung der Methanemission von Kühen durch Futterzusätze wird intensiv erforscht.<ref name="DNKamra" /><ref name="MRGMaia" /><ref name="csiro" /><ref name="DOI10.1016/j.jclepro.2019.06.193" /> |
Die [[Archaeen|archaeellen]] [[Methanbildner]] sind für die ständige Neubildung von Methan verantwortlich. Ein [[Hausrind]] z. B. stößt täglich etwa 150–250 l Methan aus, weil im Rindermagen Methanogene an der Zersetzung von [[Cellulose]] beteiligt sind. Die Senkung der Methanemission von Kühen durch Futterzusätze wird intensiv erforscht.<ref name="DNKamra" /><ref name="MRGMaia" /><ref name="csiro" /><ref name="DOI10.1016/j.jclepro.2019.06.193" /><ref>{{Literatur |Autor=Breanna M. Roque, Marielena Venegas, Robert D. Kinley, Rocky de Nys, Toni L. Duarte |Titel=Red seaweed (Asparagopsis taxiformis) supplementation reduces enteric methane by over 80 percent in beef steers |Sammelwerk=PLOS ONE |Band=16 |Nummer=3 |Datum=2021-03-17 |ISSN=1932-6203 |DOI=10.1371/journal.pone.0247820 |Seiten=e0247820 |Online=https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0247820 |Abruf=2021-03-19}}</ref> |
||
==== Pflanzen ==== |
==== Pflanzen ==== |
||
| Zeile 354: | Zeile 354: | ||
== Einzelnachweise == |
== Einzelnachweise == |
||
<references responsive> |
<references responsive=""> |
||
<ref name="GESTIS">{{GESTIS|Name= |ZVG=10000|CAS=74-82-8|Datum=1. Februar 2016}}</ref> |
<ref name="GESTIS">{{GESTIS|Name= |ZVG=10000|CAS=74-82-8|Datum=1. Februar 2016}}</ref> |
||
<ref name="evans">{{Internetquelle |url=http://evans.rc.fas.harvard.edu/pdf/evans_pKa_table.pdf |titel=pKa's of Inorganic and Oxo-Acids |autor=D. H. Ripin, D. A. Evans |format=PDF |zugriff=2014-07-15|sprache =en}}</ref> |
<ref name="evans">{{Internetquelle |url=http://evans.rc.fas.harvard.edu/pdf/evans_pKa_table.pdf |titel=pKa's of Inorganic and Oxo-Acids |autor=D. H. Ripin, D. A. Evans |format=PDF |zugriff=2014-07-15|sprache =en}}</ref> |
||
Version vom 19. März 2021, 14:47 Uhr
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Methan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH4 | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchsloses Gas[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 16,04 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−162 °C[1] | |||||||||||||||
| pKS-Wert |
48[2] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Dipolmoment |
0[4] | |||||||||||||||
| Brechungsindex |
1,000444 (0 °C, 101,325 kPa)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 10000 ml·m−3 bzw. 6700 mg·m−3[7] | |||||||||||||||
| Treibhauspotential |
28 (bezogen auf 100 Jahre)[8] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−74,87 kJ·mol−1[9] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Methan ist eine chemische Verbindung mit der Summenformel CH4 und der einfachste Vertreter aus der Stoffgruppe der Alkane. Unter Normalbedingungen ist es ein farb- und geruchloses, brennbares Gas. Methan ist in Wasser unlöslich und bildet mit Luft explosive Gemische. Es verbrennt mit bläulich-heller Flamme in Gegenwart von ausreichend Sauerstoff zu Kohlenstoffdioxid und Wasser.
Es kommt in der Natur vor und ist der Hauptbestandteil von Erdgas. Da es in Lagerstätten in großen Mengen vorkommt, ist es eine attraktive Energiequelle. Der Transport erfolgt durch Pipelines oder als tiefgekühlte Flüssigkeit mittels Tankschiffen. Des Weiteren kommt es als Methanhydrat gebunden am Meeresboden und Permafrostgebieten vor, wobei der genaue Vorrat unbekannt ist. Methan dient als Heizgas und ist in der chemischen Industrie als Ausgangsstoff für technische Synthesen wie etwa der Methanolherstellung oder der Herstellung von halogenierten Methanderivaten von großer Bedeutung. Es wird weiterhin zur Herstellung von Wasserstoff im großindustriellen Maßstab verwendet.
Das Gas entsteht in beträchtlichen Mengen durch biologische Prozesse, entweder anaerob durch Mikroorganismen oder aerob durch Phytoplankton, Pflanzen und Pilze. Anthropogene Quellen sind etwa der Reisanbau und die Rinderzucht. Abiotische Quellen wie Waldbrände oder Vulkanausbrüche setzen ebenfalls Methan frei.
Methan ist der meist vertretene Kohlenwasserstoff in der irdischen Atmosphäre, wobei die Konzentration sowohl zwischen der Nord- und Südhalbkugel als auch jahreszeitlich schwankt. Als Treibhausgas besitzt Methan ein hohes Treibhauspotential. Es trug zur klimageschichtlichen Erderwärmung bei und beeinflusst die aktuelle globale Erwärmung. In der Erdatmosphäre wird es zu Wasser, Formaldehyd und schließlich zu Kohlenstoffdioxid oxidiert. Methan ist Bestandteil der Atmosphäre anderer Planeten und Monde und wurde sowohl in Kometen als auch im interstellaren Medium nachgewiesen.
Geschichte

Bevor es ein Verständnis dafür gab, was Methan ist, trat es als Bestandteil von Erdgas gespeisten „Ewigen Feuern“, etwa in Chimaira (Lykien), in Erscheinung. Bereits seit 2000 v. Chr. sind diese Feuer bekannt. Bei dem ewigen Feuer in Baba Gurgur im Irak handelt es sich möglicherweise um den Feuerofen, der bereits in der Bibel im Buch Daniel beschrieben ist und in den König Nebukadnezar Daniels Begleiter Shadrach, Meshach, und Abednego warf, weil sie sich weigerten, eine goldene Statue anzubeten (Dan 3,23 EU).[10]
Methan als Bestandteil des Erdgases wurde bereits im 4. Jahrhundert vor Christus in China energetisch zum Eindampfen von Salzsole verwendet. Zum Teil traten aus den Bohrlöchern sowohl Methan als auch Sole aus, zum Teil wurde das Gas mittels Bambuspipelines von sogenannten trockenen Bohrlöchern aus zur Soleverarbeitung herangeführt.[11]
Über die Natur des Gases war damals noch nichts bekannt, aber es war den Alchemisten im Mittelalter bekannt als Bestandteil von Fäulnisgasen, auch als „Sumpfluft“ bezeichnet. Im Februar 1659 untersuchte der Engländer Thomas Shirley bei Wigan eine Quelle mit brennbarem Wasser. Er konnte zeigen, dass nicht das Wasser, sondern ein Gas, das vom Boden des aufgestauten Wassers aufstieg, das Phänomen verursachte. Er vermutete, dass das Gas aus einer darunterliegenden Kohlelagerstätte stammte und dass es Grubengas war.[12] Das Auftreten von Schlagwettern, einem Gasgemischen aus Methan und Luft, war im Untertagebau schon früh als Gefahr bekannt, da eine Zündquelle eine Schlagwetterexplosion auslösen konnte.
Der italienische Physiker Alessandro Volta entdeckte Methan 1776 in den Sümpfen des Lago Maggiore, angeregt durch einen Aufsatz von Benjamin Franklin über „entflammbare Luft“. Volta sammelte das aus dem Sumpf aufsteigende Gas und isolierte bis 1778 das reine Gas.[13] Marcellin Berthelot stellte Methan 1856 zum ersten Mal aus Kohlenstoffdisulfid und Schwefelwasserstoff her.
Der Name Methan leitet sich von Méthylène her. Dies war der erste Name, den die französischen Chemiker Jean-Baptiste Dumas und Eugène-Melchior Péligot 1834 der Flüssigkeit, die heute als Methanol bezeichnet wird, gaben. Sein Name setzt sich aus altgriechisch méthy (altgriechisch μέθυ) für berauschendes Getränk oder Wein und hylé (altgriechisch ὕλη) für Holz zusammen.[14] Der deutsche Chemiker August Wilhelm von Hofmann schlug 1866 in einer englischen Veröffentlichung erstmals eine systematische Nomenklatur vor, wonach der Name für das Gas sich von Methylene ableitete und Methane genannt werden sollte.[15] Daraus entstand die deutsche Form Methan. In alten Texten wurde Methan gelegentlich als Methylwasserstoff bezeichnet.
Mit Beginn der Erdölförderung wurde Methan als Hauptbestandteil des gleichzeitig geförderten Erdgases meist am Bohrlochkopf abgefackelt. Mit steigendem globalem Energiebedarf wurde Methan ein stetig wachsender Faktor der Weltprimärenergieproduktion. Zwischen 1980 und 1990 stieg der Anteil von etwa 18 auf etwa 22 %.[16]
Vorkommen
Irdisch

Methan war neben Ammoniak und Wasserdampf ein Hauptbestandteil der irdischen Uratmosphäre. Es kommt vielfältig vor und wird auf der Erde ständig neu gebildet, etwa bei technischen, biologischen oder geologischen Prozessen wie der Serpentinisierung.[18] [19] Die Methankonzentration in der Erdatmosphäre hat sich vom Jahr 1750 bis zum Jahr 2018 von 0,73 auf 1,869 ppm mehr als verdoppelt und damit den höchsten Wert seit 800.000 Jahren erreicht.[20]
In der Atmosphäre reagiert Methan mit Sauerstoff zunächst zu Formaldehyd und gegebenenfalls zu Ozon.[21] Durch weitere Oxidation entsteht schließlich Kohlenstoffdioxid.
Oberflächennah
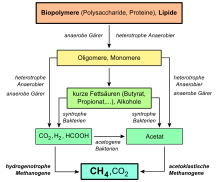
Mikroorganismen bilden einen großen Teil des terrestrischen Methans. Beim Faulen organischer Stoffe unter Luftabschluss in Sümpfen oder im Sediment auf dem Grund von Gewässern bildet sich Sumpfgas, ein Gemisch aus Methan und Kohlenstoffdioxid. Biogas enthält etwa 60 % Methan und etwa 35 % Kohlenstoffdioxid, neben geringeren Mengen Wasserstoff, Stickstoff und Schwefelwasserstoff.
Die Bildung erfolgt oberflächennah biotisch: einerseits anaerob im Zuge der Methanogenese aus Kohlenstoffdioxid und Acetat durch eine Gruppe von Archaeen, den Methanogenen. Sie nutzen einfache Verbindungen wie Kohlenstoffdioxid oder Methanol und reduzieren diese zu Methan, wobei sie Energie gewinnen. Beispielsweise werden bei der Bildung von Methan aus CO2 und Wasserstoff (H2) unter Standardbedingungen bei einem pH-Wert von sieben etwa 131 kJ/mol an Freier Enthalpie (Gibbs-Energie, ΔG0’) freigesetzt:[22]
Ein kleiner Teil der biotischen Entstehung basiert auf der aeroben Spaltung von Methylphosphonaten.[23][24]
Unterirdisch

Unterhalb der Oberfläche der Erde entsteht Methan im tieferen Untergrund bei hohen Temperaturen und Drücken und wird meist bei vulkanischen Aktivitäten frei. Als Bestandteil des Erdgases schwankt seine Konzentration je nach Lagerstätte zwischen 35 und 98 %. Andere Erdgasbestandteile können höhere Kohlenwasserstoffe, besonders Ethan sein, sowie Kohlenstoffdioxid und Stickstoff. Das meist zusammen mit Erdöl auftretende „Naßgas“ enthalten Kohlenwasserstoffe wie Pentan, Hexan, Heptan und noch höhere Kohlenwasserstoffe, während „trockenes“ Erdgas Methan als Hauptbestandteil enthält. Das in Steinkohlelagern eingeschlossene Grubengas enthält hauptsächlich Methan.[25]
Es kann abiotisch thermal im Rahmen des Reifeprozesses von Kohle in der geochemische Phase der Inkohlung, sowie aus allen Typen von Kerogenen und Erdöl entstehen.[26] 2008 wurde nachgewiesen, dass Methan aus den Lost-City-Hydrothermalquellen geochemischen Ursprungs ist.[18]
Methanhydrat
Methan, das am Meeresgrund austritt, reagiert unter hohem Druck und niedriger Temperatur mit Wasser zu festem Methanhydrat, das auch als „Methaneis“ bezeichnet wird. Der Kohlenstoffgehalt der weltweiten Methanhydratvorkommen wurde Ende der 1980er Jahre etwa 11.000 Gigatonnen geschätzt, der Kohlenstoffgehalt der nachgewiesenen Erdgas, Kohle- und Ölreserven beträgt etwa 5000 Gigatonnen.[27] Neuere Schätzungen gehen von wesentlich geringeren Vorkommen aus, wobei die Vorkommen auf etwa 1800 Gigatonnen Kohlenstoff geschätzt werden.[28][29][30]
Außerirdisch
| Planet | Anteil |
|---|---|
| Erde | 1,86 ppm |
| Mars | 0,0105 ppm |
| Jupiter[31] | 2000 ppm |
| Saturn | 4500 ± 2000 ppm |
| Uranus[32] | 20–40.000 ppm |
| Neptun | 15.000 ± 5000 ppm |
Die Atmosphären der Planeten Mars, Jupiter, Saturn, Uranus, Neptun und des Zwergplaneten Pluto enthalten ebenfalls Methan, ebenso die Atmosphären von Monden wie Titan oder Enceladus.[33] Nach Wasserstoff und Helium ist Methan die dritthäufigste Komponente der Uranusatmosphäre. Durch dessen Absorptionsbanden im roten Bereich und im nahen Infrarot erscheint Uranus aquamarin oder cyanfarben. Die etwas helleren blauen Farbtöne des Saturns sind wahrscheinlich auf denselben Effekt zurückzuführen.[34]
Außerhalb unseres Sonnensystems ist Methan als erstes organisches Molekül auf dem Exoplaneten HD 189733 b vom Typ Hot Jupiter nachgewiesen worden.[35] Die Absorptionsspektren von kühlen Braunen Zwergen, die auch als Methan-T-Zwerge bezeichnet werden, werden von Methan und Wasser dominiert. Daneben gibt es heißere, sogenannte L-Zwerge, die ebenfalls Methanabsorptionsmerkmale aufweisen, die jedoch schwächer sind als die der T-Zwerge.[36]
Mars
2009 wurde über Methaneruptionen auf dem Mars berichtet; in der Atmosphäre des Mars wurde Methan nachgewiesen, etwa 10,5 ppb.[37] Da es sich normalerweise nicht in der Atmosphäre halten kann und es keine Hinweise auf Meteoriten als Quelle gibt, muss es auf dem Planeten neu gebildet worden sein, was ein Indiz für Leben auf dem Mars sein könnte.[38] Das Methan könnte vulkanischen Ursprungs sein, wofür auf dem Mars noch keine Hinweise gefunden wurden.
Titan

Auf dem Saturnmond Titan herrscht bei −180 °C und etwa 1,6 Bar Atmosphärendruck fast der Tripelpunkt des Methans. Methan kann deshalb auf diesem Mond in allen drei Aggregatzuständen auftreten. Es gibt Wolken aus Methan, aus denen Methan regnet, das durch Flüsse, darunter der Vid Flumina, in Methanseen fließt, dort wieder verdunstet und so einen geschlossenen Methankreislauf bildet, analog zum Wasserkreislauf auf der Erde. Flüssiges Methan ist für Radarstrahlen durchsichtig, so konnte die Raumsonde Cassini die Tiefe des Sees Ligeia Mare zu 170 m bestimmen.[39]
Wahrscheinlich gibt es auf diesen Seen Eisberge aus Methan und Ethan. Diese schwimmen auf den Methanseen, wenn sie mindestens 5 % gasförmigen Stickstoff enthalten. Wenn die Temperatur nur geringfügig sinkt, zieht sich der Stickstoff soweit zusammen, dass das Eis zum Grund hinabsinkt. Steigt die Temperatur wieder, kann das Grundeis wieder zur Seeoberfläche aufsteigen. Bei bestimmten Temperaturen kann Oberflächen- und Grundeis gleichzeitig vorkommen.[40][41] Für den Ontario Lacus, einen See nahe dem Südpol des Titan, wurde als Hauptbestandteil Ethan nachgewiesen.
Gewinnung und Darstellung
Gewinnung als Erdgas
Im 19. Jahrhundert trat Methan zunächst als unerwünschtes Nebenprodukt der Erdölförderung auf. Da es zu dieser Zeit keine genügenden Transport- und Speichermedien für die geförderten Mengen gab, wurde es meist einfach in Gasfackeln verbrannt. Diese Methode wird noch in der heutigen Zeit angewandt, falls es keine kommerziell einträglichen Alternativen gibt. Zum Teil wird das Gas wieder zurück in die Erde gepresst. Alternativ kann es durch Abkühlung verflüssigt werden und als Flüssigerdgas transportiert werden.[42]
Gewinnung als Biogas
Biogas ist ein Gasgemisch, das bei der Zersetzung organischer Materie in Abwesenheit von Sauerstoff entsteht und zu etwa zwei Dritteln aus Methan und zu einem Drittel aus Kohlenstoffdioxid besteht.[43] Biogas wird von Methanbildner durch Methanogenese von landwirtschaftlichen und Grünabfällen, Abwässern, Lebensmittelabfällen sowie Abfällen aus der Viehzuchtindustrie gebildet und gilt als erneuerbare Energiequelle. Das in Biogasanlagen erzeugte Methan kann etwa als Brennstoff verwendet werden.[44]
Gewinnung aus Methanhydrat
Eine Gewinnung des Methanhydrats könnte zur Lösung irdischer Energieprobleme beitragen, ist jedoch problematisch. Ein besonderes Problem besteht zum Beispiel darin, dass bei der Bergung viel Methan in die Erdatmosphäre gelangen würde und dort als sehr wirksames Treibhausgas zu einer weiteren Erwärmung und damit weiterer Freisetzung von Methan beitragen würde. Außerdem ist die Förderung von Methanhydrat nicht ungefährlich. Erste Förderversuche sind bereits im Gange. Die Folgen eines Raubbaus sind weitgehend ungeklärt; Forscher befürchten das Abrutschen der Kontinentalhänge, die zu großen Teilen aus Methaneis, das durch die Förderung instabil werden könnte, bestehen. Wegen der globalen Erwärmung und der damit verbundenen Meerwassererwärmung befürchten einige Forscher das Schmelzen und Verdampfen des Methanhydrats. Das würde zusätzlich Methan als Treibhausgas in die Erdatmosphäre bringen und den anthropogenen Treibhauseffekt verstärken. Die Freisetzung von Methan aus tauenden Permafrostböden ist ein weiteres Kippelement des Klimawandels.[45]
Methanisierung
Die Methanisierung oder Sabatier-Prozess ist ein Prozess zur Erzeugung von synthetischem Erdgas. Dabei werden Kohle oder andere Kohlenstoff-haltige Materialien durch Kohlevergasung in Kohlenstoffmonoxid oder Kohlenstoffdioxid konvertiert, welche mit Wasserstoff katalytisch zu Methan umgesetzt werden. Diese Reaktion wurde im 19. Jahrhundert vom Franzosen und Nobelpreisträger Paul Sabatier entdeckt und nach ihm benannt.[46]
- .
- .
Laborsynthesen
Für die Herstellung aus Aluminiumcarbid gibt es zwei Methoden, sie werden meist nur im Labor eingesetzt.[47] Eine weitere Quelle für die Darstellung im Labormaßstab bietet die thermische Zersetzung von Natriumacetat.
Eigenschaften
Physikalische Eigenschaften
Methan schmilzt bei −182,6 °C und siedet bei −161,7 °C. Aufgrund der unpolaren Eigenschaften ist es in Wasser kaum löslich, in Ethanol und Diethylether löst es sich jedoch gut. Schmelzwärme und Verdampfungswärme betragen 1,1 kJ/mol und 8,17 kJ/mol. Der Heizwert Hi liegt bei 35,89 MJ·m−3 beziehungsweise 50,013 MJ kg−1. Die Standardentropie beträgt 188 J·mol−1·K−1, die Wärmekapazität 35,69 J·mol−1·K−1. Der Tripelpunkt von Methan liegt bei 90,67 K und 0,117 bar, der kritische Punkt liegt bei 190,56 K und 45,96 bar.
Festes Methan existiert in mehreren Modifikationen, zurzeit sind neun verschiedene bekannt.[48] Bei der Abkühlung von Methan bei normalem Druck entsteht Methan I. Dabei handelt es sich um einen kubisch kristallisierenden Stoff Raumgruppe Fm3m (Raumgruppen-Nr. 225). Die Positionen der Wasserstoffatome sind nicht fixiert, das heißt, die Methanmoleküle können frei rotieren. Deshalb handelt es sich um einen plastischen Kristall.[49]
Molekulare Eigenschaften
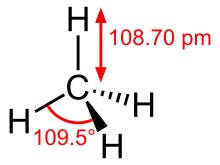
Die Kohlenstoff-Wasserstoff-Bindung ist rein kovalent. Der Kohlenstoff ist sp3–hybridisiert, die Wasserstoffatome sind tetraedrisch am Kohlenstoffatom angeordnet. Die Länge der C–H-Bindung beträgt 108,7 Picometer (pm). Der H–C–H-Bindungswinkel beträgt 109,5°. Methan besitzt Tetraedersymmetrie und gehört zur Punktgruppe .
Die mittels Infrarot- und Raman-Spektroskopie gewonnenen Messergebnisse stimmen mit einer Tetraedersymmetrie überein. Es gibt vier Molekülschwingungen bei etwa 2914, 1534, 3018 und 1306 cm−1, die mit ν1, ν2, ν3 und ν4 bezeichnet werden. Die Schwingungen ν2 (nur bei Wechselwirkungen mit anderen Molekülen, das heißt Symmetriestörung), ν3 und ν4 sind infrarotaktiv.[50][51]
Chemische Eigenschaften
Im Vergleich zu anderen Alkanen weist die C-H-Bindung im Methan eine höhere Bindungsenergie auf. In Reaktionen mit radikalischer Abstraktion des Wasserstoffatoms ist Methan gewöhnlich das am wenigsten reaktive Alkan. Das Methylkation (CH3+) ist das instabilste Carbeniumion. Daher ist Methan in Reaktionen unter Hydrid-Abstraktion ebenfalls wenig reaktiv. In Elektronentransferreaktionen reagiert Methan aufgrund seines hohen Ionisierungspotentials meist träge.[16] Mit Eisen-, Kupfer- oder Aluminiumatomen reagiert photochemisch angeregtes Methan in einer Methanmatrix bei tiefen Temperaturen unter Insertion des Metalls in die H–C-Bindung unter Bildung eines Metallkomplexes wie etwa H–Fe–CH3.[52]
Methan ist stabil gegenüber herkömmlichen Säuren und Laugen. Mit Supersäuren wie Hexafluorantimonsäure lässt sich Methan zum Methaniumion (CH5+) protonieren. Der Name Methanium wurde in Analogie zum Ammoniumion gewählt.[53] Mit Oxidationsmitteln wie Kaliumpermanganat oder Kaliumdichromat lässt es sich nicht oxidieren. Mit Oxidationsmitteln wie Peroxodisulfaten oder Cer(IV)-Salzen bildet Methan in Schwefelsäure einen Monomethylester (CH3-OSO3H).[54]
Methan ist brennbar und verbrennt an der Luft mit bläulicher, nicht rußender Flamme. Aus der Reaktion eines Methanmoleküls mit zwei Sauerstoffmolekülen entstehen zwei Wasser- und ein Kohlenstoffdioxidmolekül. Es kann explosionsartig mit Sauerstoff oder Chlor reagieren, wozu eine Initialzündung (Zufuhr von Aktivierungsenergie) oder Katalyse erforderlich ist.
Mit Sauerstoff geht Methan unterschiedliche Reaktionen ein, je nachdem wie viel Sauerstoff für die Reaktion zur Verfügung steht. Nur bei genügend großem Sauerstoffangebot ist eine vollständige Verbrennung des Methans mit optimaler Energieausbeute möglich.[55]
Bei ungenügender Sauerstoffzufuhr hingegen entstehen Nebenprodukte wie Kohlenstoffmonoxid (CO) und Kohlenstoff (Ruß). Ferner ist in diesem Fall die Nutzenergie geringer.
Mit Chlor und Brom geht Methan unter Lichteinfluss Substitutionsreaktion ein, wobei die Wasserstoffatome durch Halogenatome ersetzt werden. Bei einer solchen Reaktion kommt es oft zu Mehrfachsubstitutionen, da das zunächst gebildete monohalogenierte Produkt tendenziell schwächere H-C-Bindungen aufweist als Methan selbst und daher selektiv weiter oxidiert wird. Iodverbindungen lassen sich durch Halogenaustausch herstellen.
Mit Dampf bildet sich bei hohen Temperaturen und unter Katalyse Wasserstoff, Kohlenstoffmonoxid und Kohlenstoffdioxid. Diese sogenannte Dampfreformierung ist der technische Prozess, mit dem technisch Wasserstoff und Synthesegas hergestellt werden.
Bei Temperaturen von etwa 2000 °C bildet sich bei schneller Abkühlung Ethin. Ohne Abkühlung zerfällt Methan ab etwa 1100 °C in die Elemente. Bei einer Temperatur von etwa 1200 °C reagiert Methan mit Ammoniak zu Cyanwasserstoff und Wasserstoff.
Verwendung
Methan wird vorwiegend als Heizgas zur Wärmeerzeugung und zum Betrieb von Motoren durch Verbrennung genutzt. Neben Methan aus Erdgas wird zu diesem Zweck Biogas (Biomethan) mit einem Methangehalt von etwa 50 bis 70 % aus Mist, Gülle, Klärschlamm oder organischem Abfall gewonnen. Früher wurde Methan durch Pyrolyse von Holz gewonnen, bei der Holzgas entsteht (Holzvergasung). Holzgas, das unter anderem Methan enthält, diente wegen des Erdölmangels im Zweiten Weltkrieg zum Betrieb von zivilen Automobilen. Die aufheizenden Holzvergaser wurden meist außen angebaut. Rohes Biogas aus Abwasserreinigungsanlagen wird heute oft direkt mit Verbrennungsmotoren in Strom umgewandelt.
Verwendung als Brenn- und Kraftstoff
Durch das hohe Verhältnis von Wasserstoff zu Kohlenstoff im Methan wird bei der Verbrennung eine größere Menge an Energie pro freigesetztem Kohlenstoffdioxidmolekül geliefert als von flüssigen Kohlenwasserstoffen auf Basis von Erdöl, deren ungefähres Verhältnis von Wasserstoff zu Kohlenstoff etwa zwei beträgt oder von Kohle mit einem ungefähren Wasserstoff zu Kohlenstoffverhältnis von eins.
Ein Problem bei Verwendung von Methan als Alternativer Kraftstoff in Motoren ist der Methanschlupf, etwa 2 % des Methans werden nicht verbrannt und treten als umweltschädliches Klimagas in die Atmosphäre. Methanbasierte Kraftstoffe haben ein geringeres Versauerungs- und Eutrophierungspotential sowie geringere Effekte auf die menschliche Gesundheit als Dieselkraftstoff. Dies ist auf die geringeren Stickoxidemissionen bei der Verbrennung zurückzuführen.[56]
Verwendung als Chemierohstoff
Methan dient als wichtiges Ausgangsprodukt für die technische Synthese von Ethin, Cyanwasserstoff, Schwefelkohlenstoff, Halogenalkane und viele andere organische Verbindungen.
Dampfreformierung und partielle Oxidation

Sekundärreformer, CO-Konvertierung,
Waschturm).
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Folgeprodukte der Dampfreformierung von Methan (Auswahl). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Die Dampfreformierung, die partielle Oxidation und die Wassergas-Shift-Reaktion sind großtechnische durchgeführte Reaktionen. Das zunächst entstehende Produkt der Dampfreformierung ist ein als Synthesegas bezeichnet Gasgemisch, das unter anderem für die Produktion von Methanol verwendet wird.
Die partielle Oxidation von Methan wird ebenfalls als katalytisches Verfahren durchgeführt. Dabei reagiert Methan mit Sauerstoff in einer exothermen Reaktion zu Kohlenstoffmonoxid und Wasserstoff. Der Energiebedarf der partiellen Oxidation ist daher geringer ist als bei der Dampfreformierung, erfordert jedoch den Einsatz von reinem Sauerstoff als Reaktand. Weiterhin besteht die Gefahr einer Explosion bei instabilen Prozessbedingungen.[57]
Eine Kombination beider Prozesse, bei der die partielle Oxidation den Energiebedarf der Dampfreformierung deckt, wird Autothermale Reformierung genannt.[57]
Ist Wasserstoff das Zielprodukt, wird das entstandene Kohlenstoffmonoxid mit weiterem Wasser in einem sogenannten Sekundärreformer einer Wassergas-Shift-Reaktion zu Kohlenstoffdioxid und weiterem Wasserstoff umgesetzt.[58] Als Katalysatoren dienen Eisen(III)-oxid-Kontakte.
Der im Jahr 2010 hergestellte Wasserstoff wurde zu 98 % durch Dampfreformierung hergestellt.[59] Die Folgeprodukte der Dampfreformierung und der partiellen Oxidation sind vielfältig. Je nach Kohlenstoffmonoxid zu Wasserstoffverhältnis wird das Synthesegas zur Methanolherstellung oder zur Hydroformylierung von Olefinen eingesetzt.[60][61] Reiner Wasserstoff wird zur Produktion von Ammoniak im Haber-Bosch-Verfahren oder für Hydrierungen eingesetzt.
Thermokatalytische Zersetzung
Bei den genannten drei Verfahren fällt entweder Kohlenstoffmonoxid oder Kohlenstoffdioxid als weiteres Produkt an.[59] Eine Kohlenstoffdioxid-freie Route zu Wasserstoff besteht in der thermischen oder thermokatalytischen Zersetzung von Methan in Kohlenstoff und Wasserstoff.[59] Die Herstellung von Wasserstoff aus Methan unter Abtrennung von Kohlenstoff bietet einen Weg, Energie aus Wasserstoff durch Verbrennung oder in Brennstoffzellen ebenfalls ohne Kohlenstoffdioxid zu erzeugen.
Als Katalysator dient Nickel, der entweder als Netz oder als Nickelsalz auf verschiedenen Trägern eingesetzt werden kann. Gegenüber dem rein thermischen Zerfall, der bei etwa 1200 °C stattfindet, liegt das Temperaturniveau der thermokatalytischen Zersetzung bei etwa 500 bis 600 °C.
Herstellung von Ethin
Herstellung von Kohlenstoffdisulfid
Methan geht außer mit Sauerstoff noch vielfältige weitere Reaktionen ein. Viele davon sind sehr wichtig für die chemische Industrie, da die Produkte von großer technischer Bedeutung sind.
Cyanwasserstoff
Bei der Reaktion von Methan mit Ammoniak entsteht als Hauptprodukt Cyanwasserstoff.
- Methan reagiert mit Ammoniak und Sauerstoff an einem Platinkatalysator zu Blausäure und Wasser.
Halogenmethane
Die Chlorierung von Methan kann katalytisch, thermisch oder photochemisch erfolgen. Bei der Chlorierung nach allen drei Prozessen entstehen neben Chlormethan auch die höhere chlorierten Produkte Dichlormethan, Chloroform und Tetrachlormethan. Die höher substituierten Produkte entstehen bereits zu Beginn der Reaktion, wenn noch genügend unreagiertes Methan vorliegt. Die Reaktion ist stark exotherm mit etwa 100 Kilojoule pro Substitutionsreaktion:
- mit ΔRH = −103,5 kJ·mol−1
- mit ΔRH = −102,5 kJ·mol−1
- mit ΔRH = −99,2 kJ·mol−1
- mit ΔRH = −94,8 kJ·mol−1
- Methan reagiert mit Chlor unter Bildung von Chlorwasserstoff zunächst zu Chlormethan, und weiter zu Dichlormethan, Trichlormethan (Chloroform) und schließlich Tetrachlormethan.[62]
Die Photochlorierung von Methan läuft bei Belichtung unter Beteiligung von Methyl- und Chlorradikalen als Kettenträger nach dem folgenden Schema ab:
Höherhalogenierte Produkte entstehen nach dem selben Schema, wobei die gezielte Synthese von Chloroform bevorzugt über die Chlorierung von Aceton und die Synthese von Tetrachlormethan über die Chlorierung von Kohlenstoffdisulfid erfolgt.
Die chlorierten Methanderivate finden vielfältige industrielle Anwendung. Methylchlorid wird zue Herstellung von Methylzellulose verwendet, früher wurde es zur Herstellung von Tetramethylblei verwendet. Dichlormethan wird vor allem als Lösungsmittel verwendet. Brommethan wird in der Schädlingsbekämpfung zu Bodenbegasung und Begasung von Transportbehältern eingesetzt.
Biologische Bedeutung
Methan wird durch bestimmte Bakterien in Gewässern und Böden mit Sauerstoff (O2) zu Kohlenstoffdioxid und Wasser oxidiert. Diese Umsetzung ist exergon und die Bakterien nutzen sie als Energiequelle, weshalb sie zu den methanotrophen Mikroorganismen zählen.
In den Höhlen und unterirdischen Flüsse der Halbinsel Yucatán wurde entdeckt, dass dort Methan die treibende Kraft für das dortige Leben ist. Das im Wasser gelösten Methan wird durch Bakterien umgewandelt und stellt die Grundlage des dortigen Nahrungsnetzes. Die dort lebenden Krebstiere beziehen bis zu 21 % ihrer Nahrung aus Methan.[63]
Umweltrelevanz

Methan könnte als Treibhausgas vor etwa 252 Mio. Jahren das größte Massenaussterben des Phanerozoikums mit verursacht habe. Der Anstieg seiner Konzentration in der Erdatmosphäre in der Moderne ist einer der Aspekte des Anthropozäns. Laut zweier Studien des Global Carbon Project stammten 2017 mehr als 60 % der Methan-Emissionen aus der menschlichen Wirtschaft.[64]
Atmosphärenchemie
Da das farb- und geruchlose Gas eine geringere Dichte als Luft aufweist, steigt es in die höheren Schichten der Erdatmosphäre auf. Dort wirkt es als Treibhausgas, wobei es 20- bis 30-mal wirkungsvoller ist als Kohlenstoffdioxid, wobei es in viel geringeren Mengen als dieses in der Atmosphäre vorkommt. In einer sauerstoffhaltigen Atmosphäre wird Methan langsam oxidiert, insbesondere durch Hydroxyl-Radikalen zu Kohlenstoffdioxid und Wasser. Dieser Prozess ist langsam, die Halbwertszeit wird auf 12 Jahre geschätzt.[8][65] Laut anderen Schätzungen beträgt die atmosphärische Verweildauer 9–15 Jahre und ist verglichen mit anderen Treibhausgasen kurz.
Treibhauspotenzial
Sein Treibhauspotenzial ist dabei, auf einen Zeitraum von 100 Jahren bezogen, 28-mal höher als das der gleichen Gewichtsmenge Kohlenstoffdioxid. Nach einer neueren Untersuchung beträgt dieser Faktor 33, wenn Wechselwirkungen mit atmosphärischen Aerosolen berücksichtigt werden.[8][66] Auf einen Zeitraum von 20 Jahren bezogen steigt dieser Faktor auf 84. Methan trägt rund 20 % zum anthropogenen Treibhauseffekt bei.
Methanquellen

Die Methankonzentrationen stiegen zwischen 2000 und 2006 jährlich um etwa 0,5 ppb, seit 2006 mit einer mehr als zehnfach höheren Rate.[67] Damit ist weit mehr Methan in der Erdatmosphäre als jemals während der letzten 650.000 Jahre.[68] Eine im Februar 2020 erschienene Studie von Forschern der University of Rochester sieht starke Indizien dafür, dass rund zehnmal weniger Methan auf natürliche Weise aus geologischen Quellen austritt als bislang angenommen. Im Umkehrschluss hat die Förderung fossiler Energien (Öl, Gas und Kohle) einen deutlich höheren Anteil an den Methanemissionen.[69]
Jährlich werden auf der Erde etwa 600 Millionen Tonnen Methan emittiert. In Deutschland sank die Emission zwischen 1990 und 2018 von 121,2 Millionen Tonnen auf etwa 52,6 Millionen Tonnen CO2-Äquivalent.[70]
Anfang 2014 berichtete das Forschungsmagazin Science nach einer Meta-Studie von über 200 Studien, dass die US-amerikanische Umweltschutzbehörde Environmental Protection Agency (EPA) den Methangas-Ausstoß in den USA seit 20 Jahren um ein bis drei Viertel zu gering angegeben habe. In den USA wurden jährlich 40 Mio. Tonnen mehr in die Atmosphäre emittiert als bisher offiziell angenommen, sowohl aus natürlichen Quellen wie auch aus der Viehhaltung von beispielsweise 88 Millionen Rindern im Land sowie aus Lecks in Förderanlagen und Pipelines. Unklar ist bislang, wieweit die fehlerhaften Angaben Einfluss auf die Rechenmodelle zur Entwicklung des Weltklimas haben.[71]
Hydraulic Fracking
Dieser rasante Anstieg könnte mit der Förderung von Schiefergas durch Hydraulic Fracturing (Fracking) zusammenhängen.[72][73] Laut einer 2020 veröffentlichten Studie emittieren Fracking-Anlagen doppelt so viel Methan wie zuvor geschätzt.[74]
Permafrost
Die Freisetzung von Methan aus Permafrost und vom Meeresboden ist eine mögliche Folge und eine weitere Ursache für die globale Erwärmung.[75]
Öl- und Kohlegewinnung und Transport
Durch nicht bemerkte Lecks in Raffinerien und beim Transport von Öl und Gas durch Pipelines werden erhebliche Mengen Methan emittiert. Die Internationale Energieagentur (IEA) in Paris schätzt diese Menge Ende 2017 auf rund 75 Mio. Tonnen pro Jahr und damit 1,7 % der Gesamtfördermenge.[76]
Studien deuten darauf hin, dass die Methan-Emissionen aus Kohleminen stark unterschätzt wurden.[77] So wurde 2014 in der Gegend um Four Corners durch Satellitendaten eine gewaltige Methanemission aus nahe gelegenen Kohleabbaustätten detektiert.[78] Mit geschätzten 600.000 Tonnen Methan pro Jahr sind die Emissionen größer als die der gesamten britischen Öl-, Gas- und Kohleindustrie.[79]
Reisanbau und Rinderzucht
Etwa 70 % der mikrobiellen Methanemission der Erde ist auf menschliche Aktivitäten zurückzuführen. Die Methanemissionen in der Landwirtschaft und bei der Tierhaltung gehen zu 39 % auf die Rinderhaltung und zu 17 % auf den Nassreisanbau zurück. Die FAO schrieb 2006 dem Viehwirtschaftssektor ein knappes Fünftel der vom Menschen verursachten Treibhausgasemissionen zu, etwas mehr als dem Transportsektor.[80]
Die archaeellen Methanbildner sind für die ständige Neubildung von Methan verantwortlich. Ein Hausrind z. B. stößt täglich etwa 150–250 l Methan aus, weil im Rindermagen Methanogene an der Zersetzung von Cellulose beteiligt sind. Die Senkung der Methanemission von Kühen durch Futterzusätze wird intensiv erforscht.[81][82][83][84][85]
Pflanzen
Neue Erkenntnisse zeigen, dass Pflanzen ständig Methan produzieren und so seit jeher zum Methangehalt der Atmosphäre beitragen.[86]
Toxikologie
Methan wird bei tiefen Temperaturen flüssig gelagert, weil die Dichte dadurch enorm erhöht werden kann. Aus diesem Grund kann es beim Austritt dieses gekühlten Methans leicht zu Erfrierungen kommen. Methan ist ungiftig, die Aufnahme von Methan kann zu erhöhter Atemfrequenz (Hyperventilation) und erhöhter Herzfrequenz führen, es kann kurzzeitig niedrigen Blutdruck, Taubheit in den Extremitäten, Schläfrigkeit, mentale Verworrenheit und Gedächtnisverlust auslösen, alles hervorgerufen durch Sauerstoffmangel. Methan führt nicht zu bleibenden Schäden.[87] Wenn die Symptome auftreten, sollte das betroffene Areal verlassen und tief eingeatmet werden, falls daraufhin die Symptome nicht verschwinden, sollte die betroffene Person in ein Krankenhaus gebracht werden.
Sicherheitsaspekte

Methan bildet bei einem Volumenanteil zwischen 4,4 und 16,5 % in Luft explosive Gemische. Durch unbemerktes Ausströmen von Erdgas kommt es immer wieder zu folgenschweren Gasexplosionen, etwa die Explosion der New London School. Die gefürchteten Grubengasexplosionen in Kohlebergwerken (Schlagwetter) sind auf Methan-Luft-Gemische zurückzuführen. Methan ist hoch entzündlich, der Flammpunkt liegt bei −188 °C, die Zündtemperatur bei 595 °C.[1] Methanbehälter sollen an gut belüfteten Orten aufbewahrt und von Zündquellen ferngehalten werden und es sollten Maßnahmen gegen elektrostatische Aufladung getroffen werden.
Methan wird, um die Dichte zu erhöhen, unter hohem Druck in Gasflaschen bei 200 bar aufbewahrt. Methan liegt in der handelsüblichen 50 Liter-Stahlflasche oder in Kraftfahrzeugtanks, oft mit Kohlenstofffasern verstärktes Epoxidharz über Aluminium-Liner, komprimiert auf 200 bar gasförmig vor (sogenanntes Compressed Natural Gas, CNG).
Der Schifftransport in großen Mengen erfolgt in fast überdrucklosen Membrantanks, jedoch bei etwa −160 °C tiefkalt verflüssigt (sogenanntes Liquified Natural Gas, LNG). Schiffe mit Rohr- und Kugeltanks transportieren Erdgas bei erhöhtem Druck und bei höherer Temperatur.
Nachweis
Der Nachweis von Methan kann mittels Infrarotspektroskopie erfolgen. Für den Nachweis extraterrestrischer Vorkommen ist der infrarotspektroskopische Nachweis etabliert.[88] Methan kann mittels Gaschromatographie und mit Gaschromatographie mit Massenspektrometrie-Kopplung nachgewiesen und quantifiziert werden.[89] Im Bergbau wurden früher zur Warnung vor Schlagwettern verschiedene qualitative Nachweismethoden eingesetzt, etwa die Davy-Lampe mit Flammsieb.
Literatur
Bücher
- Enoch Durbin: Methane: Fuel for the Future. Plenum Press, New York, London, 1982, ISBN 978-1-4684-4342-4
- Reiner Wassman, Rhoda S. Lantin, Heinz-Ulrich Neue: Methane Emissions from Major Rice Ecosystems in Asia. Springer, 2000, ISBN 978-0-7923-6765-9
- Peter Pfeifer, Roland Reichelt (Hrsg.): H2O & Co. Organische Chemie. Oldenbourg, München 2003, ISBN 3-486-16032-X. (Extrakapitel über Methan und Informationen zu den anderen Alkanen)
Zeitschriftenartikel
- Pflanzen – eine vergessene Methanquelle. In: Bergbau. Heft 1/2007, S. 7–8. (Digitalisat, PDF-Datei, 72,2 kB)
Weblinks
Einzelnachweise
- ↑ a b c d e f g h i Eintrag zu CAS-Nr. 74-82-8 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ D. H. Ripin, D. A. Evans: pKa's of Inorganic and Oxo-Acids. (PDF) Abgerufen am 15. Juli 2014 (englisch).
- ↑ S. Budavari u. a.: The Merck Index, 12. Auflage. MERCK & CO., 1996, S. 1018
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Index of Refraction of Gases, S. 10-254.
- ↑ Eintrag zu Methane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA) Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-82-8 bzw. Methan), abgerufen am 15. September 2019.
- ↑ a b c G. Myhre u. a.: Anthropogenic and Natural Radiative Forcing. In: Climate Change 2013: The Physical Science Basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge/ New York 2013, S. 731, (PDF)
- ↑ M. W. Chase, Jr.: NIST-JANAF Thermochemical Tables. (= Journal of physical and chemical reference data / Monograph. 9). 4. Auflage, 1998, ISBN 1-56396-831-2, S. 1–1951
- ↑ Mirella Galletti: Kirkuk: The Pivot of Balance in Iraq Past and Present. In: Journal of Assyrian Academic Studies, 19.2, 2005, S. 21–42.
- ↑ David Curtis Wright: The history of China. Greenwood Press, Westport, 2001, ISBN 0-313-30940-X, S. 41
- ↑ Thomas Shirley: The Description of a Well, and Earth in Lanchashire, Taking Fire by a Candle Approached to It. In: Philosophical Transactions of the Royal Society, Band 2, 1667, S. 482–484 (online)
- ↑ P. Macini, E. Mesini: History of petroleum and petroleum engineering. In: Petroleum Engineering – Upstream, 4, 2018, Eolss Publishers Co. Ltd.
- ↑ George A. Olah, Alain Goeppert, G. K. Surya Prakash: Beyond oil and gas: the methanol economy. Verlag Wiley-VCH, 2009, ISBN 978-3-527-32422-4 (Anm.: 2018 erschien die 3. (erweiterte und aktualisierte) Auflage; ISBN 978-3527338030).
- ↑ August Wilhelm von Hofmann: On the action of trichloride of phosphorus on the salts of the aromatic monoamines. In: Proceedings of the Royal Society of London, Band 15, S. 55–62; Fußnoten: S. 57–58(online)
- ↑ a b Robert H. Crabtree: Aspects of methane chemistry. In: Chemical Reviews, 95.4, 1995, S. 987–1007.
- ↑ X. Xiong, F. Weng, Q. Liu, E. Olsen: Space-borne observation of methane from atmospheric infrared sounder version 6: validation and implications for data analysis. In: Atmospheric Measurement Techniques Discussions. 8, 2015, S. 8563–8597, doi:10.5194/amtd-8-8563-2015.
- ↑ a b Giora Proskurowski, Martin D. Lilley, Jeffery S. Seewald, Gretchen L. Früh-Green, Eric J. Olson, John E. Lupton, Shean P. Sylva, Deborah S. Kelley: Abiogenic hydrocarbon production at Lost City Hydrothermal Field. In: Science, Band 319, 2008, S. 604–607
- ↑ William Martin: Alles hat einen Anfang, auch die Evolution: Hydrothermalquellen und der Ursprung des Lebens (PDF; 945 kB). In: Biologie in unserer Zeit. 3/2009(39), S. 166–173. doi:10.1002/biuz.200910391
- ↑ Bing Xie, Hua Zhang, Dong-Dong Yang, Zhi-Li Wang: A modeling study of effective radiative forcing and climate response due to increased methane concentration. In: Advances in Climate Change Research. 7, 2016, S. 241–246, doi:10.1016/j.accre.2016.12.001.
- ↑ Cristina Prados-Roman u. a.: Atmospheric formaldehyde at El Teide and Pic du Midi remote high-altitude sites. In: Atmospheric Environment. 234, 2020, S. 117618, doi:10.1016/j.atmosenv.2020.117618.
- ↑ U. Deppenmeier, V. Müller: Life close to the thermodynamic limit: how methanogenic archaea conserve energy. In: Results Probl Cell Differ. Band 45, 2008, S. 123–152. PMID 17713742; doi:10.1007/400_2006_026
- ↑ David M. Karl, Lucas Beversdorf u. a.: Aerobic production of methane in the sea. In: Nature Geoscience, 1, 2008, S. 473–478, doi:10.1038/ngeo234
- ↑ Siddhesh S. Kamat, Howard J. Williams u. a.: The catalytic mechanism for aerobic formation of methane by bacteria. In: Nature, 497, 2013, S. 132–136, doi:10.1038/nature12061
- ↑ Fred N. Kissell u. a.: Handbook for methane control in mining. DHHS (NIOSH) Publication, No. 2006–127, NIOSH–Publications Dissemination, Cincinnati, S. 3–7.
- ↑ M. J. Hunt: Petroleum geochemistry and geology. 2. Auflage, W. H. Freeman and Company, New York 1995
- ↑ Keith A. Kvenvolden: Methane hydrate — A major reservoir of carbon in the shallow geosphere?. In: Chemical Geology. 71, 1988, S. 41–51, doi:10.1016/0009-2541(88)90104-0.
- ↑ C. D. Ruppel, J. D. Kessler: The interaction of climate change and methane hydrates. In: Review of Geophysics, 55, 2017, S. 126–168, doi:10.1002/2016RG000534.
- ↑ B. Buffet, D. Archer: Global inventory of methane clathrate: Sensitivität to changes in the deep ocean. In: Earth and Planetary Science Letters. Vol 227, 2004, S. 185–199, (PDF; 610 kB)
- ↑ A. V. Milkov: Global estimates of hydrate-bound gas in marine sediments: how much is really out there? In: Earth-Science Reviews, Vol. 66, 2004, S. 183–197
- ↑ Andrés Guzmán-Marmolejo, Antígona Segura: Methane in the Solar System. In: Boletín de la Sociedad Geológica Mexicana, 67, 3, 2015, S. 377–385.
- ↑ L.A. Sromovsky, E. Karkoschka, P.M. Fry, H.B. Hammel, I. de Pater, K. Rages: Methane depletion in both polar regions of Uranus inferred from HST/STIS and Keck/NIRC2 observations. In: Icarus. 238, 2014, S. 137–155, doi:10.1016/j.icarus.2014.05.016.
- ↑ J. H. Waite: Cassini Ion and Neutral Mass Spectrometer: Enceladus Plume Composition and Structure. In: Science. 311, 2006, S. 1419–1422, doi:10.1126/science.1121290.
- ↑ Jonathan I. Lunine: The Atmospheres of Uranus and Neptune. In: Annual Review of Astronomy and Astrophysics. 31, 1993, S. 217–263, doi:10.1146/annurev.aa.31.090193.001245.
- ↑ Astronomers Detect First Organic Molecule on an Exoplanet. auf: jpl.nasa.gov (englisch, 19. März 2008), abgerufen am 20. März 2008
- ↑ S. K. Leggett u. a.: The missing link: Early methane (“T”) dwarfs in the Sloan Digital Sky Survey. In: The Astrophysical Journal Letters, 536.1, 2000, S. L35–L38.
- ↑ M. J. Mumma, G. L. Villanueva, R. E. Novak, T. Hewagama, B. P. Bonev, M. A. DiSanti, A. M. Mandell, M. D. Smith: Strong Release of Methane on Mars in Northern Summer 2003. In: Science. 323, 2009, S. 1041–1045, doi:10.1126/science.1165243.
- ↑ Kenneth Chang: NASA Rover on Mars Detects Puff of Gas That Hints at Possibility of Life. In: The New York Times. 22. Juni 2019, ISSN 0362-4331 (nytimes.com [abgerufen am 16. Juli 2019]).
- ↑ NASA's Cassini Spacecraft Reveals Clues About Saturn Moon. Auf: jpl.nasa.gov, 12. Dezember 2013, abgerufen am 27. Dezember 2013
- ↑ Ralph-Mirko Richter: Eisschollen auf der Oberfläche der Titan-Seen? In: Raumfahrer.net. 13. Januar 2013, abgerufen am 11. Juni 2013
- ↑ Cassini Suggests Icing on a Lake. Auf: jpl.nasa.gov, 8. Januar 2013, abgerufen am 11. Juni 2013
- ↑ Jinrui Zhang, Hans Meerman, René Benders, André Faaij: Comprehensive review of current natural gas liquefaction processes on technical and economic performance. In: Applied Thermal Engineering. 166, 2020, S. 114736, doi:10.1016/j.applthermaleng.2019.114736.
- ↑ H. Märkl, H. Friedmann: Biogasproduktion. In: Garabed Antranikian: Angewandte Mikrobiologie. Springer, Berlin, Heidelberg, 2006, ISBN 978-3-540-24083-9, S. 459–487.
- ↑ Anelli Petersson, Arthur Wellinger: Biogas upgrading technologies–developments and innovations. In: IEA bioenergy. 20, 2009, S. 1–19.
- ↑ Christian Gutt: Brennendes Eis: Methanhydrat—Energiequelle der Zukunft oder Gefahr fürs Klima? In: Physikalische Blätter. 57.9, 2001, S. 49–54.
- ↑ Paul Sabatier, Senderens: Compte Rendu Acad. Sci., Band 134, 1902, S. 689.
- ↑ Colin Campbell, Albert Parker: CXXXVI.—The preparation and analysis of methane. In: J. Chem. Soc., Trans.. 103, 1913, S. 1292–1297, doi:10.1039/CT9130301292.
- ↑ R. Bini, G. Pratesi: High-pressure infrared study of solid methane: Phase diagram up to 30 GPa. In: Physical Review. B, 55 (22), 1997, S. 14800–14809
- ↑ Visualisierung der Kristallstruktur von Methan als Feststoff
- ↑ E. K. Plyler, E. D. Tidwell, L. R. Blaine: Infrared Absorption Spectrum of Methane From 2470 to 3200 cm. In: Journal of Research of the National Bureau of Standards, Section A: Physics and Chemistry. Band 64A, Nummer 3, 1960 May-Jun, S. 201–212, doi:10.6028/jres.064A.021, PMID 32196187, PMC 5287146 (freier Volltext).
- ↑ Johann Weidlein, Ulrich Müller, Kurt Dehnicke: Schwingungsspektroskopie: Eine Einführung. 2., überarb. Auflage. Thieme, Stuttgart 1988, ISBN 3-13-625102-4, S. 134–135.
- ↑ Geoffrey A. Ozin, John G. McCaffrey, J. Mark Parnis: Photochemistry of Transition-Metal Atoms: Reactions with Molecular Hydrogen and Methane in Low-Temperature Matrices. In: Angewandte Chemie International Edition in English. 25, 1986, S. 1072–1085, doi:10.1002/anie.198610721.
- ↑ Clinton R. King u. a.: Supermetal: SbF5-mediated methane oxidation occurs by C–H activation and isobutane oxidation occurs by hydride transfer. In: Dalton Transactions, 48.45, 2019, S. 17029–17036.
- ↑ Ayusman Sen, Mark A. Benvenuto, Minren Lin, Alan C. Hutson, Naomi Basickes: Activation of Methane and Ethane and Their Selective Oxidation to the Alcohols in Protic Media. In: Journal of the American Chemical Society. 116, 1994, S. 998–1003, doi:10.1021/ja00082a022.
- ↑ Standardreaktionsenthalpie für die Verbrennung von Methan und diversen Erdölprodukten, vgl. S. 3 ff. in: Herbert Mayr: Vorlesung 9: Erdölverarbeitung. (PDF-Datei; 190 kB). LMU München: Physikalisch-organische Chemie, 2006
- ↑ Selma K. Bengtsson, Erik Fridell, Karin E. Andersson: Fuels for short sea shipping: A comparative assessment with focus on environmental impact. In: Proceedings of the Institution of Mechanical Engineers, Part M: Journal of Engineering for the Maritime Environment. 228, 2013, S. 44–55, doi:10.1177/1475090213480349.
- ↑ a b L.S. Neiva: A Study on the Cahracteristics of the Reforming of Methane: A review. In: Brazilian Journal of Petroleum and Gas. 2010, S. 119–127, doi:10.5419/bjpg2010-0013.
- ↑ Trevor L. LeValley, Anthony R. Richard, Maohong Fan: The progress in water gas shift and steam reforming hydrogen production technologies – A review. In: International Journal of Hydrogen Energy. 39, 2014, S. 16983–17000, doi:10.1016/j.ijhydene.2014.08.041.
- ↑ a b c Hazzim F. Abbas, W.M.A. Wan Daud: Hydrogen production by methane decomposition: A review. In: International Journal of Hydrogen Energy. 35, 2010, S. 1160–1190, doi:10.1016/j.ijhydene.2009.11.036.
- ↑ Martin Bertau, Heribert Offermanns, Ludolf Plass, Friedrich Schmidt, Hans-Jürgen Wernicke: Methanol: The Basic Chemical and Energy Feedstock of the Future: Asinger’s Vision Today, 750 Seiten, Verlag Springer; 2014, ISBN 978-3-642-39709-7, S. 52.
- ↑ Boy Cornils: Hydroformylierung (Oxo-Synthese). In: J. Falbe, U. Hasserodt: Katalysatoren, Tenside und Mineralöladditive, Georg Thieme Verlag, 1978, ISBN 3-13-552601-1, S. 108–111.
- ↑ Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie. Springer-Verlag, 1972, ISBN 3-211-81060-9, S. 297–306
- ↑ D. Brankovits u, : Methane- and dissolved organic carbon-fueled microbial loop supports a tropical subterranean estuary ecosystem. In: Nature Communications. 8, 2017, S. 1–12, doi:10.1038/s41467-017-01776-x.
- ↑ Susanne Schwarz: Lasst den Rinderwahnsinn. In: taz, 15. Juli 2020.
- ↑ Treibhausgase. Umweltbundesamt, 6. Juni 2019, abgerufen am 29. Februar 2020.
- ↑ D. T. Shindell, G. Faluvegi, D. M. Koch, G. A. Schmidt, N. Unger, S. E. Bauer: Improved attribution of climate forcing to emissions. In: Science. 326, Nr. 5953, 2009, S. 716–718
- ↑ Environmental Research Letters, doi:10.1088/1748-9326/11/12/120207. Nach: deutschlandfunk.de, Forschung aktuell, Meldungen, 12. Dezember 2016: Klimawandel: Die Methankonzentrationen in der Atmosphäre steigen derzeit ungewöhnlich schnell (20. Juni 2017)
- ↑ S. Solomon, D. Qin, M. Manning, Z. Chen, M. Marquis, K. B. Averyt, M.Tignor and H. L. Miller (eds.): ipcc.ch: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change (PDF, 3,9 MB). In: IPCC, 2007: Summary for Policymakers. In: Climate Change 2007, Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA
- ↑ Benjamin Hmiel et al.: Preindustrial 14CH4 indicates greater anthropogenic fossil CH4 emissions (19. Februar 2020); deutschsprachiger Bericht auf spektrum.de (19. Februar 2020)
- ↑ Treibhausgas-Emissionen in Deutschland. Umweltbundesamt, 25. April 2019, abgerufen am 29. Februar 2020.
- ↑ Silke Hasselmann: USA haben den Ausstoß des Klimagases Methan zu niedrig angegeben. ( vom 27. Februar 2014 im Internet Archive) auf: Deutschlandfunk. 14. Februar 2014, (20. Februar 2014)
- ↑ Robert W. Howarth: Ideas and perspectives: is shale gas a major driver of recent increase in global atmospheric methane?. In: Biogeosciences. 16, 2019, S. 3033, doi:10.5194/bg-16-3033-2019.
- ↑ Stephen Leahy: Fracking boom tied to methane spike in Earth’s atmosphere. In: National Geographic. 15. August 2019, abgerufen am 20. August 2019.
- ↑ Yuzhong Zhang u. a.: Quantifying methane emissions from the largest oil-producing basin in the United States from space. In: Science Advances. 6, 2020, S. eaaz5120, doi:10.1126/sciadv.aaz5120.
- ↑ Reuters: Scientists shocked by Arctic permafrost thawing 70 years sooner than predicted. In: The Guardian. 18. Juni 2019, ISSN 0261-3077 (theguardian.com [abgerufen am 2. Juli 2019]).
- ↑ Volker Mrasek: Methanverluste – Lecks in der Öl- und Gasindustrie. In: Deutschlandfunk. Deutschlandradio, 6. Dezember 2017, abgerufen am 8. Dezember 2017.
- ↑ Josh Gabbatiss: Coal mines emit more methane than oil-and-gas sector, study finds. Carbon Brief, 24. März 2020, abgerufen am 29. März 2020 (englisch).
- ↑ Jillian Ambrose: Methane emissions from coalmines could stoke climate crisis – study. In: The Guardian. 15. November 2019, ISSN 0261-3077 (theguardian.com [abgerufen am 15. November 2019]).
- ↑ mbe: Satellitenbild der Woche: Riesiges Methanleck in den USA entdeckt. In: spiegel.de. 11. Oktober 2014, abgerufen am 11. Oktober 2014.
- ↑ Livestock's Long Shadow – Environmental Issues and Options (en), FAO 2006, Rom, (Kurzfassung, en)
- ↑ D.N. Kamra, N. Agarwal, P.C. Sakthivel, L.C. Chaudhary: Garlic as a rumen modifier for eco-friendly and economic livestock production. In: Journal of Applied Animal Research. 40, 2012, S. 90–96, doi:10.1080/09712119.2011.607764.
- ↑ Margarida R. G. Maia, António J. M. Fonseca, Hugo M. Oliveira, Carla Mendonça, Ana R. J. Cabrita: The Potential Role of Seaweeds in the Natural Manipulation of Rumen Fermentation and Methane Production. In: Scientific Reports. 6:32321, 2016, doi:10.1038/srep32321.
- ↑ Robert D. Kinley, Rocky de Nys, Matthew J. Vucko, Lorenna Machado, Nigel W. Tomkins: The red macroalgae Asparagopsis taxiformis is a potent natural antimethanogenic that reduces methane production during in vitro fermentation with rumen fluid. In: Animal Production Science. 56, 2016, S. 282–289, doi:10.1071/AN15576.
- ↑ Breanna M. Roque, Joan K. Salwen, Rob Kinley, Ermias Kebreab: Inclusion of Asparagopsis armata in lactating dairy cows’ diet reduces enteric methane emission by over 50 percent. In: Journal of Cleaner Production. 234, 2019, S. 132, doi:10.1016/j.jclepro.2019.06.193.
- ↑ Breanna M. Roque, Marielena Venegas, Robert D. Kinley, Rocky de Nys, Toni L. Duarte: Red seaweed (Asparagopsis taxiformis) supplementation reduces enteric methane by over 80 percent in beef steers. In: PLOS ONE. Band 16, Nr. 3, 17. März 2021, ISSN 1932-6203, S. e0247820, doi:10.1371/journal.pone.0247820 (plos.org [abgerufen am 19. März 2021]).
- ↑ Pflanzen mit schlechtem Atem. Auf: wissenschaft.de vom 12. Januar 2006.
- ↑ Dietrich Henschler: Toxikologie chlororganischer Verbindungen der Einfluss von Chlorsubstituenten auf die Toxizität organischer Moleküle. Verlag Chemie, Weinheim, New York, Basel, Cambridge, Tokio, 1994, ISBN 3-527-29262-4, S. 11.
- ↑ K. Kawara, B. Gregory, T. Yamamoto, H. Shibai: Infrared spectroscopic observation of methane in Comet P/Halley. In: Astronomy and Astrophysics. 207, 1, 1988, S. 174–181, bibcode:1988A&A...207..174K
- ↑ Lee Marotta, Denis Yates: Methane, Ethylene, and Ethane in Water by Headspace-Gas Chromatography (HS-GC) with Flame Ionization Detection (FID). Abgerufen am 26. Oktober 2014.

































