„Cannabis als Rauschmittel“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
→Marihuana: Einzelnachweis entfernt, die im Text angegebenen Zahlen gehen aus der verlinkten Grafik in keiner Weise hervor. |
K →Medizingeschichte: EN-Format |
||
| Zeile 44: | Zeile 44: | ||
Die ersten Schriften zur medizinischen Nutzung von Cannabis, für die aufgrund der hohen Menge der darin enthaltenen Cannabinoide fast ausschließlich die weiblichen Blüten der Hanfpflanze verwendet werden, gehen auf ein rund 4700 Jahre altes chinesisches Lehrbuch über Botanik und Heilkunst zurück. Der älteste Marihuanafund datiert auf die Zeit um 700 [[v. Chr.]] und war eine Grabbeigabe. In Ausgrabungen in den Yanghai-Gräbern im [[Xinjiang]], einem autonomen Gebiet im Westen [[Volksrepublik China|Chinas]], fanden sich Reste von [[Embryo (Pflanze)|Keimlingen]], Blättern und Früchten von ''Cannabis sativa''. Mit der [[Radiokohlenstoffdatierung]] konnte deren Alter auf ca. 2500 Jahre bestimmt werden.<ref name="Yanghai Tombs">Hong-En Jiang, Xiao Li, You-Xing Zhao, David K. Ferguson, Francis Hueber, Subir Bera, Yu-Fei Wang, Liang-Cheng Zhao, Chang-Jiang Liu, Cheng-Sen Li: ''A new insight into Cannabis sativa (Cannabaceae) utilization from 2500-year-old Yanghai Tombs, Xinjiang, China.'' In: ''[[Journal of Ethnopharmacology]]'', 108. Jg., Ausgabe 3, 6. Dezember 2006, S. 414–422, {{doi|10.1016/j.jep.2006.05.034}}.</ref> |
Die ersten Schriften zur medizinischen Nutzung von Cannabis, für die aufgrund der hohen Menge der darin enthaltenen Cannabinoide fast ausschließlich die weiblichen Blüten der Hanfpflanze verwendet werden, gehen auf ein rund 4700 Jahre altes chinesisches Lehrbuch über Botanik und Heilkunst zurück. Der älteste Marihuanafund datiert auf die Zeit um 700 [[v. Chr.]] und war eine Grabbeigabe. In Ausgrabungen in den Yanghai-Gräbern im [[Xinjiang]], einem autonomen Gebiet im Westen [[Volksrepublik China|Chinas]], fanden sich Reste von [[Embryo (Pflanze)|Keimlingen]], Blättern und Früchten von ''Cannabis sativa''. Mit der [[Radiokohlenstoffdatierung]] konnte deren Alter auf ca. 2500 Jahre bestimmt werden.<ref name="Yanghai Tombs">Hong-En Jiang, Xiao Li, You-Xing Zhao, David K. Ferguson, Francis Hueber, Subir Bera, Yu-Fei Wang, Liang-Cheng Zhao, Chang-Jiang Liu, Cheng-Sen Li: ''A new insight into Cannabis sativa (Cannabaceae) utilization from 2500-year-old Yanghai Tombs, Xinjiang, China.'' In: ''[[Journal of Ethnopharmacology]]'', 108. Jg., Ausgabe 3, 6. Dezember 2006, S. 414–422, {{doi|10.1016/j.jep.2006.05.034}}.</ref> |
||
Berichte über die Anwendung der Inhaltsstoffe zu medizinischen oder rituellen Zwecken finden sich ebenfalls in [[Indische Literatur|indischer Literatur]] [[400 v. Chr.|vor etwa 2400 Jahren]]. Medizinische Literatur dieser Zeit beschreibt auch Anwendungen in der [[Epilepsie]] und bei Schmerzen.<ref>{{Webarchiv | url=http://www.shortnews.de/id/739456/der-weltweit-aelteste-marihuanafund-ist-eine-grabbeigabe | wayback=20140307225431 | text=''Der weltweit älteste Marihuanafund ist eine Grabbeigabe.''}} Meldung in ''Shortnews.de'' vom 30. November 2008.</ref><ref> |
Berichte über die Anwendung der Inhaltsstoffe zu medizinischen oder rituellen Zwecken finden sich ebenfalls in [[Indische Literatur|indischer Literatur]] [[400 v. Chr.|vor etwa 2400 Jahren]]. Medizinische Literatur dieser Zeit beschreibt auch Anwendungen in der [[Epilepsie]] und bei Schmerzen.<ref>{{Webarchiv | url=http://www.shortnews.de/id/739456/der-weltweit-aelteste-marihuanafund-ist-eine-grabbeigabe | wayback=20140307225431 | text=''Der weltweit älteste Marihuanafund ist eine Grabbeigabe.''}} Meldung in ''Shortnews.de'' vom 30. November 2008.</ref><ref>{{Literatur|Autor=Ethan Russo|Herausgeber=Raphael Mechoulam|Titel=Cannabinoids as Therapeutics|Verlag=Birkhäuser|Ort=Basel|Jahr=2005|Kapitel=Kapitel: ''Cannabis in India: ancient lore and modern medicine''|Seiten=1–22|ISBN=978-3-7643-7055-8|DOI=10.1007/3-7643-7358-X_1}}</ref> |
||
Cannabis wurde seit dem [[Erster Kreuzzug|ersten Kreuzzug]] (1096–1099) in die europäische Volksmedizin eingeführt und taucht in vielen Klostermedizinen auf. Anwendungsbereiche waren [[rheuma]]tische und [[Bronchitis|bronchiale]] Erkrankungen. Darüber hinaus wurde Cannabis allgemein als [[Opium]]<nowiki/>ersatz verschrieben. Ab dem 16. Jahrhundert fand Cannabis Eingang in die Kräuterbücher. Im 19. Jahrhundert wurde es unter anderem gegen Migräne, Neuralgie, epilepsieähnliche Krämpfe, Schlafstörungen eingesetzt. Marihuana war, bis es im Jahr 1898 von [[Aspirin]] verdrängt und schließlich als Heilmittel von einer breiten Palette neuer, synthetischer Arzneimittel abgelöst wurde, in Amerika das am häufigsten benutzte Schmerzmittel. Zwischen 1842 und 1900 machten Cannabispräparate dort die Hälfte aller verkauften Medikamente aus.<ref name="herer">[[Jack Herer]], Mathias Bröckers: ''[[Die Wiederentdeckung der Nutzpflanze Hanf|Die Wiederentdeckung der Nutzpflanze Hanf, Cannabis Marihuana.]]'' 11. Auflage, Nachtschatten, 2008, ISBN 3-03788-181-X (dt. Übersetzung)</ref> In Europa waren zwischen 1850 und 1950 über 100 verschiedene Cannabismedikamente erhältlich.<ref name="fankhauser">Manfred Fankhauser: ''Haschisch als Medikament: zur Bedeutung von Cannabis sativa in der westlichen Medizin.'' 1996</ref> Wegen Dosierungsschwierigkeiten, paradoxen Wirkungen und der Entwicklung synthetischer Medikamente nahmen die Verschreibungen im 20. Jahrhundert ab, bis Cannabis Mitte des 20. Jahrhunderts fast weltweit komplett verboten wurde. Heute ist die medizinische Anwendung von Cannabis in vielen Ländern wieder erlaubt. Allerdings ist es in Österreich nahezu unmöglich, Cannabis legal als Medikament zu bekommen.<ref>[http://www.cannabislegal.de/cannabisinfo/medizin.htm ''Cannabis als Medizin''], Cannabislegal.de</ref> |
Cannabis wurde seit dem [[Erster Kreuzzug|ersten Kreuzzug]] (1096–1099) in die europäische Volksmedizin eingeführt und taucht in vielen Klostermedizinen auf. Anwendungsbereiche waren [[rheuma]]tische und [[Bronchitis|bronchiale]] Erkrankungen. Darüber hinaus wurde Cannabis allgemein als [[Opium]]<nowiki/>ersatz verschrieben. Ab dem 16. Jahrhundert fand Cannabis Eingang in die Kräuterbücher. Im 19. Jahrhundert wurde es unter anderem gegen Migräne, Neuralgie, epilepsieähnliche Krämpfe, Schlafstörungen eingesetzt. Marihuana war, bis es im Jahr 1898 von [[Aspirin]] verdrängt und schließlich als Heilmittel von einer breiten Palette neuer, synthetischer Arzneimittel abgelöst wurde, in Amerika das am häufigsten benutzte Schmerzmittel. Zwischen 1842 und 1900 machten Cannabispräparate dort die Hälfte aller verkauften Medikamente aus.<ref name="herer">[[Jack Herer]], Mathias Bröckers: ''[[Die Wiederentdeckung der Nutzpflanze Hanf|Die Wiederentdeckung der Nutzpflanze Hanf, Cannabis Marihuana.]]'' 11. Auflage, Nachtschatten, 2008, ISBN 3-03788-181-X (dt. Übersetzung)</ref> In Europa waren zwischen 1850 und 1950 über 100 verschiedene Cannabismedikamente erhältlich.<ref name="fankhauser">Manfred Fankhauser: ''Haschisch als Medikament: zur Bedeutung von Cannabis sativa in der westlichen Medizin.'' 1996</ref> Wegen Dosierungsschwierigkeiten, paradoxen Wirkungen und der Entwicklung synthetischer Medikamente nahmen die Verschreibungen im 20. Jahrhundert ab, bis Cannabis Mitte des 20. Jahrhunderts fast weltweit komplett verboten wurde. Heute ist die medizinische Anwendung von Cannabis in vielen Ländern wieder erlaubt. Allerdings ist es in Österreich nahezu unmöglich, Cannabis legal als Medikament zu bekommen.<ref>[http://www.cannabislegal.de/cannabisinfo/medizin.htm ''Cannabis als Medizin''], Cannabislegal.de</ref> |
||
Version vom 1. April 2016, 14:05 Uhr

Hanf als Rauschmittel bezeichnet die Verwendung von Produkten der weiblichen Hanfpflanze als Rauschmittel. Cannabis ist der wissenschaftliche Name der Gattung Hanf und wird umgangssprachlich auch für diese Produkte – insbesondere für Marihuana (Blüten) und Haschisch (Harz) – benutzt. Der Gebrauch von Hanf als Rauschmittel ist in den meisten Ländern verboten, so in Deutschland, wo Cannabis die am häufigsten konsumierte illegale Droge ist.[1] Es eignen sich nicht alle Hanfsorten als Rauschmittel; hauptsächlich psychoaktiv ist das Cannabinoid Tetrahydrocannabinol (THC), das z. B. in Nutzhanfsorten nicht „spürbar“ vorhanden ist. THC beeinflusst unter anderem das Zentralnervensystem des Menschen. Es ist vorrangig für relaxierende, sedierende und antiemetische Wirkungen verantwortlich. Die Verwendung von Hanf als Rauschmittel und Hanf als Arzneimittel ist teilweise fließend.
Übersicht
Begriffe
Die Begriffe Cannabis, Marihuana und Haschisch werden oft synonym verwendet. Der Gesetzgeber in Deutschland unterscheidet nicht zwischen dem Rohstoff und der Droge, sodass beispielsweise in Deutschland die Droge im Anhang zum BtMG als Cannabis (Marihuana, Pflanzen und Pflanzenteile)[2] erwähnt wird. Im Gesetzestext ist Marihuana als Bezeichnung für alle Teile jeder zur Gattung Cannabis gehörenden Pflanze verankert.
Männliche und weibliche Pflanzen


Es gibt männliche und weibliche Hanfpflanzen (Diözie). Als Rauschmittel wird (fast) ausschließlich die unbefruchtete weibliche Pflanze verwendet, da deren Blüten die größte Wirkstoffkonzentration aufweisen.[3][4]
Hanfarten und Hanfsorten
Aus den Arten Hanf (Cannabis sativa) und Indischer Hanf (Cannabis indica) wurden durch Kreuzung mehrere hundert Zuchtssorten generiert, z. B.: Kush oder White Widow. Ruderal-Hanf (Cannabis ruderalis) spielt für die Rauschmittelgewinnung kaum eine Rolle. Ob C. indica und C. ruderalis eigene Arten oder nur Unterarten von C. sativa sind, ist umstritten. Im Allgemeinen ist das Verhältnis CBD zu THC in indischem Hanf höher. Diesem Umstand wird die stärker beruhigende Wirkung des indischen Hanfs zugeschrieben.[5]
Produkte
Haschisch
Das gepresste Harz der Hanfpflanze wird geraucht oder, in Fett gelöst, zur Zubereitung THC-haltiger Getränke und Speisen verwendet. Haschisch enthält einen Extraktgehalt von etwa 20 %.[6] Bei einzelnen Sorten wie dem schwarzen Afghanen wurden Extraktgehalte von über 30 % ermittelt.[6]
Haschischöl
Das mit Lösungsmitteln aus der Pflanze extrahierte Öl (das im chemischen Sinne allerdings kein Öl ist, sondern relativ reines THC) wird verdampft und eingeatmet, mit Tabak vermischt, auf Papier geträufelt und gelutscht, geraucht oder zur Zubereitung THC-haltiger Getränke und Speisen verwendet (THC-Gehalt bis zu 80 %).
Marihuana
Die getrockneten unbefruchteten weiblichen Blütenstände, mit oder ohne anhängende Blätter, werden geraucht oder verdampft (THC-Gehalt zwischen 0,6 % (Polen) und 12,7 % (England und Wales), Stand 2004).[7]
Bei europäischem Freilandanbau wurden Werte zwischen 4 und 8 % ermittelt, bei tropischem Hanf zwischen 10 und 14 %.[6]
-
Haschisch
-
Haschischöl
-
Marihuana
Geschichte



Medizingeschichte
Die ersten Schriften zur medizinischen Nutzung von Cannabis, für die aufgrund der hohen Menge der darin enthaltenen Cannabinoide fast ausschließlich die weiblichen Blüten der Hanfpflanze verwendet werden, gehen auf ein rund 4700 Jahre altes chinesisches Lehrbuch über Botanik und Heilkunst zurück. Der älteste Marihuanafund datiert auf die Zeit um 700 v. Chr. und war eine Grabbeigabe. In Ausgrabungen in den Yanghai-Gräbern im Xinjiang, einem autonomen Gebiet im Westen Chinas, fanden sich Reste von Keimlingen, Blättern und Früchten von Cannabis sativa. Mit der Radiokohlenstoffdatierung konnte deren Alter auf ca. 2500 Jahre bestimmt werden.[8]
Berichte über die Anwendung der Inhaltsstoffe zu medizinischen oder rituellen Zwecken finden sich ebenfalls in indischer Literatur vor etwa 2400 Jahren. Medizinische Literatur dieser Zeit beschreibt auch Anwendungen in der Epilepsie und bei Schmerzen.[9][10]
Cannabis wurde seit dem ersten Kreuzzug (1096–1099) in die europäische Volksmedizin eingeführt und taucht in vielen Klostermedizinen auf. Anwendungsbereiche waren rheumatische und bronchiale Erkrankungen. Darüber hinaus wurde Cannabis allgemein als Opiumersatz verschrieben. Ab dem 16. Jahrhundert fand Cannabis Eingang in die Kräuterbücher. Im 19. Jahrhundert wurde es unter anderem gegen Migräne, Neuralgie, epilepsieähnliche Krämpfe, Schlafstörungen eingesetzt. Marihuana war, bis es im Jahr 1898 von Aspirin verdrängt und schließlich als Heilmittel von einer breiten Palette neuer, synthetischer Arzneimittel abgelöst wurde, in Amerika das am häufigsten benutzte Schmerzmittel. Zwischen 1842 und 1900 machten Cannabispräparate dort die Hälfte aller verkauften Medikamente aus.[11] In Europa waren zwischen 1850 und 1950 über 100 verschiedene Cannabismedikamente erhältlich.[12] Wegen Dosierungsschwierigkeiten, paradoxen Wirkungen und der Entwicklung synthetischer Medikamente nahmen die Verschreibungen im 20. Jahrhundert ab, bis Cannabis Mitte des 20. Jahrhunderts fast weltweit komplett verboten wurde. Heute ist die medizinische Anwendung von Cannabis in vielen Ländern wieder erlaubt. Allerdings ist es in Österreich nahezu unmöglich, Cannabis legal als Medikament zu bekommen.[13]
In Frankreich wurden die bewusstseinsverändernden Eigenschaften der Inhaltsstoffe betont, insbesondere in literarischen Kreisen, etwa von Alexandre Dumas dem Älteren und Fitz Hugh Ludlow, während in England medizinische Anwendungen im Vordergrund standen; W. B. O’Shanghnessy nennt Beruhigung, Anfalls- und Krampflinderung. Hanf wurde oft als günstiger Tabakersatz verwendet und in diesem Zusammenhang in der Literatur oft beiläufig als Knaster oder starker Tobak bezeichnet.
Verwendung als Rauschmittel und Verbot
Bis in das erste Drittel des 20. Jahrhunderts war Cannabis, gewöhnlich in Form von alkoholischen Extrakten, ein leicht verfügbares Medikament; im 19. Jahrhundert eines der am häufigsten verschriebenen.[14] Auf der zweiten Opiumkonferenz am 19. Februar 1925 in Genf unterzeichnete Deutschland ein überarbeitetes Abkommen aus der ersten Opiumkonferenz über den Handel mit Drogen. Es wurde am 25. September 1928 in Kraft gesetzt. Daraufhin wurden auch Drogen wie Heroin, Kokain und, auf Drängen von Ägypten, auch Cannabis mit in die Liste aufgenommen und mit Opiaten gleichgestellt. Indien, das auch als einziges Land eine wissenschaftliche Forschung vorzeigen konnte, widersprach aus religiösen und kulturellen Gründen. Auch Deutschland sah keinen Grund, Cannabis mit aufzunehmen. Daraufhin drohte Ägypten mit Importbeschränkungen für Kokain (Merck KGaA) und Heroin (Bayer AG).[15] Bayer intervenierte bei der damaligen deutschen Regierung, die sich dann dem Verbot anschloss, sodass 1929 ein neues Opiumgesetz verabschiedet wurde. Zur aktuellen Illegalisierung von Cannabis kam es Ende des 20. Jahrhunderts durch die direkte Überführung des Opiumgesetzes des Deutschen Reiches in der Fassung vom 10. Dezember 1929 (RGBl. I, S. 215) in das Betäubungsmittelgesetz am 24. Dezember 1971 (BGBl. I, S. 2092).

Anfang 1936 setzte in den USA ein gezielter Lobbyismus, eine rassistisch gefärbte Propaganda der Hearst Corporation des Medienmoguls William Randolph Hearst gegen das als "neue Droge" wahrgenommene Marihuana ein; die Verwandtschaft zwischen Marihuana und Hanf wurde nicht gesehen. In Hearsts Zeitungen wurden Verbrechen häufig mit Marihuana in Verbindung gebracht. Der Begriff Marihuana entstammt der Sprache mexikanischer Einwanderer. Marihuana wurde in Filmen wie Reefer Madness als Droge der Perversen, siechenden „Untermenschen“, geistlosen „Negern“ und mexikanischen Immigranten beschrieben.[14] Kritiker meinen, dass diese Kampagne deswegen eingeleitet wurde, weil Hanf ein preisgünstiger Ausgangsstoff für die Papier- und Rohstoffproduktion war und dem Wald- und Papiermühlenbesitzer Hearst und der Chemiefirma DuPont daher hohe finanzielle Verluste hätte einbringen können. DuPont patentierte in dieser Zeit Nylon und Rayon, die in Konkurrenz zum Hanf standen. Letztendlich könnte das zum De-facto-Verbot im Jahr 1937 geführt haben. Kurz nach dem Verbot meldete das Magazin Popular Mechanics die Erfindung und Produktion effizienter Erntemaschinen für den bis dahin aufwändig zu erntenden Hanf.[16] Auch Popular Mechanics hatte das Verbot von Hanf noch nicht als solches wahrgenommen und prophezeite ihm goldene Zeiten. Eine der treibenden Kräfte des US-Cannabisverbots war der Vorsitzende des „Bureau of Narcotics“ Harry J. Anslinger, der bis 1933 im „Prohibition Bureau“ für die Durchsetzung des landesweiten Alkoholverbots zuständig gewesen war. Er war bestellt und eingesetzt worden vom damaligen Finanzminister der USA Andrew W. Mellon, einem Schwiegeronkel von Anslinger, der auch Banker und Geldgeber von William Randolph Hearst und DuPont war.
Die Produktion des Hanfs lebte während des Zweiten Weltkrieges in den USA noch einmal auf. Hanfbauern wurden vom Militärdienst freigestellt, und man drehte Werbefilme wie Hemp for Victory, da Hanf als Rohstoff für Uniformen, Verbandszeug, Flugzeugbau und ähnliches benötigt wurde. Nach dem Zweiten Weltkrieg wurden alle Hanffelder wieder verboten und verbrannt.[14]
-
Hanfkraut von 1924
-
Anzeige des Federal Bureau of Narcotics aus dem Jahr 1935
-
Hemp for Victory aus dem Jahr 1942
Anbau

Cannabis wird weltweit angebaut.[17]

Hauptanbauländer
Afghanistan war 2010 mit einer Ernte von geschätzten 1500 bis 3500 Tonnen der weltweit größte Produzent von Cannabis.[18] Obwohl der Anbau illegal ist, wird er in 17 von 34 Provinzen betrieben und spielt dort wirtschaftlich eine wichtige Rolle. Der Großteil wird als Haschisch exportiert. Weitere bedeutende Anbauländer sind Jamaika, Kolumbien, Libanon, Marokko, Nigeria, Pakistan, Thailand und die Türkei. In Marokko wurde 1990 auf rund 120.500 Hektar Fläche Hanf angebaut; damals stammten etwa 80 % des in Europa sichergestellten Haschischs von dort.[19][20]
Situation in Österreich und Deutschland
Das in Österreich und Deutschland erhältliche Marihuana wird heute größtenteils illegal im Inland unter Kunstlicht angebaut, seltener aus der Schweiz, Tschechien oder den Niederlanden importiert. Auch der Freiluftanbau ist in Ländern wie Österreich und Deutschland prinzipiell möglich, insbesondere in wärmeren Regionen. Der Anbau kann wegen des charakteristischen Aussehens der Pflanzen relativ leicht entdeckt werden.
Das Anbauen von Marihuana unter Kunstlicht in der eigenen Wohnung, das sogenannte Indoor-Growing, etwa im Growschrank, hat in Österreich und Deutschland in den letzten Jahren offenbar deutlich zugenommen:
Im, vom Gesundheitsministerium veröffentlichten, Bericht zur Drogensituation in Österreich der Jahre 2014[21] und 2015, wird jeweils angegeben, dass die "Cannabisproduktion steigt" und 2015 "der Anbau in Österreich [...] zumeist für den Eigengebrauch oder für den Handel im kleineren Umfang [erfolgt].".[22]
Nach Angaben der Drogenbauftragten der Bundesregierung, wird Cannabis in Deutschland überwiegend in Indoor-Plantagen angebaut, wobei 2012 665 Plantagen sichergestellt wurden, während es im Vorjahr nur 619 gewesen waren.[23] Die Hamburger Polizeisprecherin Ulrike Sweden gab 2013 an, der "sprunghafte Anstieg der Cannabis-Plantagen" sei "vor allem auf den Einsatz von Grow-Schränken zurückzuführen".[24]
Indoor-Growing
Unter Indoor-Growing wird der Anbau von Cannabis innerhalb von Gewächshäusern, z. B. in sogenannten Growboxen, verstanden. Der Anbau, auch für den offenkundigen Selbstbedarf, ist strafbar (Deutschland: § 29 Abs. 1 Nr. 1 Betäubungsmittelgesetz; Österreich: § 27 Abs. 1 Nr. 2 Suchtmittelgesetz). Die Gründe für den illegalen Anbau liegen in ökonomischen Gründen, da trotz erheblicher Kosten für die langfristig aufgewandte Energiemenge zur Beleuchtung und des hohen Arbeitsaufwands versucht wird, die Schwarzmarktpreise von etwa fünf bis über zehn Euro pro Gramm (Stand 2010) zu vermeiden, was besonders für intensive Nutzer finanziell attraktiv scheint. Um das Entdeckungsrisiko zu verringern, wird versucht, mittels Entlüftungsanlage und Kohlefilter die Geruchsbelästigung durch die intensiv riechende Pflanze zu reduzieren.
Siehe auch: Growshop
-
Indoor-Growing im Growschrank Anzuchtphase
-
Indoor-Growing Blütephase
Outdoor-Growing
Unter Outdoor-Growing wird der Anbau von Cannabis außerhalb von Gewächshäusern verstanden; dies ist in Deutschland, Österreich und der Schweiz illegal.
Der Freilandanbau von Cannabis ähnelt der Aufzucht von Nutzhanf oder anderen vom Nitratgehalt des Bodens abhängigen Feldkulturen. Der Energiebedarf für diesen Anbau ist im Vergleich zur Produktion im Gewächshaus oder dem Indoor-Growing sehr gering, die Hanfpflanze kann hier von der Felderwirtschaft und Direktsaat profitieren.[25]
Hanf gedeiht am besten auf gut durchlässigen Böden, die reich an organischen Stoffen sind. Der pH-Wert des Bodens sollte neutral oder leicht darunter sein.[26]
-
Outdoor-Growing Blütephase
-
Junge männliche Pflanze in der Blütephase
Applikationswege


Grundsätzlich stehen eine Reihe verschiedener Applikationswege offen, von denen jedoch nur der inhalative und der orale Konsum gebräuchlich ist. Je nach Anwendungsform und Produkt variiert die Zeit bis zum Eintritt einer Rauschwirkung von einigen Minuten beim Inhalieren und zwischen 30 und 300 Minuten bei oraler Aufnahme. Die Wirkung nach Inhalation hält zwei bis drei Stunden an, bei oralem Konsum deutlich länger. Durch oralen Konsum oder durch Verdampfen in einem Vaporizer lässt sich die Belastung der Atemwege vermeiden bzw. minimieren.
Inhalativ (Kiffen)
Um Cannabinoide über die Lunge aufzunehmen, müssen sie in eine inhalierbare Form gebracht werden. Durch Erhitzen bis über den Verdampfungspunkt der Cannabinoide, zum Beispiel mit einem Vaporizer oder durch Verbrennen (Rauchen), wie z. B. oft mittels Joint und Bong, aber auch Pfeife, Blunt, Shillum oder Eimerrauchen, werden sie in die gasförmige Phase überführt. Das Inhalieren von Cannabis wird auch kiffen und die Konsumenten Kiffer genannt, was im 20 Jahrhundert vom Englischen kif entlehnt wurde und auf das Arabische kaif (Wohlbefinden) zurückgeht.[27]
Siehe auch: Hanf als Rauschmittel: Auswirkungen auf die Atmungsorgane, Headshop
Oral
Für den oralen Konsum wird, da Cannabinoide fettlöslich sind, Cannabis mit stark fetthaltigen Nahrungsmitteln verarbeitet oder in fetthaltigen Trägersubstanzen gelöst; Cannabis kann direkt oder als Cannabisbutter in Gebäck verbacken werden oder mit Kakao bzw. Schokolade gebunden werden. In medizinischen Anwendungen sind die Zubereitung eines alkoholischen Auszugs und die pharmazeutische Herstellung von Pflanzenextrakten oder THC in Reinform üblich.
-
Eine Bong wird geraucht
-
Cannabishaltige Nahrungsmittel
Wirkung
Biochemische Grundlagen und Wirkstoffe

Cannabiswirkstoffe entfalten ihre Effekte durch Beeinflussung des körpereigenen Endocannabinoid-Systems.[28][29] Bisher wurde eine Rezeptorklasse mit zwei Subtypen im Organismus von Wirbeltieren identifiziert: CB1 und CB2. Man geht jedoch wegen des komplexen Wirkspektrums der Cannabinoide von der Existenz weiterer Rezeptoren (d. h. non-CB1 und non-CB2) aus.
Der Rezeptor CB1 befindet sich vorrangig im zentralen Nervensystem; es existieren jedoch auch in weit geringerem Maße Rezeptoren in Zellen des Immunsystems, wie beispielsweise Mastzellen oder T-Helferzellen. Besonders viele Rezeptoren werden in den für das Gedächtnis, die Bewegung und das Schmerzempfinden verantwortlichen Hirnregionen identifiziert. Der CB2-Rezeptor ist im gesamten Organismus vorhanden, in besonderem Maße jedoch in Zellen, die Bestandteil des Immunsystems sind. CB2-Rezeptoren spielen für die Regulation der Immunantwort und bei Entzündungen eine wichtige Rolle.[30]
Δ9-Tetrahydrocannabinol (THC) ist hauptsächlich durch die Bindung an den CB1- und CB2-Rezeptoren (CB1: Ki=10 nM; CB2: Ki=24 nM[31]) für die psychotrope Wirkung von Cannabis verantwortlich. THC wurde 1964 erstmals isoliert[32], und ist daher das am längsten erforschte Cannabinoid; es macht auch den größten Anteil der isolierten Cannabinoide aus der Cannabispflanze aus (möglicher Masseanteil an der Blüte von über 20 %). Auf Grund von Studien an Mäusen wird angenommen, dass Δ9-THC als Partialagonist wirkt.[33][34] Das heißt, dass es einen bestimmten Rezeptor besetzt (Schlüssel-Schloss-Prinzip) und dabei einen Neurotransmitter (Mediator) in seiner Wirkung teilweise imitiert bzw. ersetzt.
Bisher sind neben THC 84 weitere Cannabinoide identifiziert worden, deren Masseanteil in der Regel unter 0,1 % liegt.[35] Der Anteil der Cannabinoide Cannabigerol (CBG), Cannabichromen (CBC), Cannabidiol (CBD) und Cannabinol (CBN) kann höher sein: Je nach Cannabissorte können Gehalte von deutlich über 1 % vorliegen:
• CBG macht in einer 1987 entdeckten Sorte Französischen Faserhanfs 94% der Cannabinoid-Fraktion aus.[36]
• CBC kann zwischen bei manchen Pflanzen bis zu 5 % der Cannabinoid-Fraktion ausmachen.[37]
• Der CBD-Gehalt der, speziell unter diesem Gesichtspunkt gezüchteten, Hanfsorten Harlequin beträgt etwa 4 %.[38]
• CBN bildet sich nach der Ernte von Cannabis als Abbauprodukt von THC und stellt so ein Artefakt dar.[39]
Von den vorgenannten Cannabinoiden gilt das nicht- oder nur schwach psychoaktive CBD als pharmakologisch besonders interessant. Der genaue Wirkmechanismus von CBD ist ungeklärt. Einige Quellen gehen davon aus, dass CBD nicht unmittelbar die Reaktion der CB1- oder CB2-Rezeptoren beeinflusst, sondern nur indirekt durch einen nicht geklärten Stoffwechselmechanismus; andere Quellen vermuten eine Affinität bevorzugt zum CB2-Rezeptor. Bezüglich der Wirkung von CBD ist man deshalb weitgehend auf indirekte empirische Daten angewiesen. Es wird vermutet, dass CBD den psychotropen, „kopfbetonten“ Eigenschaften des THC entgegenwirkt; es mildere den Effekt und vergrößere gleichzeitig die Wirkdauer. Cannabissorten mit hohem CBD-Gehalt, wie die Cannabis indica, besitzen eine zentraldämpfende, „körperbetonte“ Wirkung. CBD hat entspannende, entkrampfende, angstlösende, entzündungshemmende Effekte, allerdings ist nicht wissenschaftlich geklärt, ob dieser Effekt auf den höheren CBD Gehalt zurückzuführen ist oder ob andere Wirkstoffe des Cannabis dafür verantwortlich sind.[40] Während der Gehalt an THC über die Jahre deutlich anstieg, ist Cannabidiol in vielen Züchtungen nicht mehr vorhanden.[41][42]
Die anderen nicht oder kaum psychoaktiven Hauptbestandteile des Cannabis sind nur wenig erforscht. Das Verhältnis dieser Wirkstoffe wird durch die genetische Variante, vor allem bei Cannabis sativa und Cannabis indica, und vom Erntezeitpunkt bestimmt. Die Cannabinoide beeinflussen sich wechselwirkend.
Die Wirkstoffgehalte der Cannabisprodukte sind über Jahrzehnte angestiegen. Die Zucht neuer Sorten mit höheren THC-Gehalten meist unter Kunstlicht im Innenbereich hat die Produktion von Marihuana aus freilandgeeigneten Sorten geringerer Wirkstoffgehalte weitgehend abgelöst. So lag der THC-Gehalt in den Niederlanden 1997 bei etwa 8 % für Cannabis-Harz (Haschisch) und 2003 bei 18 % bzw. in Deutschland bei 7,5 % zu 14 %. In Großbritannien stieg der Wirkstoffgehalt im Harz von unter 7 % im Jahr 1977 auf etwa 9 % in 2003,[43] für Marihuana von 9,4 % auf 12,3 %.[44] Auf europäischer Ebene zeigt sich seitdem ein weiterer Anstieg des THC-Gehalts zwischen 2006 und 2012. Der Wirkstoffgehalt beider Cannabisformen ist seit 2006 gestiegen, wobei der größte Teil dieses Anstiegs bei Cannabisharz auf die Jahre 2011 und 2012 fällt.[45]
Rauschwirkung

Der Rausch kann eine Bewusstseinsverschiebung mit assoziativem, sprunghaftem Denken und eine Beeinträchtigung des Kurzzeitgedächtnisses mit sich bringen.[46] Diese Bewusstseinsveränderung kann positive, aber auch negative Empfindungen hervorrufen.[47] Der Konsument hat den Eindruck, zu tieferen Erkenntnissen und Einsichten zu gelangen (Scheintiefen), die im unberauschten Zustand jedoch nicht mehr erinnerlich sind oder sich dann überwiegend als unsinnig oder trivial erweisen. Meist wird von einer Intensivierung des Gefühlslebens, in der Regel von einem positiveren Lebensgefühl und dem Gefühl der innigeren Verbundenheit mit vertrauten Personen berichtet; gelegentlich können die Emotionen auch in Angst, Traurigkeit, Misstrauen oder Depersonalisation umschlagen.[47] Häufige körperliche Effekte sind gerötete Augen, Mundtrockenheit, gesteigertes Hungergefühl, Erhöhung des Pulses, Senkung des Blutdrucks und Müdigkeit bzw. Antriebslosigkeit.[48]
Die akuten Wirkungen von Cannabis können je nach Person, Wirkstoffanteil, momentaner körperlicher und psychischer Verfassung oder Erfahrung mit der Droge sehr unterschiedlich sein. Der Konsument kann die zu erwartende Wirkung deshalb nicht zuverlässig einschätzen.[47] Selbst wenn der Züchter einer Cannabissorte ungefähre Angaben zu den Wirkstoffen macht, was häufig der Fall ist, muss mit einer nicht unerheblichen Variabilität der tatsächlichen Konzentrationen – auch innerhalb gleicher Sorten – gerechnet werden. Eine zuverlässige und verbindliche Wirkstoffangabe ist wegen der Illegalität und dem allgemeinen Charakteristikum pflanzlichen Materials vorerst nicht zu erwarten.
Toxizität
Cannabis selbst ist nur mäßig giftig; die letale Dosis LD50 des Hauptwirkstoffes THC beträgt bei Mäusen im Fall intravenöser Gabe 29 mg je Kilogramm Körpergewicht, bei oraler Einnahme jedoch 482 mg/kg. Bei Ratten liegt die orale LD50 bei 666 mg/kg und die intravenöse bei 29 mg/kg.[49] Beim Menschen wird eine orale LD50 von etwa 150 mg/kg angenommen; andere Quellen nennen eine letale Gesamtdosis von reinem THC bei über 4 g/kg.[50] Diese Menge überschreitet die üblichen Konsumdosen um mehrere hundert Einheiten und ist durch Aufnahme über die Lunge nicht erreichbar, zumal beim Inhalieren von Marihuana lediglich etwa 20 % des im Inhalat enthaltenen THC ins Blut gelangen. Bei oraler Aufnahme werden nur etwa 6 % THC aufgenommen.[49] Ein Mensch mit 70 kg Körpergewicht müsste daher 10,5–280 g reines THC essen, um die tödliche Dosis zu erreichen. Es ist deshalb nicht bekannt, dass es beim Menschen jemals einen Todesfall gegeben hätte, der auf eine Überdosierung zurückzuführen war.
Mischkonsum mit anderen Drogen

Wie bei allen anderen Kombinationen unterschiedlicher psychoaktiver Substanzen können auch beim Mischkonsum von Cannabis mit anderen Drogen zum Teil unangenehme und gefährliche Wechselwirkungen auftreten.
Cannabis und Koffein
Studien an Totenkopfaffen (Saimiri Sciureus) die zuvor an THC-Selbstverabreichung gewöhnt worden waren und im weiteren MSX-3, einen wasserlöslichen A2A-Antagonisten erhielten, zeigten eine dosisabhängige Verstärkung der Cannabinoid-Rezeptor-Aktivierung, bei höheren Dosen jedoch eine Unterdrückung, woraus geschlossen wurde, dass A2A-Antagonisten wie Koffein die Wirkung von Schwellendosen von THC potenzieren.[51][52]
Cannabis und Alkohol
Bei Mischkonsum von Cannabis und Alkohol wird die Alkoholwirkung verstärkt, außerdem kann Übelkeit und Ohnmacht verursacht werden. Der Mischkonsum mit Alkohol wird als besonders verkehrsgefährdend [angesehen], weil sich durch die gegensätzlichen Wirkungen des antriebs- und risikosteigernden Alkohols und des dämpfend halluzinatorisch wirkenden Cannabis das Unfallrisiko deutlich erhöhe.[53]
Cannabis und Tabak
Durch den Konsum von Cannabis mit Tabak ist es möglich, dass ein zuvor nicht Tabak rauchender Cannabiskonsument eine Nikotinabhängigkeit entwickelt. Außerdem ist ein erhöhtes Atemwegsrisiko gegeben. Nikotin unterdrückt die THC-Wirkung, während THC die Nikotinwirkung steigert.[54]
Cannabis und Opiate
Delta-9-Tetrahydrocannabinol der Hauptwirkstoff von Marihuana, erhöht in Tiermodellen die Wirksamkeit von Opioiden wie Morphin. Die analgetische Wirkung von THC wird, zumindest teilweise, durch δ- und κ-Opioid-Rezeptoren vermittelt, so dass eine Verbindung zwischen Cannabinoid- und Opioid-Signalwege bei der Modulation von Schmerzwahrnehmung vermutet wird.[55]
Mögliche Auswirkungen auf die Gesundheit

Dieser Abschnitt behandelt die gesundheitsschädlichen Aspekte des Cannabiskonsums. Zu den arzneilichen Möglichkeiten siehe: Hanf als Arzneimittel.
Ob und welche Gesundheitsfolgen durch Cannabiskonsum auftreten, ist umstritten und lässt sich pauschalisierend nicht beantworten. Während Auswirkungen auf die Atmungsorgane und ein möglicherweise erhöhtes Krebsrisiko beim Rauchen von Cannabis weitgehend unbestritten sind, ist die Datenlage bezüglich gesundheitlicher Auswirkungen auf die Psyche, der Entwicklung einer Abhängigkeit und ähnlicher Fragestellungen uneinheitlich. Es ist ungeklärt, ob und, wenn ja, für welchen Personenkreis welche Dosis schädigend wirkt und ob unter Umständen bereits einmaliger oder seltener Konsum gesundheitliche Probleme bewirken kann.
Die gesundheitlichen Auswirkungen des Cannabiskonsums sind nicht hinreichend geklärt und hängen von einer Vielzahl komplexer, zum Teil ineinandergreifender Faktoren und Umstände ab:
- Drogengewöhnung
- konsumierte Menge, Konsumform
- Mischkonsum mit anderen Drogen (auch Alkohol und Nikotin)
- persönliche Reife und biologisches Alter (Hirnreifung)
- die persönliche Verfassung und Umgebung, die Tagesform (vgl. Set und Setting)
- Stabilität der Psyche, individuelle Empfänglichkeit für eine Suchtentwicklung
- unmittelbares Umfeld, vermutlich auch genetische Voraussetzungen.
Auswirkungen auf die Atmungsorgane

Bei Untersuchungen von Cannabisrauch wurde festgestellt, dass dessen Zusammensetzung jener von Tabakrauch mit ihren oft krebserregenden Inhaltsstoffen ähnlich ist.[57] Das Rauchen von Cannabis kann daher negative Auswirkungen auf die Lunge haben. Häufig wird Cannabis mit Tabak gemischt. Diese als Joints bezeichneten Mischungen gelten, auch wegen der zusätzlichen gefäßschädigenden Wirkung durch Nikotin, als besonders gesundheitsbedenklich. Ob der reine Cannabiskonsum durch Rauchen letztlich schädlicher ist als reiner Tabakkonsum durch Rauchen, ist ungeklärt. Einerseits werden Joints meist tiefer und deutlich länger inhaliert, aber andererseits werden durchschnittliche Cannabiskonsumenten deutlich weniger Joints rauchen als durchschnittliche Tabakkonsumenten Zigaretten:
Eine Kohortenstudie an 5115 Rauchen (sowohl von Cannabis als auch Tabak) ergab, dass die mittlere Intensität des Tabakkonsums mit 8-9 Zigaretten täglich wesentlich höher war als jene der Marihuana-Raucher, die durchschnittlich angaben, 2-3 mal in den letzten 30 Tagen konsumiert zu haben.[58]
Es besteht ein erhöhtes Risiko, eine chronische Bronchitis auszubilden. Eine Studie mit menschlichen Probanden in Wellington zeigte eine vergleichbare Verengung der Atemwege durch einen Joint wie durch 2,5 bis 5 Tabakzigaretten.[59]
Zwei Überblicksstudien von 2014 stellten übereinstimmend fest, dass das Risiko von Lungenkrebs wegen des Einflusses von Tabak statistisch schwer zu ermitteln sei. Die krebserregenden Stoffe im Cannabisrauch seien jedoch gut bekannt und das damit verbundene erhöhte Risiko unstrittig.[60][61]
Wird Cannabis nicht geraucht, sondern vaporisiert, entsteht, wie unter anderem eine Studie der Universität Leiden zeigt, nur ein vergleichsweise geringer Teil der krebserregenden Stoffe.[62] Beim Vaporisieren wird das Rauschmittel nur so weit erhitzt, dass vorrangig die psychotropen Substanzen, allen voran THC, verdampfen; eine Verbrennung findet nicht statt.
Cannabis und Krebserkrankungen
Wie genau THC oder andere Cannabinoide auf die Krebsentstehung einwirken, ist zentraler Forschungsgegenstand. Viele Studien weisen auf das arzneiliche Potential von Cannabis bei Krebserkrankungen hin.[63] Eine Linderung oder Heilung von Krebserkrankungen durch den Gebrauch als Rauschmittel ist jedoch nicht bekannt und auch nicht plausibel, da kanzerogene Verbrennungsprodukte beim Rauchen entstehen. Bei Untersuchungen von Cannabisrauch wurde festgestellt, dass dessen Zusammensetzung jener von Tabakrauch mit seinen oft krebserregenden Inhaltsstoffen ähnlich ist.[57][64]
Cannabis und Schizophrenie
Es gibt Anhaltspunkte dafür, dass Cannabiskonsum bei bestimmten Personen das Risiko der Ausbildung einer Schizophrenie erhöhen bzw. den Verlauf einer bestehenden schizophrenen Erkrankung verschlechtern kann.[65][66][67][68]
Es blieb bislang allerdings unklar, ob Cannabis hier als alleiniger Faktor oder in Kombination mit anderen Faktoren (Alkohol, Vorerkrankungen) als Auslöser wirkt.[69][70][68][71] Eine Metaanalyse von 35 Einzelstudien in der medizinischen Fachzeitschrift The Lancet von 2007 berichtete, dass ein „größeres Risiko“ in der Nutzergruppe bestand, „die Cannabis am häufigsten benutzte“.[68] Als möglicher neurobiologischer Mechanismus wurde eine durch Cannabinoide verursachte Störung dopaminerger Systeme diskutiert.[72][73]
Motivation und neuronale Belohnungssysteme
Die deutsche Hauptstelle für Suchtgefahren ist der Auffassung, dass bei der speziellen Gruppe von Konsumenten, bei der Cannabiskonsum und zusätzlich persönliche und soziale Risikofaktoren zusammenkommen, eine besondere Gefährdung bestehe, die folgendermaßen beschrieben wird:
„Zwar hat der Konsument selbst ein Gefühl erhöhter Leistungsfähigkeit, die jedoch objektiv betrachtet immer mehr abnimmt. An die Stelle geordneten Denkens und logischer Schlussfolgerungen tritt häufig eine Art Scheintiefsinn, wovon vor allem Sorgfaltsleistungen betroffen sind. […] Im Zusammenhang mit dem genannten Amotivationssyndrom zeigt sich ein zunehmendes allgemeines Desinteresse, gepaart mit verminderter Belastbarkeit. Der Konsument zieht sich immer mehr in sich zurück und wird sich selbst und den Aufgaben des Alltags gegenüber immer gleichgültiger: Er fühlt sich den Anforderungen der Leistungsgesellschaft allmählich immer weniger verpflichtet, aber auch immer weniger gewachsen, und schert mehr und mehr aus seinem bisherigen sozialen Gefüge aus.“
Untersuchungen der Veränderungen der Belohnungssysteme des Gehirns durch Cannabiskonsum zeigten Funktionsminderungen sowohl im Verhalten[74] als auch direct in den maßgeblichen Regionen des Gehirns bei bildgebenden Verfahren.[75]
Frühere Untersuchungen hatten bereits darauf hingedeutet, dass sich die Belohnungssysteme nach längerem Nichtkonsum wieder normalisieren. Dies wurde als wichtiger Hinweis dafür gewertet, dass tatsächlich Cannabiskonsum – und nicht etwa ein bereits zuvor gestörtes Belohnungssystem (mit der Folge einer sogenannten „Selbstmedikation“ der Konsumenten) – als Ursache des Zusammenhangs anzusehen sei.[76]
Hirnorganische Veränderungen
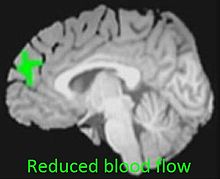
Eine Metaanalyse von 2013 bezüglich einer Vielzahl von Gehirnstudien mit bildgebenden Verfahren kam zu dem Ergebnis, dass zu vielen diesbezüglich relevanten Gehirnregionen noch keine ausreichenden Daten zu Strukturveränderungen vorlagen. Dort, wo brauchbare Datenmengen bestanden, gab es allerdings noch kein einheitliches Bild im Vergleich der Studien. Eine Ausnahme zeigte sich jedoch beim Hippocampus, der eine Schlüsselrolle bei allen Gedächtnisfunktionen hat. Hier wiesen die Konsumenten von Cannabis in allen Studien einen kleineren Hippocampus als die Nichtkonsumenten auf. Nach Einschätzung der Autoren deuten die Ergebnisse darauf hin, dass Gehirnregionen, die reich an Cannabinoid-Rezeptoren sind wie der Hippocampus, bei anhaltendem Gebrauch von Cannabis von nervenschädigenden (neurotoxischen) Effekten betroffen sein könnten.[78]
Bei Jugendlichen
Wegen der Bedeutung der körpereigenen Cannabinoid-Systeme während der Entwicklung des Gehirns[79][80][81] (Bildung neuronaler Netze) sind die Einflüsse von Cannabiskonsum bei Heranwachsenden besonders ausgeprägt. Lokale Verminderungen von Gehirnvolumen und Funktionen entsprechen herabgesetzten kognitiven Leistungen.[82][83][84][85]
Eine Auswertung von Daten der neuseeländischen Dunedin-Langzeitstudie (Dunedin Multidisciplinary Health and Development Study) kam zu dem Schluss, dass Cannabis-Konsum den Intelligenzquotienten (IQ) beeinträchtigt. Der Effekt korrelierte stark mit dem Einstiegsalter und der Dauer des Konsums. Bei einem Einstiegsalter oberhalb von 18 Jahren wiesen die Daten noch keine Beeinträchtigung aus. Wurde mit dem Konsum bereits im Jugendalter begonnen, so wurde eine Intelligenzminderung um bis zu acht IQ-Punkte festgestellt. Die Beendigung des Konsums führte dabei nicht zur vollständigen Wiederherstellung der Intelligenzleistung.[86][87][88]
Bei Erwachsenen
Metaanalysen von 2013 und 2014, die die bis dahin vorliegenden Gehirnstudien durch bildgebende Verfahren auswerteten, gelangten zu dem Ergebnis, dass Cannabiskonsum im präfrontalen Cortex (Stirnseite des Frontallappens der Großhirnrinde) zu einem verminderten Gehirnvolumen und zu einer Beeinträchtigung der weißen Substanz (Nervenverbindungen) führt,[89] sowie zu einem beidseitigen verminderten Volumen des Hippocampus. Bei letzterer Gehirnregion bestand zusätzlich eine Korrelation (Entsprechung) zwischen Volumenabnahme und Menge des bisherigen Cannabiskonsums.[90]
Abhängigkeit

Bei regelmäßigem, intensiven Konsum kann sich ein Toleranzeffekt (erforderliche Dosissteigerung, um die gewohnte Wirkung zu erzielen) entwickeln. Im diagnostischen Handbuch ICD-10 der Weltgesundheitsorganisation WHO 2012) wird zwischen schädlichem und abhängigem Cannabisgebrauch unterschieden. Es beschreibt ein spezifisches Cannabisentzugssyndrom, das innerhalb von 48 Stunden nach dem letzten Cannabiskonsum auftreten kann. Mindestens zwei psychische Beschwerden (zum Beispiel Reizbarkeit, Unruhe, Ängstlichkeit, Depressivität, Aggressivität, Appetitverlust, Schlafprobleme) und mindestens ein weiteres vegetatives Symptom (zum Beispiel Schmerzen, Zittern, Schwitzen, erhöhte Körpertemperatur, Kälteschauer) müssen für die Diagnosestellung vorliegen. Die Beschwerden sind in der ersten Woche am intensivsten und können bis zu einem Monat anhalten.
Es besteht die Annahme, dass dieses Entzugssyndrom bedingt ist durch eine Unterfunktion des mesolimbischen Systems (subkortikale Belohnungssysteme), die nach Einstellen des Konsums wirksam wird.[92] Die Annahme wurde 2016 bekräftigt durch bildgebende Verfahren.[75]
Insgesamt entwickeln etwa 9 % aller Cannabiskonsumenten über die Lebenszeit eine Cannabisabhängigkeit; diese Rate beträgt 17 %, wenn der Cannabiskonsum in der Adoleszenz beginnt und 25–50 %, wenn Cannabinoide täglich gebraucht werden.[93]
Rechtslage


Entsprechend den Bestimmungen des Einheitsabkommens über die Betäubungsmittel 1961, das von fast allen Staaten der Welt ratifiziert wurde, sind die Erzeugung, der Besitz und der Handel von Cannabis nahezu weltweit verboten, in einigen Ländern ist auch der Konsum illegal. Eine Ausnahme sind die Niederlande, wo Erwerb und Besitz geringer Mengen Cannabis (bis zu 5 Gramm bzw. 30 Gramm) geduldet und somit de facto straffrei sind, obwohl Cannabis in den Niederlanden de jure auch weiterhin illegal und verboten ist.[94] In einigen Bundesstaaten der USA ist Cannabisbesitz und -anbau für den medizinischen Bedarf legal, allen voran in Kalifornien, wo der Handel mit Hanf als Arzneimittel ein sehr ertragreiches Geschäft geworden ist.[95] Im November 2010 wurde von den Bürgern des Staates Kalifornien über die „Proposition 19“ – auch bekannt als Regulate, Control and Tax Cannabis Act of 2010 – abgestimmt, die den „Besitz, Anbau, Gebrauch und Handel von Cannabis für alle Personen ab 21 Jahren“ unter Einhaltung bestimmter Regeln legalisieren sollte. Diese wurde jedoch abgelehnt.[96] Seit 1996 können Kalifornier auch ohne Diagnose einer schweren Krankheit, für welche Cannabis als hilfreiches Therapiemittel nachgewiesen ist, leicht eine Recommendation („Empfehlung“) eines Arztes bekommen, welche den Selbstanbau und den Zugang zu Cannabisverkaufsstellen ermöglicht.[97] Diese Legalisierung durch die Hintertür hat sich in wirtschaftlicher Hinsicht und in der Kriminalitätsstatistik (Verminderung von auf Cannabis bezogenen Kriminalfällen) als sehr erfolgreich herausgestellt.[98][99]
Im November 2012 wurde in den US-Bundesstaaten Washington (Initiative 502) und Colorado (Colorado Amendment 64) der Besitz kleiner Mengen über einen Volksentscheid legalisiert. Außerdem erlaubt der Bundesstaat Massachusetts seither den Gebrauch im medizinischen Bereich.[100] Am 5. November 2014 wurde in den Bundesstaaten Alaska und Oregon Marihuana im Zuge der Kongresswahlen 2014 ebenfalls legalisiert.
In vielen anderen Ländern ist außerdem der Besitz einer geringen Menge Cannabis für den Eigengebrauch teilweise entkriminalisiert,[101] wobei von Land zu Land verschiedene Mengen als gering gelten. In Deutschland ist der bloße Konsum von Cannabis oder anderen Betäubungsmitteln de jure nicht strafbar, dagegen sind der Anbau, die Herstellung, das Verschaffen, der Erwerb, der Besitz, die Ein-, Aus- und Durchfuhr, das Veräußern, das Abgeben, das Verschreiben, das Verabreichen und das Überlassen zum unmittelbaren Verbrauch gemäß Betäubungsmittelgesetz strafbar bzw. genehmigungspflichtig.[102]
siehe auch: Cannabis Social Club, Coffeeshop, Georg Wurth
Auswirkungen der Illegalität
Gesellschaftliche Auswirkungen

Die überwiegende Mehrheit der Cannabis Konsumenten in Europa werden durch unregulierte kriminelle Märkte versorgt; und bleiben so ungeschützt vor negativen gesundheitlichen Auswirkungen.[103]
Denn im Gegensatz zum den Anbau anderer Pflanzen, gibt es aufgrund des illegalen Status von Cannabis unter anderem keine Kontrolle über oder Richtlinien bezüglich der Verwendung von Pestiziden.[104]
Aufgrund fehlender staatlicher Kontrolle von Cannabis kann Haschisch von Dealern mit anderen Substanzen gestreckt werden. Meist haben die Streckmittel negative Auswirkungen auf die Gesundheit des Konsumenten. In gestrecktem Haschisch finden sich unter anderem Bleisulfid, Aluminium und Glas.[104]
Im Raum Leipzig kam es im November 2007 zu schweren Bleivergiftungen von Konsumenten durch kontaminiertes Marihuana.[105][106][107][104]
Autofahren unter Cannabiseinwirkung
Es besteht eine widersprüchliche Studienlage zum Thema Cannabis und Fahrtüchtigkeit oder Fahreignung. In den meisten Studien besteht Einigkeit darüber, dass die Fahrtüchtigkeit im akuten Cannabisrausch bis zu einer Stunde nach dem Konsum beeinträchtigt ist.[108] Zwei bis drei Stunden nach Konsum besteht dagegen bei Einmalkonsumenten ein verringertes Unfallrisiko, da die Konsumenten vorsichtiger und langsamer fahren.[109] Experten wie Franjo Grotenhermen kritisieren jedoch die Aussagekraft von experimentellen Studien in diesem Bereich, da diese lediglich abschätzen können, ob "Cannabis ein Potenzial zur Beeinträchtigung von Fahrtüchtigkeit und Fahreignung besitzt – nicht jedoch, ob und in welchem Umfang sich dieses Potenzial auch im Straßenverkehr manifestiert. Die Frage, ob Cannabis das Unfallrisiko erhöht, wird am besten durch epidemiologische Untersuchungen beantwortet.[110] Die größte epidemiologische Studie zu diesem Thema mit über 9000 Teilnehmern wurde 2015 von der US-amerikanischen Behörde für Verkehrssicherheit National Highway Traffic Safety Administration (NHTSA) publiziert.[111] Demnach besteht nach Korrektur von Alter, Geschlecht, Herkunft und Alkoholkonsum kein erhöhtes Risiko für einen Verkehrsunfall nach Cannabiskonsum im Vergleich zur Kontrollgruppe ohne Cannabiskonsum.[112][113]
Deutschland
Anders als bei Überschreitungen der definierten Alkoholgrenzwerte (etwa der 1,1-Promille-Grenze) wird die Fahrerlaubnis bei Fahrten unter Cannabiseinfluss nicht als unmittelbare strafrechtliche Folge entzogen; dies gilt jedoch nicht für die Kombination von Mischkonsum mit Alkohol.[53]
In Deutschland sorgten Urteile des Bundesverfassungsgerichts (Juni 2002, Dezember 2004) für eine gewisse Liberalisierung der bis dato relativ strengen Praxis der Behörden. So entschied das Bundesverfassungsgericht[114] im Dezember 2004, dass bis zu einem Grenzwert von 1,0 ng/ml aktivem THC im Serum (Blut) nicht zwangsläufig eine Gefahr für den Straßenverkehr ausgeht.
Nach Fahrten unter Drogeneinfluss (über dem Grenzwert 1,0 ng/ml aktivem THC oder über 150 ng/ml von dessen Abbauprodukt THC-COOH, bei direkter Blutentnahme nach dem Konsum – bei zurückliegendem Konsum über 75 ng/ml) wird von der zuständigen Fahrerlaubnisbehörde der Führerschein üblicherweise sofort entzogen und eine Medizinisch-Psychologische Untersuchung (MPU) verlangt. Bei wiederholtem Auffallen, auch unter dem Grenzwert, kann die Behörde einen Drogentest oder ein Ärztliches Gutachten (ÄG) verlangen, da sie dann von gelegentlichem bis regelmäßigem Drogenmissbrauch ausgeht.[115] Für die Dauer einer erforderlichen, nachzuweisenden Abstinenzzeit (meist 12 Monate) wird die Fahrerlaubnis entzogen, falls dies nicht schon vorher geschehen ist. Die Kosten für die MPU hat der Führerscheininhaber zu tragen. Wird Cannabiskonsum ohne aktive Teilnahme am Straßenverkehr aktenkundig, wird dieses in der Regel der Verwaltungsbehörde gemeldet und führt zumindest zu einem Eintrag in die Führerscheindatei. Diese Maßnahme kann auch nach bloßem widerrechtlichen Besitz oder einem positiven Drogentest als Beifahrer getroffen werden. Abhängig vom Ergebnis des ärztlichen Gutachtens, darf der Betroffene die Fahrerlaubnis behalten oder es folgt die Anordnung einer MPU zur Klärung von Eignungszweifeln.
Österreich und Schweiz
In Österreich und in der Schweiz ist es verboten, unter Einfluss von Cannabis ein Fahrzeug zu führen. Als beeinträchtigt gelten Personen, bei denen Cannabis im Blut festgestellt wird.
Verbreitung in der Bevölkerung


In der europäischen und amerikanischen Jugendkultur ist Cannabis seit den späten sechziger Jahren verbreitet.[117] Von Beginn der 1990er bis Anfang der 2000er Jahre war ein kontinuierlicher Anstieg im Konsum unter Jugendlichen und jungen Erwachsenen festzustellen. Parallel hierzu wurde Cannabis seit den 1990er Jahren in diversen Jugendkulturen thematisiert, vor allem im Hip-Hop und Reggae, zudem auch in Filmen und Literatur.
2014 schätzte eine Studie der Bundeszentrale für gesundheitliche Aufklärung in Deutschland, dass 17,7 % der jungen Erwachsenen im Alter von 18 bis 25 Jahren in den vergangenen zwölf Monaten mindestens einmal Cannabis konsumiert hatten. Bei den 14–17-jährigen waren es 11,4 %. Der Anteil derer, die regelmäßig Cannabis konsumieren (mehr als zehnmal in den letzten zwölf Monaten), lag in den Befragungen seit 2001 bei den 18–25-jährigen durchgehend unter 5%, in der Altersgruppe der 14–17-jährigen unter 3%.[116]
Bei der europaweiten Umfrage Health behaviour in school-aged children (HBSC), die zwischen Oktober 2005 und Mai 2006 durchgeführt wurde, gaben 18 % der 15-jährigen Schüler an, schon einmal Cannabis geraucht zu haben.[118][119]
Als die Umfrage zwischen 2013 und 2014 wiederholt wurde, gaben europaweit noch 15 % der 15-jährigen Schüler an, schon einmal Cannabis geraucht zu haben.[120]
Für die Schweiz erbrachte eine im Jahr 2014 durchgeführte Bevölkerungsbefragung das Ergebnis, dass 31,5 % der Bevölkerung im Alter über 15 Jahren wenigstens ein Mal im Leben Erfahrungen mit Cannabis gemacht hatten, bei nur 6,7 % der Befragten waren diese Erfahrungen auch in den letzten 12 Monaten erfolgt, bei 3,0 % auch in den letzten 30 Tagen. Ausgehend von diesen Daten, hatten 210.000 Personen in der Schweiz 2014 Cannabis konsumiert.[121]
Siehe auch
Literatur
Allgemeine Darstellungen
- Franjo Grotenhermen, Michael Karus (Hrsg.): Cannabis, Straßenverkehr und Arbeitswelt. Springer, Berlin 2002, ISBN 3-540-42689-2.
- Franjo Grotenhermen (Hrsg.) Cannabis und Cannabinoide – Pharmakologie, Toxikologie und therapeutisches Potenzial. Huber, Bern 2004, ISBN 3-456-84105-1.
- Janet E. Joy u. a.: Marijuana and Medicine. Assessing the Science Base. National Academy Press, Washington 1999, ISBN 0-309-07155-0 (englisch).
- Lark-Lajon Lizermann: Der Cannabis-Anbau. Der einfache Weg zum eigenen homegrow. Alles über Botanik, Anbau, Vermehrung, Weiterverarbeitung und medizinische Anwendung sowie THC-Messverfahren. Nachtschatten, Solothurn 2004, ISBN 3-03788-134-8.
- Wolfgang Schmidbauer, Jürgen vom Scheidt: Handbuch der Rauschdrogen. Fischer, Frankfurt 2004, ISBN 3-596-16277-7.
- Bernhard van Treeck: Das große Cannabis-Lexikon. Schwarzkopf & Schwarzkopf, Berlin 2000, ISBN 3-89602-268-7.
- Bernd Werse: Cannabis in Jugendkulturen. Archiv der Jugendkulturen, Berlin 2007, ISBN 978-3-940213-40-2.
- Steffen Geyer, Georg Wurth: Rauschzeichen – Cannabis: Alles, was man wissen muss. Kiepenheuer & Witsch, Köln 2008, ISBN 978-3-462-03999-3.
- Ingo Niermann, Adriano Sack: Breites Wissen: Die seltsame Welt der Drogen und ihrer Nutzer. Eichborn, Frankfurt 2007, ISBN 978-3-8218-5669-8.
Studien
- Tabea Schoeler, Anna Monk u. a.: Continued versus discontinued cannabis use in patients with psychosis: a systematic review and meta-analysis. In: The Lancet Psychiatry. 3, 2016, S. 215, doi:10.1016/S2215-0366(15)00363-6.
- N. D. Volkow, J. M. Swanson u. a.: Effects of Cannabis Use on Human Behavior, Including Cognition, Motivation, and Psychosis: A Review. In: JAMA psychiatry. Band 73, Nummer 3, März 2016, S. 292–297, doi:10.1001/jamapsychiatry.2015.3278, PMID 26842658.
- T. D. Metz, E. H. Stickrath: Marijuana use in pregnancy and lactation: a review of the evidence. In: American journal of obstetrics and gynecology. Band 213, Nummer 6, Dezember 2015, S. 761–778, doi:10.1016/j.ajog.2015.05.025, PMID 25986032 (Review).
- Y. H. Huang, Z. F. Zhang, D. P. Tashkin, B. Feng, K. Straif, M. Hashibe: An epidemiologic review of marijuana and cancer: an update. In: Cancer epidemiology, biomarkers & prevention: a publication of the American Association for Cancer Research, cosponsored by the American Society of Preventive Oncology. Band 24, Nummer 1, Januar 2015, S. 15–31, doi:10.1158/1055-9965.EPI-14-1026, PMID 25587109, PMC 4302404 (freier Volltext) (frei ab 1. Januar 2016: bis dahin Abstract) (Review).
Weblinks
- Bundeszentrale für gesundheitliche Aufklärung (BZgA): Schule und Cannabis – Regeln, Maßnahmen, Frühintervention. Handreichung für Lehrerinnen und Lehrer der Klassen 7 bis 13. Unterrichtsmaterialien, Köln, , abgerufen am 20. Oktober 2014.
- Bundeszentrale für gesundheitliche Aufklärung (BZgA): Der Cannabiskonsum Jugendlicher und junger Erwachsener in Deutschland 2012. Ergebnisse einer aktuellen Repräsentativbefragung und Trends. Köln, , abgerufen am 20. Oktober 2014.
- Lisa Schnell: 360° Legalisierung von Cannabis – Weshalb die Droge legalisiert wird. Und was das bedeutet. In: sueddeutsche.de. Abgerufen am 29. März 2016.
- Cannabis - News und Infos. In: zeit.de. Abgerufen am 31. März 2016.
Einzelnachweise
- ↑ Cannabis. In: gbe-bund.de. Statistisches Bundesamt, Zweigstelle Bonn, abgerufen am 27. März 2016.
- ↑ Anlage I zum Betäubungsmittelgesetz (Deutschland)
- ↑ Wolfgang Ferner, Peter Xanke: Alkohol und Drogen im Straßenverkehr - Messverfahren, Bußgeldverfahren, Strafverfahren. Deubner, Recht und Praxis, Köln 2006, ISBN 978-3-88606-633-9, S. 68 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Jörg Fengler (Hrsg.): Handbuch der Suchtbehandlung: Beratung, Therapie, Prävention. ecomed-Storck, Landsberg 2002, ISBN 978-3-609-51980-7, S. 228 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Orrin Devinsky, Maria R. Cilio, Helen Cross, Javier Fernandez-Ruiz, Jacqueline French, Charlotte Hill, Russell Katz, Vincenzo Di Marzo, Didier Jutras-Aswad, William G. Notcutt, Jose Martinez-Orgado, Philip J. Robson, Brian G. Rohrback, Elizabeth Thiele, Benjamin Whalley, Daniel Friedman: Cannabidiol: Pharmacology and potential therapeutic role in epilepsy and other neuropsychiatric disorders. In: Epilepsia. Band 55, Nr. 6, 1. Juni 2014, S. 791–802, doi:10.1111/epi.12631, PMC 4707667 (freier Volltext).
- ↑ a b c T. Geschwinde: Rauschdrogen: Marktformen und Wirkungsweisen. Springer-Verlag, 2013. ISBN 9783662096819. S. 17.
- ↑ Europäische Beobachtungsstelle für Drogen und Drogensucht (Hrsg.): Stand der Drogenproblematik in Europa. 2006, ISBN 92-9168-252-7, S. 40 (PDF; 1,5 MB).
- ↑ Hong-En Jiang, Xiao Li, You-Xing Zhao, David K. Ferguson, Francis Hueber, Subir Bera, Yu-Fei Wang, Liang-Cheng Zhao, Chang-Jiang Liu, Cheng-Sen Li: A new insight into Cannabis sativa (Cannabaceae) utilization from 2500-year-old Yanghai Tombs, Xinjiang, China. In: Journal of Ethnopharmacology, 108. Jg., Ausgabe 3, 6. Dezember 2006, S. 414–422, doi:10.1016/j.jep.2006.05.034.
- ↑ Der weltweit älteste Marihuanafund ist eine Grabbeigabe. ( vom 7. März 2014 im Internet Archive) Meldung in Shortnews.de vom 30. November 2008.
- ↑ Ethan Russo: Cannabinoids as Therapeutics. Hrsg.: Raphael Mechoulam. Birkhäuser, Basel 2005, ISBN 978-3-7643-7055-8, Kapitel: Cannabis in India: ancient lore and modern medicine, S. 1–22, doi:10.1007/3-7643-7358-X_1.
- ↑ Jack Herer, Mathias Bröckers: Die Wiederentdeckung der Nutzpflanze Hanf, Cannabis Marihuana. 11. Auflage, Nachtschatten, 2008, ISBN 3-03788-181-X (dt. Übersetzung)
- ↑ Manfred Fankhauser: Haschisch als Medikament: zur Bedeutung von Cannabis sativa in der westlichen Medizin. 1996
- ↑ Cannabis als Medizin, Cannabislegal.de
- ↑ a b c Jack Herer: Die Wiederentdeckung der Nutzpflanze Hanf. Hrsg. von Mathias Bröckers (17. Auflage), Zweitausendeins, Frankfurt am Main 1994, S. 146 ff.
- ↑ League of Nations 1925; Records of the Second Opium conference. Volume I, Plenary Meetings, S. 132–135
- ↑ „New Billion-Dollar Crop“, druglibrary.org
- ↑ Deutsche Hauptstelle für Suchtfragen: Cannabis - BasisinformationenPDF .
- ↑ Jonathon Burch: Afghanistan now world’s top cannabis source: U.N. Meldung vom 31. März 2010 bei Reuters.com.
- ↑ Eintrag zu Cannabis. In: Römpp Online. Georg Thieme Verlag
- ↑ Suchtgefahren 36, 1–17 (1990).
- ↑ BMG: Bericht zur Drogensituation 2014 Zugriff 26.03.2016
- ↑ BMG: Bericht zur Drogensituation 2015 Zugriff 26.03.2016
- ↑ Drogenbeauftragte der Bundesregierung: Situation in Deutschland. ohne Datum, abgerufen am 12. Dezember 2015.
- ↑ WELT: Deutschland wird zur Kiffer-Republik Zugriff 26.03.2016
- ↑ BOTEC Analysis: Environmental Risks and Opportunities in Cannabis Cultivation Zugriff 26.03.2016
- ↑ University of Kentucky College of Agriculture, Food and Enviroment: Industrial Hemp Production Zugriff 30.03.2016
- ↑ kiffen – Wiktionary
- ↑ Beat Lutz: „Endocannabinoide“, in: Gerhard Gründer, Otto Benkert (Hrsg.): Handbuch der Psychopharmakotherapie Springer-Verlag 2011, ISBN 3642198449, S. 219–222.
- ↑ F.H. Meyers, E. Jawetz, A. Goldfien: Lehrbuch der Pharmakologie. Für Studenten der Medizin aller Studienabschnitte und für Ärzte Springer-Verlag, 2013, ISBN 3642661831, S. 46-49.
- ↑ S. Rom, Y. Persidsky: Cannabinoid receptor 2: potential role in immunomodulation and neuroinflammation. In: Journal of neuroimmune pharmacology : the official journal of the Society on NeuroImmune Pharmacology. Band 8, Nummer 3, Juni 2013, S. 608–620, doi:10.1007/s11481-013-9445-9, PMID 23471521, PMC 3663904 (freier Volltext) (Review).
- ↑ PDSP Database – UNC. NIMH Psychoactive Drug Screening Program, abgerufen am 11. Juni 2013.
- ↑ Yehiel Gaoni, Raphael Mechoulam: Isolation, structure and partial synthesis of an active constituent of hashish. In: Journal of the American Society. Band 86, Nr. 8, 1964, S. 1646–1647, doi:10.1021/ja01062a046.
- ↑ C. A. Paronis, S. P. Nikas, V. G. Shukla, A. Makriyannis: Δ(9)-Tetrahydrocannabinol acts as a partial agonist/antagonist in mice. In: Behavioural pharmacology. Band 23, Nummer 8, Dezember 2012, S. 802–805, ISSN 1473-5849. doi:10.1097/FBP.0b013e32835a7c4d. PMID 23075707. PMC 3697741 (freier Volltext).
- ↑ Pertwee RG: The pharmacology of cannabinoid receptors and their ligands: An overview. In: International Journal of Obesity. 30. Jahrgang, 2006, S. S13–S18, doi:10.1038/sj.ijo.0803272, PMID 16570099.
- ↑ Abir T. El-Alfy, Kelly Ivey, Keisha Robinson, Safwat Ahmed, Mohamed Radwan, Desmond Slade, Ikhlas Khan, Mahmoud Elsohly: Antidepressant-like effect of Δ9-tetrahydrocannabinol and other cannabinoids isolated from Cannabis sativa L. In: Pharmacology, Biochemistry and Behavior. 95. Jahrgang, Nr. 4, 2010, S. 434–42, doi:10.1016/j.pbb.2010.03.004, PMID 20332000, PMC 2866040 (freier Volltext).
- ↑ E. P. de Meijer, M. Bagatta, A. Carboni, P. Crucitti, V. M. Moliterni, P. Ranalli, G. Mandolino: The inheritance of chemical phenotype in Cannabis sativa L. In: Genetics. Band 163, Nummer 1, Januar 2003, S. 335–346, PMID 12586720, PMC 1462421 (freier Volltext).
- ↑ David Castle: Marijuana and Madness. 2011, S. 40.
- ↑ Haborside Health Center:Harlequin Medical Cannabis
- ↑ McCallum ND, Yagen B, Levy S, Mechoulam R: Cannabinol: a rapidly formed metabolite of delta-1- and delta-6-tetrahydrocannabinol In: Experientia . Band 31, Nummer 5, Mai 1975, S. 520–521, PMID 1140243.
- ↑ P. Pacher, S. Bátkai, G. Kunos: The endocannabinoid system as an emerging target of pharmacotherapy. In: Pharmacological reviews. Band 58, Nummer 3, September 2006, S. 389–462, doi:10.1124/pr.58.3.2, PMID 16968947, PMC 2241751 (freier Volltext) (Review).
- ↑ Cascini F, Aiello C, Di Tanna G: Increasing delta-9-tetrahydrocannabinol (Delta-9-THC) content in herbal cannabis over time: systematic review and meta-analysis. Current Drug Abuse Review 2012; 5:32–40.
- ↑ Atakan Z: Cannabis, a complex plant: different compounds and different effects on individuals. Therapeutic Advances in Psychopharmacology 2012; 2: 241–54.
- ↑ emcdda.europa.eu An overview of cannabis potency in Europe EMCDDA, Lisbon, January 2004: S. 38–48, Figure 10, 11, 12, 14
- ↑ Further consideration of the classification of cannabis under the Misuse of Drugs Act 1971. (PDF) badscience.net, S. 14, abgerufen am 28. Juli 2012.
- ↑ Europäische Beobachtungsstelle für Drogen und Drogensucht (EMCDDA):Europäischer Drogenbericht 2014: Trends und Entwicklungen, S. 20
- ↑ a b Illegale Drogen: Cannabis. Deutsche Hauptstelle für Suchtfragen e. V., abgerufen am 1. März 2013.
- ↑ a b c Drogenlexikon: Cannabis. Bundeszentrale für gesundheitliche Aufklärung, abgerufen am 1. März 2013.
- ↑ Cannabis / THC. Drug-Infopool.de, abgerufen am 1. März 2013.
- ↑ a b Eintrag zu Tetrahydrocannabinole. In: Römpp Online. Georg Thieme Verlag
- ↑ Lester Grinspoon, James B. Bakalar: Marihuana, die verbotene Medizin. Zweitausendeins-Verlag, Frankfurt am Main 1994, ISBN 3-86150-060-4.
- ↑ Z. Justinová; S. Ferré, G. H. Redhi, P. Mascia, J. Stroik, D. Quarta, S. Yasar, C.E. Müller,R. Franco,S. R. Goldberg: Reinforcing and neurochemical effects of cannabinoid CB1 receptor agonists, but not cocaine, are altered by an adenosine A2A receptor antagonist. In: Addiction Biology. Band 16, 4. November 2010, S. 405–415.
- ↑ Does Coffee Enhance Marijuana?, Englisch
- ↑ a b Wolfgang Ferner, Peter Xanke: Alkohol und Drogen im Straßenverkehr – Messverfahren, Bußgeldverfahren, Strafverfahren. Deubner Verlag, 2006, ISBN 3-88606-633-9, S. 64 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Cannabis – drugscouts.de. In: drugscouts.de. Abgerufen am 9. Juni 2015.
- ↑ Diana L. Cichewicz: Synergistic interactions between cannabinoid and opioid analgesics. In: Life Sciences. Band 74, Nr. 11, 30. Januar 2004, S. 1317–1324, doi:10.1016/j.lfs.2003.09.038, PMID 14706563.
- ↑ David J Nutt, Leslie A King, Lawrence D Phillips: Drug harms in the UK: a multicriteria decision analysis. In: The Lancet. 376, 2010, S. 1558–1565, doi:10.1016/S0140-6736(10)61462-6.
- ↑ a b Institute of Medicine, Marijuana and Health, Washington, D.C.: Marijuana v.s. Tobacco smoke compositions. In: erowid.org. National Academy Press, 1988, abgerufen am 7. März 2016.
- ↑ Journal of the American Medical Association: Association Between Marijuana Exposure and Pulmonary Function Over 20 Years. 2012, abgerufen am 26. März 2016.
- ↑ S. Aldington et al.: Effects of cannabis on pulmonary structure, function and symptoms. Thorax. 2007 Dec;62(12):1058–63. Epub 2007 Jul 31. PMID 17666437
- ↑ M. Underner, T. Urban, J. Perriot, I. de Chazeron, J. C. Meurice: Cannabis smoking and lung cancer. In: Revue des maladies respiratoires. Band 31, Nummer 6, Juni 2014, S. 488–498, doi:10.1016/j.rmr.2013.12.002, PMID 25012035 (Review).
- ↑ M. Joshi, A. Joshi, T. Bartter: Marijuana and lung diseases. In: Current opinion in pulmonary medicine. Band 20, Nummer 2, März 2014, S. 173–179, doi:10.1097/MCP.0000000000000026, PMID 24384575 (Review).
- ↑ A. Hazekamp, R. Ruhaak, L. Zuurman, J. van Gerven, R. Verpoorte: Evaluation of a vaporizing device (Volcano) for the pulmonary administration of tetrahydrocannabinol. In: Journal of Pharmaceutical Sciences. Band 95, Nummer 6, Juni 2006, S. 1308–1317, ISSN 0022-3549. doi:10.1002/jps.20574. PMID 16637053.
- ↑ National Cancer Institute at the National Institutes of Health: Cannabis and Cannabinoids (PDQ®) (englisch)
- ↑ Robert Melamede: Cannabis and Tobacco Smoke Are Not Equally Carcinogenic. In: Harm Reduction Journal. Band 2, 2005, Nr. 21, PMC 1277837 (freier Volltext) (englisch).
- ↑ H. Bugra, C. Rapp, E. Studerus, J. Aston, S. Borgwardt, A. Riecher-Rössler: Kann Cannabis das Risiko für schizophrene Psychosen erhöhen? In: Fortschritte der Neurologie · Psychiatrie. Band 80, Nr. 11, 1. November 2012, S. 635–643, doi:10.1055/s-0032-1325415.
- ↑ Heekeren: Führt Cannabiskonsum zu Schizophrenie? In: PRAXIS. Band 100, Nr. 22, 1. November 2011, S. 1361–1367, doi:10.1024/1661-8157/a000714 (hogrefe.com [abgerufen am 28. März 2016]).
- ↑ David M. Semple, Andrew M. McIntosh, Stephen M. Lawrie: Cannabis as a risk factor for psychosis: systematic review. In: Journal of Psychopharmacology. Band 19, Nr. 2, 1. März 2005, S. 187–194, doi:10.1177/0269881105049040 (sagepub.com).
- ↑ a b c T. H. Moore, S. Zammit, A. Lingford-Hughes, T. R. Barnes, P. B. Jones, M. Burke, G. Lewis: Cannabis use and risk of psychotic or affective mental health outcomes: a systematic review. In: Lancet (London, England). Band 370, Nummer 9584, Juli 2007, S. 319–328, doi:10.1016/S0140-6736(07)61162-3, PMID 17662880 (Review).
- ↑ J. A. McLaren, E. Silins, D. Hutchinson, R. P. Mattick, W. Hall: Assessing evidence for a causal link between cannabis and psychosis: a review of cohort studies. In: The International journal on drug policy. Band 21, Nummer 1, Januar 2010, S. 10–19, doi:10.1016/j.drugpo.2009.09.001, PMID 19783132 (Review).
- ↑ S. Minozzi, M. Davoli, A. M. Bargagli, L. Amato, S. Vecchi, C. A. Perucci: An overview of systematic reviews on cannabis and psychosis: discussing apparently conflicting results. In: Drug and alcohol review. Band 29, Nummer 3, Mai 2010, S. 304–317, doi:10.1111/j.1465-3362.2009.00132.x, PMID 20565524 (Review).
- ↑ Daniel Cressey: Drogenpolitik: Das Cannabis-Experiment. Übersetzung aus Nature. In: spektrum.de. Spektrum der Wissenschaft, 2. September 2015, abgerufen am 6. September 2015.
- ↑ R. Kuepper, P. D. Morrison, J. van Os, R. M. Murray, G. Kenis, C. Henquet: Does dopamine mediate the psychosis-inducing effects of cannabis? A review and integration of findings across disciplines. In: Schizophrenia research. Band 121, Nummer 1–3, August 2010, S. 107–117, doi:10.1016/j.schres.2010.05.031, PMID 20580531 (Review).
- ↑ Musa Basser Sami, Eugenii A. Rabiner, Sagnik Bhattacharyya: Does cannabis affect dopaminergic signaling in the human brain? A systematic review of evidence to date. In: European Neuropsychopharmacology. 25, 2015, S. 1201, doi:10.1016/j.euroneuro.2015.03.011.
- ↑ K. R. Hefner, M. J. Starr, J. J. Curtin: Altered subjective reward valuation among drug-deprived heavy marijuana users: Aversion to uncertainty. In: Journal of abnormal psychology. Band 125, Nummer 1, Januar 2016, S. 138–150, doi:10.1037/abn0000106, PMID 26595464, PMC 4701603 (freier Volltext).
- ↑ a b E. van de Giessen, J. J. Weinstein, C. M. Cassidy, M. Haney, Z. Dong, R. Ghazzaoui, N. Ojeil, L. S. Kegeles, X. Xu, N. P. Vadhan, N. D. Volkow, M. Slifstein, A. Abi-Dargham: Deficits in striatal dopamine release in cannabis dependence. In: Molecular psychiatry. [elektronische Veröffentlichung vor dem Druck] März 2016, doi:10.1038/mp.2016.21, PMID 27001613.
- ↑ Review in: M. A. Bloomfield, C. J. Morgan, A. Egerton, S. Kapur, H. V. Curran, O. D. Howes: Dopaminergic function in cannabis users and its relationship to cannabis-induced psychotic symptoms. In: Biological psychiatry. Band 75, Nummer 6, März 2014, S. 470–478, doi:10.1016/j.biopsych.2013.05.027, PMID 23820822 (freier Volltext unter DOI-Link).
- ↑ J. Jacobus, D. Goldenberg, C. E. Wierenga, N. J. Tolentino, T. T. Liu, S. F. Tapert: Altered cerebral blood flow and neurocognitive correlates in adolescent cannabis users. In: Psychopharmacology. Band 222, Nummer 4, August 2012, S. 675–684, doi:10.1007/s00213-012-2674-4, PMID 22395430, PMC 3510003 (freier Volltext).
- ↑ M. Rocchetti, A. Crescini, S. Borgwardt, E. Caverzasi, P. Politi, Z. Atakan, P. Fusar-Poli: Is cannabis neurotoxic for the healthy brain? A meta-analytical review of structural brain alterations in non-psychotic users. In: Psychiatry and clinical neurosciences. Band 67, Nummer 7, November 2013, S. 483–492, doi:10.1111/pcn.12085, PMID 24118193 (Review).
- ↑ M. Maccarrone, M. Guzmán, K. Mackie, P. Doherty, T. Harkany: Programming of neural cells by (endo)cannabinoids: from physiological rules to emerging therapies. In: Nature reviews. Neuroscience. Band 15, Nummer 12, Dezember 2014, S. 786–801, doi:10.1038/nrn3846, PMID 25409697 (Review).
- ↑ P. Campolongo, V. Trezza, M. Palmery, L. Trabace, V. Cuomo: Developmental exposure to cannabinoids causes subtle and enduring neurofunctional alterations. In: International review of neurobiology. Band 85, 2009, S. 117–133, doi:10.1016/S0074-7742(09)85009-5, PMID 19607965 (Review).
- ↑ S. Anavi-Goffer, J. Mulder: The polarised life of the endocannabinoid system in CNS development. In: Chembiochem: a European journal of chemical biology. Band 10, Nummer 10, Juli 2009, S. 1591–1598, doi:10.1002/cbic.200800827, PMID 19533710 (Review).
- ↑ D. I. Lubman, A. Cheetham, M. Yücel: Cannabis and adolescent brain development. In: Pharmacology & therapeutics. Band 148, April 2015, S. 1–16, doi:10.1016/j.pharmthera.2014.11.009, PMID 25460036 (Review).
- ↑ B. Chadwick, M. L. Miller, Y. L. Hurd: Cannabis Use during Adolescent Development: Susceptibility to Psychiatric Illness. In: Frontiers in psychiatry. Band 4, 2013, S. 129, doi:10.3389/fpsyt.2013.00129, PMID 24133461, PMC 3796318 (freier Volltext) (Review).
- ↑ D. T. Malone, M. N. Hill, T. Rubino: Adolescent cannabis use and psychosis: epidemiology and neurodevelopmental models. In: British journal of pharmacology. Band 160, Nummer 3, Juni 2010, S. 511–522, doi:10.1111/j.1476-5381.2010.00721.x, PMID 20590561, PMC 2931552 (freier Volltext) (Review).
- ↑ N. Realini, T. Rubino, D. Parolaro: Neurobiological alterations at adult age triggered by adolescent exposure to cannabinoids. In: Pharmacological research: the official journal of the Italian Pharmacological Society. Band 60, Nummer 2, August 2009, S. 132–138, doi:10.1016/j.phrs.2009.03.006, PMID 19559364 (Review).
- ↑ M. H. Meier, A. Caspi, A. Ambler, H. Harrington, R. Houts, R. S. Keefe, K. McDonald, A. Ward, R. Poulton, T. E. Moffitt: Persistent cannabis users show neuropsychological decline from childhood to midlife. In: Proceedings of the National Academy of Sciences of the United States of America. Band 109, Nummer 40, Oktober 2012, S. E2657–E2664, doi:10.1073/pnas.1206820109, PMID 22927402, PMC 3479587 (freier Volltext).
- ↑ T. E. Moffitt, M. H. Meier, A. Caspi, R. Poulton: Reply to Rogeberg and Daly: No evidence that socioeconomic status or personality differences confound the association between cannabis use and IQ decline. In: Proceedings of the National Academy of Sciences of the United States of America. Band 110, Nummer 11, März 2013, S. E980–E982, PMID 23599952, PMC 3600438 (freier Volltext).
- ↑ Langzeitstudie: Jahrelanges Kiffen lässt IQ sinken. In: Spiegel Online. 27. August 2012, abgerufen am 27. Dezember 2014.
- ↑ J. Wrege, A. Schmidt, A. Walter, R. Smieskova, K. Bendfeldt, E. W. Radue, U. E. Lang, S. Borgwardt: Effects of cannabis on impulsivity: a systematic review of neuroimaging findings. In: Current pharmaceutical design. Band 20, Nummer 13, 2014, S. 2126–2137, PMID 23829358, PMC 4052819 (freier Volltext) (Review).
- ↑ A. Batalla, S. Bhattacharyya, M. Yücel, P. Fusar-Poli, J. A. Crippa, S. Nogué, M. Torrens, J. Pujol, M. Farré, R. Martin-Santos: Structural and functional imaging studies in chronic cannabis users: a systematic review of adolescent and adult findings. In: PloS one. Band 8, Nummer 2, 2013, S. e55821, PMID 23390554, PMC 3563634 (freier Volltext) (Review).
- ↑ R. S. Gable: Drugs and society: U.S. public policy. Rowman & Littlefield, Lanham, Md. 2006, ISBN 978-0-7425-4245-7, Kapitel „Acute toxicity of drugs versus regulatory status“, S. 149–162, Diagramm S. 155 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ E. B. Oleson, J. F. Cheer: A brain on cannabinoids: the role of dopamine release in reward seeking. In: Cold Spring Harbor perspectives in medicine. Band 2, Nummer 8, 2012, S. , doi:10.1101/cshperspect.a012229, PMID 22908200, PMC 3405830 (freier Volltext) (Review).
- ↑ E. Hoch, U. Bonnet, R. Thomasius, F. Ganzer, U. Havemann-Reinecke, U. W. Preuss: Risks associated with the non-medicinal use of cannabis. In: Deutsches Ärzteblatt international. Band 112, Nummer 16, April 2015, S. 271–278, doi:10.3238/arztebl.2015.0271, PMID 25939318, PMC 4442549 (freier Volltext), (Review), (Version auf Deutsch: Risiken bei nichtmedizinischem Gebrauch von Cannabis, freier Volltext, PDF).
- ↑ Die Drogenpolitik der Niederlande, Artikel auf cannabislegal.de
- ↑ Stefan Wagner: FOCUS-Reportage: Kaliforniens grüner Rausch. In: Focus Online. 6. April 2010, abgerufen am 27. Dezember 2014.
- ↑ Proposition 19 Map Election Results. California Secretary Of State, 8. November 2010, archiviert vom am 3. November 2010; abgerufen am 8. November 2010. ( abger. 2. August 2012)
- ↑ Medical Marijuana, Prop 215 and SB 420, ( vom 20. März 2011 im Internet Archive) Informationsseite von NORML California (abger. 2. August 2012).
- ↑ Thomas Spang: Kiffen auf Rezept. In: Berliner Zeitung. 20. Oktober 2009, abgerufen am 15. Juni 2015.
- ↑ Christiane Heil: Kalifornien wird grün. In: FAZ.net. 27. Oktober 2009, abgerufen am 27. Dezember 2014.
- ↑ Todesstrafe, Kondompflicht, Marihuana: Was die US-Bürger in der Wahlnacht noch entschieden haben. In: Focus Online. 8. November 2012, abgerufen am 27. Dezember 2014.
- ↑ Daniel Cressey: Das Cannabis-Experiment (Übersetzung aus Nature), in: Spektrum der Wissenschaft: Newsletter, 2. September 2015, Online (abgerufen am 6. September 2015).
- ↑ § 3 Erlaubnis zum Verkehr mit Betäubungsmitteln
- ↑ Referenzfehler: Ungültiges
<ref>-Tag; kein Text angegeben für Einzelnachweis mit dem Namen apfel. - ↑ a b c Claire Cole, Lisa Jones: A Guide to Adulterants Bulking Agents and other Contaminants found in illicit drugs;[1]S.37
- ↑ Warnung vor kontaminiertem Marihuana. In: drugscouts.de. Stadt Leipzig, 7. November 2007, abgerufen am 26. März 2016.
- ↑ Bleiverseuchtes Marihuana Vergiftungen in Leipzig. In: ntv. ntv, 7. November 2007, abgerufen am 31. März 2016.
- ↑ Lead Poisoning Due to Adulterated Marijuana. (PDF) In: New England Journal of Medicine.
- ↑ Cannabis and driving: a review of the literature and commentary (No.12). In: webarchive.nationalarchives.gov.uk. Abgerufen am 9. Juni 2015 (englisch).
- ↑ Wolfgang Müller: Fahrsicherheit: Risikobewusst dank Hasch? In: Focus Online. 14. Juli 2013, abgerufen am 16. Mai 2015.
- ↑ Franjo Grotenhermen: Fahrtüchtigkeit, Fahreignung und Cannabiskonsum - Springer. In: link.springer.com. 26. März 1999, abgerufen am 9. Juni 2015 (deutsch). doi:10.1007/978-3-642-56070-5_9
- ↑ NHTSA Releases Two New Studies on Impaired Driving on U.S. Roads, Department of Transportation’s National Highway Traffic Safety Administration, 6. Februar 2015
- ↑ C Ingraham: Stoned drivers are a lot safer than drunk ones, new federal data show, Washington Post, 9. Februar 2015. Abgerufen am 13. Februar 2015
- ↑ R. Compton, A. Berning: Drug and Alcohol Crash Risk. In: Traffic Safety Facts. Department of Transportation’s National Highway Traffic Safety Administration, Februar 2015 (nhtsa.gov [PDF]).
- ↑ Urteil BVerfG 21. Dezember 2004
- ↑ verkehrslexikon.de
- ↑ a b c Basiert auf Daten aus: Der Cannabiskonsum Jugendlicher und junger Erwachsener in Deutschland 2014. Bundeszentrale für gesundheitliche Aufklärung, 2015
- ↑ Sven Reichardt, Authentizität und Gemeinschaft. Linksalternatives Leben in den siebziger und frühen achtziger Jahren, Berlin 2014, S. 834f.
- ↑ Child and Adolescent Health Research Unit (CAHRU): Health Policy for Children and Adolescents, No. 5 - S. 140. 2006, abgerufen am 29. März 2016.
- ↑ Centre de Prévention des Toxicomanies (Hrsg.): Schule & Cannabis. Ein Leitfaden für das Schulpersonal. 2009, ISBN 978-2-87995-006-8 (PDF; 668 kB ( vom 16. November 2011 im Internet Archive)).
- ↑ Child and Adolescent Health Research Unit (CAHRU): Health Policy for Children and Adolescents, No. 7 - S. 172. 2014, abgerufen am 29. März 2016.
- ↑ Suchtmonitoring Schweiz: Cannabis Überblick - Gegenwärtige Situation. 2014, abgerufen am 29. März 2016.










