Glucose
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|

| |||||||||
| D-Glucose (links) und L-Glucose (rechts)
Fischer-Projektion, offenkettige Darstellung | |||||||||
| Allgemeines | |||||||||
| Name | Glucose | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C6H12O6 | ||||||||
| Kurzbeschreibung |
D-Glucose: | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Arzneistoffangaben | |||||||||
| ATC-Code | |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 180,16 g·mol−1 | ||||||||
| Aggregatzustand |
fest | ||||||||
| Dichte |
1,562 g·cm−3[4] | ||||||||
| Schmelzpunkt | |||||||||
| Löslichkeit |
gut in Wasser (470 g·l−1 bei 20 °C)[2] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Glucose (Abkürzung: Glc) oder Glukose (von griechisch γλυκύς ‚süß‘,[7] und -ose als Suffix für Zucker) ist ein natürlich vorkommendes Kohlenhydrat. Von den Glucoseenantiomeren ist die D-Glucose die natürliche Form. Sie wird auch als Traubenzucker oder bei Lebensmittelinhaltstoffen als Dextrose bezeichnet und ist das häufigste Monosaccharid (Einfachzucker).[8] L-Glucose kann synthetisch dargestellt werden, besitzt aber nur geringe Bedeutung (für eine Erklärung der Bezeichnungen „D“ und „L“ siehe Fischer-Projektion). Wenn Glucose ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist D-Glucose gemeint.
Glucose entsteht in Pflanzen und den meisten Algen mit Hilfe der Photosynthese aus Wasser und Kohlenstoffdioxid. In lebenden Organismen ist Glucose die Hauptenergiequelle. Sie wird als polymeres Glucan gespeichert, in Tieren als Glycogen und in Pflanzen als Stärke. Als Baustein der Cellulose ist sie Hauptbestandteil pflanzlicher Zellwände und damit das häufigste Kohlenhydrat.[9] Glucose wird in medizinischen Infusionslösungen verwendet und gilt als unentbehrliches Arzneimittel.[10]
Geschichte[Bearbeiten | Quelltext bearbeiten]
Glucose wurde erstmals im Jahr 1747 von Andreas Sigismund Marggraf aus Rosinen isoliert.[11][12] Sie wurde 1792 von Johann Tobias Lowitz aus Weintrauben isoliert und als verschieden von Rohrzucker (Saccharose) erkannt.[13] Glucose ist der von Jean Baptiste Dumas 1838 geprägte Begriff, der sich in der chemischen Literatur durchgesetzt hat. Von Friedrich August Kekulé stammt der Vorschlag Dextrose (von lateinisch dexter = rechts), da Traubenzucker in wässriger Lösung die Ebene des linear polarisierten Lichtes nach rechts dreht.[14] Im Gegensatz dazu drehen D-Fructose (eine Ketohexose) und L-Glucose linear polarisiertes Licht nach links (lateinisch laevus = links). Die hierauf gründende, frühere d- und l-Nomenklatur wurde zugunsten der D- und L-Schreibweise aufgegeben,[15] die sich auf die absolute Konfiguration desjenigen Asymmetriezentrums bezieht, das von der Carbonylgruppe am weitesten entfernt ist, und das mit der von D- oder L-Glyceraldehyd übereinstimmt.[16][17]
Die Struktur der Glucose und die Strukturbeziehungen zu den anderen Monosacchariden wurden zwischen 1891 und 1894 von Emil Fischer, der 1890 den Traubenzucker auch synthetisieren[18] konnte, mit Hilfe der Fischer-Projektion beschrieben und stellten einen Meilenstein der Naturstoffchemie dar,[14] für den er 1902 den Nobelpreis für Chemie erhielt.[19] Seine erstmals gelungene Glucosesynthese bestätigte die Theorien von Jacobus Henricus van ’t Hoff zur tetraedrischen Anordnung von chemischen Bindungen in organischen Kohlenstoffverbindungen und zur chemischen Kinetik.[20] Die so erhaltenen Erkenntnisse ermöglichten die Einführung einer systematischen Nomenklatur der stereoisomeren Kohlenhydrate unter Verwendung der konventionellen Namen mit Hinweis auf ihre räumliche Symmetrie (z. B. Fischer-Nomenklatur, D/L-Nomenklatur).[21]
Von 1850 bis 1857 führte Claude Bernard Studien über Glykogen und Zuckerbildung in der Leber durch.[22] Für die Aufklärung des Stoffwechsels der Glucose erhielt Otto Meyerhof 1922 den Nobelpreis für Physiologie oder Medizin.[23] Hans von Euler-Chelpin erhielt zusammen mit Arthur Harden im Jahr 1929 den Nobelpreis für Chemie für ihre Forschung über die „Zuckervergärung und deren Anteil der Enzyme an diesem Vorgang“.[24][25] Im Jahr 1947 erhielten Carl und Gerty Cori für ihre Entdeckung der Wiederverwertung der im Muskel durch Glycolyse produzierten Milchsäure für die Gluconeogenese und Glycogensynthese in der Leber sowie Bernardo Houssay für seine Entdeckung der Rolle der Hypophysenhormone im Glucosestoffwechsel den Nobelpreis für Physiologie oder Medizin.[26][27][28] Für die Entdeckung der aus Glucose gebildeten Zucker-Nukleotide bei der Biosynthese von Kohlenhydraten erhielt Luis Leloir im Jahr 1970 den Nobelpreis für Chemie.[29]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Glucose liegt in fester Form meist als ein Monohydrat mit geschlossenem Pyranring vor (Hydratdextrose). In wässriger Lösung ist sie dagegen in geringem Umfang offenkettig und liegt überwiegend als α- oder β-Pyranose vor, die durch Mutarotation teilweise ineinander übergehen. Aus wässrigen Lösungen können die drei bekannten Formen kristallisiert werden: α-Glucopyranose, β-Glucopyranose und β-Glucopyranose-Hydrat.[30] Glucose ist ein Baustein der Zweifachzucker Lactose (Milchzucker), Saccharose (Rohr- oder Rübenzucker) und Maltose sowie von Mehrfachzuckern wie Raffinose und Vielfachzuckern wie Stärke und Amylopectin, Glycogen und Cellulose. Die Glasübergangstemperatur von Glucose liegt bei 31 °C und die Gordon-Taylor-Konstante (eine experimentell ermittelte Konstante zur Vorhersage der Glasübergangstemperatur bei verschiedenen Massenanteilen eines Gemischs aus zwei Stoffen)[31] liegt bei 4,5.[32]
Vermutlich ist Glucose das häufigste natürliche Monosaccharid, weil sie weniger mit Proteinen per Glykation reagiert als andere Monosaccharide.[33][34] Eine andere Hypothese ist, dass bei Glucose in Form der β-D-Glucose als einzige D-Aldohexose alle fünf Hydroxy-Substituenten in äquatorialer Position stehen und damit für chemische Reaktionen leichter zugänglich sind,[35] beispielsweise für eine Veresterung[36] oder Acetalbildung.[37] Aus diesem Grund ist D-Glucose auch der stark bevorzugte Baustein in natürlichen Polysacchariden (Glycanen).
Systematik der Glucose[Bearbeiten | Quelltext bearbeiten]
| Verschiedene Formen und Darstellungen von D-Glucose im Vergleich | ||
|---|---|---|
| Haworth-Schreibweise | ||
 α-D-Glucofuranose |
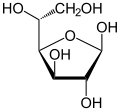 β-D-Glucofuranose | |
 α-D-Glucopyranose |
 β-D-Glucopyranose | |
| α-D-Glucopyranose in (1) Tollens/Fischer- (2) Haworth- (3) Sessel-Darstellung (4) stereochemischer Ansicht | ||

| ||
Die oben abgebildete Darstellung der α-D-Glucose als α-D-Glucopyranose, siehe 2, wird dabei deren Haworth-Projektion genannt und der neu gebildete Ring in dieser Darstellung der Einfachheit halber als eben gezeichnet (was zwar nicht der Realität entspricht, für viele Zwecke aber ausreichend ist). Durch den Ringschluss wird das erste C-Atom hierbei zu einem neuen, weiteren Chiralitätszentrum, was zur Folge hat, dass damit ein Paar von Anomeren möglich wird. Anomere sind stereoisomere Zucker, die sich nur in der Konfiguration an ihrem beim Ringschluss neu gebildeten Chiralitätszentrum unterscheiden und damit ein Spezialfall der Epimere sind.
Die Struktur, bei der die neu entstandene OH-Gruppe des Halbacetals in dessen Haworth-Projektion (axial) „nach unten“ weist, wird dabei als α-D-Glucose bezeichnet, die mit der OH-Gruppe (äquatorial) „nach oben“ weisende als β-D-Glucose. Allgemein gilt, dass bei α-anomeren Zuckern die beim Ringschluss neu gebildete OH-Gruppe in der Haworth-Projektion auf der der endständigen CH2OH-Gruppe gegenüberliegenden Seite der Ringebene steht, bei der β-Form dagegen auf derselben. Diese Definition gilt übrigens in gleicher Weise auch für alle weiteren D- und L-Zucker sowie – sofern die endständige CH2OH-Gruppe dabei nicht ebenfalls, wie z. B. bei der Fructopyranose, Teil des Ringschlusses wird – ebenso für Aldosen wie für Ketosen.
Die Fischer-Projektion ist bei den cyclischen Halbacetal-Formen, siehe 1, unübersichtlich. Um die gewinkelte Anordnung der Kohlenstoff-Kette zu verdeutlichen, wird die Sessel-Darstellung 3 gewählt. Auch die Darstellung 4 ist üblich und stereochemisch eindeutig.
Verhalten in wässriger Lösung[Bearbeiten | Quelltext bearbeiten]

In wässriger Lösung kann der Ring geöffnet und geschlossen werden, so dass ein Gleichgewicht zwischen Pyranose- (Sechsring mit endozyklischem Sauerstoffatom, 99,75 %), Furanoseform (Fünfring, in Spuren) und offenkettiger Aldehydform (0,25 %) vorliegt. Die Zugabe von Säure oder Lauge beschleunigt diesen Vorgang. Da beim Ringschluss entweder die Alpha- oder die Beta-Form entstehen kann, liegt auch ein Gleichgewicht zwischen Alpha-Form (36 %) und Beta-Form (63,9 %) vor.[38] Das Gleichgewicht liegt, wie an den prozentualen Anteilen zu erkennen ist, auf der Seite der β-D-Glucose. Sie ist das stabilere Anomer, da alle Hydroxygruppen in der Sesselkonformation äquatorial angeordnet sind und somit den größtmöglichen Abstand voneinander haben. Dass trotz seiner axialen OH-Gruppe das α-Anomer noch zu 36 % vorliegt, deutet auf weitere Einflüsse hin (anomerer Effekt). Ohne den anomeren Effekt ergäbe sich ein Verhältnis von 11 % α-Form zu 89 % β-Form.[39]
Mutarotation[Bearbeiten | Quelltext bearbeiten]
Die Umwandlung zwischen den beiden Anomeren kann im Polarimeter beobachtet werden, da reine α-D-Glucose einen spezifischen Drehwinkel von +112,2°·ml·dm−1·g−1 hat, reine β-D-Glucose von +17,5°·ml·dm−1·g−1.[40] Hat sich nach einer gewissen Zeit das Gleichgewicht eingestellt, liegt ein Drehwinkel von +52,7°·ml·dm−1·g−1 vor.[40] Diese Veränderung des Drehwinkels wird als Mutarotation bezeichnet. Durch Zugabe von Säure oder Base kann diese Umwandlung massiv beschleunigt werden. Die Gleichgewichtseinstellung läuft über die offenkettige Aldehyd-Form.

Isomerisierung[Bearbeiten | Quelltext bearbeiten]
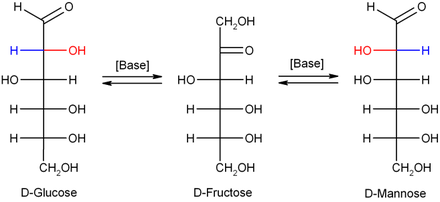
In verdünnter Natronlauge werden Mannose, Glucose und Fructose ineinander umgewandelt (Lobry-de-Bruyn-Alberda-van-Ekenstein-Umlagerung), so dass sich ein Gleichgewicht zwischen diesen Isomeren ausbildet. Diese Reaktion verläuft über ein Endiol:
Merkhilfen zur Stereochemie[Bearbeiten | Quelltext bearbeiten]

Um sich die Glucose-Konfiguration in der Fischer-Projektion zu merken, gibt es folgende Eselsbrücke: Die Positionen der Hydroxygruppen rechts und links der Kohlenstoffkette lassen sich durch Onomatopoeia des Geräusches eines Martinshorns („Ta-Tü-Ta-Ta“) „versinnbildlichen“. Die Anordnung der Hydroxygruppen der Galactose kann man sich hingegen als Blaulicht (siehe Abbildung) merken.
Man kann sich mit dem Wort „HochBett“ (B wie beta) merken, welche Form der Glucose vorliegt. Ist bei der Haworth-Projektion die C-1-Hydroxygruppe oben („Hoch“), so handelt es sich um die beta-Form („Bett“).
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Glucose kommt in allen Lebewesen vor, da sie zentraler Bestandteil des Stoffwechsels in allen Lebewesen ist.
| Nahrungsmittel | Gesamtkohlenhydrate inkl. Ballaststoffe |
Gesamtzucker | Fructose | Glucose | Saccharose | Fructose/ Glucose Verhältnis |
Saccharose in % des Gesamtzuckers |
|---|---|---|---|---|---|---|---|
| Früchte | |||||||
| Apfel | 13,8 | 10,4 | 5,9 | 2,4 | 2,1 | 2,0 | 19,9 |
| Aprikose | 11,1 | 9,2 | 0,9 | 2,4 | 5,9 | 0,7 | 63,5 |
| Banane | 22,8 | 12,2 | 4,9 | 5,0 | 2,4 | 1,0 | 20,0 |
| Feige, getrocknet | 63,9 | 47,9 | 22,9 | 24,8 | 0,9 | 0,93 | 0,15 |
| Trauben | 18,1 | 15,5 | 8,1 | 7,2 | 0,2 | 1,1 | 1 |
| Nabelorange | 12,5 | 8,5 | 2,25 | 2,0 | 4,3 | 1,1 | 50,4 |
| Pfirsich | 9,5 | 8,4 | 1,5 | 2,0 | 4,8 | 0,9 | 56,7 |
| Birne | 15,5 | 9,8 | 6,2 | 2,8 | 0,8 | 2,1 | 8,0 |
| Ananas | 13,1 | 9,9 | 2,1 | 1,7 | 6,0 | 1,1 | 60,8 |
| Pflaume | 11,4 | 9,9 | 3,1 | 5,1 | 1,6 | 0,66 | 16,2 |
| Paprika | 6,0 | 4,2 | 2,3 | 1,9 | 0,0 | 1,2 | 0,0 |
| Gemüse | |||||||
| Rote Bete | 9,6 | 6,8 | 0,1 | 0,1 | 6,5 | 1,0 | 96,2 |
| Karotte | 9,6 | 4,7 | 0,6 | 0,6 | 3,6 | 1,0 | 77 |
| Zwiebel | 7,6 | 5,0 | 2,0 | 2,3 | 0,7 | 0,9 | 14,3 |
| Süßkartoffel | 20,1 | 4,2 | 0,7 | 1,0 | 2,5 | 0,9 | 60,3 |
| Yamswurzel | 27,9 | 0,5 | Spuren | Spuren | Spuren | – | Spuren |
| Zuckerrohr | 13–18 | 0,2 – 1,0 | 0,2 – 1,0 | 11–16 | 1,0 | hoch | |
| Zuckerrübe | 17–18 | 0,1 – 0,5 | 0,1 – 0,5 | 16–17 | 1,0 | hoch | |
| Getreide | |||||||
| Mais | 19,0 | 6,2 | 1,9 | 3,4 | 0,9 | 0,61 | 15,0 |
Industrielle Erzeugung[Bearbeiten | Quelltext bearbeiten]

Glucose wird industriell aus Stärke durch enzymatische Hydrolyse unter Verwendung der Glucose-Amylase oder durch Verwendung von Säuren erzeugt, wobei die enzymatische Hydrolyse die säurekatalysierte Hydrolyse weitgehend verdrängt hat.[43] Dabei entsteht Glucosesirup (enzymatisch mit über 90 % Glucoseanteil in der Trockenmasse)[43] mit einer jährlichen weltweiten Produktionsmenge von 20 Millionen Tonnen (Stand 2011).[44] Daraus resultiert die früher gängige Bezeichnung „Stärkezucker“.[45] Als Stärkequellen werden Mais,[43] Kartoffeln,[43] Reis,[43] Weizen,[43] Roggen,[43] Cassava,[43] Süßkartoffel[46] und Sago verwendet. Die Amylasen stammen meistens aus Bacillus licheniformis[47] oder Bacillus subtilis (Stamm MN-385),[47] die thermostabiler als die zuvor verwendeten Enzyme sind.[47][48] Ab 1982 wurden bei der Herstellung von Glucosesirup Pullulanasen aus Aspergillus niger zur Umwandlung von Amylopectin in Amylose verwendet, wodurch die Ausbeute an Glucose erhöht wurde.[49] Die Reaktion wird bei einem pH-Wert von 4,6–5,2 und einer Temperatur von 55–60 °C durchgeführt.[11] Maissirup weist zwischen 20 % und 95 % Glucose in der Trockenmasse auf.[50] Die japanische Form des Glucosesirups Mizuame wird aus Süßkartoffel- oder Reisstärke hergestellt.[46] Maltodextrin enthält etwa 20 % Glucose.
Umwandlung in Fructose[Bearbeiten | Quelltext bearbeiten]
In den USA wird fast ausschließlich Mais mit Hilfe von Amylase sowie Glucoseisomerase zur Produktion der Lebensmittelsüße Isoglucose eingesetzt, die eine Mischung von Glucose und Fructose ist (auch High Fructose Corn Syrup HFCS). Fructose hat eine höhere Süßkraft als Glucose bei gleichem physiologischen Brennwert von 1563 kJ (= 374 kcal) pro 100 g. Die jährliche weltweite Produktionsmenge von Isoglucose beträgt acht Millionen Tonnen (Stand 2011).[44]
Industrielle Verwendung[Bearbeiten | Quelltext bearbeiten]
Vor allem wird Glucose zur Herstellung von Fructose und bei der Herstellung von Glucose-haltigen Lebensmitteln verwendet. Bei Lebensmitteln wird es als Süßungsmittel, als Feuchthaltemittel, zur Volumenvergrößerung und zur Erzeugung eines weicheren Mundgefühls eingesetzt.[43] Verschiedene Glucosequellen wie beispielsweise Traubensaft (bei Wein) oder Malz (bei Bier) werden zur Vergärung zu Ethanol im Zuge der Herstellung von alkoholischen Getränken verwendet. Die meisten Softdrinks in den USA verwenden HFCS-55 (d. h. 55 % Fructose), während die meisten anderen HFCS-gesüßten Lebensmittel in den USA HFCS-42 verwenden.[51] Im Nachbarland Mexiko wird dagegen im Softdrink Coca-Cola Rohrzucker als Süßungsmittel verwendet, welcher eine höhere Süßkraft besitzt.[52] Daneben wird Glucosesirup unter anderem bei der Erzeugung von Süßwaren wie Bonbons, Toffee und Fondant verwendet.[53] Typische chemische Reaktionen von Glucose bei trockenen Gartechniken sind die Karamellisierung und mit Aminosäuren die Maillard-Reaktion.[54][55]
Glucose ist geeignet als Substrat für industrielle Fermentation, beispielsweise mit Clostridium thermoaceticum zur Herstellung von Essigsäure, mit Penicillium notatum zur Herstellung von Araboascorbinsäure, mit Rhizopus delemar zur Herstellung von Fumarsäure, mit Aspergillus niger zur Herstellung von Gluconsäure, mit Candida brumptii zur Herstellung von Isocitronensäure, mit Aspergillus terreus zur Herstellung von Itaconsäure, mit Pseudomonas fluorescens zur Herstellung von 2-Ketogluconsäure, mit Gluconobacter suboxydans zur Herstellung von 5-Ketogluconsäure, mit Aspergillus oryzae zur Herstellung von Kojisäure, mit Lactobacillus delbrückii zur Herstellung von Milchsäure, mit Lactobacillus brevis zur Herstellung von Äpfelsäure, mit Propionibacter shermanii zur Herstellung von Propionsäure, mit Pseudomonas aeruginosa zur Herstellung von Brenztraubensäure sowie mit Gluconobacter suboxydans zur Herstellung von Weinsteinsäure.[56]
Folgende Schautafel gibt einen kurzen Überblick über wichtige Produkte, die biotechnologisch erzeugt werden können. Die industriell interessanten Produkte bzw. deren Vorstufen sind fett gekennzeichnet:
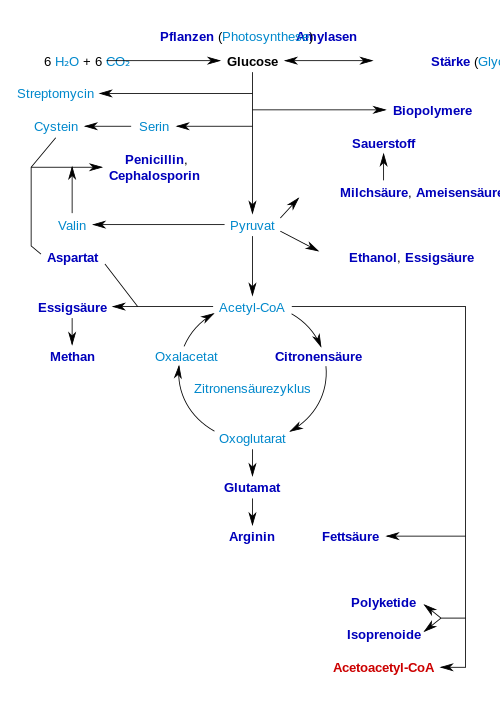
Aus Cellulose wird mit dem Enzym Cellulase Glucose für die Herstellung von Ethanol (Cellulose-Ethanol) zur Verwendung als Biokraftstoff erzeugt.[57]
Biochemie[Bearbeiten | Quelltext bearbeiten]
Glucose entsteht in Pflanzen mit Hilfe der Photosynthese aus Wasser und Kohlenstoffdioxid und kann von allen Lebewesen als Energie- und Kohlenstofflieferant verwertet werden. Ein Großteil der Glucose in Pflanzen und Tieren kommt aber nicht frei, sondern in gebundener Form vor, beispielsweise in Form von Milchzucker oder Rübenzucker (Saccharose), oder in Form von Polymeren wie Stärke oder Cellulose, die in Pflanzen Reservestoffe oder Bestandteile der Zellwand sind. Diese Polymere werden bei der Nahrungsaufnahme durch Tiere, Pilze und Bakterien mithilfe von Enzymen erst zu Glucose abgebaut. Beim Menschen geschieht dies teilweise bereits beim Kauen mittels Amylase, die im Speichel enthalten ist, sowie durch die Maltase. Alle Lebewesen sind außerdem in der Lage, Glucose aus bestimmten Ausgangsprodukten selbst herzustellen, wenn sich die Notwendigkeit ergibt. Nervenzellen, Zellen des Nierenmarks und Erythrozyten sind für ihre Energiegewinnung auf Glucose angewiesen.[58] Im erwachsenen Menschen sind etwa 18 g Glucose,[59] davon etwa 4 g im Blut.[60] In 24 Stunden werden in der Leber eines erwachsenen Menschen etwa 180 bis 220 g Glucose gebildet.[59]
Vorläufer anderer Biomoleküle[Bearbeiten | Quelltext bearbeiten]
Glucose wird in Lebewesen zu mehreren anderen chemischen Verbindungen umgesetzt, die Ausgangsprodukt verschiedener Stoffwechselwege sind. Darunter werden aus Glucose alle anderen Monosaccharide[38] wie Fructose (über den Polyol-Weg),[61] Mannose (das Epimer an Position 2), Galactose (das Epimer an Position 4), Fucose, verschiedene Uronsäuren und die Aminozucker hergestellt.[62] Neben der Phosphorylierung zu Glucose-6-phosphat, die Teil der Glycolyse ist, kann Glucose bei ihrem Abbau zunächst zu Glucono-1,5-lacton oxidiert werden. Glucose dient in manchen Bakterien als Baustein bei der Biosynthese von Trehalose oder Dextran und in Tieren als Baustein von Glycogen. Glucose kann außerdem von der bakteriellen Xylose-Isomerase in Fructose umgewandelt werden. Daneben werden aus Stoffwechselprodukten von Glucose alle nichtessentiellen Aminosäuren, Zuckeralkohole wie Mannitol und Sorbitol, Fettsäuren, Cholesterin und Nukleinsäuren erzeugt.[38] Zuletzt findet Glucose Verwendung als Baustein bei der für die Funktion vieler Proteine notwendige Glycosylierung zu Glycoproteinen[63] und auch bei anderen glycosylierten Stoffen wie Glycolipide, Peptidoglycane und Glycoside. Die Glycosylierung wird katalysiert durch Glycosyltransferasen und kann durch Glycosidasen wieder abgespalten werden.
Aufnahme[Bearbeiten | Quelltext bearbeiten]
Aus der Nahrung aufgenommene Glucose bindet beim Menschen zunächst an den Rezeptor für Süßgeschmack auf der Zunge. Dieser Komplex aus den Proteinen T1R2 und T1R3 erlaubt es, glucosehaltige Nahrungsquellen zu identifizieren. Glucose stammt hauptsächlich aus Lebensmitteln – etwa 300 g pro Tag werden durch die Umwandlung von Nahrung produziert,[64] aber sie wird auch aus anderen Metaboliten in den Körperzellen synthetisiert. Glucose ist ein Baustein vieler Kohlenhydrate und kann aus diesen mithilfe von bestimmten Enzymen abgespalten werden. Glucosidasen (eine Untergruppe der Glycosidasen) katalysieren zunächst die Hydrolyse langkettiger Glucose-enthaltender Polysaccharide, wobei endständige Glucose entfernt wird. Disaccharide wiederum werden meist von speziellen Glycosidasen zu Glucose abgebaut. Die Namen der abbauenden Enzyme sind oft vom jeweiligen Poly- und Disaccharid abgeleitet; so gibt es unter anderem für den Abbau von Polysaccharidketten Amylasen (von Amylose, Bestandteil der Stärke), Cellulasen (von Cellulose), Chitinasen (von Chitin) und mehr; weiters für die Spaltung von Disacchariden die Lactase, Saccharase, Trehalase und andere. Beim Menschen sind etwa 70 Gene bekannt, die für Glycosidasen codieren. Sie haben Funktionen bei der Verdauung und beim Abbau von Glycogen, Sphingolipiden, Mucopolysacchariden und Poly(ADP-Ribose).[65] Beim Menschen erfolgt der Abbau von Glucose-haltigen Polysacchariden zum Teil bereits beim Kauen durch die Amylase, die im Speichel enthalten ist, sowie durch die Maltase, die Lactase und die Saccharase im Bürstensaum des Dünndarms.
Um über die Zellmembranen in Zellen und Zellkompartimente hinein oder aus ihnen heraus zu gelangen, benötigt die Glucose spezielle Transportproteine aus der Major-Facilitator-Superfamilie.[66] Im Dünndarm (genauer im Jejunum)[67] wird Glucose mit Hilfe des Glucosetransporters[68] über einen als Natriumionen-Glucose-Symport (Natrium/Glucose-Cotransporter 1) bezeichneten sekundär aktiven Transportmechanismus in die Darmepithelzellen aufgenommen.[61] Die Weitergabe erfolgt auf der basolateralen Seite der Darmepithelzelle passiv über den Glucosetransporter GLUT2,[61] ebenso wie ihre Aufnahme in Hepatozyten, Nierenzellen, β-Zellen der Langerhans-Inseln, Neuronen, Astrozyten und Tanyzyten.[69] Über die Vena portae gelangt Glucose in die Leber und wird dort zellulär als Glycogen gespeichert.[62] In der Leberzelle wird sie durch die Glucokinase an Position 6 zu Glucose-6-phosphat phosphoryliert; damit kann sie die Zelle nicht mehr verlassen. Mit Hilfe der Glucose-6-Phosphatase wird, ausschließlich in der Leber, Glucose-6-phosphat bei Bedarf wieder in Glucose zurückgewandelt, so dass sie zur Erhaltung einer ausreichenden Blutkonzentration zur Verfügung steht. In anderen Zellen erfolgt die Aufnahme mittels passiven Transports durch eines der 14 GLUT-Proteine.[61] In den anderen Zelltypen erfolgt die Phosphorylierung durch eine Hexokinase, woraufhin Glucose nicht mehr aus der Zelle diffundieren kann.[70]
GLUT1 wird von den meisten Zelltypen gebildet und besitzt besondere Bedeutung für Nervenzellen und die im Pankreas befindlichen β-Zellen.[61] GLUT3 wird gehäuft von Nervenzellen gebildet.[61] Von Muskelzellen (Skelettmuskeln[71] und Herzmuskel) und Fettzellen wird Glucose aus dem Blutkreislauf über GLUT4 aufgenommen.[72] GLUT14 wird ausschließlich in Hoden gebildet.[61] Überschüssig aufgenommene Glucose wird abgebaut und in Fettsäuren umgewandelt, die als Triacylglycerid gespeichert werden. In den Nieren wird Glucose aus dem Harn über SGLT1 und SGLT2 in den apikalen Zellmembranen resorbiert und über GLUT2 in den basolateralen Zellmembranen weitergeleitet.[73] Etwa 90 % der Glucoseresorption der Niere erfolgt über SGLT2 und etwa 3 % über SGLT1.[74]
Biosynthese[Bearbeiten | Quelltext bearbeiten]
Der Stoffwechselweg zum Aufbau von Glucose aus kleinen Molekülen von zwei bis vier Kohlenstoffatomen, der im Glucosemolekül mit sechs Kohlenstoffatomen endet, heißt Gluconeogenese und kommt in allen Lebewesen vor. Durch die Gluconeogenese kann der Organismus Glucose aus anderen Stoffwechselprodukten, unter anderem aus Lactat oder bestimmten Aminosäuren unter Energieverbrauch aufbauen. Die kleineren Ausgangsstoffe sind das Resultat anderer Stoffwechselwege und stammen bei Pflanzen letztlich von der Assimilation von Kohlenstoffdioxid. Letztendlich stammen fast alle Biomoleküle aus der Assimilation von Kohlendioxid in Pflanzen während der Photosynthese.[75] Die freie Energie der Bildung von α-D-Glucose beträgt 917,2 Kilojoule pro Mol.[76] Beim Menschen erfolgt die Gluconeogenese in der Leber und der Niere,[77] aber auch in anderen Zelltypen. Auch die Tubuluszellen der Nieren können Glucose bilden.
Die Spaltung von Glycogen wird als Glycogenolyse bezeichnet, die Spaltung von Stärke als Stärkeabbau.[78] In Leber werden etwa 150 g Glycogen bevorratet, in der Skelettmuskulatur etwa 250 g.[58] Die in Muskelzellen bei der Spaltung des Glycogens freigesetzte Glucose kann allerdings nicht an den Blutkreislauf abgegeben werden, da Glucose durch die Hexokinase phosphoryliert wird, keine Glucose-6-Phosphatase zur Entfernung der Phosphatgruppe gebildet wird und für Glucose-6-Phosphat im Gegensatz zu Glucose kein Transportprotein existiert.
Abbau[Bearbeiten | Quelltext bearbeiten]
Traubenzucker wird im Stoffwechsel über die Glycolyse[79] und den Pentosephosphatweg[80] abgebaut. Die Glycolyse wird von allen lebenden Organismen[81][82] mit kleinen Variationen verwendet, und alle Organismen erzeugen Energie aus dem Abbau von Monosacchariden.[81] Im weiteren Verlauf des Stoffwechsels kann sie über die oxidative Decarboxylierung, den Citratzyklus und die Atmungskette vollständig zu Wasser und Kohlenstoffdioxid abgebaut werden. Ist dafür nicht genügend Sauerstoff verfügbar, erfolgt der Glucoseabbau in Tieren anaerob bis zum Lactat durch die Milchsäuregärung und setzt weniger Energie frei. Das Lactat aus der Muskulatur gelangt in Säugetieren über den Blutkreislauf in die Leber, wo die Gluconeogenese erfolgt (Cori-Zyklus). In anderen Lebewesen kommen auch andere Formen der Gärung vor. Bei hohem Angebot an Glucose wird der Metabolit Acetyl-CoA auch zur Fettsäuresynthese genutzt.[83] Ebenfalls wird durch Glucose der Glycogenspeicher des Körpers wieder aufgefüllt, der vor allem in Leber und Skelettmuskulatur zu finden ist. Diese Vorgänge werden hormonell reguliert.

Das Bakterium Escherichia coli kann auf Nährmedien wachsen, die Glucose als einzige Kohlenstoffquelle aufweisen.[76] In einigen Bakterien und – in modifizierter Form – auch in Archaeen wird Glucose über den Entner-Doudoroff-Weg abgebaut.[84] Anhand der Glucose wurde in E. coli ein Mechanismus der Genregulation entdeckt, die Katabolitrepression.
Tumorzellen wachsen oftmals vergleichsweise schnell und verbrauchen überdurchschnittlich viel Glucose per Glycolyse,[85][86] wodurch es auch in Anwesenheit von Sauerstoff zur Bildung von Lactat kommt, dem Endprodukt der Gärung in Säugetieren. Dieser Effekt wird als Warburg-Effekt bezeichnet. Für die erhöhte Aufnahme von Glucose in Tumoren werden verschiedene SGLT und GLUT vermehrt gebildet.[87][88] In Hefe entsteht bei hohen Glucose-Konzentrationen auch bei Anwesenheit von Sauerstoff (führt normalerweise zur Atmung, aber nicht zur Gärung) Ethanol per Gärung.[89][90] Dieser Effekt wird als Crabtree-Effekt bezeichnet.
Brennwert[Bearbeiten | Quelltext bearbeiten]
Der physiologische Brennwert von Glucose beträgt, je nach Quelle, 16,2 Kilojoule pro Gramm[91] beziehungsweise 15,7 kJ/g (3,74 kcal/g).[92] Die hohe Verfügbarkeit von Kohlenhydraten durch die pflanzliche Biomasse hat während der Evolution, besonders der Mikroorganismen, zu einer Vielfalt von Methoden geführt, den Energie- und Kohlenstoffspeicher Glucose zu verwerten. Unterschiede bestehen darin, bis zu welchem nicht mehr für die Energiegewinnung nutzbaren Endprodukt der Weg führt. Hier entscheidet das Vorhandensein einzelner Gene, und ihrer Genprodukte, der Enzyme, welche Reaktionen möglich sind (siehe Abbildung). Dabei wird der Stoffwechselweg der Glycolyse von nahezu allen Lebewesen genutzt. Ein wesentlicher Unterschied dieses Wegs besteht in der Gewinnung von NADP als Reduktionsmittel für den Anabolismus, das sonst indirekt erzeugt werden müsste.[93]
Glucosekonzentrationen[Bearbeiten | Quelltext bearbeiten]
Die Glucose im Blut wird als Blutzucker bezeichnet. Die Regulation des Blutzuckerspiegels erfolgt durch Glucose-bindende Nervenzellen im Hypothalamus.[94] Daneben bindet Glucose im Gehirn an Glucose-Rezeptoren des Belohnungszentrums im Nucleus accumbens.[94] Die Bindung von Glucose an den Rezeptor für Süßgeschmack auf der Zunge löst mit und ohne Einnahme von Glucose eine Ausschüttung verschiedener Hormone des Energiestoffwechsels aus, die zu verstärkter Aufnahme in Zellen und zu einer Absenkung des Blutzuckerspiegels führen.[95] Süßstoffe führen dagegen nicht zu einer Absenkung des Blutzuckerspiegels.[95]
Der Blutzuckergehalt eines gesunden Menschen beträgt im nüchternen Zustand, d. h. nach Übernachtfasten, etwa 70 bis 100 mg/dl Blut (4 bis 5,5 mM). Im Blutplasma liegen die gemessenen Werte etwa 10–15 % höher. Außerdem liegen die Werte im arteriellen Blut über den Konzentrationen im venösen Blut, da Glucose während der Passage des Kapillarbettes in das Gewebe aufgenommen wird. Auch im Kapillarblut, das häufig zur Blutzuckerbestimmung verwendet wird, liegen die Werte teils höher als im venösen Blut. Der Glucosegehalt des Blutes wird durch die Hormone Insulin, Inkretin und Glucagon geregelt:[94][96] Insulin senkt den Glucosespiegel, Glucagon erhöht ihn.[59] Weiterhin führen die Hormone Adrenalin, Thyroxin, Glucocorticoide, Somatotropin und Adrenocorticotropin zu einer Erhöhung des Glucosespiegels.[59] Daneben gibt es auch noch eine hormonunabhängige Regulation, die als Glucoseautoregulation bezeichnet wird.[97] Nach Nahrungsaufnahme steigt die Blutzuckerkonzentration an. Werte über 180 mg/dl in venösem Vollblut sind pathologisch und werden als Hyperglykämie, Werte unter 40 mg/dl werden als Hypoglykämie bezeichnet.[98]
Bei Verbrauch wird Glucose durch die Glucose-6-Phosphatase aus Glucose-6-phosphat sowie aus Glycogen von der Leber und der Niere in den Blutkreislauf abgegeben, wodurch eine Homöostase der Blutglucosekonzentration erreicht wird.[58][77] Bei Wiederkäuern liegt die Blutglucosekonzentration niedriger (60 mg/dL bei Rindern und 40 mg/dL bei Schafen), weil die Kohlenhydrate von der Darmflora mehr in kurzkettige Fettsäuren umgewandelt werden.[99]
Im auf Glucose als Hauptenergielieferant angewiesenen Gehirn beträgt die Glucosekonzentration normalerweise 4 bis 6 mM (5 mM entspricht 90 mg/dL),[59] sinkt aber bei Fasten auf 2 bis 3 mM.[100] Niedrige Glucosekonzentrationen im Gehirn wirken sich negativ auf die Denkfähigkeit,[101] die Selbstbeherrschung und den Willen aus.[102] Unter 1 mM treten Verwirrung und bei niedrigeren Werten auch Koma auf.[100]
Der glykämische Index ist ein Indikator der Geschwindigkeit der Aufnahme und Umwandlung in Blutglukose aus eingenommenen Kohlenhydraten und wird als Integral des Blutglucosespiegels nach Einnahme im Vergleich zu Glucose bestimmt (eingenommene Glucose ist als 100 definiert).[103] Die klinische Bedeutung des glykämischen Indexes wird kontrovers diskutiert,[103][104] da Nahrungsmittel mit hohem Fettgehalt die Aufnahme von Glucose verlangsamen und so den glykämischen Index senken, wie beispielsweise Speiseeis.[104] Ein alternatives Maß mit gleicher Problematik ist der Insulin-Index,[105] gemessen als Einfluss der Aufnahme von Kohlenhydraten auf den Insulinspiegel im Blut. Die glykämische Last ist ein Indikator für die Menge an Glucose, die dem Blutkreislauf nach Einnahme von Kohlenhydraten zugefügt wird, und basiert auf dem glykämischen Index und der Menge an eingenommener Nahrung.
Pathobiochemie[Bearbeiten | Quelltext bearbeiten]
Autoimmuner Diabetes[Bearbeiten | Quelltext bearbeiten]
Im Zuge einer Autoimmunreaktion gegen die β-Zellen in den Langerhans-Inseln der Bauchspeicheldrüse werden die β-Zellen abgetötet, wodurch das Hormon Insulin nicht mehr hergestellt wird. Dadurch entsteht das Krankheitsbild Diabetes mellitus Typ I (autoimmune Diabetes).[106] Insulin oder Analoga müssen danach regelmäßig je nach Ergebnis einer Messung mit einem Blutzuckermessgerät durch subkutane Injektion zugeführt werden.
Erworbener Diabetes[Bearbeiten | Quelltext bearbeiten]
Eine Fehlregulation des Glucosespiegels wird als intermediäre Hyperglykämie und in stärkeren Verlaufsformen als Diabetes mellitus Typ II (synonym erworbener Diabetes, Insulinresistenz) bezeichnet.[107] Ein wiederholt oder dauerhaft erhöhter Blutzuckerwert weist in der Regel auf Diabetes mellitus hin. Je nach Ausprägung können oral eingenommene Antidiabetika verwendet werden. Regelmäßige sportliche Betätigung und die Vermeidung von Übergewicht senken das Risiko für Diabetes mellitus Typ II, ebenso wird Sport zur Behandlung von Diabetes mellitus Typ II empfohlen.[108]
Übergewicht und Fettleber[Bearbeiten | Quelltext bearbeiten]
Eine übermäßige Einnahme von glucosehaltigen Lebensmitteln kann leicht zu Übergewicht führen. In deren Folge kann sich das metabolische Syndrom einer nichtalkoholischen Fettleberhepatitis ausbilden.[109] Konsum von Glucose im Rahmen einer normalen Zufuhr von Nahrungsenergie ist in dieser Hinsicht unbedenklich.
Analytik[Bearbeiten | Quelltext bearbeiten]
Wenn spezifisch ein Glucosemolekül an einer bestimmten Position in einem größeren Molekül nachgewiesen werden soll, wird eine Kernspinresonanzspektroskopie, eine Röntgenkristallstrukturanalyse oder eine Lektin-Immunfärbung mit einem Concanavalin A-Reporterenzym-Konjugat (bindet nur Glucose oder Mannose) durchgeführt.
Klassische qualitative Nachweisreaktionen[Bearbeiten | Quelltext bearbeiten]
Diese Reaktionen haben nur historische Bedeutung:
Fehling-Reaktion[Bearbeiten | Quelltext bearbeiten]
Die Fehling-Probe ist ein klassischer Nachweis für Aldosen.[110] Aufgrund der Mutarotation liegt Glucose immer zu einem geringen Anteil als offenkettiger Aldehyd vor. Durch Zugabe der Fehling-Reagenzien (Fehling-(I)-Lösung und Fehling-(II)-Lösung) wird die Aldehydgruppe zur Carbonsäure oxidiert, während der Cu2+-Tartratkomplex zu Cu+ reduziert wird und als ziegelroter Niederschlag (Cu2O) ausfällt.
Tollens-Reaktion[Bearbeiten | Quelltext bearbeiten]
Bei der Tollens-Probe wird nach Zugabe von ammoniakalischen AgNO3 zur Probelösung Ag+ von Glucose zu elementarem Silber reduziert.[111]
Barfoedsche Probe[Bearbeiten | Quelltext bearbeiten]
Bei der Barfoedschen Probe wird eine Mischung aus gelöstem Kupferacetat, Natriumacetat und Essigsäure, mit der Lösung des zu untersuchenden Zuckers versetzt und im Wasserbad einige Minuten erhitzt. Bei Glucose und anderen Monosacchariden bildet sich schnell eine rötliche Färbung und rotbraunes Kupfer(I)-oxid (Cu2O).[112]
Nylanders Reagenz[Bearbeiten | Quelltext bearbeiten]
Als reduzierender Zucker reagiert Glucose mit Nylanders Reagenz.[113]
Weitere Nachweise[Bearbeiten | Quelltext bearbeiten]
Bei Erhitzen einer verdünnten Kaliumhydroxidlösung mit Glucose auf 100 °C findet eine starke rötliche Bräunung und eine karamellartige Geruchsentwicklung statt.[114] Konzentrierte Schwefelsäure löst trockene Glucose ohne Schwärzung bei Raumtemperatur, unter Bildung von Zuckerschwefelsäure.[114] In Lösung mit Hefe entsteht umgehend durch die alkoholische Gärung Kohlenstoffdioxid im Verhältnis von 2,0454 Moleküle Glucose zu einem Molekül CO2.[114] Mit Zinnchlorid bildet Glucose eine schwarze Masse.[114] In ammoniakalischer Silberlösung führt Glucose (wie auch Lactose und Dextrin) zu einer Abscheidung von Silber ohne Bildung eines Silberspiegels.[114] In ammoniakalischer Bleiacetatlösung bildet sich in Anwesenheit von Glucose weißes Bleiglycosat, das bei Kochen weniger löslich wird und sich braun verfärbt.[114] In ammoniakalischer Kupferlösung wird mit Glucose bei Raumtemperatur gelbes Kupferoxid-Hydrat gebildet, bei Kochen dagegen rotes Kupferoxid (mit Dextrin ebenso, außer bei ammoniakalischer Kupferacetatlösung).[114] Mit Hagers Reagenz bildet Glucose beim Kochen Quecksilberoxid.[114] Mit alkalischer Bismutlösung wird mit Glucose elementares, schwarz-braunes Bismut abgeschieden.[114] In Ammoniummolybdatlösung gekochte Glucose färbt die Lösung blau.[114] Eine Lösung mit Indigokarmin und Natriumcarbonat entfärbt bei Kochen mit Glucose.[114]
Instrumentelle quantitative Bestimmung[Bearbeiten | Quelltext bearbeiten]
Refraktometrie und Polarimetrie[Bearbeiten | Quelltext bearbeiten]
In konzentrierten Lösungen von Glucose mit geringem Anteil anderer Kohlenhydrate kann ihre Konzentration mit einem Polarimeter bestimmt werden. Bei Zuckermischungen kann die Konzentration mit einem Refraktometer ermittelt werden, beispielsweise bei der Oechsle-Bestimmung im Zuge der Herstellung von Wein.
Photometrisch-enzymatische Verfahren in Lösung[Bearbeiten | Quelltext bearbeiten]
Das Enzym Glucose-Oxidase (GOx) setzt Glucose unter Verbrauch von Sauerstoff zu Gluconsäure und Wasserstoffperoxid um. Ein weiteres Enzym, die Peroxidase, katalysiert eine chromogene Reaktion (Trinder-Reaktion) von Phenol mit 4-Aminoantipyrin zu einem violetten Farbstoff.[115]
Photometrische Teststreifen-Methode[Bearbeiten | Quelltext bearbeiten]
Die Teststreifenmethode bedient sich der oben erwähnten enzymatischen Umsetzung von Glucose zu Gluconsäure unter Bildung von Wasserstoffperoxid. Die Reagenzien sind auf einer Polymermatrix immobilisiert, dem sog. Teststreifen, der eine mehr oder weniger starke Farbe annimmt. Diese kann mit Hilfe eines LED-basierten Handphotometers bei 510 nm reflektometrisch ausgelesen werden. Dies ermöglicht die routinemäßige Blutzuckerbestimmung durch Laien. Neben der Reaktion von Phenol mit 4-Aminoantipyrin wurden neue chromogene Reaktionen entwickelt, welche die Photometrie bei höheren Wellenlängen (550 nm, 750 nm) erlauben.[116]
Amperometrische Glucosesensorik[Bearbeiten | Quelltext bearbeiten]
Die Elektroanalytik der Glucose basiert ebenfalls auf der oben erwähnten enzymatischen Umsetzung. Das produzierte Wasserstoffperoxid kann durch anodische Oxidation bei einem Potential von 600 mV amperometrisch quantifiziert werden.[117] Die GOx wird auf der Elektrodenoberfläche oder in einer dicht vor der Elektrode angeordneten Membran immobilisiert. Als Elektroden kommen neben den klassischen Edelmetallen wie Platin oder Gold in jüngster Zeit immer häufiger Kohlenstoffnanoröhren-Elektroden zum Einsatz, welche z. B. mit Bor dotiert wurden.[118] Auch Cu-CuO-Nanodrähte finden als enzymfreie amperometrische Elektroden Verwendung. Es wurde damit eine Nachweisgrenze von 50 µmol/L erzielt.[119] Eine besonders aussichtsreiche Methode besteht im sog. „enzyme wiring“. Dabei wird das bei der Oxidation fließende Elektron direkt aus dem Enzym über einen molekularen Draht auf die Elektrode abgeleitet.[120]
Andere sensorische Methoden[Bearbeiten | Quelltext bearbeiten]
Für Glucose gibt es eine Vielzahl anderer chemischer Sensoren.[121][122] Angesichts der Bedeutung der Analytik von Glucose in den Biowissenschaften sind auch zahlreiche optische Sonden für Saccharide entwickelt worden, die auf der Verwendung von Boronsäuren[123] beruhen und vor allem für intrazelluläre, sensorische Anwendungen in Frage kommen, wo andere (optische) Methoden gar nicht oder nur bedingt einsetzbar sind. Neben den organischen Boronsäurenderivaten, welche oft hochspezifisch an die 1,2-Diolgruppen der Zucker binden, gibt es noch weitere nach Funktionsmechanismen klassifizierte Sondenkonzepte, die selektive Glucose-bindende Proteine (z. B. Concanavalin A) als Rezeptor verwenden.[121] Des Weiteren wurden Methoden entwickelt, welche die Glucosekonzentration indirekt über die Konzentration von verstoffwechselten Produkten erfassen, z. B. den Verbrauch von Sauerstoff mit Hilfe fluoreszenz-optischer Sensoren.[124] Schließlich gibt es enzymbasierte Konzepte, die die intrinsische Absorbanz bzw. Fluoreszenz von (fluoreszenzmarkierten) Enzymen als Informationsträger nutzen.[121]
Kupfer-Iodometrie[Bearbeiten | Quelltext bearbeiten]
Glucose kann per Kupfer-Iodometrie quantifiziert werden.[125]
Chromatographische Verfahren[Bearbeiten | Quelltext bearbeiten]
Insbesondere für die Analytik komplexer Mischungen, die Glucose enthalten, wie z. B. beim Honig werden heute chromatographische Verfahren wie Hochleistungsflüssigkeitschromatographie und Gaschromatographie,[125] häufig in Kopplung mit der Massenspektrometrie eingesetzt.[126][127] Unter Berücksichtigung der Isotopenverhältnisse lassen sich mit dieser Analytik auch zuverlässig Honigverfälschungen durch zugesetzte Zucker nachweisen.[128] Als vorteilhaft erweisen sich dabei Derivatisierungen unter Verwendung von Silylierungsreagenzien.[129] So können auch die Anteile von Di- und Trisacchariden quantifiziert werden.
In-vivo-Analyse[Bearbeiten | Quelltext bearbeiten]
Die Glucoseaufnahme in Zellen von Organismen wird mit 2-Desoxy-D-glucose oder Fluordesoxyglucose untersucht.[100] (18F)-Fluordesoxyglucose wird in der Onkologie und Neurologie als Tracer in der Positronenemissionstomographie verwendet,[130] wo es das mit Abstand am häufigsten verwendete Diagnostikum ist.[131]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Jochen Lehmann: Kohlenhydrate. Chemie und Biologie. 2., neu bearb. und erw. Auflage. Thieme, Stuttgart/ New York 1996, ISBN 3-13-532902-X.
- Hans Vogel: Tabellen der Zucker und Ihrer Derivate. Springer-Verlag, Berlin 2013, ISBN 978-3-642-47764-5.
- Günther Wolff: Der Zuckerstoffwechsel – eine biographische Studie. In: Medizinische Monatsschrift. Band 12, 1958, S. 766–774 und 838–846.
Weblinks[Bearbeiten | Quelltext bearbeiten]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Eintrag zu GLUCOSE in der CosIng-Datenbank der EU-Kommission, abgerufen am 16. Februar 2020.
- ↑ a b c d Eintrag zu CAS-Nr. 50-99-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 18. September 2014. (JavaScript erforderlich)
- ↑ Alfred Töpel: Chemie und Physik der Milch: Naturstoff – Rohstoff – Lebensmittel. Behr’s Verlag DE, 2004, ISBN 3-89947-131-8, S. 101 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-268.
- ↑ a b c Eintrag zu d-Glucose. In: Römpp Online. Georg Thieme Verlag, abgerufen am 31. Mai 2013.
- ↑ Datenblatt Glucose (PDF) bei Carl Roth, abgerufen am 24. August 2010.
- ↑ Thénard, Gay-Lussac, Biot, Dumas: Rapport sur un mémoire de M. Péligiot, intitulé: Recherches sur la nature et les propriétés chimiques des sucres. In: Comptes rendus, 1838, Band 7, S. 106–113.
- ↑ Abraham J. Domb, Joseph Kost, David Wiseman: Handbook of Biodegradable Polymers. CRC Press, 1998. ISBN 978-1-4200-4936-7. S. 275.
- ↑ Kenji Kamide: Cellulose and Cellulose Derivatives. Elsevier, 2005, ISBN 978-0-08-045444-3, S. 1.
- ↑ WHO Model List of Essential Medicines. (PDF) In: World Health Organization. Oktober 2013, archiviert vom (nicht mehr online verfügbar) am 23. April 2014; abgerufen am 22. April 2014 (englisch).
- ↑ a b Benjamin Caballero, Paul Finglas, Fidel Toldrá: Encyclopedia of Food and Health. Academic Press (2016). ISBN 978-0-12-384953-3, Band 3, S. 239, 608.
- ↑ Marggraf: Experiences chimiques faites dans le dessein de tirer un veritable sucre de diverses plantes, qui croissent dans nos contrées. ‚Chemische Experimente mit der Absicht der Extraktion echten Zuckers aus verschiedenen Pflanzen, die in unseren Landen wachsen‘. In: Histoire de l’académie royale des sciences et belles-lettres de Berlin (1747), S. 90: Les raisins secs, etant humectés d’une petite quantité d’eau, de maniere qu’ils mollissent, peuvent alors etre pilés, & le suc qu'on en exprime, etant depuré & épaissi, fournira une espece de Sucre. ‚Rosinen, mit wenig Wasser angefeuchtet, so dass sie aufweichen, können ausgepresst werden, und der ausgepresste Saft, gereinigt und eingedickt, ergibt eine Sorte Zucker.‘
- ↑ Aaron J. Ihde: The Development of Modern Chemistry. Harper and Row, New York 1964.
- ↑ a b John F. Robyt: Essentials of Carbohydrate Chemistry. (= Springer Advanced Texts in Chemistry) 1998, ISBN 0-387-94951-8.
- ↑ Tentative Rules for Carbohydrate Nomenclature Journal of Biological Chemistry Nr. 247, S. 613, 1972.
- ↑ John F. Robyt: Essentials of Carbohydrate Chemistry. Springer Science & Business Media, 2012, ISBN 978-1-4612-1622-3. S. 7.
- ↑ M. A. Rosanoff: On Fischer’s classification of stereo-isomers. In: Journal of the American Chemical Society. 28, 1906, S. 114, doi:10.1021/ja01967a014.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 46.
- ↑ Emil Fischer - Biographical. In: nobelprize.org. 15. Juli 1919, abgerufen am 4. Juni 2018 (englisch).
- ↑ Bert Fraser-Reid: van ’t Hoff’s Glucose. In: Chem. Eng. News, 1999, Band 77, Heft 39, S. 8; doi:10.1021/cen-v077n039.p008.
- ↑ IUPAC: Nomenclature of Carbohydrates (Recommendations 1996).
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 36.
- ↑ Otto Meyerhof - Facts. In: nobelprize.org. 15. Juli 2018, abgerufen am 15. Juli 2018 (englisch).
- ↑ Hans von Euler-Chelpin - Facts. In: nobelprize.org. Abgerufen am 3. September 2018 (englisch).
- ↑ Arthur Harden - Facts. In: nobelprize.org. 17. Juni 1940, abgerufen am 3. September 2018 (englisch).
- ↑ Bernardo Houssay - Facts. In: nobelprize.org. 21. September 1971, abgerufen am 15. Juli 2018 (englisch).
- ↑ Carl Cori - Facts. In: nobelprize.org. 20. Oktober 1984, abgerufen am 15. Juli 2018 (englisch).
- ↑ Gerty Cori - Facts. In: nobelprize.org. 26. Oktober 1957, abgerufen am 15. Juli 2018 (englisch).
- ↑ Luis Leloir - Facts. In: nobelprize.org. 15. Juli 2018, abgerufen am 15. Juli 2018 (englisch).
- ↑ Fred W. Schenck: Glucose and Glucose-Containing Syrups. In: Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2006. doi:10.1002/14356007.a12_457.pub2.
- ↑ Patrick F. Fox: Advanced Dairy Chemistry Volume 3: Lactose, water, salts and vitamins, Springer, 1992. Band 3, ISBN 978-0-412-63020-0. S. 316.
- ↑ Benjamin Caballero, Paul Finglas, Fidel Toldrá: Encyclopedia of Food and Health. Academic Press (2016). ISBN 978-0-12-384953-3, Band 1, S. 76.
- ↑ H. F. Bunn, P. J. Higgins: Reaction of monosaccharides with proteins: possible evolutionary significance. In: Science. 213. Jahrgang, Nr. 4504, 1981, S. 222–224, doi:10.1126/science.12192669.
- ↑ Jeremy M. Berg: Stryer Biochemie. Springer-Verlag, 2017, ISBN 978-3-662-54620-8, S. 531.
- ↑ Reginald H. Garrett: Biochemistry. Cengage Learning, 2012, ISBN 978-1-133-10629-6. S. 194, 199.
- ↑ Donald Voet, Judith G. Voet: Biochemistry, 4th Edition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1. S. 363.
- ↑ Albert L. Lehninger, Biochemistry, 6th printing, Worth Publishers Inc. 1972, ISBN 0-87901-009-6, S. 228.
- ↑ a b c Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3, S. 27.
- ↑ Eusebio Juaristi, Gabriel Cuevas: The Anomeric Effect CRC Press, 1995. ISBN 0-8493-8941-0. S. 9–10.
- ↑ a b Manfred Hesse, Herbert Meier, Bernd Zeeh, Stefan Bienz, Laurent Bigler, Thomas Fox: Spektroskopische Methoden in der organischen Chemie. 8., überarb. Auflage. Georg Thieme, 2011, ISBN 978-3-13-160038-7, S. 34.
- ↑ Food Composition Databases Show Foods List. In: ndb.nal.usda.gov. Archiviert vom (nicht mehr online verfügbar) am 22. Dezember 2017; abgerufen am 25. August 2018 (englisch).
- ↑ Sugar. ( vom 18. Juli 2011 im Internet Archive) Oregon State University; abgerufen am 28. Juni 2018.
- ↑ a b c d e f g h i P J Fellows: Food Processing Technology. Woodhead Publishing, 2016, ISBN 978-0-08-100523-1, S. 197.
- ↑ a b Thomas Becker, Dietmar Breithaupt, Horst Werner Doelle, Armin Fiechter, Günther Schlegel, Sakayu Shimizu, Hideaki Yamada: Biotechnology. In: Ullmann’s Encyclopedia of Industrial Chemistry. 7. Auflage. Wiley-VCH, 2011, ISBN 978-3-527-32943-4, Band 6, S. 48.
- ↑ Stärkezucker. In: Merck’s Warenlexikon. 3. Aufl. 1884 ff., S. 457 f.
- ↑ a b Alan Davidson: The Oxford Companion to Food. OUP Oxford, 2014, ISBN 978-0-19-104072-6, S. 527.
- ↑ a b c The Amylase Research Society of Japan: Handbook of Amylases and Related Enzymes. Elsevier, 2014, ISBN 978-1-4832-9939-6, S. 195.
- ↑ G. B. Madsen, B. E. Norman, S. Slott: A New, Heat Stable Bacterial Amylase and its Use in High Temperature Liquefaction. In: Starch (1973), Band 25, Heft 9, doi:10.1002/star.19730250906. S. 304–308.
- ↑ B. E. Norman: A Novel Debranching Enzyme for Application in the Glucose Syrup Industry. In: Starch – Stärke, 34, 1982, S. 340, doi:10.1002/star.19820341005.
- ↑ James N. BeMiller, Roy L. Whistler,: Starch: Chemistry and Technology (= Food Science and Technology). 3rd Auflage. Academic Press, New York 2009, ISBN 0-08-092655-X (google.com).
- ↑ High Fructose Corn Syrup: Questions and Answers. US Food and Drug Administration, 5. November 2014, archiviert vom (nicht mehr online verfügbar) am 25. Januar 2018; abgerufen am 18. Dezember 2017 (englisch).
- ↑ Kevin Pang: Mexican Coke a hit in U.S. ( vom 29. Juni 2011 im Internet Archive) In: Seattle Times vom 29. Oktober 2004.
- ↑ Steve T. Beckett: Beckett’s Industrial Chocolate Manufacture and Use. John Wiley & Sons, 2017, ISBN 978-1-118-78014-5, S. 82.
- ↑ Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Food chemistry. Springer, Berlin 2009. ISBN 978-3-540-69935-4. S. 270–289.
- ↑ Nathan Myhrvold, Chris Young, Maxime Bilet: Modernist Cuisine: The Art and Science of Cooking. The Cooking Lab 2011. ISBN 978-0-9827610-0-7. Band 3, S. 89ff.
- ↑ James A. Kent: Riegel’s Handbook of Industrial Chemistry. Springer Science & Business Media, 2013, ISBN 978-1-4757-6431-4, S. 938.
- ↑ Ashok Pandey: Industrial Biorefineries and White Biotechnology. Elsevier, 2015, ISBN 978-0-444-63464-1, S. 488.
- ↑ a b c Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3, S. 195.
- ↑ a b c d e U. Satyanarayana: Biochemistry. Elsevier Health Sciences, 2014, ISBN 978-81-312-3713-7. S. 674.
- ↑ D. H. Wasserman: Four grams of glucose. In: American Journal of Physiology – Endocrinology and Metabolism. Band 296, Nummer 1, Januar 2009, S. E11–E21, doi:10.1152/ajpendo.90563.2008, PMID 18840763, PMC 2636990 (freier Volltext).
- ↑ a b c d e f g Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3, S. 199, 200.
- ↑ a b Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3, S. 214.
- ↑ Ajit Varki (Hrsg.): Essentials of Glycobiology. 2nd Auflage. Cold Spring Harbor Laboratories Press, ISBN 978-0-87969-770-9 (archive.org).
- ↑ Peter C. Heinrich: Löffler/Petrides Biochemie und Pathobiochemie. Springer-Verlag, 2014, ISBN 978-3-642-17972-3, S. 404.
- ↑ Suchergebnis UniProt.
- ↑ Suchergebnis UniProt.
- ↑ Harold A. Harper: Medizinische Biochemie. Springer-Verlag, 2013, ISBN 978-3-662-22150-1, S. 641.
- ↑ A. M. Navale, A. N. Paranjape: Glucose transporters: physiological and pathological roles. In: Biophysical Reviews. Band 8, Nummer 1, März 2016, S. 5–9, doi:10.1007/s12551-015-0186-2, PMID 28510148, PMC 5425736 (freier Volltext).
- ↑ B. Thorens: GLUT2, glucose sensing and glucose homeostasis. In: Diabetologia. Band 58, Nummer 2, Februar 2015, S. 221–232, doi:10.1007/s00125-014-3451-1, PMID 25421524.
- ↑ R. C. Bonadonna, S. Del Prato, E. Bonora, M. P. Saccomani, G. Gulli, A. Natali, S. Frascerra, N. Pecori, E. Ferrannini, D. Bier, C. Cobelli, R. A. DeFronzo: Roles of glucose transport and glucose phosphorylation in muscle insulin resistance of NIDDM. In: Diabetes. Band 45, Nummer 7, Juli 1996, S. 915–925, PMID 8666143.
- ↑ S. Huang, M. P. Czech: The GLUT4 glucose transporter. In: Cell Metabolism. Band 5, Nummer 4, April 2007, S. 237–252, doi:10.1016/j.cmet.2007.03.006, PMID 17403369.
- ↑ R. Govers: Cellular regulation of glucose uptake by glucose transporter GLUT4. In: Advances in Clinical Chemistry. Band 66, 2014, S. 173–240, PMID 25344989.
- ↑ C. Ghezzi, D. D. Loo, E. M. Wright: Physiology of renal glucose handling via SGLT1, SGLT2 and GLUT2. In: Diabetologia. [elektronische Veröffentlichung vor dem Druck] August 2018, doi:10.1007/s00125-018-4656-5, PMID 30132032.
- ↑ S. B. Poulsen, R. A. Fenton, T. Rieg: Sodium-glucose cotransport. In: Current opinion in nephrology and hypertension. Band 24, Nummer 5, September 2015, S. 463–469, doi:10.1097/MNH.0000000000000152, PMID 26125647, PMC 5364028 (freier Volltext).
- ↑ Donald Voet, Judith G. Voet: Biochemistry, 4th Edition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1. S. 359.
- ↑ a b Donald Voet, Judith G. Voet: Biochemistry, 4th Edition. John Wiley & Sons, 2010, ISBN 978-0-470-57095-1. S. 59.
- ↑ a b Leszek Szablewski: Glucose Homeostasis and Insulin Resistance. Bentham Science Publishers, 2011, ISBN 978-1-60805-189-2, S. 46.
- ↑ A. M. Smith, S. C. Zeeman, S. M. Smith: Starch degradation. In: Annual Review of Plant Biology. Band 56, 2005, S. 73–98, doi:10.1146/annurev.arplant.56.032604.144257, PMID 15862090.
- ↑ M. M. Adeva-Andany, N. Pérez-Felpete, C. Fernández-Fernández, C. Donapetry-García, C. Pazos-García: Liver glucose metabolism in humans. In: Bioscience Reports. Band 36, Nummer 6, 12 2016, S. e00416, doi:10.1042/BSR20160385, PMID 27707936, PMC 5293555 (freier Volltext).
- ↑ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 490–496.
- ↑ a b Brian K. Hall: Strickberger’s Evolution. Jones & Bartlett Publishers, 2013, ISBN 978-1-4496-1484-3, S. 164.
- ↑ Reginald H. Garrett: Biochemistry. Cengage Learning, 2012, ISBN 978-1-133-10629-6, S. 551.
- ↑ J. G. Jones: Hepatic glucose and lipid metabolism. In: Diabetologia. Band 59, Nummer 6, 06 2016, S. 1098–1103, doi:10.1007/s00125-016-3940-5, PMID 27048250.
- ↑ N. Entner, M. Doudoroff: Glucose and gluconic acid oxidation of Pseudomonas saccharophila. In: J Biol Chem., 1952, 196(2), S. 853–862 (englisch); PMID 12981024; jbc.org (PDF).
- ↑ A. Annibaldi, C. Widmann: Glucose metabolism in cancer cells. In: Current Opinion in Clinical Nutrition and Metabolic Care. Band 13, Nummer 4, Juli 2010, S. 466–470, doi:10.1097/MCO.0b013e32833a5577, PMID 20473153.
- ↑ X. D. Xu, S. X. Shao, H. P. Jiang, Y. W. Cao, Y. H. Wang, X. C. Yang, Y. L. Wang, X. S. Wang, H. T. Niu: Warburg effect or reverse Warburg effect? A review of cancer metabolism. In: Oncology Research and Treatment. Band 38, Nummer 3, 2015, S. 117–122, doi:10.1159/000375435, PMID 25792083.
- ↑ L. Szablewski: Expression of glucose transporters in cancers. In: Biochimica et Biophysica Acta. Band 1835, Nummer 2, April 2013, S. 164–169, doi:10.1016/j.bbcan.2012.12.004, PMID 23266512.
- ↑ K. Adekola, S. T. Rosen, M. Shanmugam: Glucose transporters in cancer metabolism. In: Current Opinion in Oncology. Band 24, Nummer 6, November 2012, S. 650–654, doi:10.1097/CCO.0b013e328356da72, PMID 22913968.
- ↑ R. H. De Deken: The Crabtree effect: a regulatory system in yeast. In: Journal of General Microbiology. Band 44, Nummer 2, August 1966, S. 149–156, doi:10.1099/00221287-44-2-149, PMID 5969497.
- ↑ E. de Alteriis, F. Cartenì, P. Parascandola, J. Serpa, S. Mazzoleni: Revisiting the Crabtree/Warburg effect in a dynamic perspective: a fitness advantage against sugar-induced cell death. In: Cell Cycle. Band 17, Nummer 6, 2018, S. 688–701, doi:10.1080/15384101.2018.1442622, PMID 29509056, PMC 5969562 (freier Volltext).
- ↑ Georg Schwedt: Zuckersüße Chemie. John Wiley & Sons, 2012, ISBN 978-3-527-66001-8, S. 100.
- ↑ Schmidt, Lang: Physiologie des Menschen, 30. Auflage. Springer Verlag, 2007, S. 907.
- ↑ T. Dandekar, S. Schuster, B. Snel, M. Huynen, P. Bork: Pathway alignment: application to the comparative analysis of glycolytic enzymes. In: Biochem. J. 343 Pt 1, 1999, S. 115–124 (PMID 10493919; PMC 1220531 (freier Volltext)).
- ↑ a b c L. L. Koekkoek, J. D. Mul, S. E. la Fleur: Glucose-Sensing in the Reward System. In: Frontiers in Neuroscience. Band 11, 2017, S. 716, doi:10.3389/fnins.2017.00716, PMID 29311793, PMC 5742113 (freier Volltext).
- ↑ a b R. M. Tucker, S. Y. Tan: Do non-nutritive sweeteners influence acute glucose homeostasis in humans? A systematic review. In: Physiology & Behavior. Band 182, Dezember 2017, S. 17–26, doi:10.1016/j.physbeh.2017.09.016, PMID 28939430.
- ↑ S. E. La Fleur, E. Fliers, A. Kalsbeek: Neuroscience of glucose homeostasis. In: Handbook of Clinical Neurology. Band 126, 2014, S. 341–351, doi:10.1016/B978-0-444-53480-4.00026-6, PMID 25410233.
- ↑ P. H. Bisschop, E. Fliers, A. Kalsbeek: Autonomic regulation of hepatic glucose production. In: Comprehensive Physiology. Band 5, Nummer 1, Januar 2015, S. 147–165, doi:10.1002/cphy.c140009, PMID 25589267.
- ↑ W. A. Scherbaum, B. M. Lobnig, In: Hans-Peter Wolff, Thomas R. Weihrauch: Internistische Therapie 2006, 2007. 16. Auflage. Elsevier, München 2006, ISBN 3-437-23182-0, S. 927, 985.
- ↑ Harold A. Harper: Medizinische Biochemie. Springer-Verlag, 2013, ISBN 978-3-662-22150-1, S. 294.
- ↑ a b c Donard Dwyer: Glucose Metabolism in the Brain. Academic Press, 2002, ISBN 978-0-12-366852-3, S. XIII.
- ↑ S. H. Fairclough, K. Houston: A metabolic measure of mental effort. In: Biological Psychology. Band 66, Nummer 2, April 2004, S. 177–190, doi:10.1016/j.biopsycho.2003.10.001, PMID 15041139.
- ↑ M. T. Gailliot, R. F. Baumeister: The physiology of willpower: linking blood glucose to self-control. In: Personality and social psychology review: an official journal of the Society for Personality and Social Psychology, Inc. Band 11, Nummer 4, November 2007, S. 303–327, doi:10.1177/1088868307303030, PMID 18453466.
- ↑ a b Richard A. Harvey, Denise R. Ferrier: Biochemistry. 5th Edition, Lippincott Williams & Wilkins, 2011, ISBN 978-1-60831-412-6, S. 366.
- ↑ a b U. Satyanarayana: Biochemistry. Elsevier Health Sciences, 2014, ISBN 978-81-312-3713-7, S. 508.
- ↑ S. H. Holt, J. C. Miller, P. Petocz: An insulin index of foods: the insulin demand generated by 1000-kJ portions of common foods. In: The American Journal of Clinical Nutrition. Volume 66, issue 5, November 1997, S. 1264–1276, doi:10.1093/ajcn/66.5.1264, PMID 9356547.
- ↑ P. Concannon, S. S. Rich, G. T. Nepom: Genetics of type 1A diabetes. In: The New England Journal of Medicine. Band 360, Nummer 16, April 2009, S. 1646–1654, doi:10.1056/NEJMra0808284, PMID 19369670.
- ↑ R. Goyal, I. Jialal: Glucose Intolerance. In: StatPearls [Internet]. Treasure Island (FL), 2018. PMID 29763085.
- ↑ R. Buresh: Exercise and glucose control. In: The Journal of Sports Medicine and Physical Fitness. Band 54, Nummer 4, August 2014, S. 373–382, PMID 25034542.
- ↑ H. Yki-Järvinen: Non-alcoholic fatty liver disease as a cause and a consequence of metabolic syndrome. In: The Lancet. Diabetes & endocrinology. Band 2, Nummer 11, November 2014, S. 901–910, doi:10.1016/S2213-8587(14)70032-4, PMID 24731669.
- ↑ H. Fehling: Quantitative Bestimmung des Zuckers im Harn. In: Archiv für physiologische Heilkunde (1848), Band 7, S. 64–73.
- ↑ B. Tollens: Über ammon-alkalische Silberlösung als Reagens auf Aldehyd. In: Berichte der Deutschen Chemischen Gesellschaft. 15. Jahrgang, 1882, S. 1635–1639 (hathitrust.org).
- ↑ C. Barfoed: Über die Nachweisung des Traubenzuckers neben Dextrin und verwandten Körpern. In: Zeitschrift für Analytische Chemie. 12. Jahrgang, Nr. 1, 1873, S. 27, doi:10.1007/BF01462957.
- ↑ Emil Nylander: Über alkalische Wismuthlösung als Reagens auf Traubenzucker im Harne, Zeitschrift für physiologische Chemie. Band 8, Heft 3, 1884, S. 175–185 (Abstract).
- ↑ a b c d e f g h i j k Georg Schwedt: Zuckersüße Chemie. John Wiley & Sons, 2012, ISBN 978-3-527-66001-8, S. 102.
- ↑ P. Trinder: Determination of glucose in blood using glucose oxidase with an alternative oxygen acceptor. In: Annals of Clinical Biochemistry. 6, 1969, S. 24–27; doi:10.1177/000456326900600108.
- ↑ M. Mizoguchi, M. Ishiyama, M. Shiga, K. Sasamoto: Water-soluble chromogenic reagent for colorimetric detection of hydrogen peroxide – an alternative to 4-aminoantipyrine working at a long wavelength. In: Analytical Communications. 35, 1998, S. 71–73; doi:10.1039/A709038B.
- ↑ J. Wang: Electrochemical Glucose Biosensors. In: Chem. Rev. 108, 2008, S. 814–825; PMID 18154363.
- ↑ X. Chen, J. Chen, Ch. Deng, Ch. Xiao, Y. Yang, Z. Nie, S. Yao: Amperometric glucose biosensor based on boron-doped carbon nanotubes modified electrode. In: Talanta. 76, 2008, S. 763–767; doi:10.1016/j.talanta.2008.04.023; PMID 18656655.
- ↑ G. Wang, Y. Wei, W. Zhang, X. Zhang, B. Fang, L. Wang: Enzyme-free amperometric sensing of glucose using Cu-CuO nanowire composites. In: Microchimica Acta. 168, 2010, S. 87–92; doi:10.1007/s00604-009-0260-1.
- ↑ T. J. Ohara, R. Rajagopaian, A. Heller: „Wired“ Enzyme Electrodes for Amperometric Determination of Glucose or Lactate in the Presence of Interfering Substances. In: Anal. Chem. 66, 1994, S. 2451–2457; doi:10.1021/ac00087a008; PMID 8092486.
- ↑ a b c S. M. Borisov, O. S. Wolfbeis: Optical Biosensors. In: Chem. Rev. 108, 2008, S. 423–461; doi:10.1021/cr068105t; PMID 18229952.
- ↑ S. Ferri, K. Kojima, K. Sode: Review of glucose oxidases and glucose dehydrogenases: a bird’s eye view of glucose sensing enzymes. In: Journal of Diabetes Science and Technology. Band 5, Nummer 5, September 2011, S. 1068–1076, doi:10.1177/193229681100500507, PMID 22027299, PMC 3208862 (freier Volltext).
- ↑ H. S. Mader, O. S. Wolfbeis: Boronic acid based probes for microdetermination of saccharides and glycosylated biomolecules. In: Microchimica Acta, 162, 2008, S. 1–34; doi:10.1007/s00604-008-0947-8.
- ↑ O. S. Wolfbeis, I. Oehme, N. Papkovskaya, I. Klimant: Sol-Gel based Glucose Biosensors Employing Optical Oxygen Transducers, and a Method for Compensating for Variable Oxygen Background. In: Biosensors & Bioelectronics. 15, 2000, S. 69–76; doi:10.1016/S0956-5663(99)00073-1.
- ↑ a b A. L. Galant, R. C. Kaufman, J. D. Wilson: Glucose: Detection and analysis. In: Food Chemistry. Band 188, Dezember 2015, S. 149–160, doi:10.1016/j.foodchem.2015.04.071, PMID 26041177.
- ↑ M. L. Sanz, J. Sanz, I. Martínez-Castro: Gas chromatographic-mass spectrometric method for the qualitative and quantitative determination of disaccharides and trisaccharides in honey. In: Journal of Chromatography A 1059(1–2), 2004, S. 143–148; PMID 15628134.
- ↑ GMD - Glucose (1MEOX) (5TMS) BP - InChI=1S/C22H55NO6Si5/c1-24-23-17-19(26-31(5,6)7)21(28-33(11,12)13)22(29-34(14,15)16)20(27-32(8,9)10)18-25-30(2,3)4/h17,19-22H. In: gmd.mpimp-golm.mpg.de. 19. Juli 2007, abgerufen am 4. Juni 2018 (englisch).
- ↑ A. I. Cabañero, J. L. Recio, M. Rupérez: Liquid chromatography coupled to isotope ratio mass spectrometry: a new perspective on honey adulteration detection. In: J Agric Food Chem. 54(26), 27. Dez 2006, S. 9719–9727; PMID 17177492.
- ↑ M. Becker, F. Ler, T. Rosenau, A. Potthast: Ethoximation-silylation approach fiebnor mono- and disaccharide analysis and characterization of their identification parameters by GC/MS. In: Talanta. 115, 2013, S. 642–651; PMID 24054643.
- ↑ Gesellschaft Deutscher Chemiker: Anlagen zum Positionspapier der Fachgruppe Nuklearchemie ( vom 31. März 2010 im Internet Archive), Februar 2000.
- ↑ Simone Maschauer, Olaf Prante: Sweetening Pharmaceutical Radiochemistry by 18F-Fluoroglycosylation: A Short Review. In: BioMed Research International, Band 2014, Artikel-ID 214748; doi:10.1155/2014/214748; PMID 24991541; PMC 4058687 (freier Volltext).